Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Portuguesa de Pneumologia
versão impressa ISSN 0873-2159
Rev Port Pneumol v.16 n.2 Lisboa abr. 2010
Tumor de células gigantes de fémur distal com metástases pulmonares
Nicolas S Lazaretti1, Viviane Weiller Dallagasperina2, Rodrigo Ughini Villaroel1, Luis Alberto Schlittler1
1 Médico Oncologista Clínico do Hospital da Cidade
2 Académica da Faculdade de Medicina da Universidade de Passo Fundo
Resumo
O tumor de células gigantes é uma lesão óssea primária benigna que acomete a epífise de ossos longos, com maior incidência na terceira e quarta décadas de vida, mas que pode apresentar comportamento de um tumor maligno, com metástases à distância. Até dez por cento dos doentes podem apresentar metástases à distância, principalmente para o pulmão, geralmente acompanhadas de recidiva no local primário.
O tratamento do tumor primário é a ampla ressecção cirúrgica. Os autores relatam o caso de um doente com 35 anos com metástases pulmonares 21 meses após ter realizado curetagem de tumor de células gigantes em fémur distal.
Palavras-chave: Tumor de células gigantes, neoplasias ósseas, metástases pulmonares.
Giant cell tumour of distal femur with pulmonary metastases
Abstract
Gian cell is normally a benign primary skeletal lesion located in the epiphysis of the long bones. It is more frequente in the third and fourth decades of life but can exhibit the behaviour of a malignant tumour with distal metatasis. Up to 10% of patients present distal metatasis, usually in the lung, and it is concomitant to recurrence in the primary site. The treatment of primary tumour is extensive surgical resection. We report a case of a 35-year-old patient with lung metatases 21 months after curettage of giant cell tumour in distal femur.
Key-words: Giant cell tumor, bone neoplasm, pulmonary metastases.
Introdução
O tumor ósseo de células gigantes (GCT) representa aproximadamente 10% dos tumores ósseos primários1. Usualmente, é uma lesão esquelética de comportamento benigno, geralmente epifisária com tendência a expansão para metáfise em ossos longos2, ocorrendo principalmente no fémur distal e tíbia proximal, podendo acometer também vértebras, pelve e sacro. A sua prevalência é maior após a maturidade esquelética, com pequena predilecção pelo género feminino, e com o seu pico de incidência na terceira e quarta décadas de vida3.
O seu comportamento pode variar desde indolente e estático até alta agressividade local, com extensa destruição óssea, avanço cortical e extensão para tecidos moles adjacentes3.
O objectivo do tratamento é a excisão completa do tumor e preenchimento do defeito ósseo. É realizado por curetagem, seguida de aplicação local de fármacos ou crioterapia e preenchimento do defeito com enxerto ósseo ou polimetilmetacrilato1,4-6.
Nos casos em que há recorrência, esta geralmente desenvolve-se nos dois primeiros anos após ressecção do tumor primário, embora tenham sido descritos casos até 18 anos após tratamento inicial3.
A frequência de metástases varia de 1 a 10% dos casos e a maioria destas é pulmonar1,3.
Descrevemos os achados clínicos e de imagem de um caso de tumor de células gigantes com metástase pulmonar confrontando os achados com a literatura prévia.
Relato do caso
Doente masculino, 35 anos, procurou atendimento médico em Junho de 2008 com queixa de dispneia aos pequenos esforços durante os últimos três meses. O exame físico do doente nessa ocasião era normal.
Em 2006 (21 meses antes) foi submetido a cirurgia para ressecção de um tumor em fémur distal esquerdo, com diagnóstico histológico de tumor de células gigantes. Nessa ocasião foi aplicado polimetilmetacrilato para correção do defeito ósseo. Doente previamente hígido, sem história de tabagismo ativo ou passivo (Fig. 1).
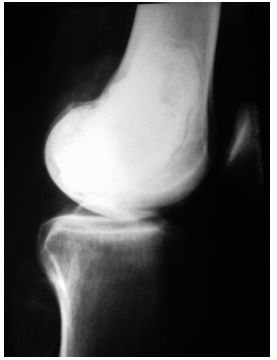
Fig. 1 – Radiografia de joelho realizada em 2007, para controlo após ressecção do tumor no fémur distal, evidencia cavidade preenchida por cimento ósseo, sem outras alterações
A radiografia de tórax evidenciou infiltrado intersticial difuso e massas pulmonares com melhor definição no terço médio do pulmão esquerdo e base pulmonar direita (Fig. 2). A tomografia computadorizada demonstrou parênquima pulmonar com incontáveis lesões micronodulares e nodulares, extensamente disseminadas no parênquima pulmonar, bilateralmente, de forma relativamente simétrica, acometendo predominantemente as extremidades distais vasculares associadas a espessamento do interstício linfático (Fig. 3).
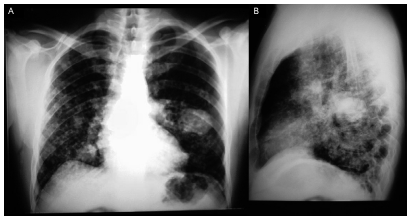
Fig. 2 – Radiografia de tórax. A: incidência posteroanterior. B: incidência lateral esquerda. Visualiza-se infiltrado intersticial difuso e assimétrico e massas bilaterais, massa medindo aproximadamente 6 centímetros no terço médio do pulmão esquerdo e 3,5 centímetros na base do pulmão direito
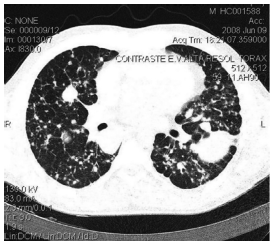
Fig. 3 – TC tórax de alta resolução com contraste endovenoso. Linfangite, múltiplos nódulos e micronódulos extensamente disseminados no parênquima pulmonar, bilateralmente, de forma realtivamente simétrica, acometendo predominantemente as extremidades distais vasculares; massa no pulmão esquerdo
Com base no quadro clínico e achados de imagem, aventou-se a hipótese diagnóstica de lesão neoplásica metastática. Foi realizada biopsia de nódulo pulmonar percutânea guiada por tomografia computadorizada com o seguinte laudo anatomopatológico: fragmento tecidual infiltrado por tecido neoplásico constituído por células atípicas que apresentam citoplasma claro, vacuolizado e mais raramente vacúolos esféricos, citoplasma que rechaça o núcleo para a periferia. Ocasionalmente, observam-se células de aspecto fibroblástico e há também células gigantes multinucleadas de aspecto inflamatório (Fig. 4). Aspectos morfológicos compatíveis com tumor de células gigantes.
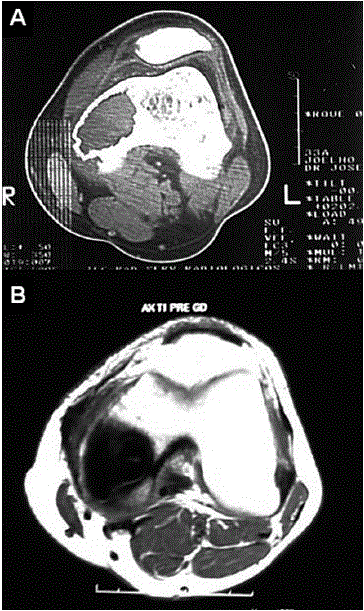
Fig. 4 – Ressonância magnética nuclear do joelho esquerdo. A: T2 axial. B: T1 axial. Presença de cavidade cirúrgica tamponada com cimento ósseo no côndilo medial do fémur. Junto da borda superoposterior da cavidade cirúrgica observamos área com alteração de sinal, com baixo sinal em T1 (B)
A radiografia ao joelho esquerdo evidenciou côndilo femoral medial com preenchimento por cimento, sem outras alterações. Ressonância magnética nuclear demonstrou cavidade cirúrgica tamponada com cimento ósseo no côndilo medial do fémur, junto à borda superoposterior da cavidade cirúrgica, observando-se áreas de alteração do sinal, caracterizada por baixo sinal em T1, alto sinal em DP, com discreta impregnação pelo contraste endovenoso, sugerindo recidiva tumoral (Figs. 5, 6 e 7).
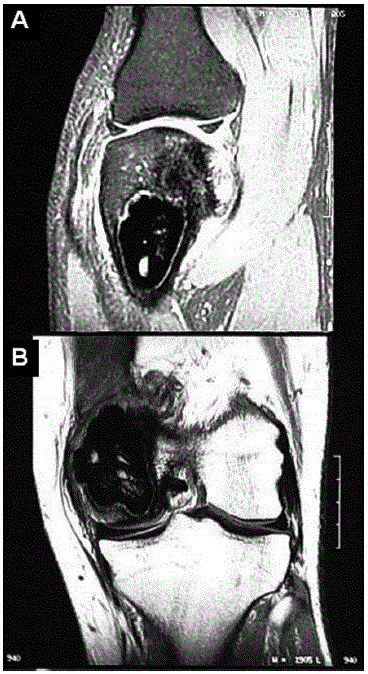
Fig. 5 – RNM, cortes sagitais. Presença de cavidade cirúrgica tamponada com cimento ósseo no côndilo medial do fémur. Junto à borda superoposterior da cavidade cirúrgica observamos área com alteração de sinal, com baixo sinal em T1 (B)
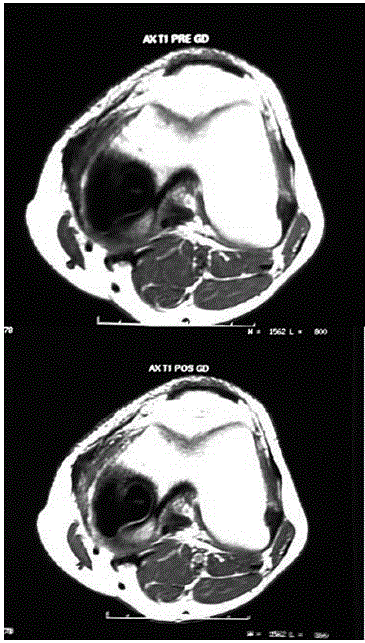
Fig. 6 – RMN, cortes axiais antes e após a aplicação endovenosa de gadolíneo, com discreta impregnação da lesão
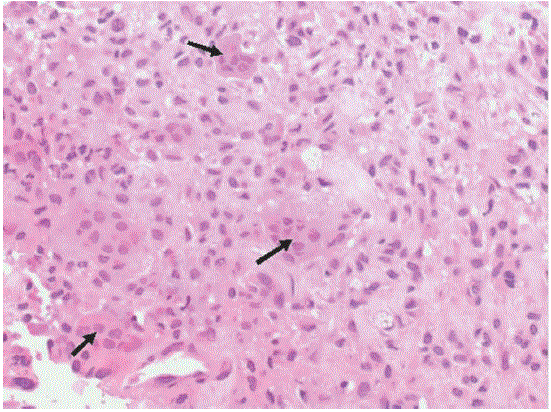
Fig. 7 – HE 200×. Grupamento de células tumorais, tendo de permeio células gigantes multinucleadas (setas)
O doente está em acompanhamento clínico, apenas com tratamento sintomático.
Discussão
Após procedimentos intralesionais, a taxa de recorrência local do tumor de células gigantes varia de 10 a 40%7,8, e é mais elevada no rádio distal, fémur proximal e tíbia distal7.
Ressecção cirúrgica incompleta e recorrência local é acompanhada de elevação do risco de metástase pulmonar3,9.
Num estudo que avaliou 67 casos de recorrência, 69,7% ocorreram nos dois anos seguintes ao tratamento do tumor primário e 97% nos primeiros 5 anos. Sete destes doentes (10,5%) desenvolveram metástases pulmonares. Cinco deles associados à primeira recidiva local, um após a segunda e um após a terceira reincidência. Portanto, todos os doentes com recorrência local de GCTB devem ser submetidos a uma tomografia computadorizada de tórax7.
No caso relatado neste artigo, o diagnóstico de recidiva tumoral e metástase pulmonar foi realizado 21 meses após tratamento local do tumor primário, o que condiz com os dados da literatura, que já evidenciou que a maioria das recidivas ocorre nos dois primeiros anos após o diagnóstico inicial, e o sítio de metástase mais comum é pulmonar.
O mecanismo de desenvolvimento das metástases é desconhecido. Alguns autores sugerem a hipótese de a infiltração do tumor de células gigantes em vasos no local da lesão primária poder gerar alguns êmbolos para o parênquima pulmonar que permanecem viáveis. Outros autores não encontraram qualquer correlação entre invasão vascular e metastização do tumor ósseo de células gigantes1. Disseminação para linfonodos e depósitos subcutâneos são raros, mas também têm sido relatados10.
Estes casos de GCT benigno com doença metastática são, por vezes, erroneamente descritos como malignos. No entanto, estas metástases são histologicamente idênticas ao tumor benigno primário e têm bom prognóstico, por isso o termo GCT maligno deve ser reservado para casos de sarcoma resultantes de um GCT anteriormente documentado ou adjacente a um típico GCT10.
A transformação maligna do tumor de células gigantes (GCT) é um fenómeno raro. O diagnóstico, na maioria dos casos, é inesperado e, geralmente, descoberto acidentalmente mediante análise patológica do espécime ressecado do sítio de metástase. A identificação de ossificação dentro de um GCT em exames de imagem, que, na sua forma benigna, é puramente lítico, deve ser interpretado como um possível indicador de malignidade10.
A análise por imunofluorescência de alguns GCT evidenciou componentes de osteossarcomas; por conseguinte, é possível que uma transformação maligna osteossarcomatosa possa ocorrer. Uma segunda hipótese é o aumento da remodelação óssea induzida por GCT levou à formação de mutações genéticas que podem, eventualmente, conduzir ao desenvolvimento de osteosarcoma adjacente ao GCT10.
GCT malignos são divididos em primários e secundários. Os primários são aqueles com componente sacomatoso maligno, e são muito raros. Os secundários apresentam sarcoma de alto grau e ocorrem em sítios de GCT previamente tratados, principalmente após radioterapia. O tipo secundário é o mais comum10.
Infelizmente, não é possível diferenciar confiavelmente o GCT malignos primários do seu homólogo benigno baseado apenas no aspecto radiológico das lesões. Os sintomas clínicos e sinais, como rápido aumento da dor ou tamanho da lesão, aumentam a suspeita de malignização. Características radiológicas que sugerem agressividade, como um grande componente de tecidos moles ou invasão cortical, podem ser vistas na malignização primária e secundária, bem como no GCT benigno com metastização, e são, portanto, inúteis nessa diferenciação. O grau de sobreposição dos achados radiológicos faz com que a análise histológica do osso seja crucial para o diagnóstico; devendo haver o cuidado de investigar a presença de pequenas áreas focais de sarcoma10.
A análise histológica do caso apresentado evidenciava características morfológicas de tumor de células gigantes sem componente sarcomatoso, o que levou ao diagnóstico de GCT benigno com metástase pulmonar.
O tumor de células gigantes consiste principalmente em três tipos de células: gigantes multinucleadas semelhantes a osteoclastos (que originou a antiga nomenclatura de osteoclastoma), células mononucleares e células do estroma onde o tumor prolifera3,11.
Outros diagnósticos diferenciais incluem: osteossarcoma, fibrossarcoma, histiocitoma fibroso maligno, plasmocitoma, tumores marrons no hiperparatireoidismo, granulomas de células gigantes reparativos e metástases de carcinomas1.
As metástases pulmonares ocorrem em aproximadamente 2% dos casos1. Num estudo que avaliou 214 casos de tumores de células gigantes, entre 1980 e 2007, com seguimento médio de 59,8 meses, teve incidência de metástases pulmonares de 3,3%. O tratamento das metástases pulmonares nesta série foi a remoção cirúrgica em quatro casos, quimioterapia neoadjuvante (combinação de isofosfamida, cisplatina e adriamicina), seguida de ressecção cirúrgica em um caso,aplicação do interferon á e bifosfonados em três casos, e interferon á associado a bifosfonados e quimioterapia em um doente. Dois doentes não tinham condições cirúrgicas e foram tratados com quimioterapia associada a radioterapia e o outro com interferon á associado a bifosfonados. Na última consulta de acompanhamento (média de 54,9 meses), um doente foi considerado curado da doença, uma tinha doença estável e uma morreu em decorrência da doença, apesar das elevadas doses de quimioterapia. Esta última doente tinha metástases no pulmão, tecidos moles do braço, tórax, língua, cérebro e intestino delgado e teve como causa do óbito uma perfuração intestinal3.
A história natural das lesões metastáticas é imprevisível e há evidências de que a melhor resposta ao tratamento das metástases pulmonares ocorre nos três primeiros anos1.
O prognóstico após a remoção cirúrgica das metástases geralmente é bom3,9. Se a remoção das lesões não é possível, alguns especialistas recomendam quimioterapia; porém, ainda não há consenso na literatura sobre a efectividade da quimioterapia nestes casos3.
Os bifosfonados apresentam actividade citotóxica sobre os osteoclastos e células gigantes tumorais, o que justifica a sua eficácia no tratamento deste tumor3.
Devido ao doente ter apresentado grande melhoria da dispneia apenas com cuidados clínicos, estamos realizando manejo conservador com revisões periódicas mensais.
Bibliografia
1. Sayed MN, Kondekar S, Jaiswal S, Rasalkar D, Agrawal S. Giant cell tumor of the talus with pulmonary metastasis – Seven years follow up. The Foot 2006; 16:107-111.
2. Sayed M.N, et al. Giant cell tumor of talus, a case report of rare site. European Journal of Radiology Extra2007; 61:73-75. [ Links ]
3. Balke M, Schremper L, Gebert C, Ahrens H, Streitbuerger A, Koehler G, et al. Giant cell tumor of bone: treatment and outcome of 214 cases. J Cancer Res Clin Oncol 2008. DOI 10.1007/s00432-008-0370 -x.
4. Saiz P, Virkus W, Piasecki P, Templeton A, Shott S, Gitelis S. Results of giant cell tumor of bone treated with intralesional excision. Clin Orthop 2004; 424:221-226.
5. Wakitani S, Imoto K, Saito M, Yamamoto T, Kawabata H. A case report: reconstruction of a damaged knee following treatment of giant cell tumor of the proximal tibia with cryosurgery and cementation. Osteoarthritis Cartilage 2002; 10:402-407.
6. Zhen W, Yaotian H, Songjian L, Ge L, Qingliang W. Giant-cell tumour of bone. The long -term results of treatment by curettage and bone graft. J Bone Joint Surg Br 2004; 86:212-216.
7. Balke M, Ahrens H, Streitbuerger A, Koehler G, Winkelmann W, Gosheger G, et al. Treatment options for recurrent giant cell tumors of bone. J Cancer Res Clin Oncol 2008. DOI 10.1007/s00432 -008-0427 -x.
8. Malek F, Krueger P, Hatmi ZN, Malayeri AA, Faezipour H, ODonnell RJ. Local control of long boné giant cell tumour using curettage, burring and boné grafting without adjuvant therapy. Int Orthop 2006; 30(6):495-498.
9. Siebenrock KA, Unni KK, Rock MG. Giant-cell tumour of bone metastasising to the lungs. A long–term follow-up. J Bone Joint Surg Br 1998; 80(1):43-47.
10. Heffernan EJ, OSullivan PJ, Adibeig M, Louis LJ, Ryana AG, Neilsen TO, et al. Primary malignant transformation of giant cell tumor of bone. European Journal of Radiology Extra 2007; 62:89-93.
11. Werner M. Giant cell tumour of bone: morphological, biological and histogenetical aspects. Int Orthop 2006; 30(6):484-489.
Serviço de Oncologia do Hospital da Cidade
Rua Tiradentes, 295 – Passo Fundo/ Rio Grande do Sul/ Brasil
Cep 99010-260
Tel. (54) 2103 3333
e-mail: hc@hcpf.com.br
Recebido para publicação/received for publication:09.03.05
Aceite para publicação/accepted for publication:09.08.06













