Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Portuguesa de Pneumologia
versão impressa ISSN 0873-2159
Rev Port Pneumol v.16 n.3 Lisboa jun. 2010
Pneumonia a Varicella zoster
Carla Ferreira Santos1, Ana Gomes2, António Garrido3, Ana Albuquerque4, Eduardo Melo4, Inês Barros4, António Marques5, José Pedro Saraiva6
1 Interna do Complementar de Medicina Interna, Serviço Medicina Interna
2 Especialista em Medicina Interna, Serviço Medicina Interna
3 Especialista em Medicina Interna, Serviço Medicina Interna
4 Assistente Hospitalar Graduado em Medicina Interna, Intensivista, UCIP
5 Especialista em Medicina Interna, Intensivista, UCIP
6 Chefe de Serviço de Anestesiologia, Intensivista. Director de Serviço de UCIP
Hospital de São Teotónio, EPE
Avenida Rei Dom Duarte
3504-509 Viseu – Portugal
Resumo
A varicela é uma doença infecto contagiosa comum na infância, ocorrendo pouco mais de 2% dos casos em adultos. Desde a década de 80 que a sua incidência nos adultos tem vindo a aumentar, dos quais apenas 7% são seronegativos1. A pneumonia a Varicella zoster, se bem que rara, constitui a complicação mais grave e mais frequente no adulto. Os autores apresentam um caso clínico ilustrativo de pneumonia a Varicella zoster num adulto fumador e imunocompetente e fazem uma breve revisão teórica sobre o tema.
Palavras-chave: Varicela, pneumonia, ARDS.
Varicella zoster pneumonia
Abstract
Varicella (chickenpox) is a common contagious infection of childhood, with fewer than 2% of the cases occurring in adults. Since the early 1980s the incidence of chickenpox in adults has been increasing and only 7% of them are seronegative for Varicella zoster antibodies. Pneumonia, although rare, is the most common and serious complication of chickenpox infection in adults.
The authors present an illustrative case of varicella pneumonia in an immunocompetent adult with smoking habits and make a brief thematic review.
Key-words: Chickenpox, pneumonia, ARDS.
Introdução
A varicela, doença altamente contagiosa, é a infecção primária causada pelo vírus Varicella zoster (VVZ), um vírus ADN pertencente à família Herpesviridae.
A varicela no adulto associa-se a considerável morbi mortalidade. Das múltiplas complicações da varicela, a pneumonia a VVZ (PV) é a complicação mais grave e mais frequente nos adultos, sendo potencialmente fatal. As chaves no tratamento da pneumonia a Varicella zoster passam pela precocidade do diagnóstico e na instituição de terapia adequada. O aciclovir constitui o fármaco de 1.ª linha, apesar da inexistência de evidência da sua eficácia. A corticoterapia tem vindo a ser cada vez mais preconizada. Aquando da necessidade de suporte ventilatório, a utilização de PEEP (positive end-expiratory pressure) elevado é relevante.
Patogénese
Os dados disponíveis sobre a fisiopatologia da varicela são limitados. Não se sabe ao certo a porta de entrada do VVZ no nosso organismo – conjuntivas, faringe ou pulmões –, após o que se segue um período de incubação médio de cerca de 15 dias. O VVZ multiplica-se inicialmente nos gânglios regionais e cerca de 4-6 dias depois ocorre a primeira viremia subclínica, durante a qual se verifica disseminação visceral. O vírus passa então a replicar-se no sistema reticuloendotelial, sobretudo a nível dos macrófagos1, ocorrendo a segunda viremia, aproximadamente 14 dias após a infecção, com disseminação vírica à mucosa da nasofaringe e à pele, manifestando-se sob a forma do típico exantema maculopapulovesicular10. O VVZ transmite-se por gotículas da nasofaringe e, menos frequentemente, por contacto directo a partir do líquido das vesículas de varicela e da zona7. O contágio pode ocorrer de 1 a 2 dias antes do aparecimento do exantema até 48h após formação da última crosta7.
A infecção primária é habitualmente ligeira e os sintomas duram cerca de uma semana, conferindo imunização vitalícia7. A disseminação pulmonar do VVZ, ocorrida aquando da segunda viremia, produz uma pneumonite intersticial disseminada com consolidações hemorrágicas dispersas. As alterações histopatológicas manifestam-se como uma florida reacção imune, caracterizada por infiltrados intersticiais de células mononucleadas, edema septal, destruição do endotélio capilar, necrose fibrinóide, preenchimento alveolar por fluido proteináceo rico em eritrócitos e células mononucleadas. Os infiltrados neutrofílicos são inespecíficos e sugestivos de sobreinfecção bacteriana.
Epidemiologia
Apesar de apenas 7% dos adultos serem seronegativos1, desde a década de 80 que a incidência da infecção em adultos tem vindo a aumentar, a par do aumento de admissões hospitalares e da mortalidade. Embora ocorram pouco mais de 2% dos casos em adultos, a doença é mais severa e as complicações são 25 vezes mais frequentes do que nas crianças7, particularmente as neurológicas e as respiratórias.
A PV foi reconhecida como entidade clínica em 1942. Apesar de rara, é a complicação mais frequente e mais grave da varicela nos adultos1,3, apresentando uma incidência aproximadamente de 1 por cada 400 casos de infecção1, ou seja, cerca de 25 vezes a das crianças. Entre 5 a 50% de todos os casos de PV2,3,21 ocorrem em adultos previamente saudáveis, maioritariamente da 3.ª à 5.ª décadas de vida. Consideram-se factores de risco para o desenvolvimento de pneumonia: tabagismo7,11,12,17,21, gravidez (sobretudo 2.º e 3.º trimestres)1,7,11,12,21, compromisso imunológico1,7,11,21, idade avançada10,21, convívio próximo com o caso-índice1, sexo masculino11 e doença pulmonar crónica1,12,21. Outras variáveis associadas ao desenvolvimento de PV foram: febre superior a 38,3.ºC17, lesões cutâneas em número superior a 10017 ou exantema cutâneo/hemorrágico severo21, enantema da cavidade oral17, hepatite17 e migração de áreas de baixa prevalência de VVZ7. A presença de mais que um factor de risco associa-se a progressão para PV severa e constitui factor preditivo para admissão em UCI12.
O risco aumentado nos fumadores parece estar relacionado com o efeito do tabaco sobre os macrófagos pulmonares, tornando estes indivíduos mais susceptíveis à infecção pelo VVZ12. Alguns autores referem que, em relação aos casos de varicela no adulto, cerca de 50% dos fumadores desenvolvem pneumonia, em contraposição com 3% dos não fumadores3.
A incidência de pneumonia entre grávidas com varicela é de 9 a 40% e habitualmente severa1,3,7. A PV foi também reconhecida como relativamente comum em doentes imunocomprometidos (Quadro I). Tem-se verificado maior incidência nos receptores de transplante de medula óssea (até 50%) e nas crianças com neoplasias (até 20% na leucemia e 32% nos tumores sólidos).
Quadro I – Factores contribuintes de risco acrescido para desenvolvimento de pneumonia a varicela

A varicela é particularmente severa em indivíduos imunocomprometidos, para os quais o risco de disseminação visceral é elevado (30 a 50%), encontrando-se significativamente aumentada nos casos de doença de enxerto vs hospedeiro. O risco para PV é também superior. O período de contágionestes doentes prolonga-se várias semanas10 e a cura demora até o triplo do tempo. O melhor factor preditivo de disseminação pulmonar encontrado foi a contagem absoluta de linfócitos (CAL) aquando da infecção, ocorrendo em 48% dos doentes com CAL inferior a 500 células/μL e em 21% dos que apresentavam CAL superior a 500 células/μL. Com o declínio da CAL, o risco para PV aumenta, atingindo os 71% para CAL inferior a 100 células/μL. Em conformidade, o risco de mortalidade passou de 7% nos casos com CAL superior a 500 células/ μL para 29% naqueles com CAL inferior a 100 células/μL.
Relativamente à mortalidade, à PV no adulto não tratada está associada uma pesada taxa de 10 a 30%3,11, sendo mais elevada nos imunocomprometidos e nas grávidas (entre 30 e 40%2), chegando mesmo a atingir os 50% se falência respiratória com necessidade de ventilação mecânica invasiva (VMI)11. A idade superior a 65 anos, o compromisso do estado imunológico e a falência renal aguda parecem favorecer o aumento da mortalidade por PV.
A mortalidade por PV, antes da introdução do aciclovir, variava entre 7 e 19%1,12. Contudo, tem-se verificado uma diminuição da mortalidade por PV (de 19% nas décadas de 60-70 para 6% na de 9011). Esta melhoria parece estar relacionada não somente com a disponibilidade e instituição precoce do anti-vírico, bem como com a maior experiência por parte dos profissionais de saúde, com a maior precocidade do diagnóstico e com o melhor suporte respiratório nas UCI.
Clínica
Na maioria dos casos, o exantema característico estabelece o diagnóstico clínico, frequentemente em associação com história recente de exposição. O diagnóstico diferencial de varicela passa por: reacções alérgicas (síndroma de Stevens-Johnson), zona generalizada, infecções por herpes simplex ou enterovírus, rickettsiose vesiculosa, pitiríase liquenóide e varioliforme aguda e psoríase gutata.
O diagnóstico de PV é dificultado pela baixa frequência de sintomatologia típica (101,7 a 25%1 dos doentes). Constituem sinais precoces de risco para desenvolvimento de pneumonia a erupção continuada de novas lesões, a persistência da febre e a ocorrência de tosse de novo3. Febre, tosse, dispneia/taquipneia, toracalgia pleurítica e hemoptises são apanágio de infecção pulmonar severa. Em 50 a 75% dos doentes, a pneumonia é acompanhada ou precedida em 1 a 2 dias por dor abdominal ou dorsolombar severa e por vezes persistente, tipo neuropático, de origem vírica ou imunológica. O exame objectivo pode revelar adicionalmente alteração do estado mental, sinais de dificuldade respiratória, crepitações bibasais e inevitavelmente o exantema característico, uma vez que a pneumonia se estabelece cerca de 1 a 6 dias após o mesmo e só muito raramente antes. As vesículas geralmente visualizam-se também no palato e vias respiratórias superiores, mediante laringoscopia.
Exames complementares de diagnóstico
Analiticamente, é frequente encontrar-se trombocitopenia moderada, hiponatremia e elevação das transaminases7, das enzimas musculares e da amilase. Menos frequentemente, pode verificar-se disfunção renal.
O VVZ pode ser identificado mediante cultura (requer 3 a 5 dias), indirectamente por PCR ou testes antigénicos rápidos de imunofluorescência indirecta (resultados em 1-2h). Os testes serológicos permitem obter resultados mais tardios, sendo o FAMA (fluorescent antibody to membrane antigen) tido como gold standard. Podem ocorrer reacções cruzadas com o vírus herpes simplex tipo 1 (VHS1), indicativo de homologia de sequência de aminoácidos da glicoproteina B do invólucro vírico10. A ocorrência de reacções cruzadas com o VHS1, a não definição do tempo para seroconversão e o facto de a inexistência de anticorpos não excluir infecção podem condicionar dificuldades na interpretação dos testes serológicos.
A realização/monitorização da oximetria é um procedimento muito importante no reconhecimento precoce de PV, uma vez que a hipoxemia precede frequentemente a dispneia e os achados radiológicos12, constituindo um sinal de alerta para gravidade clínica. A gasometria arterial evidencia frequentemente insuficiência respiratória tipo 1 com normocápnia7.
A radiografia do tórax deve ser realizada a todos os adultos com varicela6,7. Em 1965, num estabelecimento militar norte-americano, 16% dos indivíduos com varicela apresentavam alterações radiológicas1,7,21, dos quais apenas ¼ se encontravam sintomáticos. Pode revelar infiltrado reticulonodular difuso, mas poupando os vértices. Inicialmente, os nódulos apresentam diâmetros de 2 a 5 mm e são mais facilmente visualizados à periferia ou no perfil. Com a progressão da doença, os nódulos aumentam e coalescem, resultando em infiltrados extensos. Nos casos ligeiros, os infiltrados podem resolver em 3 a 5 dias, enquanto nas formas disseminadas e severas podem persistir durante várias semanas. São achados pouco frequentes nas fases iniciais: derrame pleural, adenopatias hilares e pneumotórax. O diagnóstico diferencial coloca-se com as diversas causas de infiltrados reticulonodulares (Quadro II). A extensão das alterações radiológicas não tem correlação directa com a severidade da morbilidade pulmonar (PaO2/FiO2), mas parece reflectir a intensidade do exantema7.
Quadro II – Causas principais de Infi ltrado reticulo nodular – diagnóstico radiológico diferencial com PV

A tomografia computorizada (TC) torácica permite a visualização de nódulos isolados, nódulos com imagem em vidro despolido circundante, imagens em vidro despolido isoladas e lesões coalescentes. Sugere-se a sua realização para avaliação do envolvimento pulmonar em doentes com varicela e sintomas respiratórios, mas sem alterações na radiologia convencional14. A broncoscopia permite observação de lesões vesiculares brônquicas. O lavado bronco broncoalveolar apresenta aumento de contagem absoluta de linfócitos e diminuição da relaçãoCD4/CD8 6,7.
Tratamento
Perante um doente com sinais de dificuldade respiratória, deve instituir-se imediatamente oxigenoterapia de alto débito e mantê-lo sob vigilância clínica e oximetria de pulso contínua. As opções terapêuticas no caso de falência respiratória incluem ventilação mecânica não invasiva (pressão positiva contínua – CPAP ou binível – BIPAP) e VMI7. Alguns autores advogam que a frequência respiratória na admissão pode ter valor preditivo para a necessidade de suporte ventilatório. Os doentes submetidos a VMI beneficiam de PEEP elevada e, eventualmente, de prone position para optimização da função diafragmática e da relação V/Q. Numa série de 7 doentes com falência respiratória refractária, a modalidade de ventilação convencional, foi instituída oxigenação por membrana extracorpórea, com boa resposta em 5 doentes8.
Dada a elevada prevalência de infecções bacterianas secundárias, os antibióticos são frequentemente utilizados de acordo com o estado imunológico do doente e com a estirpe e sensibilidade identificadas. A aplicação tópica de clorhexidina pode reduzir a colonização cutânea por microrganismos Gram positivos7. O aciclovir é de uso mandatório em doentes com risco de doença severa (imunocomprometidos, recém-nascidos de mães com varicela no periparto) e/ou complicações. É recomendado o seu uso no caso de indivíduos com idade superior a 13 anos, crianças com mais de 1 ano com patologia crónica (pulmonar ou cutânea) e em utilizadores crónicos de salicilatos10. O aciclovir demonstrou reduzir a mortalidade em indivíduos com varicela complicada por pneumonia, quer em imunocompetentes, quer em imunocomprometidos e grávidas7,13. Tem maior eficácia se administrado por via intravenosa e nas primeiras 72h de doença10 ou nas primeiras 24h de exantema7, associando-se a melhoria clínica (desaparecimento da febre e taquipneia), da oxigenação e a uma mais rápida resolução da pneumonia. Para o tratamento da pneumonia, a via de administração preferida é a intravenosa3, na dose de 5-15 mg/kg cada 8h, durante 7-10 dias. Embora menos sensível ao aciclovir que o VHS, o VVZ é inibido para concentrações séricas do aciclovir de 0,08 a 1,2mg/L, sobejamente alcançadas pelas doses preconizadas. A dose deve ser ajustada na insuficiência renal, devido à potencial nefrotoxicidade.
Outros efeitos secundários importantes são o desenvolvimento de flebites nos locais de infusão, disfunção neurológica (desorientação, tremores) e elevação das transaminases. A resistência do VVZ ao aciclovir é pouco frequente, tendo sido relatada sobretudo entre doentes infectados pelo VIH, podendo utilizar-se em alternativa o foscanert por via intravenosa. Os pró-fármacos do aciclovir (valaciclovir e famciclovir) apresentam biodisponibilidde oral acrescida de 60 e 80%, respectivamente, em comparação com o aciclovir. Uma vez que as concentrações mínimas inibitórias para o VVZ não são alcançadas com a administração do aciclovir por via oral, no ambulatório é preferível a utilização do valaciclovir (pró -fármaco disponível em Portugal), 1g cada 8 horas durante 7-10 dias.
A utilização de corticosteróides como coadjuvantes no tratamento da PV, se bem que controversa, é advogada pela maioria dos autores. Os corticóides exercem modulação da resposta inflamatória intrapulmonar e têm demonstrado sucesso noutras doenças infecciosas e não infecciosas (tuberculose pulmonar miliar, Pneumocystis jirovecii, vasculite, aspiração de conteúdo gástrico, fase fibroproliferativa do ARDS), limitando a deterioração da função respiratória11. Num estudo retrospectivo e prospectivo envolvendo 15 doentes com PV, em que a 6 deles foi administrado 200mg de hidrocortisona intravenosa cada 6h durante 48h, com início nas primeiras 24h de admissão na UCI, verificou-se diminuição da duração do internamento (quer na UCI, quer hospitalar) e da mortalidade. Ocorreu também uma mais rápida recuperação radiológica e das trocas gasosas, bem como menor número de complicações11. Os corticóides parece modificarem a resposta inflamatória que o vírus desencadeia sobre o parênquima pulmonar quando administrados precocemente11. Há necessidade de realizar estudos randomizados para aferir o grau de evidência da utilidade dos corticosteróides na PV.
Profilaxia
O VVZ tem baixa variabilidade molecular, só tendo sido identificados três genótipos major até à data10, já todos completamente sequenciados. A vacina, de vírus vivo atenuado, é cerca de 80 -85% eficaz contra a doença de uma forma geral e altamente eficaz (> 95%) na prevenção de casos graves10.
Em Portugal não está incluída no Plano Nacional de Vacinação, existindo no mercado duas formulações da vacina disponíveis. A Sociedade Portuguesa de Pediatria recomenda a vacinação de crianças com idade superior a 2 anos e doença crónica (fibrose quística, diabetes, etc.) e de adolescentes não imunes e advoga a realização de estudos custo/benefício para a vacinação universal.
Com a implementação em 1995 do programa de vacinação na infância nos EUA, a mortalidade relacionada com a varicela sofreu uma quebra dramática (de 0,41/1 000 000 para 0,14/1 000 000 habitantes, p<0,001)9, verificando-se concomitantemente redução da incidência da doença, complicações e admissões hospitalares10,18,19. Contudo, a maioria das mortes que continuam a ocorrer são entre indivíduos sem factores de alto risco e elegíveis para vacinação9. A vacina está contraindicada nos indivíduos imunossuprimidos e nas grávidas. Na Europa tem aprovação para indivíduos imunocomprometidos com mais de 1200 linfócitos/μL10. A vacina também tem eficácia na pós-exposição, prevenindo e modificando a varicela em cerca de 96% dos indivíduos expostos, se administrada nas primeiras 72h, ou em 67% dos casos se administrada nos primeiros 5 dias10.
A imunização passiva com a IGVZ (imunoglobulina anti-varicela zoster) reduz a incidência de varicela clínica em 50% dos doentes quando administrada nas primeiras 72 a 96h de exposição, ao prevenir a progressão da doença antes da primeira viremia. Os restantes 50% apresentam formas ligeiras ou subclínicas. Contudo, em pequena percentagem de doentes imunocomprometidos, pode ocorrer pneumonia, devendo este subgrupo ser tratado com aciclovir3. A IGVZ está indicada para grávidas, recém-nascidos cujas mães contraíram varicela até 7 dias antes a 2 dias após o parto, indivíduos imunocomprometidos e para profissionais de saúde não imunes após exposição ocupacional. Um estudo japonês de 1993, não controlado e não randomizado, sugere que a administração de aciclovir entre o 7.º e o 9.º dias do período de incubação previne a varicela3.
Existem poucos estudos em doentes imunocomprometidas, mas a implementação de aciclovir em altas doses em associação com a IGVZ ou isoladamente (janela temporal para administração IGVZ ultrapassada) pode ter a sua utilidade neste grupo de alto risco.
Complicações e sequelas pulmonares
As infecções bacterianas ou sépsis devido a sobreinfecção pulmonar ou cutânea ocorrem em 25-50% dos doentes com PV3,7. Os cocos Gram-positivos (sobretudo, Streptococcus â-hemolíticos do grupo A e Staphylococcus aureus) são os agentes etiológicos principais nos doentes com contagem de neutrófilos superior a 500/μL. Aquando de neutropenia (<500/μL), o risco de infecção aumenta, nomeadamente por bacilos entéricos Gram-negativos e fungos.
Nos doentes ventilados verifica-se maior risco de infecções nosocomiais3 e de desenvolvimento de pneumomediastino e pneumotórax3. A hemorragia pulmonar, complicação tardia, resulta da lesão difusa e necrose focal de grandes vasos, frequentemente acompanhada de coagulação intravascular disseminada3. Do conjunto de sequelas pulmonares descritas em indivíduos com passado de PV, os defeitos de difusão de CO3, a diminuição da tolerância ao exercício3 e o desenvolvimento de padrão restritivo3,7 são as que cursam com maior incapacidade, porém apresentam evolução favorável. Podem ainda manter-se durante anos nódulos de tecidos moles7 e, decorridos 2 anos, é frequente a observação de microcalcificações pulmonares miliares residuais, com cerca de 2-3mm3,7, em radiografia do tórax.
Caso clínico
Indivíduo de 38 anos, sexo masculino, fumador (15 UMA), recorre ao serviço de urgência em 14/02/2006 por quadro, com três dias de evolução, composto por epigastralgia, odinofagia e exantema. A apresentação cutânea consiste em lesões papulares localizadas ao tronco com subsequente distribuição centrífuga e generalização, com evolução simultânea para vesículas. É admitido o diagnóstico de varicela, sendo medicado com omeprazol e ebastina para o ambulatório. Dois dias depois é reencaminhado ao SU por agravamento das lesões cutâneas e disfonia ligeira, havendo ainda referência a tosse seca e sudorese nocturna.
Ao exame objectivo apresentava-se com normal estado mental, corado, hidratado, anictérico, eupneico, febril (temperatura axilar = 38,5.ºC), normotenso, com placas brancas destacáveis na mucosa da cavidade orofaríngea compatíveis com candidíase, sem alterações auscultatórias cardio pulmonares e com exantema maculopapulovesicular generalizado. Analiticamente apresentava trombocitopenia moderada (86 000 × 109/L), hipoprotrombinemia (70%), citólise hepática com TGO de 560 UI/L e TGP 698 UI/L, LDH de 2042 UI/L e PCR de 0,4 mg/dL. A radiografia do tórax revela um infiltrado micronodular bilateral. O doente é internado no serviço de Medicina Interna, admitindo-se candidíase orofaríngea e exantema a esclarecer, instituindo-se terapêutica com fluconazol.
No primeiro dia de internamento (D1) verificam-se baixos valores da oximetria de pulso, com evidência de insuficiência respiratória tipo I (pH 7,422, pCO2 34 mmHg, pO2 50,8 mmHg, HCO3 22,6 mMol/L, SpO2 87,1%). Inicia-se oxigenoterapia suplementar com FiO2 de 50%, com boa resposta gasimétrica. Por apresentar serologia compatível com infecção aguda por citomegalovírus (CMV), admite-se infecção diseminada a CMV e institui-se terapia com Ganciclovir e profilaxia de sobre infecção bacteriana com flucloxacilina. As serologias para VIH, VHB, VHC e VDRL resultam negativas.
Ao D2, apresenta agravamento clínico e radiológico, com exantema mais exuberante (Figs. 1-4). Este caracteriza-se por lesões em diversas fases de evolução (pápulas eritematosas, vesículas claras, vesículas com conteúdo turvo, vesículas com umbilicação central, vesículas com zona central necrótica e pústulas), algumas com 1 cm de maior diâmetro, localizado preferencialmente à face, pescoço e couro cabeludo e com preservação das plantas e palmas. Adicionalmente, desenvolve edema periorbitário bilateral e dos tecidos moles do pescoço; adenomegalias submandibulares, laterocervicais e cervicais posteriores fusiformes, elásticas e dolorosas; febre elevada; taquipneia e fervores crepitantes bibasais à auscultação pulmonar.
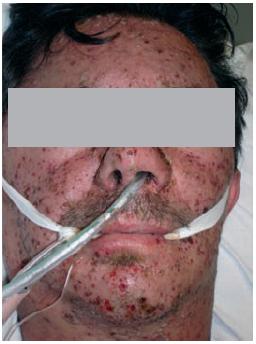
Fig. 1 – Edema periorbitário bilateral e dos tecidos moles do pescoço
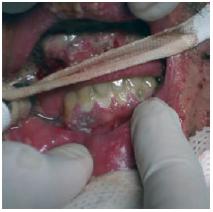
Fig. 2 – Enantema da cavidade oral
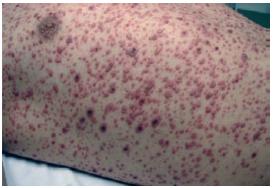
Fig. 3
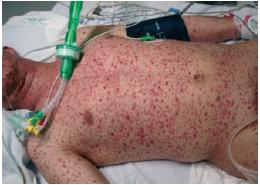
Figs. 3 e 4 – Exantema exuberante com lesões em diversas fases de evolução (pápulas eritematosas, vesículas claras, vesículas com conteúdo turvo, vesículas com umbilicação central, vesículas com zona central necrótica e pústulas), algumas com 1 cm de maior diâmetro. Localizado preferencialmente à face, pescoço e couro cabeludo e com preservação das plantas e palmas
A radiografia torácica revela agravamento do infiltrado reticulonodular bilateral (Fig. 5). Perante insuficiência respiratória, hipoxemia com necessidades crescentes de oxigenoterapia suplementar, o doente é admitido na UCIP. É conectado a prótese ventilatória, na modalidade de volume controlado e com necessidade de PEEP elevado – 10 cmH2O e FiO2 de 80%, para uma PaO2/FiO2 de 205 mmHg. Admitida Pneumonia a Varicella zoster, institui-se aciclovir 10 mg/kg ev 8/8h e prednisolona 60mg oral id.
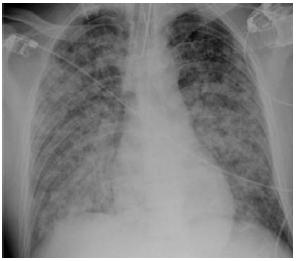
Fig. 5 – Radiografia do tórax – Infiltrado intersticial difuso bilateral com padrão nodular
Realiza endoscopia digestiva alta e ecografia cervical constatando-se espectivamente esofagogastroduodenite erosiva, com lesões sugestivas de atingimento esofágico por VVZ (excluindo-se lesões por cândida) e adenite das glândulas salivares, adenopatias e celulite do pescoço.
Ao D4, objectiva-se agravamento da relação PaO2/FiO2 para 160 mmHg, pelo que se admite ARDS primário. Posteriormente, verifica-se evolução favorável do quadro clínico, com diminuição progressiva da temperatura central, inicialmente de 41.ºC; resolução do edema cervical; regressão parcial do exantema, controlo da sobreinfecção bacteriana cutânea com ácido fusídico e iodopovidona; melhoria do infiltrado radiológico e da relação PaO2/FiO2, permitindo o desmame do ventilador a partir do D6 e extubação com sucesso ao D7. Manteve estabilidade eléctrica e hemodinâmica, bem como função renal e natremia normais. As serologias para VVZ, CMV e HSV1+2 foram positivas e compatíveis com infecção recente. Ao D7 regressa à enfermaria de medicina onde tem como intercorrência pneumonia nosocomial necrotizante do LID sem agente isolado tratada com piperacilina+tazobactam (Fig. 6). Tem alta após 25 dias de internamento, mantendo condensação radiológica com cavitação central em resolução.
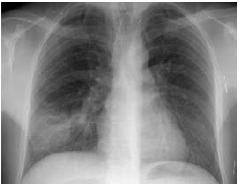
Fig. 6 – Radiografia do tórax – Condensação pneumónica à base do pulmão direito, com cavitação central e nível
Na primeira consulta de seguimento é medicado com amoxicilina+ácido clavulânico por tosse produtiva.
Na segunda consulta, 23 dias após a alta, é reinternado por suspeita de tuberculose pulmonar no contexto de febrícula e tosse produtiva arrastadas, com referência a toracalgia pleurítica na base direita com três dias de evolução. Durante o segundo internamento, realizou-se TC torácica que revelou uma massa sólida de morfologia triangular e base externa nos segmentos posteriores do LID compatível com consolidação parenquimatosa escavada e abcedada ou lesão tumoral necrosada (Fig. 7); broncofibroscopia com observação de grande quantidade de secreções grumosas nas árvores brônquicas, resultando a pesquisa de células neoplásicas negativa e o exame de amostra de biópsia transbrônquica revelando processo inflamatório intenso, misto, sem especificidade; BATT, cujo exame revelou parênquima pulmonar com lesão inflamatória crónica, transitando para área de condensação e ausência de características histomorfológicas de tuberculose e de lesão neoplásica; e diversas culturas, não se conseguindo qualquer isolamento microbiológico, nomeadamente de fungos ou micobactérias.
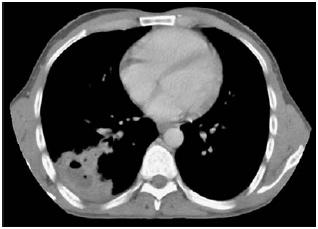
Fig. 7 – TAC torácica – Nos segmentos posteriores do LID, observa-se uma massa sólida de morfologia triangular de base externa, com limites irregulares. Apresenta realce heterogéneo com contraste, áreas centrais hipodensas e ar no seu interior, medindo 8x6 cm. As alterações descritas poderão corresponder a consolidação parenquimatosa escavada e abcedada ou a lesão tumoral necrosada
É diagnosticada pneumonia escavada do LID sem agente isolado, após exclusão de tuberculose e neoplasia pulmonares, apresentando boa evolução clínica, analítica e radiológica, mediante tratamento com vancomicina em perfusão contínua.
Durante o seguimento, manteve-se assintomático, com fibrose residual radiológica (Fig. 8), mas sem outras sequelas. Em Outubro de 2006, tem alta da consulta de Medicina Interna.
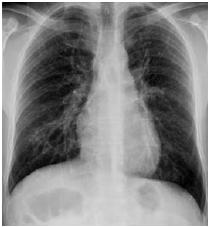
Fig. 8 – Radiografia do tórax – Fibrose residual bilateral, sobretudo ao campo pulmonar inferior direito
Discussão
No caso apresentado o doente contraiu a infecção em Fevereiro, em concordância com o pico de incidência da varicela no final do Inverno, não tendo sido identificada a fonte de contágio. Os factores de risco encontrados para desenvolvimento de PV foram apenas o sexo masculino e o tabagismo. No entanto, também apresentou outras variáveis para as quais se encontra estabelecido na literatura algum grau de associação a PV: febre elevada, exantema cutâneo grave com mais de 100 lesões, enantema da cavidade orofaríngea e hepatite. Analiticamente verificou-se ainda trombocitopenia moderada sem diátase hemorrágica. O facto de as serologias para VVZ, CMV e VHS1+2 terem sido positivas e compatíveis com infecção recente, é seguramente o resultado da ocorrência de reacções cruzadas entre os diversos herpesvírus.
Realizou-se com sucesso profilaxia da sobreinfecção bacteriana cutânea, tendo ocorrido sobre infecção pulmonar, que pode acontecer em até 50% dos doentes com PV, favorecida neste caso pelo suporte ventilatório invasivo. Esta intercorrência prolongou significativamente o internamento hospitalar e obrigou a segundo reinternamento por reinfecção da cavitação pulmonar. Não se verificaram outras complicações da varicela e foi realizado estudo com exclusão de neoplasia ou compromisso da imunidade celular, nomeadamente serologia para o VIH.
O aciclovir foi neste caso instituído tardiamente (7.º dia de exantema e 4.º dia de sintomas respiratórios), devido à assunção prévia de infecção disseminada por CMV, diagnosticada pela respectiva serologia, que interpretamos a posteriori como reacção cruzada. Contudo, e apesar de o risco de morte neste doente ser cerca de 50%, verificou-se evolução favorável.
A utilização de corticóides parece-nos valorizável, tendo favorecido a boa evolução da PV, bem como a extubação com sucesso ao fim de 5 dias, apesar do desenvolvimento de ARDS.
Conclusões
As chaves no tratamento da PV passam pela precocidade no diagnóstico e na instituição de terapia adequada. O diagnóstico é habitualmente clínico e eventualmente induzido por história de exposição. Em todos os doentes com varicela deve ser investigada a existência de factores de risco para complicações, designadamente para PV. No doente com varicela, deve-se estar atento à possibilidade de múltiplas complicações, enfatizando a necessidade de vigilância clínica apertada. A probabilidade de desenvolvimento de falência respiratória com necessidade de ventilação mecânica é difícil de estabelecer no início da doença. A qualquer doente adulto assintomático com varicela deve realizar-se radiografia torácica e oximetria/gasometria arterial. O doente com alterações radiológicas ligeiras e com normal saturação de O2 pode ter alta medicado com valaciclovir, devendo ser reavaliado dentro de 24 a 48h. Os doentes que apresentem qualquer grau de hipoxemia devem ser admitidos com monitorização da SpO2 contínua.
O aciclovir constitui o fármaco de primeira linha, devendo ser iniciado de imediato, se possível nas primeiras 24h de exantema ou nas primeiras 72h de doença. A profilaxia de sobre infecção bacteriana cutânea deve ser universal. A utilização de corticoterapia e, nos doentes com suporte ventilatório, de PEEP elevado, parecem-nos relevantes.
Bibliografia
1. Mohsen AH and McKendrick M. Varicella pneumonia in adults. Eur Resp J 2003; 21:886-891.
2. Hockberger RS and Rothstein RJ. Varicella Pneumonia in adults: A spectrum of disease. Annals of Emergency Medicine 1986; 15:117-120.
3. Feldman S. Varicella-zoster pneumonitis. Chest 1994; 106:22-27. [ Links ]
4. Ong EL, Mulvenna P, Webb KA. Varicella-zoster infection in adults with cystic fibrosis: role of acyclovir. Scand J Infect Dis 1991; 23:283-285.
5. MacDonald NE, Morris RF, Beaudry PH. Varicella in children with cystic fibrosis. Pediatric Infect Dis J 1987; 6:414-416.
6. Shirai T, et al. Varicella pneumonia in a healthy adult presenting with severe respiratory failure. Internal Medicine 1996; 35(4):315 -318.
7. Nee PA, Edrich PJ. Chickenpox pneumonia: case report and literature review. J Accid Emerg Med 1999; 16:147 -154.
8. Lee WA, Kolla S, Schreiner RL, et al. Prolonged extracorporeal life support (ECLS) for varicella pneumonia. Crit Care Med 1997; 25:977 -82.
9. Huong QN, Aisha OJ, Jane FS. Decline in mortality due to varicella after implementation of varicella vaccination in the United States. NEJM 2005; 352:450-458.
10. Heininger U, Seward JF. Varicella. Lancet 2006; 368:13651376
11. Mer M, Richards GA. Corticosteroids in life–threatening varicella pneumonia. Chest 1998; 114:426-431.
12. Jones AM, Thomas N, Wilkins EGL. Outcome of varicella pneumonitis in immunocompetent adults requiring treatment in a high dependency unit. J Infect 2001; 43:135-139.
13. Enders G, Miller E. Varicella and herpes zoster in pregnancy and the newborn. Varicella zoster virus: Basic virology and clinical management. Cambridge: Cambridge University Press, 2000
14. Kim JS, et al. High -resolution CT findings of varicella-zoster pneumonia. AJR 999;172:113-116.
15. Gnann JW. Varicella-zoster virus: Atypical Presentations and unsual complications. JID 2002;186:S91-S98.
16. Dahan E, et al. Varicella zoster infection and pulmonary complications. Euro J Intern Med 2005;16:449-450.
17. Dehecq C, et al. Retrospective study of 106 cases of varicella in immunocompetent adults. Parameters associated with varicella pneumonia. Med Mal Infect. 2008 Dec 16.
18. Reynolds MA, et al. Epidemiology of varicella hospitalizations in the United States, 1995-2005. JID 2008;197:S120 -S126.
19. Chaves S, et al. Varicella disease among vaccinated persons: clinical and epidemiological characteristics, 1997 -2005. JID 2008; 197:S127-S131.
20. Whitley RJ. Varicella -zoster virus. In: Mandell GL, Bennett JE, Dolin R. Principles and practice of infectious diseases, 6th edition. Infectious Diseases and Their Etiologic Agents 133:1780-1786.
21. Dizon MN, Matfin G. Fever and dyspnoea in a young man with rash. Postgrad Med J 1999;75:251-253
Dr.ª Carla Ferreira Santos
Urbanização Quinta das Mesuras, Lote 9, 3.º Esq
3500-225 Viseu
Tel: 966 831 650
e-mail: cfsantos@sapo.pt
Recebido para publicação/received for publication: 09.03.26
Aceite para publicação/accepted for publication: 09.10.27













