Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Portuguesa de Ortopedia e Traumatologia
versão impressa ISSN 1646-2122versão On-line ISSN 1646-2939
Rev. Port. Ortop. Traum. vol.26 no.4 Lisboa dez. 2018
ARTIGO DE REVISÃO
Prótese total do joelho dolorosa - Abordagem diagnóstica
Ana Cristina P. GuimarãesI; Ricardo J.G. SousaII
I. Serviço de Ortopedia, Centro Hospitalar do Porto, Hospital de Santo António. Porto.
II. Unidade de Cuidados de Saúde Personalizados da Mealhada - Polo Pampilhosa.
RESUMO
A artroplastia do joelho é uma das cirurgias com maior sucesso em Ortopedia. Por isso, as indicações para a cirurgia têm vindo a expandir-se levando a um exponencial aumento no número de próteses realizadas em todo o mundo. Assim, a prevalência de doentes a viver com uma artroplastia do joelho e consequentemente em risco de falência é também cada vez maior. Apesar do seu sucesso, existe uma proporção relevante de doentes com mau resultado funcional cujo mecanismo subjacente de falência nem sempre é óbvio.
O objetivo deste artigo não é rever de forma exaustiva todos os possíveis modos de falência de uma artroplastia total do joelho, mas antes fazer uma revisão da abordagem diagnóstica perante uma prótese total do joelho (PTJ) dolorosa que facilite e torne reprodutível a elucidação do mecanismo de falência da prótese subjacente.
Os mecanismos abordados e mais difíceis de diagnosticar são a descelagem asséptica, a infeção, a instabilidade e o desalinhamento patelofemoral pela sua apresentação, por vezes fruste, associada a dor inespecífica no joelho. Nestes casos, para além da clínica, é importante recorrer aos exames auxiliares de diagnóstico numa tentativa de melhor elucidar qual o mecanismo subjacente à falência da prótese, não havendo um único exame de eleição na avaliação da PTJ dolorosa. É também discutido neste artigo a rigidez e outras causas menos comuns de PTJ dolorosa que são de diagnóstico mais evidente.
Palavras chave: Prótese total do joelho dolorosa, diagnóstico, descelagem assética, infeção, instabilidade, desalinhamento patelofemoral, rigidez.
ABSTRACT
Knee arthroplasty is one of the procedures in Orthopaedics with better results. Therefore, its indications are more extensive leading to a rising incidence and prevalence of knee arthroplasties worldwide as well as a rise in the number of total knee arthroplasties (TKA) in risk of failure. Nevertheless, there is an important proportion of patients with deficient functional results which failure mechanism is not always obvious.
This article does not aim to exhaustively analyse all failure mechanisms of a TKA but to review the diagnostic approach of a painful TKA providing an easy and reproducible explanation of the failure mechanism.
The broached and harder to diagnose mechanisms are aseptic loosening, infection, instability and patellofemoral maltracking because of its sometimes eased presentation associated with unspecific knee pain. In these cases, besides anamnesis, it is important use imaging studies to better elucidate the failure mechanism despite not existing a gold standard method. It is also discussed in this article stiffness and other less common causes of painful TKA which have a more obvious diagnose.
Key words: Total knee arthroplasty, diagnosis, aseptic loosening, infection, instability, patellofemoral maltracking, stiffness.
INTRODUÇÃO
Atualmente, a prótese total do joelho (PTJ) está indicada para o alívio da dor resistente ao tratamento conservador ou incapacidade funcional provocada por osteoartrose ou artrite inflamatória graves1. Devido aos bons resultados ao longo das últimas décadas, tem havido um aumento considerável da incidência de artroplastias do joelho a nível mundial1-6. Embora continuem a ser mais comummente realizadas entre a sétima e oitava décadas de vida, é importante referir que se observa uma paulatina diminuição da idade média de realização da primeira artroplastia2-6. A conjugação destes dois fatores conduz ao aumento considerável da prevalência de doentes a viver com uma PTJ e, por isso mesmo, um aumento do número de próteses em risco de falência2-6.
É difícil concretizar uma taxa de revisão global. A maior parte dos estudos publicados apresentam resultados de próteses específicas ou centros dedicados que, em geral, relatam baixas taxas de falência7. Todavia, os estudos populacionais apresentam taxas bastante superiores7. Certo é que a taxa de revisão em artroplastias primárias mais antigas é superior à das artroplastias realizadas nos últimos 20 anos3-6.
Estima-se que pelo menos 20% dos doentes com PTJ estejam insatisfeitos com o procedimento sendo a dor a queixa principal8. Diversas etiologias podem ser responsáveis pelo insucesso de uma PTJ. Alguns modos de falência, como fraturas periprotésicas, rotura do aparelho extensor ou falência do próprio componente, são em geral evidentes mas os mais frequentes, como descelagem assética, infeção, instabilidade ou dor anterior no joelho, podem ser bastante obscuros e difíceis de diagnosticar9.
Antes de considerar a cirurgia de revisão é essencial obter um diagnóstico concreto uma vez que a revisão por dor inexplicada está associada a pior prognóstico10,11. Assim, o objetivo principal deste artigo centra-se na elaboração de uma metodologia de abordagem diagnóstica racional e sequencial da PTJ dolorosa que permita ao ortopedista elucidar o mecanismo de falência subjacente.
A) DESCELAGEM ASSÉTICA
Descelagem (ou descolamento) assética refere-se à falência mecânica da interface hospedeiro-prótese com micro ou macromovimentos entre o componente e o osso adjacente12. Ocorre primariamente como resultado de perda óssea por um processo inflamatório focal que ocorre nesta interface despoletado por detritos particulados de desgaste gerados nas superfícies articulares de carga, não articulares e cimento12.
Em termos globais, esta é a complicação mais frequente, variando entre 25% e 47% como causa para revisão de prótese entre as diferentes séries e é especialmente comum após os primeiros dois anos, período onde a infeção predomina2-6,13,14.
Anamnese e exame objetivo
A descelagem deve ser um diagnóstico a considerar quando há inicialmente uma melhoria funcional seguida de um início tardio de dor ou disfunção e dor no início do movimento15. O exame objetivo é inespecífico embora, por vezes, seja possível localizar pontos de maior dor na interface prótese-hospedeiro16.
Exames auxiliares de diagnóstico
Radiografias
Os achados radiológicos sugestivos de descelagem são a presença de uma linha radiolucente superior a 2 mm e/ou com aumento progressivo, migração ou afundamento dos componentes com alterações no ângulo articular em carga, fratura do cimento ou reação à volta do topo da haste do componente17-20. O significado das linhas radiolucentes prende-se com a sua extensão (parcial ou completa) e a sua progressão ou estabilidade (medida em mm) em radiografias seriadas com orientação do componente e posição do membro idênticas21.
As linhas radiolucentes devem ser procuradas em radiografias do joelho nas incidências anteroposterior, perfil e axial da rótula com especial enfoque na interface prótese-hospedeiro embora, em fases iniciais, estas linhas estejam frequentemente ausentes21,22.
É importante referir que o verdadeiro significado clínico das linhas radiolucentes finas, parciais e não progressivas não é totalmente conhecido18,23. Uma radiolucência menor que 2 mm entre o cimento e o osso é considerada normal, aparecendo normalmente nos primeiros seis meses após uma prótese cimentada e nos primeiros dois anos após uma prótese não cimentada17,20,24-26. Estas linhas podem ser devidas a uma contração do cimento, a imperfeições dos cortes tibiais ou micromovimentos que impedem a normal osteointegração com subsequente deposição de tecido fibroso que, por sua vez, podem causar dor moderada17,20,25,26. Apesar destas linhas finas, parciais e não progressivas não afetarem a fixação da prótese, elas promovem a passagem de detritos para a interface prótese-hospedeiro facilitando assim a progressão da osteólise com consequente descelagem27. Doentes cujas radiografias precoces já apresentem linhas radiolucentes devem ser reavaliados em intervalos de tempo mais curtos para que se consiga identificar precocemente quais as próteses em maior risco de descelagem28. Outro fenómeno que merece ser diferenciado é a radiolucência e osteopenia periprotésicas que podem ser devidas ao stress shielding, nos casos em que se utilizem hastes de apoio diafisário, e que geralmente ocorre nos primeiros dois anos após a cirurgia17,24,29.
Numa tentativa de uniformizar a leitura das radiografias em PTJ, a Sociedade Americana do Joelho elaborou um sistema de avaliação em que se utiliza a espessura das linhas radiolucentes para classificar a estabilidade dos componentes (0 a 4 mm - não significativo; 5 a 9 mm - manter vigilância apertada; mais de 10 mm - descelagem)30. No entanto, esta metodologia revelou não ser suficientemente fiável23,31.
A posição relativa da prótese deve ser estimada pela medição dos ângulos de flexão femoral e tibial nas incidências anteroposterior e perfil sendo que a alteração da posição dos componentes deve alertar para o risco iminente de falência da prótese30. Aliás, o afundamento medial do componente tibial pode resultar no aparecimento de um alinhamento em varo de novo (mais comum nos componentes tibiais não cimentados) e traduz descelagem deste17-20. A descelagem femoral é menos frequente e mais difícil de detetar, estando tipicamente associada a um aumento progressivo na flexão do componente17-20,26,32.
Se as radiografias convencionais forem inconclusivas, pode optar-se por radiografias oblíquas ou guiadas fluoroscopicamente de forma a melhorar a visualização da interface hospedeiro-prótese15,17-20,29. Alguns autores defendem que as radiografias guiadas fluoroscopicamente permitem uma melhor deteção das linhas radiolucentes inclusivamente as menores que 1 mm para além de, por vezes, demonstrarem descelagem com a manipulação em tempo real31,33.
Globalmente, a avaliação radiográfica seriada tem uma sensibilidade de 77% e 83% para o fémur e tíbia, respetivamente, e uma especificidade de 90% para o fémur, mas apenas 72% para a tíbia34. Assim, o valor preditivo positivo (VPP) é muito superior para o fémur (91%) do que para a tíbia (77%) e o valor preditivo negativo (VPN) é relativamente baixo para ambos, 75% e 80% respetivamente34. Em suma, a exatidão diagnóstica é baixa rondando os 38%22.
Outros exames de imagem
Outros exames de imagiologia ou medicina nuclear podem ter interesse em casos pontuais perante uma suspeita de descelagem. É o caso da tomografia computadorizada (TC) que pode ter uma função complementar na determinação da existência, extensão e largura das linhas lucentes e da osteólise periprotésicas17,35. A ressonância magnética nuclear (RMN) tem um papel limitado na avaliação das artroplastias do joelho devido à maior suscetibilidade de artefactos associados às próteses metálicas requerendo por isso estratégias que os diminuam17,29,36.
A cintigrafia óssea trifásica com bifosfonados marcados com tecnécio é frequentemente solicitada durante o estudo de uma PTJ dolorosa para o diagnóstico de descelagem. Para melhor interpretar este exame é fundamental saber que a captação do radionuclídeo é influenciada pelo fluxo sanguíneo, atividade osteoclástica e tónus simpático18,20. Na primeira fase do exame observa-se a perfusão da lesão, na segunda fase observa-se a vascularização relativa da lesão e na terceira fase o turnover relativo do osso18. Qualquer condição fisiológica ou patológica que aumente a formação de osso causa um aumento da atividade periprotésica o que explica a baixa especificidade deste método37. É importante ter em conta que, após a artroplastia primária, uma captação periprotésica ligeira a moderada do radionuclídeo na terceira fase pode persistir, normalmente, durante cerca de um ano ou mesmo vários anos para próteses não cimentadas o que justifica a elevada percentagem de casos falsos-positivos (até 72%) numa fase precoce15,18,20,38,39.
Na aquisição no plano frontal, os achados associados a maior probabilidade de descelagem são a captação periprotésica mais extensa ou mais intensa na periferia dos componentes e a captação à volta das hastes tibial ou femoral comparativamente à captação sob o prato tibial17,18. Também na cintigrafia é essencial a obtenção de uma aquisição no plano sagital, para se adquirir uma perceção tridimensional da localização da hiperfixação22.
Tem sido sugerido que um cintilograma normal na segunda fase mas anormal na terceira com aumento focal ou generalizado da captação é mais sugestivo de descelagem assética enquanto que hipercaptação nas duas fases é mais sugestivo de infeção33,39. No entanto, é essencial reconhecer que a acuidade diagnóstica deste achado, para diferenciar de modo fiável entre descelagem sética e assética, é baixa33,39.
Num estudo recente, esta técnica apresentou uma sensibilidade de 76%, especificidade de 83%, VPP de 93% e VPN de 56% para descelagem assética40 porém outros estudos apresentam valores diferentes38. Para contornar o baixo valor preditivo de um único cintilograma, alguns autores recomendam a realização de cintigrafias ósseas seriadas33.
Outras técnicas de medicina nuclear são menos comuns entre nós, mas merecem ser referidas dado o seu aparente potencial. A tomografia computadorizada por emissão de fotão único (SPECT) hibridizada com TC (SPECT/TC) proporciona a deteção de alterações metabólicas e a sua localização anatómica o que é potencialmente vantajoso35,41. Embora alguns estudos demonstrem excelente acuidade diagnóstica41,42, não se conseguiu ainda provar qual a vantagem do uso isolado desta técnica face ao uso da cintigrafia óssea38. Outro exame que tem sido repetidamente sugerido neste contexto é a tomografia por emissão de positrões (PET), embora o seu real valor acrescido permaneça por provar37,43. À semelhança da cintigrafia óssea, numa fase precoce, verifica-se uma captação inespecífica devida à remodelação pós-operatória inviabilizando assim a técnica neste período37. Há também o risco de falsos-negativos na descelagem de componentes cimentados uma vez que não existem elementos celulares consumidores de glicose neste local44. É também importante referir que a técnica híbrida PET/TC poderá ter um elevado valor clínico pela maior sensibilidade para detetar a doença de partículas podendo prever a descelagem numa fase precoce37,45.
Outras técnicas como a artrografia com radionuclídeos ou a artrografia de subtração digital, embora menos estudadas, parecem ter uma acuidade diagnóstica limitada e não acrescentam informação relevante comparativamente aos exames mais tradicionais, por isso entendemos não se justificarem os riscos adicionais associados à necessária injeção de contraste (iodado ou radiofármaco) intra-articular19,20,22,29,32,34,37.
B) INFEÇÃO
Embora no plano teórico seja fácil definir infeção periprotésica (IPP) como falência de prótese causada pela presença de bactérias na interface hospedeiro-prótese, na prática pode ser extremamente difícil assumir em definitivo a sua presença ou ausência46. As IPP podem apresentar-se de forma inequívoca com um quadro infecioso agudo que pode surgir nas primeiras semanas após a cirurgia ou em qualquer outra altura da vida da prótese após um evento de disseminação hematogénea46. No entanto, a maioria das infeções são crónicas e têm uma apresentação frustre caracterizada apenas por dor persistente46. É nestes casos que o diagnóstico diferencial com os outros modos de falência protésica se torna crucial.
Recentemente, uma Reunião Internacional de Consenso procurou alcançar uma definição consensual de IPP que tem em consideração elementos de ordem clínica e laboratorial (Tabela 1). Todavia, o mesmo documento realça que a IPP pode estar presente mesmo na ausência destes critérios, especialmente no caso de infeções causadas por microrganismos menos virulentos46.
Em termos epidemiológicos, a IPP é das complicações mais frequentes ocorrendo em 20-30% das próteses com indicação para revisão, sendo ainda mais frequente se nos focarmos apenas nos primeiros anos após a PTJ primária2-6,13,14.
Anamnese e exame objetivo
Um dos principais achados clínicos sugestivos de infeção crónica é a dor persistente desde a cirurgia (“never right joint”)46. A presença de fatores de risco para infeção como história de múltiplas cirurgias na mesma articulação, comorbilidades predisponentes para imunossupressão (por exemplo diabetes mellitus, artropatia inflamatória, desnutrição), fatores que aumentam o risco de descontinuidade da pele (uso de drogas intravenosas, más condições de feridas, psoríase, estase venosa crónica ou ulceração da pele), episódios de bacteriemia recente e ainda antecedentes de IPP ou mesmo infeção superficial do local cirúrgico devem alertar para esta possibilidade46.
O exame físico pode ser extremamente inespecífico ou mesmo absolutamente normal. Achados como calor, hiperemia, edema articular, deiscência da ferida ou fístula cutânea devem ser pesquisados46.
Exames auxiliares de diagnóstico
Estudo analítico
Para além da anamnese, exame físico e estudo radiográfico básico, o estudo de uma eventual infeção implica o estudo de marcadores inflamatórios do sangue periférico46. A velocidade de sedimentação eritrocitária (VS) e a proteína C reativa (PCR) estão generalizadamente disponíveis e devem ser interpretadas em conjunto para uma melhor acuidade diagnóstica porque, como teste de rastreio que são, apresentam boa sensibilidade apesar de baixa especificidade46. É importante relembrar que se mantêm elevadas até 90 dias após a artroplastia primária (em especial a VS) e podem ser influenciadas por outras patologias infeciosas e/ou inflamatórias46. A sua interpretação deve seguir regras específicas consoante a cronologia da prótese em questão47.
Perante uma forte suspeita clínica de infeção ou VS superior a 30 mm/h e/ou PCR superior a 10 mg/L, o passo diagnóstico seguinte para exclusão de IPP deve ser a artrocentese para estudo do líquido sinovial46.
A tradicional coloração Gram do líquido aspirado tem uma sensibilidade baixa pelo que nunca deve ser utilizada como fator de exclusão de infeção48,49. O próprio exame cultural do líquido sinovial, embora indiscutivelmente importante e potencialmente informativo, também tem uma acuidade diagnóstica limitada pelo número importante de falsos-negativos e falsos-positivos50,51. O uso de uma fita-teste para pesquisa da esterase leucocitária no líquido sinovial (i.e. o vulgar Combur®) é um teste simples, instantâneo que pode ser realizado no consultório e potencialmente informativo46. Quando é absolutamente negativo apresenta um elevado VPN acima dos 95% e quando apresenta um resultado francamente positivo (++) o VPP do teste é também bastante elevado52-54. Todavia, o resultado é equívoco, se resultado fracamente positivo (+) ou mesmo ilegível, por exemplo no caso de aspirações sanguinolentas, numa proporção significativa dos casos55.
Apesar de todos os recentes avanços, a tradicional contagem diferencial de leucócitos do líquido sinovial é ainda um passo fundamental56-58. O já citado recente consenso coloca o limiar de diagnóstico acima dos 3000 leucócitos/mL e 80% de polimorfonucleares (PMN)46. No entanto, diversos trabalhos sugerem que no caso específico de próteses do joelho, o limiar do número total de leucócitos deve rondar os 1100-1700 leucócitos/mL com uma percentagem de PMN superior a 65%56-58. Com estes limiares de diagnóstico, a sensibilidade e especificidade deste teste são consistentemente superiores a 90%56-58.
O estudo do líquido sinovial é extremamente importante e tem sido alvo de recentes desenvolvimentos na busca de um biomarcador mais exato de infeção sendo que a PCR e a α-defensina parecem ser os mais promissores59-64. Na nossa instituição preconizamos a adoção de um limiar baixo para a contagem de leucócitos, complementando a sua interpretação com o doseamento da PCR de alta sensibilidade no líquido sinovial65.
Imagiologia
A radiografia convencional é indispensável pois pode revelar achados relacionados como descelagem de componentes, osteólise ou reabsorção óssea em torno dos componentes46. Em casos excecionais, pode mesmo ser evidente uma reação subperiosteal ou fístulas transcorticais46. As técnicas de medicina nuclear têm um papel limitado no diagnóstico da IPP. Faltam estudos sobre qual a técnica mais custo-efetiva e com melhor precisão diagnóstica mas claramente a utilização destas técnicas deve ser a exceção e não a regra no diagnóstico de IPP46. Na nossa realidade, foi já validada uma abordagem inicial com estudo de cintigrafia com anticorpos anti-leucócitos (Leukoscan®) seguido de uma cintigrafia medular óssea para eliminar os falsos-positivos66.
No intraoperatório
Embora escape um pouco ao âmbito desta revisão, não podemos deixar de referir que frequentemente, o diagnóstico definitivo de IPP só se pode obter depois da cirurgia de revisão46. É importante que se adote uma abordagem protocolada com recolha de amostras para estudo microbiológico em todos os casos de cirurgia de revisão46. Não é infrequente encontrar infeções mesmo em casos de revisão com diagnóstico pré-operatório de complicação assética67.
C) INSTABILIDADE
A instabilidade após PTJ pode ser definida como movimento anormal e excessivo do joelho com insuficiência dos ligamentos estabilizadores primários68,69. É a terceira causa mais frequente de revisão de PTJ dolorosa, presente em cerca de 15% dos casos2-6,13,14. Porém, é um dos diagnósticos mais difíceis de uniformizar pelo que se impõe alguma clarificação.
Classificação
A instabilidade pode ser classificada em termos temporais como precoce, surgindo nas primeiras semanas a meses, ou tardia68,70. A instabilidade precoce está maioritariamente relacionada com incorreções técnicas durante a realização da artroplastia15,71. Por sua vez, a instabilidade tardia está frequentemente associada ao incorreto posicionamento coronal dos componentes e subsequente desgaste assimétrico do polietileno ou mesmo descelagem15,71. No caso de próteses com preservação do ligamento cruzado posterior (CR), pode ocorrer também atenuação ou estiramento do ligamento cruzado posterior (LCP) com progressivo desgaste do polietileno e instabilidade tardia no plano sagital15,71. Já nas próteses postero-estabilizadas (PS), a instabilidade pode ser por desgaste significativo ou fratura da haste tibial15,71. A instabilidade também pode ser classificada em termos anatómicos podendo ocorrer em extensão ou flexão (Figura 1)72.
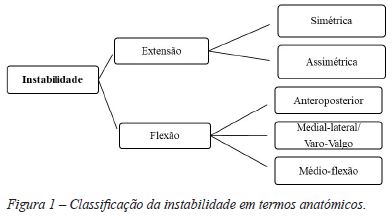
Instabilidade em extensão
A instabilidade assimétrica é a forma mais comum e pode ser devida a deformidades angulares residuais por deficiente correção, assimetria ligamentar induzida ou não corrigida durante a cirurgia ou por um evento traumático pós-operatório9,71-75. Pode também ocorrer tardiamente por desgaste do polietileno, pelo estiramento das estruturas laterais ou mediais secundário a posicionamento em varo ou valgo dos componentes ou mesmo pela descelagem do componente tibial71,72,76.
A instabilidade simétrica ocorre tipicamente quando o espaço de extensão não é adequadamente preenchido pelos componentes ou quando há uma resseção excessiva do fémur distal ou da tíbia proximal71,73,74. Nestes casos pode ocorrer uma deformidade em hiperextensão ou recurvatum do joelho estando em maior risco os doentes com patologia neuromuscular71,73.
Instabilidade em flexão
É definida como a presença de um espaço articular em flexão superior ao espaço em extensão e é frequentemente observada em doentes com próteses bem alinhadas axialmente e bem fixas68,71,74,76-78. Geralmente é avaliada com o joelho fletido a 90° e pode manifestar-se na direção anteroposterior ou medial-lateral79. Pode também estar presente de uma forma mais discreta apenas em médio-flexão79.
A instabilidade anteroposterior em flexão pode dever-se a resseção excessiva dos côndilos femorais posteriores, componente femoral de pequena dimensão ou corte tibial com inclinação posterior (slope) exagerada68,71,76,77. A atenuação ou rotura do LCP após artroplastia com prótese CR ou laxidez dos ligamentos colaterais em doentes com prótese PS são outras possíveis etiologias9,68,71,74,76. Nos doentes com próteses PS, a instabilidade está associada à presença de um espaço em flexão amplo o suficiente para permitir uma translação tibial anterior substancial (>10 mm) sendo que a verdadeira luxação é muito rara (<0.5%)68,73-75,80.
A instabilidade medial-lateral ou varo-valgo em flexão é devida, na maior parte dos casos, a erros técnicos durante a cirurgia que condicionam um desequilíbrio entre os espaços de flexão-extensão79. A instabilidade em médio-flexão é uma forma mais discreta de instabilidade após PTJ, sendo mais comum após uma resseção femoral distal extensa e utilizando uma prótese PS com o objetivo de corrigir uma contratura em flexão pré-operatória76,81. Os ligamentos colaterais vão ficar mais laxos pela elevação da linha articular conduzindo à instabilidade do joelho no plano coronal a partir da flexão em 20-30°74,76,81,82. Os doentes com joelho valgo também têm uma maior tendência para a instabilidade em médio-flexão após PTJ72,82.
Anamnese e exame objetivo
O diagnóstico de instabilidade é feito sobretudo com base na história clínica e no exame físico68,70,73,74,83. Deve-se atentar no diagnóstico que levou à PTJ primária, grau de deformidade pré-operatória, contratura dos tecidos periarticulares, cirurgias prévias no joelho ipsilateral, técnica cirúrgica, grau de constrição da prótese utilizada, programa de reabilitação e eventual história de trauma após a artroplastia primária68.
Os sintomas associados à PTJ instável são muito variáveis e o seu aparecimento pode ser repentino após um período assintomático, indiciando uma rotura ligamentar ou falência dos componentes, ou podem persistir desde a artroplastia primária, sugerindo um erro na técnica cirúrgica68,76-78,83,84.
A dor é um achado comum e pode resultar de fadiga muscular ou de derrames articulares recorrentes83. Por vezes, os doentes descrevem dificuldade em subir e/ou descer escadas, levantar da cadeira, dor anterior no joelho e sensibilidade peri-retinacular difusa68,74,78,83. Pode existir uma típica sensação de instabilidade do joelho em diferentes graus de flexão68,76-78,83. Paradoxalmente, a sensação de subluxação pode muitas vezes induzir uma rigidez com diminuição da amplitude de movimento, especialmente da flexão total84. A instabilidade do LCP (no caso de próteses CR) apresenta-se tipicamente com dor crónica, especialmente durante atividades com flexão profunda como descer escadas ou levantar da cadeira85.
É importante observar a movimentação do doente em atividades similares às do seu quotidiano, avaliando a simetria na extensão, a integridade do mecanismo extensor no movimento ativo e passivo e a existência de deformidade fixa em flexão ou défice de extensão18,70,83,84,86.
A avaliação da estabilidade ligamentar deve ser feita nos planos coronal (varo-valgo), com o joelho em extensão total, flexão de 90°, médio-flexão de 20°-30° e sagital (anteroposterior)68,73,76,78,82,83,85,87. Os testes de gaveta anterior e posterior podem desencadear um movimento excessivo da tíbia ou sintomas consistentes com as queixas do doente68,73,76,83. No entanto, é importante referir que a quantidade precisa de laxidez e translação consideradas patológicas no contexto de PTJ ainda não foram definidas86.
Exames auxiliares de diagnóstico
Radiografias
Para além da avaliação radiográfica da prótese em si, é importante observar as radiografias pré-artroplastia em busca de informações relevantes respeitantes a deformidades prévias, contraturas e/ou cirurgias prévias ao joelho73,88,89.
Na incidência anteroposterior deve-se avaliar o alinhamento coronal dos componentes femoral e tibial, eventual desgaste do polietileno e, sobretudo, a localização da interlinha articular74,80,83,86. É ainda possível avaliar a rotação do componente femoral usando a radiografia convencional com auxílio de uma mesa radiolucente, de modo a conseguir uma incidência anteroposterior com o joelho em flexão de 90°90,91. A má rotação do componente femoral pode levar a um aumento da laxidez lateral em flexão condicionando um lift-off condilar exagerado, acentuando a carga na periferia com falência prematura do polietileno92. As translações dos componentes femoral ou tibial superiores a 3 mm medial, lateral ou anteriormente ou superiores a 10 mm posteriormente são consideradas anormais93. Componentes com cobertura femoral inferior a 80% ou superior a 110% são considerados, respetivamente, demasiado pequenos ou grandes93.
As radiografias de perfil devem ser realizadas com o joelho em extensão total, flexão de 45° e máxima70,79. É importante medir o slope tibial, avaliar o tamanho do componente femoral e, sobretudo, o offset condilar posterior, isto é, a distância até ao limite posterior dos côndilos do componente femoral (Figura 2)80,83,94.
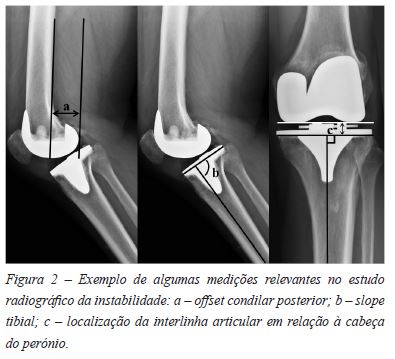
A radiografia extralonga do membro inferior em extensão e carga tem interesse para avaliar os eixos mecânico e anatómico, a posição dos componentes face ao eixo mecânico, o desgaste assimétrico ou falência do polietileno, a má posição dos componentes ou mesmo descelagem68,74,83.
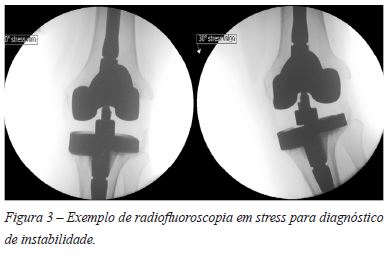
A laxidez ligamentar é, por vezes, bastante difícil de apreciar no exame físico em particular nos doentes obesos68,69. Assim, a realização de radiografias em stress varo-valgo e anteroposterior podem ser úteis para avaliar mais objetivamente o grau de laxidez ligamentar auxiliando sobretudo no diagnóstico de instabilidades subtis19,29,68,83. A utilização da radiofluoroscopia em stress é uma opção barata, segura e reprodutível para a deteção de instabilidade varo-valgo sendo especialmente útil na avaliação do joelho em flexão95. Uma abertura lateral média de 4° da articulação do joelho em flexão é significativa para instabilidade sintomática (Figura 3)92. Um aumento ligeiro a moderado na laxidez varo-valgo em extensão não aparenta ter relevância clínica, porém não se sabe qual o desequilíbrio entre o espaço de flexão-extensão tolerado clinicamente por falta de estudos92. As radiografias dinâmicas das gavetas anterior e posterior podem ser usadas para objetivar desequilíbrios nos espaços de flexão-extensão83.
Outros exames de imagem
A TC é o método mais fiável para a apreciação do alinhamento, posicionamento e rotação dos componentes, podendo ainda fornecer dados auxiliares (como osteólise e descelagem dos componentes) que podem ser extremamente úteis na avaliação de potencial instabilidade68,83,84. Na segunda parte deste artigo, no subtema desalinhamento patelofemoral será discutido em pormenor como calcular a rotação dos componentes, mas sabe-se que uma rotação interna superior a 4.5° do componente femoral é significativa para instabilidade sintomática92. O desalinhamento dos componentes é definido no plano coronal, como um desvio superior a 5° em relação ao eixo mecânico, e no plano sagital, quando o componente tibial tem uma inclinação anterior inferior a 0° ou posterior superior a 10°89.
A RMN tem o potencial para substituir a TC na avaliação da rotação dos componentes com eventual informação adicional sobre as partes moles extra-articulares, mas requer aparelhos com novas sequências de pulsos e um software especializado para reduzir a interferência metálica36,57.
D) DESALINHAMENTO PATELOFEMORAL
A cinemática patelar depende da relação entre o mecanismo extensor e a articulação femorotibial96. O desalinhamento patelofemoral é responsável pelo aparecimento de forças de cisalhamento e stress excessivos, podendo resultar em dor, destruição da cartilagem com alterações degenerativas ou mesmo falência mecânica do componente patelar70,97-99.
Em termos epidemiológicos, o desalinhamento patelofemoral é uma complicação importante, surgindo consistentemente como a quarta ou quintacausa mais frequente de revisão e é mais comum nos primeiros anos após a artroplastia primária2-6,13,14.
Etiologia
O alinhamento patelofemoral após PTJ é influenciado por diversos fatores, alguns semelhantes aos dos joelhos nativos e outros especificamente relacionados com a prótese e/ou técnica cirúrgica (Tabela 2)97,99-105.

Existem fatores pré-operatórios que aumentam o risco de desalinhamento patelar, no entanto a maioria pode e deve ser devidamente abordada durante a cirurgia e os erros técnicos cirúrgicos são a causa mais frequente de maltracking patelar99,106. Embora a discussão pormenorizada de todos os aspetos da correta técnica cirúrgica ultrapasse o âmbito desta revisão, não se pode deixar de discutir os mais importantes pois a correta análise pós-operatória depende do seu reconhecimento.
Componente femoral
A má rotação do componente femoral contribui grandemente para a dor anterior no joelho, instabilidade, desalinhamento patelofemoral e rigidez36,70,83, especialmente nos doentes com alinhamento axial normal porque aumenta as forças de contacto e o desgaste do polietileno102,107.
A rotação interna do componente femoral implica a medialização da tróclea femoral relativamente ao mecanismo extensor o que aumenta o ângulo Q e a tensão nos tecidos moles laterais predispondo ao maltracking patelar lateral102,103,105,108. Uma rotação interna entre 3°-6° tende a ser tolerável e uma rotação externa até 8° pode não causar problemas clínicos não se sabendo porque alguns doentes são mais sintomáticos que outros109.
Em termos de posicionamento medial-lateral, o componente femoral colocado medialmente irá deslocar medialmente a tróclea femoral causando um aumento do stress de contacto entre a parede lateral da tróclea e a faceta lateral da rótula nativa ou do componente patelar97,101. O vetor lateral resultante excessivo contribui para a falência da PTJ pela distribuição desigual dos pontos de contacto e das forças de cisalhamento97,101.
Componente tibial
Relativamente ao componente tibial, a rotação externa do prato parece ter reduzida influência na posição da rótula durante o movimento de flexão-extensão110. Pelo contrário, a rotação interna do componente relativamente à tuberosidade anterior da tíbia (TAT) lateraliza o aparelho extensor e exacerba o vetor de força lateral causando um stress anormal na rótula e nos tecidos moles adjacentes com alteração da cinemática patelar103,107,108,110.
A rotação interna combinada dos componentes femoral e tibial corresponde ao somatório dos ângulos excessivos de rotação dos componentes e é a causa predominante das complicações patelofemorais (Tabela 3) em doentes com alinhamento axial normal101,102. Correlaciona-se diretamente com a gravidade da instabilidade patelofemoral e, quando tal ocorre, os doentes têm um maior risco relativo (>5 vezes) de desenvolver dor anterior no joelho102,107.

Componente patelar
Quando se coloca o botão patelar, o nível e a angulação da resseção óssea são fundamentais. É importante que o conjunto do osso patelar remanescente com o componente patelar tenha uma espessura semelhante à da rótula nativa para a manter a força de extensão sem exacerbar as forças de contacto retropatelares98,100. Quando a resseção é insuficiente ou assimétrica surge a anteriorização da rótula e o overstuffing na faceta lateral e no polo distal aumentando a tensão no retináculo lateral e a tendência para a rótula deslocar lateralmente, subluxando ou luxando84,88,101,103,105,109. Para além disso, uma rótula excessivamente espessa leva à redução de 3° na amplitude de movimento por cada 2 mm adicionais na espessura patelar, mas uma rótula excessivamente fina pode condicionar fraturas periprotésicas e subluxação lateral100,111.
Balanço ligamentar
O desequilíbrio ligamentar predispõe para a subluxação lateral patelar sendo mais preocupante nos doentes com deformidade em valgo (pela hipoplasia do côndilo femoral lateral), contratura de longa duração do retináculo lateral ou outros restritores laterais e fraqueza dos tecidos moles mediais105,108.
Anamnese e exame objetivo
A sintomatologia relacionada com o desalinhamento patelofemoral pode ocorrer num momento específico da marcha ou com atividades específicas96. O sintoma mais comum é a dor anterior no joelho que difere da dor prévia à artroplastia e cuja intensidade pode ser ligeira a grave podendo mesmo ser incapacitante84. Cerca de 74% dos doentes com desalinhamento patelofemoral têm uma história prévia de dor anterior no joelho que está significativamente associada a uma maior lateralização da TAT112,113.
No exame físico, para além de procurar localizar áreas de maior sensibilidade dolorosa ou crepitação, devem ser executados testes específicos que permitam avaliar a estabilidade e a cinemática patelar na tróclea femoral75,84,114. Também a fraqueza do músculo quadricipital pode levar à má rotação do fémur sobre a tíbia causando desalinhamento patelofemoral pelo que deve ser avaliada com testes funcionais simulando-se, se possível, as situações de carga presentes no quotidiano do doente96,115.
Exames auxiliares de diagnóstico
A imagiologia da articulação patelofemoral após PTJ segue muitos dos mesmos princípios da articulação nativa havendo, no entanto, alguns critérios específicos sobretudo se a rótula tiver sido substituída116. Outro aspeto importante já citado é o da rotação dos componentes femoral e tibial.
Radiografias
Para além da avaliação do alinhamento coronal do membro inferior na radiografia extralonga, as incidências de perfil e axial da rótula são as mais informativas115. Um desalinhamento tibiofemoral com um valgo superior a 10° direciona medialmente a tróclea femoral podendo estar associado a um aumento do ângulo Q com maior risco de subluxação ou luxação patelar pelo aumento do vetor lateral sobre o quadricípite88,103,105. Por sua vez, a ausência de correção de um joelho em varo influencia negativamente o alinhamento patelofemoral dado que a rótula posiciona-se medialmente e inclina-se lateralmente117.
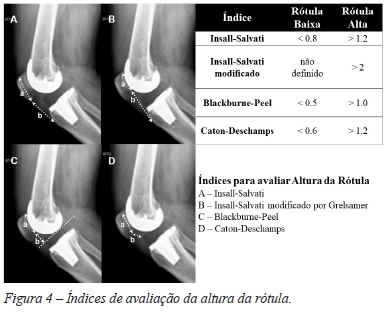
A incidência de perfil permite a determinação da posição vertical ou altura da rótula usando diferentes índices (Figura 4). É fundamental diferenciar entre duas situações clínicas diferentes: a verdadeira rótula baixa, com retração do tendão rotuliano, e a pseudorrótula baixa, secundária a uma elevação da interlinha articular116. Os índices Blackburne-Peel e Caton-Deschamps utilizam o prato tibial como referência não sendo, por isso, adequados nesta situação116. Assim, o índice Insall-Salvati (original ou modificado) que utiliza como referência a TAT é, teoricamente, mais adequado116.
A incidência axial é importante para avaliar a báscula e/ou subluxação laterais patelares, a espessura patelar por comparação com o pré-operatório particularmente nos casos de colocação de botão patelar e a presença de osteófitos17,70,114. É importante uma observação cuidadosa das radiografias podendo estar presentes corpos soltos ou pequenas fraturas por avulsão114. A báscula lateral define-se pelo ângulo formado pela linha que une os côndilos femorais anteriores com a linha que passa pela interface hospedeiro-prótese do componente patelar ou o maior eixo da rótula nativa20,116. Uma báscula lateral superior a 5-10° está associada a maltracking patelar, com uma sensibilidade 85% e especificidade acima de 80%90,118. É também essencial relembrar que a báscula lateral é significativamente alterada pela rotação externa do componente femoral mas apenas na flexão precoce98. A subluxação lateral define-se como a distância entre duas linhas paralelas que atravessam o centro do componente patelar e a tróclea femoral116. Considera-se que uma subluxação superior a 3-5 mm está associada a maltracking patelar, com uma sensibilidade de 70-80%, especificidade de 90%90,113, VPP de 78% e VPN de 90%113. A presença de báscula e subluxação laterais no mesmo joelho com PTJ são muito sugestivas de maltracking patelar e associam-se a maior desgaste do polietileno104,113. A assimetria do corte da rótula pode condicionar a presença de báscula, subluxação e overstuffing117,119. É medida a espessura da rótula em dois níveis nomeadamente a 1.5 cm das margens medial e lateral da rótula119. Assume-se que o corte é simétrico quando a diferença de espessuras varia entre 0-1 mm e assimétrico quando a diferença é igual ou superior a 2 mm (assimetria importante, ≥4 mm)119. É ainda de referir que este é um importante fator de correlação com dor anterior no joelho98,119.
A incidência axial em carga pode ser mais vantajosa que a radiografia convencional uma vez que reduz significativamente o número de joelhos com báscula e/ou subluxação laterais patelares anormais119. Mais especificamente, a báscula lateral patelar superior a 5° descrita com base nesta incidência correlaciona-se positivamente com dor anterior no joelho contrariamente ao identificado na incidência de Merchant119. Não foi possível obter significância estatística relativa à subluxação lateral patelar pela baixa prevalência identificada por este método119.
Tomografia computadorizada
A TC é a técnica de imagem de eleição perante a suspeita de má rotação dos componentes femoral e tibial17. A rotação do componente femoral (Figura 5) é definida num corte axial como o ângulo entre uma linha tangente aos côndilos posteriores (CP) e o eixo epicondilar102,107. O eixo epicondilar corresponde a uma linha que une a proeminência epicondilar lateral com a proeminência - eixo epicondilar clínico (EECl) - ou sulco medial - eixo epicondilar cirúrgico (EECi)116.
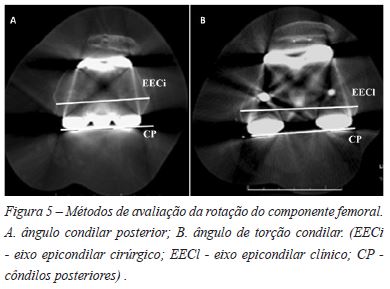
O ângulo formado com o EECi designa-se ângulo condilar posterior e o ângulo formado com o EECl denomina-se ângulo de torção condilar116. Considera-se que a amplitude normal do ângulo condilar posterior é de 0.3° (±1.2°) de rotação interna para mulheres e de 3.5° (±1.2°) de rotação interna para homens102. É importante ter em atenção que o EECi está rodado internamente 3-4° relativamente ao EECl, pelo que o ângulo de torção condilar pode ser estimado pela adição de 3-4° ao ângulo condilar posterior116.
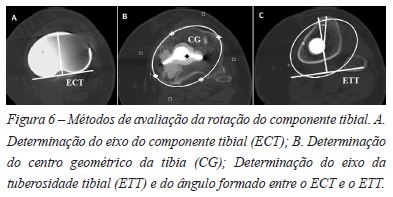
Na avaliação da rotação do componente tibial (Figura 6), são necessários três cortes axiais116. O primeiro corte, utilizado para definir o eixo do componente tibial (ECT), deve atravessar o componente protésico tibial116. No caso de componentes simétricos é definido como um eixo perpendicular à margem posterior do componente e em componentes assimétricos é definido como um eixo perpendicular a uma linha que une os centros de cada hemiprato116. O segundo corte deve ser obtido imediatamente abaixo do prato tibial identificando o centro geométrico (CG) da tíbia proximal e o terceiro corte deve atravessar a TAT116. Sobrepondo estes cortes, une-se o centro geométrico com o ponto mais anterior da TAT obtendo-se o eixo da tuberosidade tibial (ETT)116. O ângulo formado por estes dois eixos traduz a rotação da tíbia em relação ao mecanismo extensor que é considerada normal com ângulos até 18°(±2.6°)116.
Cintigrafia óssea
Embora seja comum um aumento da captação do biomarcador na região patelar associado a uma PTJ dolorosa, a sua significância não está totalmente esclarecida120. Este achado cintigráfico comummente designado de “hot patella” está significativamente associado a dor anterior no joelho120. Todavia, são necessários mais estudos de forma a clarificar devidamente qual a sua importância uma vez que não se demonstrou ainda uma correlação satisfatória entre este achado e o sucesso clínico de uma substituição patelar secundária isolada116.
E) RIGIDEZ
Na maioria dos casos, a rigidez é a manifestação final de um dos vários problemas relacionados com a prótese pelo que o seu diagnóstico passa pela verificação exaustiva ou exclusão das possíveis causas conjugando os achados clínicos com os resultados dos meios complementares de diagnóstico. A rigidez de causa primária ou artrofibrose é um diagnóstico raro que deve ser assumido após a exclusão de causas bem mais frequentes como erros técnicos, descelagem dos componentes, infeção oculta, instabilidade ou desalinhamento patelofemoral.
Definição
Existe uma considerável falta de consenso na definição de rigidez após PTJ mas, de uma forma geral, pode ser definida como uma limitação da amplitude do movimento que afeta a capacidade do doente realizar as suas atividades do quotidiano frequentemente associada a dor e graus de satisfação mais baixos121-123. Mais difícil é definir com exatidão quais os limites concretos do arco de mobilidade que constituem um resultado insatisfatório. Uma das definições frequentemente utilizada é o flexo superior a 10-25° ou incapacidade para flexão superior a 90°122.
Consoante a definição usada, a prevalência pode variar entre 1.3 e 13.2%123-125. É uma complicação importante sendo responsável por cerca de 3-4% dos casos de cirurgia de revisão sendo a quarta ou quinta causa mais frequente em diferentes séries3-6,8,14,15.
Etiologia
Embora por vezes seja difícil estabelecer uma etiologia concreta da rigidez, sabe-se que, na maioria das vezes, é multifatorial sendo fulcral identificar as causas uma vez que algumas são passíveis de correção cirúrgica77,121,122,124,126,127. As diferentes causas podem ser divididas em quatro grandes grupos: 1) fatores relacionados com o doente; 2) patologia articular prévia; 3) aspetos relacionados com a técnica cirúrgica; 4) período pós-operatório/reabilitação128. É ainda importante pesquisar causas extra-articulares de rigidez do joelho nomeadamente osteoartrose ou contratura de flexão da anca ipsilateral, cifose dorsolombar, contratura do quadricípite ou dos músculos isquiotibiais secundária a lesão muscular, lesão neurológica que condicione rigidez muscular, síndrome dolorosa regional complexa e espasticidade77,121,129.
1) Fatores relacionados com o doente
Certas comorbilidades, como diabetes mellitus ou obesidade, podem facilmente condicionar uma reduzida mobilidade pós-operatória126. Nos doentes jovens, paradoxalmente, a fisioterapia demasiado intensiva pode gerar um estado inflamatório com rigidez subsequente130. Também a personalidade do doente, a sua tolerância à dor e a motivação para a recuperação podem condicionar o resultado final124,127,131.
Certos doentes têm predisposição para uma proliferação extensa dos fibroblastos e metaplasia fibrosa do tecido de cicatrização favorecendo a desorganização da matriz celular e, consequentemente, maior rigidez no local da lesão122,130. Em casos extremos pode mesmo fazer-se o diagnóstico de artrofibrose que se caracteriza por produção excessiva e progressiva de tecido de cicatrização que inibe diretamente a flexão e/ou extensão e é uma das causas menos responsivas ao tratamento129. A artrofibrose primária é rara (<1%) e a sua etiologia não está claramente definida16. A artrofibrose secundária cuja incidência é variável entre 1.2 e 17% é, na maior parte dos casos, devida a uma infeção crónica de baixo grau e/ou problemas mecânicos16,121.
2) Patologia articular prévia
A reduzida amplitude de movimento pré-operatória é o fator preditivo mais importante da mobilidade pós-operatória122,124,131. O joelho rígido prévio à PTJ apresenta uma contratura do mecanismo extensor e das estruturas capsulares que, apesar de poderem ser libertadas na cirurgia primária, vão ter a sua elasticidade restrita pela fibrose crónica131. Outras alterações da articulação nativa estão associadas ao aparecimento de rigidez após PTJ nomeadamente a rótula baixa, a deformidade fixa em varo/valgo e história de cirurgias prévias ao joelho124,126,131.
3) Técnica cirúrgica
É importante conhecer as diferentes variáveis que podem condicionar rigidez para que possam ser corrigidas numa eventual cirurgia de revisão122,124,125,132. A Tabela 4 enumera as mais importantes e frequentes sendo que muitas foram já discutidas ao longo deste artigo.

É importante salientar que uma redução do offset condilar posterior igual ou superior a 3 mm em relação ao pré-operatório pode levar a uma perda significativa de quase 30° no arco de flexão133.
Para além das eventuais incorreções técnicas, a própria incisão cirúrgica implica o corte da pele, mecanismo extensor, retináculo inferior, sinovial e bolsa adiposa infrapatelar podendo causar formação de queloide, fibrose sinovial, artrofibrose, rótula baixa e miosite ossificante127.
4) Período pós-operatório/reabilitação
Neste período, os fatores que condicionam um maior período de imobilização contribuem mais facilmente para o aparecimento de rigidez após PTJ131. Alguns já foram previamente discutidos (como infeção de baixo grau, artrofibrose ou decorrentes de má técnica cirúrgica) mas existem outros como falta de adesão à fisioterapia, hemartrose, aderências, ossificação heterotópica ou mesmo síndrome dolorosa regional complexa9,77,121,122,125-127,129,131,132.
Anamnese e exame objetivo
A tríade clínica comum é a flexão limitada do joelho afetado, a contratura em flexão e a dor77,123,127,131. É também importante referir que a perceção dos doentes acerca da rigidez do joelho é muito variável e dependente da amplitude de movimento pré-operatória de cada um126. A mesma amplitude pode ser percecionada como boa num doente com grande rigidez prévia ou como má num doente com boa mobilidade pré-operatória126.
No exame físico, é importante avaliar global e rigorosamente as articulações tibiofemoral e patelofemoral e quantificar o arco de amplitude de movimento na flexão e extensão passivas para que se possa ter uma suspeita clínica concisa orientando a requisição dos meios complementares de diagnóstico70,87.
Exames auxiliares de diagnóstico
O estudo de uma rigidez é sobreponível ao estudo de uma prótese dolorosa tal como foi sendo abordado ao longo deste artigo e será preferível não avançar para a revisão de uma PTJ por rigidez sem antes de estar(em) devidamente identificada(s) a(s) causa(s) subjacente(s) à rigidez e à perda da amplitude de movimento122.
F) OUTRAS CAUSAS DE PRÓTESE DOLOROSA
Fraturas periprotésicas
Apesar de serem motivo relativamente comum de cirurgia de revisão (cerca de 3%), são geralmente bastante incapacitantes e o diagnóstico é geralmente evidente2-6,13,14. A exceção é a fratura da rótula frequentemente assintomática e diagnosticada como achado acidental nas radiografias134,135. As fraturas transversas são melhor identificadas na incidência de perfil enquanto que as verticais são mais evidentes na incidência axial136.
Rotura do mecanismo extensor
À semelhança das fraturas periprotésicas, a rotura do tendão rotuliano ou quadricipital é em geral bastante incapacitante pelo que o diagnóstico é evidente137. A incidência de perfil das radiografias permite inferir indiretamente o estado dos tendões uma vez que a sua rotura conduz a alterações consideráveis na posição da rótula137. Perante um diagnóstico dúbio, deve-se recorrer à ecografia para identificar o local da rotura ou excluí-la29,75.
Síndrome de clunk patelar
A síndrome de clunk patelar é caracterizada pela existência de um nódulo fibroso reativo na superfície profunda e distal do tendão quadricipital imediatamente acima do polo superior da rótula18,29,71,88. Tecido cicatricial ou sinovial distal do tendão quadricipital, anterior ou superior ao componente femoral, fica encarcerado na fossa intercondilar a partir dos 30-40° de flexão do joelho, voltando a deslizar na tróclea com a extensão e, ao longo de meses, esta agressão contínua causa o nódulo fibroso71,75. A síndrome de clunk patelar ocorre geralmente com os modelos de prótese estabilizada posteriormente75,88.
Em termos clínicos, o doente queixa-se de dor especialmente quando se senta ou levanta de uma cadeira87. No exame físico, pode-se palpar uma massa sob o tendão quadricipital e sentir crepitação com o movimento de flexão para extensão18,29,71,75,88. A ecografia pode revelar uma massa ecogénica com vascularidade interna adjacente à superfície profunda do tendão quadricipital29.
Conflito com o tendão poplíteo
Em 0.2% das PTJ, o tendão poplíteo tende a ficar retido num osteófito do côndilo femoral lateral, na extremidade lateral saliente do componente femoral ou ainda na região posterolateral proeminente do prato tibial se este for demasiado grande9,18. O diagnóstico é feito através da manipulação do joelho em várias amplitudes de movimento, com a cápsula encerrada, sentindo-se uma crepitação dolorosa e por vezes audível no canto posterolateral do joelho9. Uma boa resposta à infiltração de anestésico local pode ajudar a fazer o diagnóstico16.
Síndrome dolorosa regional complexa
Cerca de 1% das PTJ dolorosas estão associadas à síndrome dolorosa regional complexa sendo importante a identificação dos sintomas sensitivos (hiperalgesia e/ou alodínia), vasomotores (alterações da coloração, coloração assimétrica da pele e/ou assimetria da temperatura corporal), alterações tróficas (diminuição da amplitude de movimento, atrofia muscular, espasmos, disfunção motora - fraqueza, tremor, distonia - e/ou assimetria no crescimento das unhas, pele e pelos), edema e alterações na sudação9,16,77,138. O diagnóstico é clínico, baseado nos critérios de Budapeste (2003)138.
Dor referida
É importante relembrar que o doente pode-se queixar de dor no joelho mas esta pode ter origem na anca ipsilateral, na coluna lombar ou em patologia vascular do membro ipsilateral sendo tal identificado com uma anamnese e exame físico rigorosos e completos9.
CONCLUSÃO
Apesar dos bons resultados clínicos normalmente alcançáveis com a realização de uma PTJ, existe uma proporção não desprezível de doentes que não ficam satisfeitos após a cirurgia. A correta identificação do modo de falência ou etiologia para as queixas do doente com uma artroplastia total do joelho dolorosa é uma condição essencial para o sucesso do tratamento seja ele conservador ou uma cirurgia de revisão.
Apesar de nalguns casos o problema poder ser evidente, é cada vez mais comum na prática clínica diária a necessidade de avaliação diagnóstica de doentes com dor persistente após a colocação de uma PTJ sem que seja evidente qual é a etiologia das queixas.
A investigação de uma prótese dolorosa começa necessariamente com uma anamnese e exame objetivo cuidados. As radiografias convencionais nas incidências abordadas são baratas, generalizadamente disponíveis e podem ser extremamente informativas se corretamente realizadas e interpretadas. Também o estudo analítico para despistar a infeção, que pode estar presente em simultâneo com praticamente qualquer um dos outros modos de falência, deve ser uma das primeiras preocupações.
Só depois de realizada esta investigação básica se deverá avançar de forma sequencial para outros exames auxiliares de diagnóstico que deverão ser solicitados de acordo com a suspeita inicial. Se houver forte suspeita clínica de infeção ou os parâmetros inflamatórios estiverem alterados, a artrocentese para obtenção de líquido sinovial para estudo deve ser o próximo passo. Se houver uma suspeita de descelagem assética tardia não perfeitamente evidente nas radiografias, a cintigrafia óssea pode ser útil. Perante uma suspeita de instabilidade tibiofemoral em extensão ou flexão, as radiografias em stress e/ou a TC para avaliação da rotação dos componentes podem ser importantes. Esta avaliação é também importante nos casos de desalinhamento patelofemoral e/ou rigidez sem causa aparente. É importante nunca esquecer a patologia extra-articular (por exemplo da anca ou coluna) particularmente quando o doente refira manter queixas semelhantes às do pré-operatório.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Carr AJ, Robertsson O, Graves S, Price AJ, Arden NK, Judge A, et al. Knee replacement. Lancet. 2012 Apr; 379 (9823): 1331-1340
2. The Norwegian Arthroplasty Register - Report[homepage on the Internet]. Bergen (NO): Haukeland University Hospital, Department of Orthopedic Surgery; 2010; [cited 2015 Oct 6]. Available from: http://nrlweb.ihelse.net/eng/Rapporter/Report_2010.pdf.
3. Danish Knee Arthroplasty Register. Annual Report 2010[homepage on the Internet]. Aarhus, Denmark: Aarhus Universitetshospital, Afdeling KE; 2010; [cited 2015 Oct 6]. Available from: http://www.dshk.org/DKR-frame.htm.
4. The Swedish Knee Arthroplasty Register. Annual Report 2015[homepage on the Internet]. Sweden: Lund University/Skane University Hospital, Department of Clinical Sciences - Orthopedics; 2015; [updated 2015 Oct 6]. Available from: http://www.myknee.se/pdf/SVK_2015_Eng_1.0.pdf.
5. 12th Annual Report[homepage on the Internet]. Hertfordshire (UK): National Joint Registry; 2015; [cited 2015 Oct 6]. Available from: http://www.njrcentre.org.uk/njrcentre/Portals/0/Documents/England/Reports/12th%20annual%20report/NJR%20Online%20Annual%20Report%202015.pdf.
6. Australian Orthopaedic Association National Joint Replacement Registry. Hip and Knee Arthroplasty - Annual Report[homepage on the Internet]. Adelaide (AU): Australian Orthopaedic Association; 2015; [cited 2015 Oct 6]. Available from: https://aoanjrr.sahmri.com/documents/10180/217745/Hip%20and%20Knee%20Arthroplasty.
7. Schroer WC, Berend KR, Lombardi AV, Barnes CL, Bolognesi MP, Berend ME, et al. Why are total knees failing today? Etiology of total knee revision in 2010 and 2011. J Arthroplasty. 2013 Sep; 28 (8): 116-119
8. McDowell M, Park A, Gerlinger TL. The painful total knee arthroplasty. Orthop Clin North Am. 2016 Apr; 47 (2): 317-326
9. Azer NM, Thornhill TS. The painful total knee arthroplasty. In Bono JV, Scott RD, editors. Revision Total Knee Arthroplasty. New York, US: Springer; 2005. p. 24-35.
10. Jacobs MA, Hungerford DS, Krackow KA, Lennox DW. Revision total knee arthroplasty for aseptic failure. Clin Orthop Relat Res. 1988 Jan; 226: 78-85
11. Friedman RJ, Hirst P, Poss R, Kelley K, Sledge CB. Results of revision total knee arthroplasty performed for aseptic loosening. Clin Orthop Relat Res. 1990 Jun; 255: 235-241
12. MacInnes SJ, Gordon A, Wilkinson JM. Risk factors for aseptic loosening following total hip arthroplasty. In Fokter S, editors. Recent Advances in Arthroplasty. Rijeka, HR: InTech; 2012. p. 275-294.
13. Registo Português de Artroplastias. 2.º Relatório Anual 2010-2011[homepage on the Internet]. Portugal: Sociedade Portuguesa de Ortopedia e Traumatologia; 2011; [cited 2015 Oct 6]. Available from: http://www.rpa.spot.pt/getdoc/3644f495-464b-448b-bc70-fe4893759997/1489-Relatorio-RPA-Final.aspx.
14. Registo Português de Artroplastias. 1.º Relatório Anual 06/2009-05/2010[homepage on the Internet]. Portugal: Sociedade Portuguesa de Ortopedia e Traumatologia; 2010; [cited 2015 Oct 6]. Available from: http://www.rpa.spot.pt/getdoc/7b2eab64-321f-4500-97f3-794d1202a201/1066-001-172_Relatorio_2.aspx.
15. Nett MP, Scuderi GR. Revision of aseptic failed total knee arthroplasty. In Scott WN, editors. Insall & Scott Surgery of the Knee. 5th ed. Philadelphia, US: Elsevier; 2012. p. 1327-1345.
16. Hofmann S, Seitlinger G, Djahani O, Pietsch M. The painful knee after TKA: A diagnostic algorithm for failure analysis. Knee Surg Sports Traumatol Arthrosc. 2011 Sep; 19 (9): 1442-1452
17. Math KR, Zaidi SF, Petchprapa C, Harwin SF. Imaging of total knee arthroplasty. Semin Musculoskelet Radiol. 2006 Mar; 10 (1): 47-63
18. Mandalia V, Eyres K, Schranz PJ, Toms AD. Evaluation of patients with a painful total knee replacement. J Bone Joint Surg Br. 2008 Mar; 90 (3): 265-271
19. Athiviraham A, Math KR, Scuderi GR. Imaging in the failed total knee arthroplasty. In Scuderi GR, editors. Techniques in Revision Hip and Knee Arthroplasty. Philadelphia, US: Saunders; 2015. p. 18-25.
20. Feiock DA, Newman JS, Newberg AH. Radiological evaluation of total knee arthroplasty. In Bono JV, Scott RD, editors. Revision Total Knee Arthroplasty. New York, US: Springer; 2005. p. 36-52.
21. Meneghini RM, Mont MA, Backstein DB, Bourne RB, Dennis DA, Scuderi GR. Development of a modern Knee Society radiographic evaluation system and methodology for total knee arthroplasty. J Arthroplasty. 2015 Dec; 30 (12): 311-314
22. Gelman MI, Coleman RE, Stevens PM, Davey BW. Radiography, radionuclide imaging, and arthrography in the evaluation of total hip and knee replacement. Radiology. 1978 Sep; 128 (3): 677-682
23. Bach CM, Steingruber IE, Peer S, Nogler M, Wimmer CL, Ogon M. Radiographic assessment in total knee arthroplasty. Clin Orthop Relat Res. 2001 Apr; 385: 144-150
24. Manaster BJ. Total knee arthroplasty: Postoperative radiologic findings. Am J Roentgenol. 1995 Oct; 165 (4): 899-904
25. Sadoghi P, Leithner A, Weber P, Friesenbichler J, Gruber G, Kastner N, et al. Radiolucent lines in low-contact-stress mobile-bearing total knee arthroplasty: A blinded and matched case control study. BMC Musculoskelet Disord. 2011 Jun 29; 12: 142
26. Ahlberg A, Lindén B. The radiolucent zone in arthroplasty of the knee. Acta Orthop Scand. 1977; 48 (6): 687-690 [ Links ]
27. Smith S, Naima VSN, Freeman MAR. The natural history of tibial radiolucent lines in a proximally cemented stemmed TKA. J Arthroplasty. 1999 Jan; 14 (1): 3-8
28. Bach CM, Mayr E, Liebensteiner M, Gstottner M, Nogler M, Thaler M. Correlation between radiographic assessment and quality of life after total knee arthroplasty. Knee. 2009 Jun; 16 (3): 207-210
29. Miller TT. Imaging of knee arthroplasty. Eur J Radiol. 2005 May; 54 (2): 164-177
30. Ewald FC. The Knee Society total knee arthroplasty roentgenographic evaluation and scoring system. Clin Orthop Relat Res. 1989 Nov; 248: 9-12
31. Vyskocil P, Gerber C, Bamert P. Radiolucent lines and component stability in knee arthroplasty: Standard versus fluoroscopically-assisted radiographs. J Bone Joint Surg Br. 1999 Jan; 81 (1): 24-26
32. Kitchener MI, Coats E, Keene G, Paterson R. Assessment of radionuclide arthrography in the evaluation of loosening of knee prostheses. Knee. 2006 Jun; 13 (3): 220-225
33. Expert Panel on Musculoskeletal Imaging, Hochman MG, Melenevsky YV, Metter DF, Roberts CC, Bencardino JT, et al. ACR Appropriateness Criteria® imaging after total knee arthroplasty. J Am Coll Radiol. 2017 Nov; 14 (11): 421-448
34. Marx A, Saxler G, Landgraeber S, Löer F, Holland-Letz T, Knoch MV. Comparison of subtraction arthrography, radionuclide arthrography and conventional plain radiography to assess loosening of total knee arthroplasty. Biomed Tech (Berl). 2005 May; 50 (5): 143-147
35. Hirschmann MT, Konala P, Iranpour F, Kerner A, Rasch H, Friederich NF. Clinical value of SPECT/CT for evaluation of patients with painful knees after total knee arthroplasty - a new dimension of diagnostics?. BMC Musculoskelet Disord. 2011 Fev 4; 12: 36
36. Sneag DB, Bogner EA, Potter HG. Magnetic resonance imaging evaluation of the painful total knee arthroplasty. Semin Musculoskelet Radiol. 2015 Fev; 19 (1): 40-48
37. Jansen JA, Smit F, Arias-Bouda LMP. The role of nuclear medicine techniques in differentiation between septic and aseptic loosening of total hip and knee arthroplasty. Tijdschr Nucl Geneeskd. 2012; 34 (4): 988-994 [ Links ]
38. Strobel K, Steurer-Dober I, Huellner MW, Veit-Haibach P, Allgayer B. Importance of SPECT/CT for knee and hip joint prostheses. Radiologe. 2012 Jul; 52 (7): 629-635
39. Smith SL, Wastie ML, Forster I. Radionuclide bone scintigraphy in the detection of significant complications after total knee joint replacement. Clin Radiol. 2001 Mar; 56 (3): 221-224
40. Claassen L, Ettinger M, Plaass C, Daniilidis K, Calliess T, Ezechieli M. Diagnostic value of bone scintigraphy for aseptic loosening after total knee arthroplasty. Technol Health Care. 2014; 22 (5): 767-773 [ Links ]
41. Al-Nabhani K, Michopoulou SL, Allie R, Alkalbani J, Saad Z, Sajjan R, et al. Painful knee prosthesis: Can we help with bone SPECT/CT?. Nucl Med Commun. 2014 Fev; 35 (2): 182-188
42. Abele JT, Swami VG, Russell G, Masson EC, Flemming JP. The accuracy of single photon emission computed tomography/computed tomography arthrography in evaluating aseptic loosening of hip and knee prostheses. J Arthroplasty. 2015 Sep; 30 (9): 1647-1651
43. Sterner T, Pink R, Freudenberg L, Jentzen T, Quitmann H, Bockisch A, et al. The role of [18F]fluoride positron emission tomography in the early detection of aseptic loosening of total knee arthroplasty. Int J Surg. 2007 Apr; 5 (2): 99-104
44. Delank KS, Schmidt M, Michael JW-P, Dietlein M, Schicha H, Eysel P. The implications of 18F-FDG PET for the diagnosis of endoprosthetic loosening and infection in hip and knee arthroplasty: Results from a prospective, blinded study. BMC Musculoskelet Disord. 2006 Mar; 7: 20
45. Reinartz P. FDG-PET in patients with painful hip and knee arthroplasty: Technical breakthrough or just more of the same. Q J Nucl Med Mol Imaging. 2009 Fev; 53 (1): 41-50
46. Parvizi J, Gehrke T. Proceedings of the International Consensus Meeting on Periprosthetic Joint Infection 2013. https://www.efort.org/wp-content/uploads/2013/10/philadelphia_consensus.pdf; [ Links ] .
47. Costa L, Soares D, Aido R, Sousa R. The value of monitoring inflammatory markers after total joint arthroplasty. Hard Tissue. 2013 Mar 9; 2 (2): 17
48. Oethinger M, Warner DK, Schindler SA, Kobayashi H, Bauer TW. Diagnosing periprosthetic infection: Falsepositive intraoperative Gram stains. Clin Orthop Relat Res. 2011 Apr; 469 (4): 954-960
49. Johnson AJ, Zywiel MG, Stroh DA, Marker DR, Mont MA. Should gram stains have a role in diagnosing hip arthroplasty infections?. Clin Orthop Relat Res. 2010 Sep; 468 (9): 2387-2391
50. Parvizi J, Ghanem E, Menashe S, Barrack RL, Bauer TW. Periprosthetic infection: What are the diagnostic challenges?. J Bone Joint Surg Am. 2006 Dec; 88 (4): 138-147
51. Ali F, Wilkinson JM, Cooper JR, Kerry RM, Hamer AJ, Norman P, et al. Accuracy of joint aspiration for the preoperative diagnosis of infection in total hip arthroplasty. J Arthroplasty. 2006 Fev; 21 (2): 221-226
52. Tischler EH, Cavanaugh PK, Parvizi J. Leukocyte esterase strip test: Matched for musculoskeletalinfection society criteria. J Bone Joint Surg Am. 2014 Nov 19; 96 (22): 1917-1920
53. Parvizi J, Jacovides C, Antoci V, Ghanem E. Diagnosis of periprosthetic joint infection: The utility of a simple yet unappreciated enzyme. J Bone Joint Surg Am. 2011 Dec; 93 (24): 2242-2248
54. Shafafy R, McClatchie W, Chettiar K, Gill K, Hargrove R, Sturridge S, et al. Use of leukocyte esterase reagent strips in the diagnosis or exclusion of prosthetic joint infection. Bone Joint J. 2015 Sep; 97 (9): 1232-1236
55. Wetters NG, Berend KR, Lombardi AV, Morris MJ, Tucker TL, Della Valle CJ. Leukocyte esterase reagent strips for the rapid diagnosis of periprosthetic joint infection. J Arthroplasty. 2012 Sep; 27 (8): 8-11
56. Zmistowski B, Restrepo C, Huang R, Hozack WJ, Parvizi J. Periprosthetic joint infection diagnosis: A complete understanding of white blood cell count and differential. J Arthroplasty. 2012 Oct; 27 (9): 1589-1593
57. Ghanem E, Parvizi J, Burnett RS, Sharkey PF, Keshavarzi N, Aggarwal A, et al. Cell count and differential of aspirated fluid in the diagnosis of infection at the site of total knee arthroplasty. J Bone Joint Surg Am. 2008 Aug; 90 (8): 1637-1643
58. Dinneen A, Guyot A, Clements J, Bradley N. Synovial fluid white cell and differential count in the diagnosis or exclusion of prosthetic joint infection. Bone Joint J. 2013 Apr; 95 (4): 554-557
59. Parvizi J, Jacovides C, Adeli B, Jung KA, Hozack WJ. Mark B. Coventry Award: Synovial C-reactive protein: A prospective evaluation of a molecular marker for periprosthetic knee joint infection. Clin Orthop Relat Res. 2012 Jan; 470 (1): 54-60
60. Lenski M, Scherer MA. Synovial IL-6 as inflammatory marker in periprosthetic joint infections. J Arthroplasty. 2014 Jan; 29 (6): 1105-1109
61. Jacovides CL, Parvizi J, Adeli B, Jung KA. Molecular markers for diagnosis of periprosthetic joint infection. J Arthroplasty. 2011 Sep; 26 (6): 99-103
62. Frangiamore SJ, Saleh A, Grosso MJ, Kovac MF, Higuera CA, Iannotti JP, et al. alpha-Defensin as a predictor of periprosthetic shoulder infection. J Shoulder Elbow Surg. 2015 Jul; 24 (7): 1021-1027
63. Deirmengian C, Kardos K, Kilmartin P, Cameron A, Schiller K, Parvizi J. Diagnosing periprosthetic joint infection: Has the era of the biomarker arrived?. Clin Orthop Relat Res. 2014 Nov; 472 (11): 3254-3262
64. Deirmengian C, Kardos K, Kilmartin P, Cameron A, Schiller K, Parvizi J. Combined measurement of synovial fluid alpha-defensin and C-reactive protein levels: Highly accurate for diagnosing periprosthetic joint infection. J Bone Joint Surg Am. 2014 Sep; 96 (17): 1439-1445
65. Sousa R, Serrano P, Dias J Gomes, Oliveira JC, Oliveira A. Improving the accuracy of synovial fluid analysis in the diagnosis of prosthetic joint infection with simple and inexpensive biomarkers: C-reactive protein and adenosine deaminase. Bone Joint J. 2017 Mar; 99 (3): 351-357
66. Sousa R, Massada M, Pereira A, Fontes F, Amorim I, Oliveira A. Diagnostic accuracy of combined 99mTc-sulesomab and 99mTc-nanocolloid bone marrow imaging in detecting prosthetic joint infection. Nucl Med Commun. 2011 Sep; 32 (9): 834-839
67. Rasouli MR, Harandi AA, Adeli B, Purtill JJ, Parvizi J. Revision total knee arthroplasty: Infection should be ruled out in all cases. J Arthroplasty. 2012 Jun; 27 (6): 1239-1243
68. Chang MJ, Lim H, Lee NR, Moon YW. Diagnosis, causes and treatments of instability following total knee arthroplasty. Knee Surg Relat Res. 2014 Jun; 26 (2): 61-67
69. Rodríguez-Merchán EC, García-Tovar OI. The unstable knee prosthesis. Rev Esp Cir Ortop Traumatol. 2009; 53 (2): 113-119 [ Links ]
70. Vince KG. The problem total knee replacement: Systematic, comprehensive and efficient evaluation. Bone Joint J. 2014 Nov; 96 (11): 105-111
71. Khakharia S, Nett MP, Hajnik CA, Scuderi GR. Complications of total knee arthroplasty. In Scott WN, editors. Insall & Scott Surgery of the Knee 5th ed. Philadelphia, US: Elsevier; 2012. p. 1293-1319.
72. Yercan HS, Ait Si Selmi T, Sugun TS, Neyret P. Tibiofemoral instability in primary total knee replacement: a review, Part 1: Basic principles and classification. Knee. 2005 Aug; 12 (4): 257-266
73. Abdel M, Haas S. The unstable knee: Wobble and buckle. Bone Joint J. 2014 Nov; 96 (11): 112-114
74. Parratte S, Pagnano MW. Instability after total knee arthroplasty. J Bone Joint Surg Am. 2008 Jan; 90 (1): 184-194
75. Selvan D, Donnelly T, McNicholas M. (ii) Management of complications of primary total knee replacement. Orthop Trauma. 2013 Dec; 27 (6): 355-363
76. Gaizo DJ Del, Della Valle CJ. Instability in primary total knee arthroplasty. Orthopedics. 2011 Sep; 34 (9): 519-521
77. Vince KG. Modes of failure in total knee arthroplasty. In Lieberman JR, Berry DJ, Azar FM, editors. Advanced Reconstruction: Knee. Illinois, US: AAOS; 2010. p. 341-354.
78. Pagnano M, Hanssen A, Lewallen D, Stuart M. Flexion instability after primary posterior cruciate retaining total knee arthroplasty. Clin Orthop Relat Res. 1998 Nov; 356: 39-46
79. Bellemans J. Flexion instability. In Bellemans J, Ries M, Victor JK, editors. Total Knee Arthroplasty. DE: Springer-Verlag Berlin Heidelberg; 2005. p. 96-100.
80. Abdel MP, Pulido L, Severson EP, Hanssen AD. Stepwise surgical correction of instability in flexion after total knee replacement. Bone Joint J. 2014 Dec; 96 (12): 1644-1648
81. Minoda Y, Nakagawa S, Sugama R, Ikawa T, Noguchi T, Hirakawa M, et al. Intraoperative assessment of midflexion laxity in total knee prosthesis. Knee. 2014 Aug; 21 (4): 810-814
82. Ramappa M. Midflexion instability in primary total knee replacement: A review. SICOT-J. 2015 Aug 5; 1: 24
83. Yercan HS, Ait Si Selmi T, Sugun TS, Neyret P. Tibiofemoral instability in primary total knee replacement: A review. Part 2: Diagnosis, patient evaluation, and treatment. Knee. 2005 Oct; 12 (5): 336-340
84. Motsis EK, Paschos N, Pakos EE, Georgoulis AD. Patellar instability after total knee arthroplasty. J Orthop Surg (Hong Kong). 2009 Dec; 17 (3): 351-357
85. Dennis DA. Evaluation of painful total knee arthroplasty. J Arthroplasty. 2004 Jun; 19 (4): 35-40
86. Browne JA, Parratte S, Pagnano MW. Instability in total knee arthroplasty. In Scott WN, editors. Insall & Scott Surgery of the Knee. 5th ed. Philadelphia, US: Elsevier; 2012. p. 1359-1366.
87. Garvin KL. Revision total knee arthroplasty: Indications and contraindications. In Lieberman JR, Berry DJ, Azar FM, editors. Advanced Reconstruction: Knee. Illinois, US: AAOS; 2010. p. 355-363.
88. Hansen EN, Lonner JH. Patella instability. In Scuderi GR, editors. Techniques in Revision Hip and Knee Arthroplasty. Philadelphia, US: Saunders; 2015. p. 176-186.
89. Song SJ, Detch RC, Maloney WJ, Goodman SB, Huddleston JI 3rd. Causes of instability after total knee arthroplasty. J Arthroplasty. 2014 Fev; 29 (2): 360-364
90. Heesterbeek PJ, Beumers MP, Jacobs WC, Havinga ME, Wymenga AB. A comparison of reproducibility of measurement techniques for patella position on axial radiographs after total knee arthroplasty. Knee. 14 (5): 411-416 [ Links ]
91. Kanekasu K, Kondo M, Kadoya Y. Axial radiography of the distal femur to assess rotational alignment in total knee arthroplasty. Clin Orthop Relat Res. 2005 May; 434: 193-197
92. Romero J, Stahelin T, Binkert C, Pfirrmann C, Hodler J, Kessler O. The clinical consequences of flexion gap asymmetry in total knee arthroplasty. J Arthroplasty. 2007 Fev; 22 (2): 235-240
93. Mont M, Serna F, Krackow K, Hungerford D. Exploration of radiographically normal total knee replacements for unexplained pain. Clin Orthop Relat Res. 1996 Oct; 331: 216-220
94. Deshmane PP, Rathod PA, Deshmukh AJ, Rodriguez JA, Scuderi GR. Symptomatic flexion instability in posterior stabilized primary total knee arthroplasty. Orthopedics. 2014 Sep; 37 (9): 768-774
95. Stähelin T, Kessler O, Pfirrmann C, Jacob HAC, Romero J. Fluoroscopically assisted stress radiography for varus-valgus stability assessment in flexion after total knee arthroplasty. J Arthroplasty. 2003 Jun; 18 (4): 513-515
96. Katchburian MV, Bull AMJ, Shih Y-F, Heatley FW, Amis AA. Measurement of patellar tracking: Assessment and analysis of the literature. Clin Orthop Relat Res. 2003 Jul; 412: 241-259
97. Heegaard JH, Leyvraz PF, Hovey CB. A computer model to simulate patellar biomechanics following total knee replacement: The effects of femoral component alignment. Clin Biomech (Bristol, Avon). 2001 Jun; 16 (5): 415-423
98. Anglin C, Brimacombe JM, Hodgson AJ, Masri BA, Greidanus NV, Tonetti J, et al. Determinants of patellar tracking in total knee arthroplasty. Clin Biomech (Bristol, Avon). 2008 Aug; 23 (7): 900-910
99. Gasparini G, Familiari F, Ranuccio F. Patellar malalignment treatment in total knee arthroplasty. Joints. 2013 Jun 12; 1 (1): 10-17
100. Hsu HC, Luo ZP, Rand JA, An KN. Influence of patellar thickness on patellar tracking and patellofemoral contact characteristics after total knee arthroplasty. J Arthroplasty. 1996 Jan; 11 (1): 69-80
101. Eisenhuth SA, Saleh KJ, Cui Q, Clark CR, Brown TE. Patellofemoral instability after total knee arthroplasty. Clin Orthop Relat Res. 2006 May; 446: 149-160
102. Berger RA, Crossett LS, Jacobs JJ, Rubash HE. Malrotation causing patellofemoral complications after total knee arthroplasty. Clin Orthop Relat Res. 1998 Nov; 356: 144-153
103. Briard JL, Hungerford DS. Patellofemoral instability in total knee arthroplasty. J Arthroplasty. 1989; 4: 87-97 [ Links ]
104. Bindelglass DF, Cohen JL, Dorr LD. Patellar tilt and subluxation in total knee arthroplasty: Relationship to pain, fixation, and design. Clin Orthop Relat Res. 1993 Jan; 286: 103-109
105. Lonner JH, Booth RE Jr. Assessment and balancing of patellar tracking. In Bellemans J, Ries MD, Victor JK, editors. Total Knee Arthroplasty. Berlin, Heidelberg, DE: Springer-Verlag Berlin Heidelberg; 2005. p. 228-233.
106. Kong CG, Cho HM, Suhl KH, Kim MU, In Y. Patellar tracking after total knee arthroplasty performed without lateral release. Knee. 2012 Oct; 19 (5): 692-695
107. Barrack RL, Schrader T, Bertot AJ, Wolfe MW, Myers L. Component rotation and anterior knee pain after total knee arthroplasty. Clin Orthop Relat Res. 2001 Nov; 392: 46-55
108. Boselli KJ, Lee G-C, Garino JP. Patellofemoral maltracking: Identification and solutions. In Brown T, Cui Q, Mihalko W, Saleh K, editors. Arthritis and Arthroplasty: The Kne, 1st ed. Philadelphia, US: Elsevier Saunders; 2009. p. 274-287.
109. Ghosh KM, Merican AM, Iranpour F, Deehan DJ, Amis AA. The effect of femoral component rotation on the extensor retinaculum of the knee. J Orthop Res. 2010 Sep; 28 (9): 1136-1141
110. Nagamine R, Whiteside LA, White SE, McCarthy DS. Patellar tracking after total knee arthroplasty: The effect of tibial tray malrotation and articular surface configuration. Clin Orthop Relat Res. 1994 Jul; 304: 262-271
111. Bengs BC, Scott RD. The effect of patellar thickness on intraoperative knee flexion and patellar tracking in total knee arthroplasty. J Arthroplasty. 2006 Aug; 21 (5): 650-655
112. Figueroa D, Novoa F, Meleán P, Calvo R, Vaisman A, Figueroa F, et al. Usefulness of magnetic resonance imaging in the evaluation of patellar malalignment. Rev Esp Cir Ortop Traumatol. 2014 Jan; 58 (1): 19-23
113. Chia SL, Merican AM, Devadasan B, Strachan RK, Amis AA. Radiographic features predictive of patellar maltracking during total knee arthroplasty. Knee Surg Sports Traumatol Arthrosc. 2009 Oct; 17 (10): 1217-1224
114. Koh JL, Stewart C. Patellar instability. Orthop Clin North Am. 2015 Jan; 46 (1): 147-157
115. Keller JM, Levine WN. Evaluation and imaging of the patellofemoral joint. Oper Tech Orthop. 2007 Oct; 17 (4): 204-210
116. Sousa R, Massada M. Imaging of the patellofemoral joint. In Parvizi J, editors. The Knee: Reconstruction, Replacement, and Revision. Towson, US: Data Trace Publishing Company; 2013.
117. Fukagawa S, Matsuda S, Mizu-uchi H, Miura H, Okazaki K, Iwamoto Y. Changes in patellar alignment after total knee arthroplasty. Knee Surg Sports Traumatol Arthrosc. 2011 Jan; 19 (1): 99-104
118. Grelsamer RP, Bazos AN, Proctor CS. Radiographic analysis of patellar tilt. J Bone Joint Surg Br. 1993 Sep; 75 (5): 822-824
119. Baldini A, Anderson JA, Cerulli-Mariani P, Kalyvas J, Pavlov H, Sculco TP. Patellofemoral evaluation after total knee arthroplasty. Validation of a new weightbearing axial radiographic view. J Bone Joint Surg Am. 2007 Aug; 89 (8): 1810-1817
120. Ahmad R, Kumar G Senthil, Katam K, Dunlop D, Pozo JL. Significance of a "hot patella" in total knee replacement without primary patellar resurfacing. Knee. 2009 Oct; 16 (5): 337-340
121. Schiavone Panni A, Cerciello S, Vasso M, Tartarone M. Stiffness in total knee arthroplasty. J Orthop Traumatol. 2009 Sep; 10 (3): 111-118
122. Heesterbeek PJ, Goosen JH, Schimmel JJ, Defoort KC, van Hellemondt GG, Wymenga AB. Moderate clinical improvement after revision arthroplasty of the severely stiff knee. Knee Surg Sports Traumatol Arthrosc. 2016 Oct; 24 (10): 3235-3241
123. Kim GK, Mortazavi SM, Parvizi J, Purtill JJ. Revision for stiffness following TKA: A predictable procedure?. Knee. 2012 Aug; 19 (4): 332-334
124. Bedard M, Vince KG, Redfern J, Collen SR. Internal rotation of the tibial component is frequent in stiff total knee arthroplasty. Clin Orthop Relat Res. 2011 Aug; 469 (8): 2346-2355
125. Ghani H, Maffulli N, Khanduja V. Management of stiffness following total knee arthroplasty: A systematic review. Knee. 2012 Dec; 19 (6): 751-759
126. Yercan HS, Sugun TS, Bussiere C, Ait Si Selmi T, Davies A, Neyret P. Stiffness after total knee arthroplasty: Prevalence, management and outcomes. Knee. 2006 Mar; 13 (2): 111-117
127. Scranton PE Jr. Management of knee pain and stiffness after total knee arthroplasty. J Arthroplasty. 2001 Jun; 16 (4): 428-435
128. Vince KG. The stiff total knee arthroplasty: Causes and cures. J Bone Joint Surg Br. 2012 Nov; 94 (11): 103-111
129. Nelson CL, Kim J, Lotke PA. Stiffness after total knee arthroplasty. J Bone Joint Surg Am. 2005 Sep; 87 (1): 264-270
130. Kim GK, Mortazavi SM, Purtill JJ, Sharkey PF, Hozack WJ, Parvizi J. Stiffness after revision total knee arthroplasty. J Arthroplasty. 2010 Sep; 25 (6): 844-850
131. Scuderi GR. The stiff total knee arthroplasty: Causality and solution. J Arthroplasty. 2005 Jun; 20 (4): 23-26
132. Fabi D, Levine B, Rosenberg AG. Revision total knee arthroplasty. In Scott WN, editors. Techniques in Revision Hip and Knee Arthroplasty. 5th ed. Philadelphia, US: Saunders; 2015. p. 100-107.
133. Bellemans J, Banks S, Victor J, Vandenneucker H, Moemans A. Fluoroscopic analysis of the kinematics of deep flexion in total knee arthroplasty. Bone Joint J Br. 2002 Jan; 84 (1): 50-53
134. Ayers ME, Iorio R, Healy WL. Periprosthetic fractures after total knee arthroplasty. In Bono JV, Scott RD, editors. Revision Total Knee Arthroplasty. New York, US: Springer; 2005. p. 183-192.
135. Yoo JD, Kim NK. Periprosthetic fractures following total knee arthroplasty. Knee Surg Relat Res. 2015 Mar; 27 (1): 1-9
136. Purudappa PPA, Gioe TJ. Classification and treatment of patella fractures. In Scuderi GR, editors. Techniques in Revision Hip and Knee Arthroplasty. Philadelphia, US: Saunders; 2015. p. 240-246.
137. Deirmengian CA, Lonner JH. Extensor mechanism rupture. In Brown TE, Cui Q, Mihalko WM, Saleh KJ, editors. Arthritis and Arthroplasty: The Knee. 1st ed. Philadelphia, US: Saunders; 2009. p. 288-295.
138. Dutton K, Littlejohn G. Terminology, criteria, and definitions in complex regional pain syndrome: Challenges and solutions. J Pain Res. 2015 Dec 11; 8: 871-877
Conflito de interesse:
Nada a declarar.
Ricardo Sousa
Serviço de Ortopedia, Centro Hospitalar do Porto - Hospital de Santo António
Largo Professor Abel Salazar
4099-001 PORTO
Telefone: 222 077 500
ricardojgsousa@gmail.com
Data de Submissão: 2018-04-19
Data de Revisão: 2018-06-05
Data de Aceitação: 2018-06-30














