Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Acta Obstétrica e Ginecológica Portuguesa
versão impressa ISSN 1646-5830
Acta Obstet Ginecol Port vol.10 no.2 Coimbra jun. 2016
ARTIGO DE REVISÃO/REVIEW ARTICLE
Gravidez e epilepsia
Pregnancy and epilepsy
Sofia Aguilar*, Maria José Alves**, Fátima Serrano***
Maternidade Dr. Alfredo da Costa, Centro Hospitalar de Lisboa Central
**Interna de Ginecologia e Obstetrícia
**Assistente Graduada Sénior de Ginecologia e Obstetrícia
***Assistente Hospitalar Graduada de Ginecologia e Obstetrícia
Endereço para correspondência | Dirección para correspondencia | Correspondence
ABSTRACT
Epilepsy is common among women of childbearing age. Maternal-fetal risk is slightly superior to general population, resulting from antiepileptic drugs’ teratogenicity and seizures. Optimized disease control and screening for medication’s adverse effects are crucial parts of prenatal care. Most pregnant women require chronic therapy to prevent seizures; definition of an effective and least teratogenic regime should be performed preconceptionally. Sodium valproate is the most teratogenic drug; teratogenicity also increases with polytherapy and medication dosage. Labour should take place in a qualified obstetrical and neonatal centre. Usually breastfeeding is safe. Regarding contraception, consider interactions between enzyme-inducing antiepileptics drugs and hormonal contraceptives.
Keywords: Gravidez; Epilepsia; Fármacos antiepiléticos; Amamentação; Contraceção.
Introdução
A epilepsia é uma das doenças neurológicas mais comuns na gravidez, estimando-se que afete 0,3% a 0,4% das gestantes1. Aproximadamente 1/4 da população feminina com epilepsia ativa encontra-se em idade fértil2. A maioria das doentes que recebem um tratamento antiepilético otimizado e que estão adequadamente informadas, apoiadas e aconselhadas têm gestações e partos sem intercorrências e filhos saudáveis3. Porém, em 10% verifica-se um aumento das complicações materno-fetais, decorrente dos efeitos da gravidez no controlo da epilepsia, do impacto materno-fetal das crises epiléticas e das repercussões fetais dos fármacos antiepiléticos4.
Efeitos da epilepsia e terapêutica antiepilética na gravidez
A morbilidade materno-fetal associada às crises epiléticas aumenta proporcionalmente com a sua gravidade e frequência, dependendo também do tipo de crise3. As crises tónico-clónicas generalizadas são as que representam um maior risco, não existindo evidência de que as crises focais, de ausência ou mioclónicas afetem a gravidez ou feto, exceto se ocorrer traumatismo da grávida3. Durante uma crise tónico-clónica generalizada aumentam as necessidades maternas de oxigénio, o que pode reduzir a perfusão útero-placentária e condicionar hipóxia fetal5,6. Se houver traumatismo materno, este pode desencadear contractilidade uterina ou descolamento placentar6.
As potenciais consequências das crises epiléticas na gravidez incluem ainda alterações da frequência cardíaca fetal durante a convulsão, recém-nascidos leves para a idade gestacional e filhos com quociente de inteligência (QI) verbal reduzido7. Se suspensão abruta da medicação pode inclusive ocorrer morte súbita materna7.
No acompanhamento destas grávidas o principal objetivo é a prevenção das crises e, para tal, a grande maioria necessita de medicação crónica. A passagem transplacentária em quantidades clinicamente importantes foi documentada para vários antiepiléticos e a teratogenicidade é um dos seus possíveis efeitos8,9. A incidência de malformações congénitas major é de 4-9% comparativamente com o valor de 1-2% na população geral10. Acredita-se que o metabolismo destes fármacos aumenta o stress oxidativo, originando produtos intermediários que danificam o ADN embrionário/fetal11. Os anticonvulsivantes interferem também com o metabolismo dos folatos, conduzindo ao seu défice12.
O risco de malformações congénitas está bem documentado para os antiepiléticos mais antigos, particularmente para o valproato de sódio10,13-16. A informação alusiva aos novos fármacos antiepiléticos (lamotrigina, topiramato, levatiracetam) é mais escassa3,14; investigações recentes atribuem-lhes um menor efeito teratogénico17,18.
Segundo uma revisão da American Academy of Neurology (AAN) e da American Epilepsy Society (AES) a medicação anticonvulsivante durante o primeiro trimestre gestacional aumenta o risco de malformações congénitas major comparativamente com o das grávidas epiléticas não medicadas, desconhecendo-se se o risco é atribuível a todos os antiepiléticos ou apenas a alguns; o valproato de sódio associa-se a um risco aproximadamente 3 vezes superior ao dos outros antiepiléticos7,14.
O risco teratogénico, para além de ser maior para tratamentos que incluam o valproato de sódio (classe D da Food and Drug Administration), aumenta ainda em politerapia e se existir história obstétrica ou familiar de malformações congénitas2,10,14-16,19; também aparenta aumentar com a dosagem farmacológica20. Os resultados dos estudos que investigaram se o efeito teratogénico é dose-dependente divergem, sendo essa relação particularmente consensual para o valproato de sódio e lamotrigina14. Uma dose diária de valproato de sódio superior a 800mg/dia é a que se associa a maior teratogenicidade3. Tomson T et al verificaram que, em monoterapia, as doses diárias que se associam a menor incidência de malformações são inferiores a 300 mg de lamotrigina e a 400 mg de carbamazepina2. O UK and Ireland Epilepsy and Pregnancy Registers documentaram que a frequência de malformações é similar à da população geral para a lamotrigina e carbamazepina administradas em doses inferiores a 400mg/dia e 1.000mg/dia respetivamente10. A taxa de malformações pode exceder os 20% para doses diárias de valproato de sódio superiores a 1.500mg2,21.
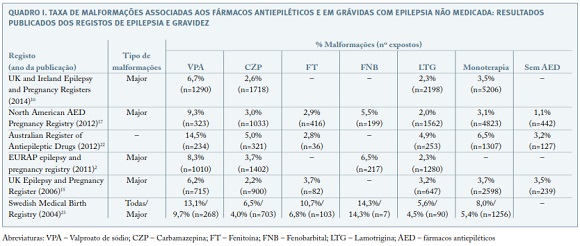
Os registos de epilepsia na gravidez desenvolvidos têm proporcionado cálculos de incidência de malformações congénitas (Quadro I).
No UK Epilepsy and Pregnancy Register, que incluíu 3.607 gestações, a incidência de malformações congénitas major global foi de 4,2%, sendo de 3,7% em grávidas sob anticonvulsivantes em monoterapia, aumentando para 6% em tratamentos com associação de fármacos e diminuindo para 3,5% em grávidas sem medicação15.
As malformações major mais frequentemente associadas aos fármacos antiepiléticos são: defeitos do tubo neural (como espinha bífida), orofaciais (especialmente fendas), cardiopatias e hipospadias; as minor incluem: hipertelorismo, pregas epicânticas e hipoplasia digital15,16,24-29.
A maioria das malformações major desenvolve-se nas primeiras semanas gestacionais, mas a exposição aos antiepiléticos, mesmo em fases mais tardias da gestação, pode induzir anomalias morfológicas minor ou dificuldades de aprendizagem5,30,31.
Efetivamente, o tratamento anticonvulsivante materno parece associar-se a efeitos adversos a longo prazo para os filhos, como compromisso da função psicomotora e cognitiva32-36 (também mais frequentes com politerapia e tratamento com valproato de sódio37,38) e, possivelmente, recém-nascidos leves para a idade gestacional1,39-41 e índices de Apgar baixos1,14,40,42,43. Dois estudos encontraram uma associação entre exposição in utero ao valproato de sódio e incidência de autismo ou alterações comportamentais do espetro autista44,45.
Não está esclarecido se outras complicações obstétricas aumentam em mulheres epiléticas: uma revisão da AAN/AES não encontrou um aumento substancial da incidência de cesariana, hemorragia do 3º trimestre e parto pré-termo46. Contudo, um estudo subsequente registou um risco mais elevado de pré-eclâmpsia ligeira, hipertensão gestacional, hemorragia do 3º trimestre e parto antes das 34 semanas, em gestantes medicadas com antiepiléticos47.
Um estudo de coorte apurou um aumento significativo da incidência de ameaça parto pré-termo e parto pré-termo em grávidas epiléticas fumadoras39.
Efeitos da gravidez na epilepsia
Num estudo recente, que incluiu 1.297 gestações, a ocorrência de crises epiléticas no mês anterior à conceção foi o principal preditor da sua recidiva na gravidez48. As grávidas sem crises nos 9 meses precedentes à conceção têm uma grande probabilidade (84%-92%) de permanecerem livres de crises46. A frequência destas não se altera na maioria das gestantes, mas pode aumentar em 15-37%3. Esse incremento relaciona-se com alterações da absorção gastrointestinal (vómitos, diarreia), stress, privação de sono, fraca adesão ao tratamento antiepilético, terapêutica desajustada e modificações farmacocinéticas dos anticonvulsivantes49,50. Estas últimas resultam de alterações fisiológicas da gravidez: aumento do metabolismo hepático, depuração renal e volume de distribuição e redução das proteínas plasmáticas de ligação51. As AAN/AES concluíram que os níveis séricos da lamotrigina, carbamazepina, fenitoína, levetiracetam e oxcarbazepina encontram-se provavelmente reduzidos na gravidez, não existindo evidência que tal ocorra para o valproato de sódio, fenobarbital, primidona e etossuximida8.
O relatório do grupo EURAP (International Registry of Antiepileptic Drugs and Pregnancy), que abrangeu 1956 grávidas, concluiu que a monoterapia foi eficaz em 79%52. Estado de mal epilético ocorreu em menos de 1%52.
Conduta na gravidez
O tratamento das grávidas com epilepsia abrange a medicação crónica para prevenção das crises, a sua terapêutica aguda e a suplementação com ácido fólico e vitamina K.
O objetivo é a profilaxia das crises, tentando simultaneamente obter o menor risco teratogénico3.
Tratamento antiepilético crónico
É de extrema relevância escolher um regime terapêutico simultaneamente eficaz e o menos teratogénico possível e que esse ajuste seja efetuado na pré-conceção3,14. Na gravidez, deve manter-se a medicação estabelecida pré-concecionalmente, que só deve ser alterada caso a frequência das crises aumente53. O ajuste medicamentoso não deve ser realizado apenas com o intuito de reduzir a teratogenicidade porque14:
1. Pode precipitar uma descompensação da doença;
2. Durante a mudança de antiepiléticos a sua eventual sobreposição expõe o feto ao efeito de dois fármacos;
3. A vantagem do ajuste medicamentoso quando a gravidez é diagnosticada é pequena, dado que, nessa altura, já decorreram várias semanas gestacionais, tendo sido ultrapassado o período de maior suscetibilidade teratogénica.
Importa alertar a grávida para o risco de descontrolo da doença com a suspensão dos antiepiléticos, que pode culminar em estado de mal epilético e morte súbita materna3.
O controlo gestacional dos níveis plasmáticos dos fármacos antiepiléticos não é consensual54. Em 2012 o National Institute for Health and Clinical Excellence (NICE) enumerou aquelas que consideram ser as indicações para proceder a essa monitorização (Quadro II)3. Outros autores aconselham o doseamento sérico dos anticonvulsivantes de 2 em 2 meses50. No caso da lamotrigina alguns clínicos sugerem monitorização mensal7. As recomendações da AAN/AES afirmam que a monitorização sérica da lamotrigina, carbamazepina e fenitoína deve ser considerada (nível de evidência B) e a do levetiracetam e da oxcarbazepina pode ser considerada (nível de evidência C)8.
Tratamento agudo das crises24,55
Medidas de primeira linha:
• decúbito lateral esquerdo;
• oximetria de pulso;
• acesso venoso;
• oxigenoterapia;
• soroterapia;
• medicação anticonvulsivante em todas as crises não autolimitadas; em 1ª linha: benzodiazepinas (diazepam 10mg e.v. bólus, máximo de 5mg/min, pode repetir-se 10 minutos depois; também existe formulação retal: 500microgramas/kg, máximo de 30mg); se crise persistir administrar antiepilético (como fenitoína 18mg/kg, máximo de 50mg/min);
• monitorização cardíaca materno-fetal (se tratamento com benzodiazepinas, manter traçado fetal até pelo menos 1h após administração);
• Se causa metabólica: tratar
Medidas de segunda linha:
• se crise persistir por mais de 30 minutos, contactar anestesia para eventual entubação endotraqueal e fenobarbital e.v.
Investigação etiológica:
• inicial: glicemia, ionograma, calcemia, magnesiemia e uremia;
• adicional: ressonância magnética cerebral se primeira crise sem causa metabólica ou crise diferente do habitual com alterações do exame neurológico; punção lombar se suspeita de infeção do sistema nervoso central.
Suplementação com ácido fólico
À semelhança da população geral, a suplementação com ácido fólico deve ser iniciada 1 a 3 meses antes da data prevista da conceção e continuada pelo menos no decurso do 1º trimestre24,56; contudo, a dose diária recomendada nas mulheres com epilepsia é controversa8. É discutível a eficácia superior de uma dose diária de 4-5mg, ao invés de 0,4mg/dia e quem mais beneficia dessa maior dosagem. Alguns autores recomendam 4-5mg/dia de ácido fólico a todas as mulheres epiléticas, outros defendem que essa dose deve ser limitada às medicadas com antiepiléticos3. Além disso, os estudos revelaram-se inconclusivos relativamente à eficácia do ácido fólico na prevenção de doenças do tubo neural ou de outras malformações associadas aos antiepiléticos, talvez porque resultam de um mecanismo teratogénico independente do metabolismo dos folatos57,58. Embora o estudo de Tomson et al não tivesse mostrado benefício da suplementação com ácido fólico na redução da incidência de malformações congénitas, concluiu que melhora o QI dos filhos de mães expostas aos antiepiléticos2.
Suplementação com vitamina K
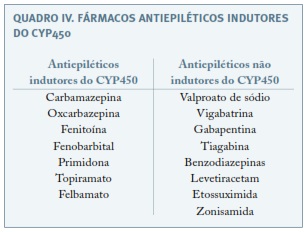
Estudos mais antigos associaram os indutores do citocrómio P450 (CYP450) com uma maior incidência de complicações hemorrágicas neonatais59. Argumentava-se que, esses fármacos, ao atravessarem a barreira placentária, aumentavam a degradação oxidativa fetal da vitamina K, condicionando uma diminuição dos fatores de coagulação dela dependentes. A recomendação para suplementação com vitamina K1 durante o último mês de gravidez, na dose de 10 a 20mg/dia, em gestantes medicadas com antiepiléticos indutores enzimáticos, visa portanto a profilaxia de hemorragia pós-natal24,56,59.
Recentemente tem sido contestado o aumento da morbilidade hemorrágica em recém-nascidos expostos aos antiepiléticos indutores enzimáticos60,61. A AAN/AES afirmam não existir evidência suficiente de que os filhos de grávidas medicadas com antiepiléticos tenham um maior risco de complicações hemorrágicas, não podendo suportar ou refutar a administração oral de vitamina K no último mês de gestação8. Como tal, para prevenção de complicações hemorrágicas neonatais em filhos de mães medicadas com antiepiléticos indutores enzimáticos, recomenda-se somente a administração intramuscular de 1mg de vitamina K que é realizada em todos os recém-nascidos3.
Vigilância gestacional
Uma vigilância pré-natal adequada implica a cooperação entre o médico de saúde materna e neurologista ou médico internista3.
A frequência das crises deve ser averiguada regularmente, e dela vai depender a periodicidade das consultas7. Se quadro de vómitos em contexto de medicação antiepilética, tratar rápida e adequadamente7.
Uma componente importante dos cuidados obstétricos da mulher epilética é o rastreio e diagnóstico de malformações fetais3. Para tal, é crucial um estudo morfológico completo, realizado entre as 18-22 semanas de gestação por ecografista devidamente qualificado, com recurso a um ecógrafo de alta resolução24,62. Alguns autores defendem a realização de ecocardiograma fetal às 22-24 semanas em mulheres medicadas com antiepiléticos, especialmente em regimes de politerapia24; outros advogam a sua utilização apenas se o exame da área cardíaca na ecografia morfológica for subótimo63.
Conduta no trabalho de parto
A indicação para indução de trabalho de parto ou para cesariana deve ser apenas obstétrica55. Alguns autores ponderam cesariana eletiva se55,64:
• crises frequentes no 3º trimestre;
• história de estado de mal epilético em situação de stress acentuado.
A incidência de crises tónico-clónicas no trabalho de parto é de aproximadamente 1-2%3, tendo no estudo EURAP atingido os 3,5%52; o seu aparecimento correlacionou-se com a ocorrência prévia na gravidez48,52. A parturiente apresenta uma predisposição acrescida para crises devido a uma série de fatores presentes no trabalho de parto: stress, dor, privação de sono, hiperventilação, hipoglicemia, falhas na toma dos antiepiléticos e medicações concomitantes53,64.
É necessário evitar a exaustão e hiperventilação maternas, manter a terapêutica crónica antiepilética durante o trabalho de parto e que este tenha lugar num centro capacitado para o tratamento das crises, manobras de reanimação materna e neonatal e realização de cesariana emergente 3,53,24,64,65. Pode ponderar-se o doseamento sérico intraparto dos fármacos a fim de garantir níveis adequados53. A analgesia epidural deve ser administrada numa fase precoce do trabalho de parto64 e a petidina evitada (esta última pode baixar o limiar convulsivo)54.
Em caso de crise tónico-clónica, tratar imediatamente com uma benzodiazepina endovenosa55,56; o sulfato de magnésio não é uma opção adequada nas convulsões epiléticas55. Com o tratamento da crise pode verificar-se sedação materna marcada, com necessidade de recurso a cesariana por não colaboração da parturiente53; as benzodiazepinas podem também condicionar alterações no registo cardiográfico fetal65. O fenobarbital, a primidona e as benzodiazepinas permanecem no plasma do recém-nascido durante vários dias, existindo o risco de sedação e síndrome de privação neonatal53,55. Quando forem administrados antiepiléticos com efeito sedativo durante o trabalho de parto, os esforços respiratórios do recém-nascido podem estar reduzidos, sendo necessário que neonatologista esteja disponível53.
Conduta no pós-parto
Nas primeiras 24 horas de puerpério a incidência de crises tónico-clónicas ronda os 1-4%3. Para a sua prevenção é fundamental a adesão à medicação e períodos de descanso e horas de sono adequados7.
Todos os fármacos anticonvulsivantes são excretados no leite materno, mas habitualmente em quantidade inferior à transferida por via transplacentária, pelo que geralmente a amamentação é segura e deve ser encorajada3,5,56. É aconselhável protelar a toma dos fármacos para depois das mamadas, de modo a diminuir a sua concentração no leite53.
Há que avaliar a necessidade de manutenção da medicação antiepilética na puérpera: se a dosagem foi alterada durante a gravidez, considerar o retorno gradual ao esquema pré-gravídico nas primeiras semanas pós-parto5,53. Deve ser tomada especial atenção aos fármacos sedativos, como o fenobarbital, a fenitoína e as benzodiazepinas, pois podem condicionar irritabilidade, sonolência ou atraso no crescimento no recém-nascido55. A excreção de lamotrigina no leite materno é particularmente elevada, embora Ohman et al não tenham encontrado efeitos secundários no recém-nascido decorrentes dessa eliminação66,67.
Importa ainda instituir contraceção adequada que, nas mulheres sem medicação antiepilética ou tratadas com antiepiléticos não indutores do CYP450, segue as recomendações habituais no puerpério; se tratamento com antiepiléticos indutores enzimáticos proceder aos devidos ajustes (ver “Abordagem pré-concecional)24,56.
Fox et al estudaram a importância de informar as puérperas com epilepsia acerca de medidas de segurança a adotar durante a prestação de cuidados aos recém-nascidos, de modo a evitar acidentes (Quadro III)68. Constataram que, das 187 mulheres informadas, apenas 3 protagonizaram acidentes minor, comparativamente com os 8 acidentes major e 4 acidentes minor verificados no grupo das 38 mulheres não informadas; todos os acidentes documentados eram evitáveis à exceção de um, logo concluíu-se que a comunicação e adoção de precauções especiais nos cuidados com o recém-nascido em mulheres epiléticas reduzem o risco de acidentes e minimizam a ansiedade.
Abordagem pré-concecional
A abordagem da epilepsia e gravidez deve começar no início da vida reprodutiva53. A intervenção pré-concecional implica uma parceria entre os médicos responsáveis pela contraceção (ginecologista ou médico de família) e pelo seguimento da epilepsia (neurologista ou médico internista).
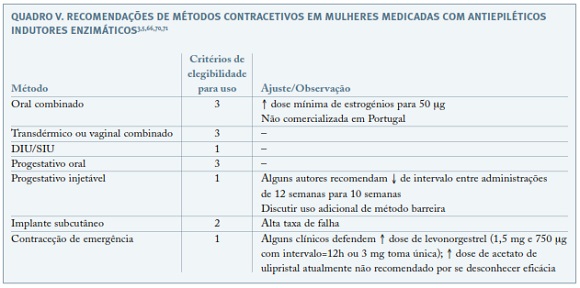
O prognóstico gestacional depende de um controlo otimizado da doença e cuidadoso planeamento da gravidez, pelo que é fundamental uma contraceção adequada até estar estabelecido o momento ideal para a conceção24. Embora nenhum método hormonal esteja contra-indicado em mulheres com epilepsia, para o seu aconselhamento contracetivo há que ter presente que os fármacos antiepiléticos indutores do CYP450 podem reduzir a eficácia de alguns anticoncecionais hormonais, ao aumentar o metabolismo estroprogestativo (Quadros IV e V)64,70. O tratamento com lamotrigina pode ser afetado pelo uso de contraceptivos orais combinados (COC): estes aumentam a depuração de lamotrigina, reduzindo os seus níveis séricos; o contrário acontece no período de pausa do COC, durante o qual se pode registar um aumento dos efeitos adversos deste antiepilético71. Se epilepsia não medicada, qualquer método contracetivo pode ser escolhido72.
Pré-concecionalmente importa, após confirmação do diagnóstico de epilepsia, apurar o tipo de epilepsia e o grau de controlo; este último determina a necessidade de terapêutica anticonvulsivante. Uma das recomendações baseia-se na ocorrência de crises epiléticas nos dois anos anteriores24:
• se ausentes, o desmame com eventual suspensão da medicação anticonvulsivante pode ser equacionado, exceto se a utente apresentar epilepsia mioclónica juvenil53,64;
• se presentes, a terapêutica tem indicação para ser continuada ou iniciada pré-concecionalmente e mantida durante a gravidez.
Na escolha do tratamento antiepilético recomenda-se:
• Preferir monoterapia;
• Escolher o fármaco com a melhor relação risco- -benefício (sendo o valproato de sódio a última linha terapêutica);
• Titular a dose do fármaco até controlo das crises ou sinais de intolerância;
• Se o fármaco escolhido for ineficaz considerar outro;
• Perante antecedentes obstétricos de malformações, evitar o fármaco antiepilético que a doente tomava nessa altura7.
A ausência total das crises epiléticas no ano que precede a conceção correlaciona-se com a manutenção de um controlo otimizado da doença na gravidez73.
Na pré-conceção há que providenciar os devidos esclarecimentos às mulheres acerca do prognóstico de uma gravidez no contexto de epilepsia3. Crawford et al estudaram as questões evidenciadas pelas doentes com epilepsia face a uma futura gravidez; concluíram que a sua principal preocupação prende-se com os efeitos fetais dos antiepiléticos, o que explica que muitas suspendam a medicação quando engravidam; cerca de 55% das mulheres classificou como insuficientes as informações que lhe foram transmitidas, demonstrando que desejam ter acesso atempado aos dados relevantes74,75.
Conclusão
Sendo a epilepsia uma doença comum na gravidez, é fundamental que os profissionais de saúde estejam informados acerca do risco materno-fetal inerente, nomeadamente acerca dos efeitos potenciais das crises epiléticas e dos fármacos anticonvulsivantes, e sobre quais as opções contracetivas válidas. A maioria das gestantes requer medicação crónica para controlo da doença, importando definir pré-concecionalmente um regime eficaz e o menos teratogénico possível. Alguns aspetos da intervenção pré-natal ainda estão por esclarecer, tais como o efeito dos novos antiepiléticos e o papel da suplementação com acido fólico e vitamina K. Para tal é fundamental otimizar o registo dos desfechos obstétricos e neonatais destas gestações.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Viinikainen K, Heinonen S, Eriksson K, Kalviainen R. Community-based, prospective, controlled study of obstetric and neonatal outcome of 179 pregnancies in women with epilepsy. Epilepsia 2006;47:186-192. [ Links ]
2. Tomson T, Battino D, Bonizzoni E, Craig J, Lindhout D, Sabers A, et al; for the EURAP Study Group. Dose-Dependent Risk of Malformations With Antiepileptic Drugs: An Analysis of Data From the EURAP Epilepsy and Pregnancy Registry. Lancet Neurol 2011;10(7):609-617.
3. National Clinical Guideline Centre. Pharmacological Update of Clinical Guideline 20. The diagnosis and management of the epilepsies in adults and children in primary and secondary care. 2012. [ Links ]
4. Report of the Quality Standards Subcommittee of the American Academy of Neurology. Practice parameter: management issues for women with epilepsy (summary statement). Neurology 1998;51:944-948 [ Links ]
5. Betts T, Crawford P. Women and Epilepsy. London, UK: Martin Dunitz, 1998:27-28. [ Links ]
6. Barrett C, Richens A. Epilepsy and pregnancy: Report of an Epilepsy Research Foundation Workshop. Epilepsy Res. 2003;52(3):147-187. [ Links ]
7. Harden CL. Pregnancy and Epilepsy. Continuum (Minneap Minn) 2014;20(1):60-79. [ Links ]
8. Harden CL, Pennell PB, Koppel BS, Hovinga CA, Gidal B, Meador KJ, et al; American Academy of Neurology; American Epilepsy Society. Practice parameter update: management issues for women with epilepsy: focus on pregnancy (an evidence-based review): vitamin K, folic acid, blood levels, and breastfeeding: report of the Quality Standards Subcommittee and Therapeutics and Technology Assessment Subcommittee of the American Academy of Neurology and American Epilepsy Society. Neurology 2009;73(2):142-149. [ Links ]
9. Meador KJ, Baker GA, Finnell RH, Kalayjian LA, Liporace JD, Loring DW, et al; NEAD Study Group. In utero antiepileptic drug exposure: fetal death and malformations. Neurology 2006;67:407-412. [ Links ]
10. Campbell E, Kennedy F, Russell A, Smithson WH, Parsons L, Morrison PJ, et al. Malformation risks of antiepileptic drug monotherapies in pregnancy: updated results from the UK and Ireland Epilepsy and Pregnancy Registers. J Neurol Neurosurg Psychiatry 2014;85(9):1029-1034. [ Links ]
11. Wells PG, McCallum GP, Chen CS, Henderson JT, Lee CJ, Perstin J, et al. Oxidative stress in developmental origins of disease: Teratogenesis, neurodevelopmental deficits, and cancer. Toxicol Sci 2009;108:4-18. [ Links ]
12. Dansky LV, Rosenblatt DS, Andermann E. Mechanisms of teratogenesis: Folic acid and antiepileptic therapy. Neurology 1992;42:32-42. [ Links ]
13. Artama M, Auvinen A, Raudaskoski T, Isojärvi I, Isojärvi J. Antiepileptic drug use of women with epilepsy and congenital malformations in offspring. Neurology 2005;64(11):1874-1878. [ Links ]
14. Harden CL, Meador KJ, Pennell PB, Hauser WA, Gronseth GS, French JA, et al; American Academy of Neurology; American Epilepsy Society. Practice parameter update: management issues for women with epilepsy-Focus on pregnancy (an evidence-based review): II. Teratogenesis and perinatal outcomes: Report of the Quality Standards Subcommittee and Therapeutics and Technology Subcommittee of the American Academy of Neurology and the American Epilepsy Society. Epilepsia. 2009;50(5):1237-1246. [ Links ]
15. Morrow J, Russell A, Guthrie E, Parsons L, Robertson I, Waddell R, et al. Malformation risks of antiepileptic drugs in pregnancy: A prospective study from the UK Epilepsy and Pregnancy Register. J Neurol Neurosurg Psychiatry 2006;77:193-198. [ Links ]
16. Meador K, Reynoldsb MW, Creanb S, Fahrbachb K, Probst C. Pregnancy outcomes in women with epilepsy: A systematic review and meta-analysis of published pregnancy registries and cohorts. Epilepsy Res. 2008; 81(1):1-13. [ Links ]
17. Hernández-Díaz S, Smith CR, Shen A, Mittendorf R, Hauser WA, Yerby M, Holmes LB; North American AED Pregnancy Registry; North American AED Pregnancy Registry. Comparative safety of antiepileptic drugs during pregnancy. Neurology 2012;78(21):1692-1699. [ Links ]
18. Mølgaard-Nielsen D1, Hviid A. Newer-generation antiepileptic drugs and the risk of major birth defects. JAMA. 2011 May 18;305(19):1996-2002. [ Links ]
19. Vajda FJ, O’Brien TJ, Lander CM, Graham J, Roten A, Eadie MJ. Teratogenesis in repeated pregnancies in antiepileptic drug-treated women. Epilepsia. 2013 Jan;54(1):181-186.
20. Vajda FJ, O’Brien TJ, Graham J, Lander CM, Eadie MJ. Prediction of the hazard of foetal malformation in pregnant women with epilepsy. Epilepsy Res. 2014 Aug;108(6):1013-1017.
21. Vajda FJ, Graham J, Roten A, Lander CM, O’Brien TJ, Eadie M. Teratogenicity of the newer antiepileptic drugs - the Australian experience. J Clin Neurosci 2012;19(1):57-59. [ Links ]
22. Vajda FJ, Horgan D, Hollingworth S, Graham J, Hitchcock AA, Roten A, et al. The prescribing of antiepileptic drugs for pregnant Australian women. Aust N Z J Obstet Gynaecol. 2012 Feb;52(1):49-53.
23. Wide K, Winbladh B, Källén B. Major malformations in infants exposed to antiepileptic drugs in utero, with emphasis on carbamazepine and valproic acid: a nation-wide, population-based register study. Acta Paediatr 2004;93:174-176. [ Links ]
24. Worcestershire Health and Care NHS Trust. Guideline for the management of women with epilepsy in pregnancy. 2014. [ Links ]
25. Samrén EB, van Duijn CM, Christiaens GCML, Hofman A, Lindhout E. Antiepileptic drug regimens and major congenital abnormalities in the offspring. Ann Neurol 1999;46:739-746. [ Links ]
26. Arpino C, Brescianini S, Robert E, Castilla EE, Cocchi G, Cornel MC, et al. Teratogenic effects of antiepileptic drugs: use of an international database on malformations and drug exposure (MADRE). Epilepsia 2000;41:1436-1443. [ Links ]
27. Jentink J, Loane MA, Dolk H, Barisic I, Garne E, Morris JK, et al; EUROCAT Antiepileptic Study Working Group. Valproic acid monotherapy in pregnancy and major congenital malformations. N Engl J Med 2010;362(23):2185-2193. [ Links ]
28. Puho EH, Szunyogh M, Metneki J, Czeizel AE. Drug treatment during pregnancy and isolated orofacial clefts in Hungary. Cleft Palate Craniofac J 2007;4:194-202. [ Links ]
29. Canger R, Battino D, Canevini MP, Fumarola C, Guidolin L, Vignoli A, et al. Malformations in offspring of women with epilepsy: a prospective study. Epilepsia 1999;40:1231-1236. [ Links ]
30. Adab N, Jacoby A, Smith D, Chadwick D. Additional educational needs in children born to mothers with epilepsy. J Neurol Neurosurg Psychiatry 2001;70:15-21. [ Links ]
31. Reinisch JM, Sanders SA, Mortensen EL, Rubin DB. In utero exposure to phenobarbital and intelligence deficits in adult men. JAMA 1995;274:1518-1525. [ Links ]
32. Hirano T, Fujioka K, Okada M, Iwasa H, Kaneko S. Physical and psychomotor development in the offspring born to mothers with epilepsy. Epilepsia 2004;45(suppl 8):53-57. [ Links ]
33. Thomas SV, Ajaykumar B, Sindhu K, Nair MK, George B, Sarma PS. Motor and mental development of infants exposed to antiepileptic drugs in utero. Epilepsy Behav 2008;13:229-236. [ Links ]
34. Koch S, Titze K, Zimmermann RB, Schröder M, Lehmkuhl U, Rauh H. Long-term neuropsychological consequences of maternal epilepsy and anticonvulsant treatment during pregnancy for school-age children and adolescents. Epilepsia 1999;40:1237-1243. [ Links ]
35. Oyen N, Vollset SE, Eide MG, Bjerkedal T, Skjærven R. Maternal epilepsy and offspring’s adult intelligence: a population-based study from Norway. Epilepsia 2007;48:1731-1738. [ Links ]
36. Thomas SV, Sukumaran S, Lukose N, George A, Sarma PS. Intellectual and language functions in children of mothers with epilepsy. Epilepsia 2007;48:2234-2340. [ Links ]
37. Meador KJ, Baker GA, Browning N, Cohen MJ, Bromley RL, Clayton-Smith J, et al; NEAD Study Group. Fetal Antiepileptic Drug Exposure and Cognitive Outcomes at Age 6 Years (NEAD Study): A Prospective Observational Study. Lancet Neurol 2013;12:244-252.
38. Vinten J, Adab N, Kini U, Gorry J, Gregg J, Baker GA; Liverpool and Manchester Neurodevelopment Study Group. Neuropsychological effects of exposure to anticonvulsant medication in utero. Neurology 2005;64(6):949-954 . [ Links ]
39. Hvas CL, Henriksen TB, Ostergaard JR, Dam M. Epilepsy and pregnancy: effect of antiepileptic drugs and lifestyle on birth weight. Br J Obstet Gynaecol 2000;107:896-902. [ Links ]
40. Veiby G, Daltveit AK, Engelsen BA, Gilhus NE. Pregnancy, delivery, and outcome for the child in maternal epilepsy. Epilepsia 2009;50(9):2130-2139. [ Links ]
41. Pennell PB, Klein AM, Browning N, Baker GA, Clayton-Smith J, Kalayjian LA, et al; NEAD Study Group. Differential effects of antiepileptic drugs on neonatal outcomes. Epilepsy Behav 2012;24(4):449-456
42. Laskowska M, Leszczyriska-Gorzelak B, Oleszczuk J. Pregnancy in women with epilepsy. Gynecol Obstet Invest 2001;51:99-102. [ Links ]
43. Borthen I, Eide MG, Daltveit AK, Gilhus NE. Delivery outcome of women with epilepsy: a population-based cohort study. BJOG. 2010;117(12):1537-1543. [ Links ]
44. Bromley RL, Mawer G, Clayton-Smith J,Baker GA; Liverpool and Manchester Neurodevelopment Group. Autism spectrum disorders following in utero exposure to antiepileptic drugs. Neurology 2008;71(23):1923-1924. [ Links ]
45. Christensen J, Grønborg TK, Sørensen MJ, Schendel D, Parner ET, Pedersen LH, Vestergaard M. Prenatal valproate exposure and risk of autism spectrum disorders and childhood autism. JAMA 2013;309(16):1696-1703. [ Links ]
46. Harden CL, Hopp J, Ting TY, Pennell PB, French JA, Allen Hauser W, et al; American Academy of Neurology; American Epilepsy Society. Practice parameter update: management issues for women with epilepsy-Focus on pregnancy (an evidence-based review): I. Obstetrical complications and change in seizure frequency: Report of the Quality Standards Subcommittee and Therapeutics and Technology Assessment Subcommittee of the American Academy of Neurology and the American Epilepsy Society. Epilepsia 2009;50(5): 1229-1236.
47. Borthen I, Eide MG, Veiby G, Daltveit AK, Gilhus NE. Complications during pregnancy in women with epilepsy: population-based cohort study. BJOG 2009;116(13):1736-1742. [ Links ]
48. Thomas SV, Syam U, Devi JS. Predictors of seizures during pregnancy in women with epilepsy. Epilepsia 2012;53(5):85-88. [ Links ]
49. Schmidt D, Canger R, Avanzini G, Battino D, Cusi C, Beck-Mannagetta G, et al. Change of seizure frequency in pregnant epileptic women. Journal of Neurology, Neurosurgery & Psychiatry. 1983; 46(8):751-755. [ Links ]
50. Tomson T, Landmark CJ, Battino D. Antiepileptic drug treatment in pregnancy: changes in drug disposition and their clinical implications. Epilepsia. 2013;54(3):405-414. [ Links ]
51. Pennell PB. Antiepileptic drug pharmacokinetics during pregnancy and lactation. Neurology 2003;61(6 Suppl 2):S35-42. [ Links ]
52. EURAP Study Group. Seizure Control and Treatment in Pregnancy: Observations from the EURAP Epilepsy Pregnancy Registry. Neurology 2006;66:354-360. [ Links ]
53. Thomas SV. Managing epilepsy in pregnancy. Neurol India 2011;59:59-65. [ Links ]
54. Adab N. Therapeutic monitoring of antiepileptic drugs during pregnancy and in the postpartum period: is it useful? CNS Drugs. 2006;20(10):791-800. [ Links ]
55. Schachter SC (2014). Management of epilepsy and pregnancy. Em: Eichler AF (Ed), UpToDate. Retirado de http://www.uptodate.com/home. [ Links ]
56. The Scottish Obstetrics Guidelines and Audit Project. The management of pregnancy in women with epilepsy. A clinical practical guideline for professionals involved in maternity care in Scotland. 1997. [ Links ]
57. Yerby MS. Management issues for women with epilepsy: Neural tube defects and folic acid supplementation. Neurology. 2003; 61(6 Suppl 2):S23-S26. [ Links ]
58. Morrow JI, Hunt SJ, Russell AJ, Smithson WH, Parsons L, Robertson I, et al. Folic acid use and major congenital malformations in offspring of women with epilepsy: a prospective study from the UK Epilepsy and Pregnancy Register. J Neurol Neurosurg Psychiatry 2009;80(5):506- -511. [ Links ]
59. Kazmin A, Wong RC, Sermer M, Koren G. Antiepileptic drugs in pregnancy and hemorrhagic disease of the newborn - An update. Can Fam Physician. 2010; 56(12):1291-1292. [ Links ]
60. Kaaja E, Kaaja R, Matila R, Hiilesmaa V. Enzyme-inducing antiepileptic drugs in pregnancy and the risk of bleeding in the neonate. Neurology 2002;58(4):549-553. [ Links ]
61. Choulika S, Grabowski E, Holmes LB. Is antenatal vitamin K prophylaxis needed for pregnant women taking anticonvulsants? Am J Obstet Gynecol 2004;190(4):882-883. [ Links ]
62. National Collaborating Centre for Women’s and Children’s Health. Antenatal care. Routine care for the healthy pregnant woman. London: RCOG Press, 2003. [ Links ]
63. Pennell PB. Pregnancy in the woman with epilepsy: maternal and fetal outcomes. Semin Neurol 2002;22(3):299-308. [ Links ]
64. Crawford P. Best Practice Guidelines for the Management of Women with Epilepsy. Epilepsia 2005; 46(Suppl. 9):117-124. [ Links ]
65. Walker S, Permezel M, Berkovic S. The management of epilepsy in pregnancy. BJOG 2009;116:758-767. [ Links ]
66. Liporace J, Kao A, D’Abreu A. Concerns regarding lamotrigine and breast-feeding. Epilepsy Behav 2004;5:102-105. [ Links ]
67. Ohman I, Vitols S, Thomson T. Lamotrigine in pregnancy: pharmacokinetics during delivery, in the neonate during lactation. Epilepsia 2000;41:709-713. [ Links ]
68. Fox C, Betts T. How much risk does a woman with active epilepsy pose to her newborn child in the puerperium? A pilot study. Seizure. 1999; 8(6):367-369. [ Links ]
69. https://www.epilepsy.org.uk/info/caring-childern/keeping-baby-child-safe-home [ Links ]
70. Crawford P. Interactions between antiepileptic drugs and hormonal contraception. CNS Drugs 2002;16:263-272. [ Links ]
71. Faculty of Sexual and Reproductive Healthcare Clinical Effectiveness Unit. Antiepileptic Drugs and Contraception. CEU Statement 2010. [ Links ]
72. Sociedade Portuguesa de Ginecologia, Sociedade Portuguesa da Contraceção, Sociedade Portuguesa de Medicina da Reprodução. Contraceção em situações médicas especiais em: Consensos sobre contraceção. 2011:99-100. [ Links ]
73. Eadie MJ. Treating epilepsy in pregnant women. Expert Opin Pharmacother. 2014 Apr;15(6):841-850. [ Links ]
74. Crawford P, Lee P. Gender difference in management of epilepsy - What women are hearing. Seizure. 1999; 8(3):135-139. [ Links ]
75. Crawford P, Hudson S. Understanding the information needs of women with epilepsy at different lifestages: results of the ‘Ideal World’ survey. Seizure 2003;12:502-507. [ Links ]
Endereço para correspondência | Dirección para correspondencia | Correspondence
Sofia Aguilar
E-mail: sofia6aguilar@gmail.com
Recebido em: 28/1/2015
Aceite para publicação: 16/6/2015