Introdução
A diabetes gestacional (DG) é um subtipo de intolerância aos hidratos de carbono diagnosticado pela primeira vez no decurso da gravidez.1 Trata-se de uma complicação obstétrica comum, afetando, a nível global, cerca de 13,4% das gestações. (2 Em Portugal, o número total de casos tem aumentado nos últimos anos, estimando-se uma prevalência de 8,8% em 2018. (3 A DG está associada a múltiplos desfechos maternos e neonatais indesejáveis e a um risco aumentado de complicações a longo prazo. (1,2
Evidências recentes sugerem que o microbiota intestinal, que corresponde aos microrganismos que colonizam o trato gastrointestinal, possa desempenhar um papel na fisiopatologia da DG. (4 Mulheres que desenvolvem DG apresentam um desequilíbrio do padrão microbiano (disbiose intestinal) capaz de induzir alterações em vias de secreção e sinalização de insulina e contribuir para a patogénese da doença. (5,6 Nesse sentido, a manipulação do microbiota intestinal através do uso de probióticos poderá revelar-se uma abordagem promissora na prevenção e tratamento da DG.
Os probióticos são definidos como microrganismos vivos que, em doses adequadas, conferem benefícios à saúde. (7 Apesar de terem sido relatados efeitos benéficos dos probióticos no metabolismo da glicose durante a gravidez, ensaios clínicos e meta-análises apresentam resultados inconsistentes, não estando, atualmente, esclarecido qual o papel dos probióticos na DG. (8,14
O objetivo desta revisão é elucidar as alterações do microbiota intestinal associadas à DG, a forma como estas contribuem para a patogénese da doença, os mecanismos de ação dos probióticos e o seu o papel na prevenção e tratamento da DG.
Metodologia
A pesquisa bibliográfica foi realizada nas bases de dados Pubmed, Scielo e Tripdatabase em novembro de 2020, através das seguintes equações de pesquisa: “(“Diabetes, Gestational”[Mesh]) AND (“Microbiota”[Mesh] OR “Probiotics”[Mesh] OR “Dysbiosis” [Mesh])”; “(“gestational diabetes” OR “pregnancy-induced diabetes”) AND (probiotics OR microbiota OR microbiome OR microflora OR flora OR microbial OR dysbiosis OR dysbacteriosis)”. Num total de 462 resultados, obtiveram-se 333 artigos após a remoção dos duplicados.
Definiram-se como critérios de inclusão artigos publicados entre 2010 e 2021, em inglês, português ou espanhol e que relacionassem o microbiota intestinal materna com a DG ou o uso de probióticos com a sua prevenção e tratamento. Foram incluídos ensaios clínicos randomizados, meta-análises, revisões sistemáticas, revisões narrativas, estudos coorte, estudos caso-controlo, estudos transversais e estudos com animais, sendo que nestes últimos apenas foram selecionados os que abordavam mecanismos fisiopatológicos do microbiota intestinal ou mecanismos de ação dos probióticos na DG. Foram excluídos artigos redundantes, protocolos de estudos, guidelines, comentários e artigos sem versão completa disponível.
O processo de seleção foi realizado por duas fases: inicialmente foram excluídos 220 artigos pela avaliação do título e resumo e posteriormente 56 através da análise do texto completo. A verificação das referências bibliográficas dos artigos selecionados permitiu adicionar 7 artigos de interesse. Em dezembro de 2021 foi realizada uma atualização da pesquisa bibliográfica, tendo sido incluídos 4 novos artigos, sendo que no total foram incluídos 68 artigos nesta revisão (Figura 1).
Adicionalmente, foram ainda considerados 2 artigos relativos à epidemiologia da DG e 1 artigo referente ao último consenso nacional de DG.
Discussão
1. Microbiota intestinal
1.1. Disbiose intestinal associada à DG
A gravidez está associada a inúmeras alterações fisiológicas essenciais à adaptação do organismo materno, que parecem abranger também o microbiota intestinal. (15-18 Na gravidez complicada com DG, esta evolução fisiológica ocorre de forma distinta, verificando-se um microbiota intestinal mais estática, sujeita a menor número de alterações.16,17,19 Deste modo, mulheres que desenvolvem DG evidenciam diferenças taxonómicas, funcionais e na diversidade do microbiota intestinal no primeiro, (16,20,21 segundo6,16,22-24 e terceiro19,25-30 trimestres de gravidez.
Na avaliação da diversidade do microbiota intestinal, a maioria dos resultados associam o desenvolvimento de DG a uma menor diversidade α (número de espécies diferentes dentro da amostra). (6,15,21-23,30,31 e a uma diversidade β aumentada (número de espécies diferentes entre amostras). (21,22,28 Esta menor riqueza microbiana (diversidade α) e maior individualidade da flora do intestino (diversidade β) podem ter consequências metabólicas, uma vez que foram relacionadas com valores mais elevados de glicose plasmática durante a gravidez. (22,30
A nível taxonómico, no segundo e terceiro trimestres de gravidez, foi descrita uma maior abundância do filo Firmicutes e uma menor abundância do filo Bacteroidetes em mulheres com DG. (6,19,26,30 Em níveis taxonómicos mais baixos, apesar das alterações na composição do microbiota intestinal na DG serem múltiplas e variáveis, revelou-se de forma mais consistente uma maior abundância de patobiontes gram-negativos, como espécies dos géneros Parabacteroides, Prevotella, Haemophilus, Desulfovibrio, Escherichia, Sutterella, Tyzzerella e gram-positivos, como espécies dos géneros Blautia, Collinsella. Por outro lado, evidencia-se uma menor quantidade de bactérias benéficas gram-positivas produtoras de ácidos gordos de cadeia curta (AGCC), como espécies dos géneros Faecalibacterium, Roseburia, Eubacterium, Alistipes, Coprococcus, Akkermansia; assim como bactérias produtoras de lactato, como espécies dos géneros Bifidobacterium, Lactobacillus, Streptococcus6,16,19-31 (Figura 2).
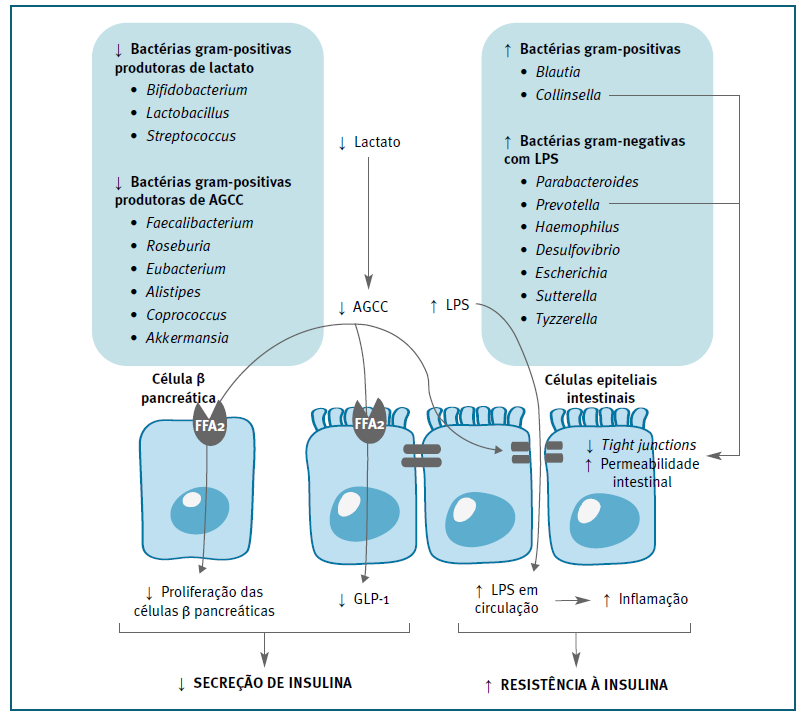
Figura 2 Papel da disbiose intestinal na fisiopatologia da diabetes gestacional5,6,16,19-31,33,36. ↑ aumenta; ↓ diminui; LPS lipopolissacarídeos; AGCC ácidos gordos de cadeia curta; GLP-1 peptídeo semelhante ao glucagon 1.
1.2. Disbiose intestinal na fisiopatologia da DG
A disbiose intestinal descrita na DG caracteriza-se pelo aumento da abundância de bactérias gram-negativas que contém lipopolissacarídeos (LPS) na sua parede celular, associada à diminuição da abundância de bactérias produtoras de AGCC. (16,21,23 A menor produção de AGCC e o aumento dos níveis de LPS, pode contribuir para o desenvolvimento de DG através de mecanismos que promovem a desregulação da permeabilidade intestinal, a secreção de hormonas intestinais e insulina, e a indução de um estado inflamatório de baixo grau. (5,32 (Figura 2).
1.2.1. Papel dos AGCC na secreção de insulina
Os principais AGCC são o acetato, propionato e butirato, que resultam da fermentação pelo microbiota intestinal de hidratos de carbono não digeríveis, como a fibra alimentar. (4,5 Estes interferem no metabolismo da glicose através da sua atuação em recetores FFA2 (recetores acoplados à proteína G, Gpr43) expressos nas células β pancreáticas e nas células L intestinais. Nas células β pancreáticas, a ligação dos AGCC aos recetores FFA2 proporciona a proliferação destas células e o aumento da secreção de insulina durante a gestação. (33 Por outro lado, a sinalização de FFA2 nas células L intestinais, leva à estimulação da secreção de hormonas intestinais, nomeadamente de peptídeo semelhante ao glucagon 1 (GLP-1), que promove a secreção de insulina. (34
A menor abundância de bactérias produtoras de AGCC em mulheres com DG vai condicionar estes mecanismos, comprometendo a adaptação das células β pancreáticas e a secreção de insulina durante a gravidez.
1.2.2. Papel dos AGCC e LPS na regulação da permeabilidade intestinal e inflamação de baixo grau
O epitélio intestinal é constituído por células epiteliais adjacentes unidas por tight junctions, que formam a barreira intestinal. (35 O microbiota intestinal regula a permeabilidade intestinal através da produção de AGCC, aumentando a integridade das junções intercelulares ao regular positivamente genes de proteínas de tight junctions, como a ocludina e zonula occludens-1. (5 Além disso, nas células epiteliais do cólon, o butirato é a principal fonte de energia. Quando há uma redução dos seus níveis, o ciclo de Krebs é inibido, provocando défices na respiração mitocondrial e, consequentemente, a autofagia dos componentes de tight junctions nas células epiteliais do cólon. (37 Desta forma, em mulheres com DG, a menor abundância de bactérias produtoras de AGCC vai favorecer o aumento da permeabilidade do intestino.
Outras bactérias não produtoras de AGCC também podem condicionar a barreira intestinal. Espécies dos géneros Prevotella e Collinsella encontram-se em quantidade aumentada no microbiota intestinal de mulheres com DG, (19,25,30,31 contribuindo para o aumento da permeabilidade do intestino através da sua capacidade de degradar mucina5,30,38 e reduzir a expressão de genes que codificam proteínas de tight junctions, (36 respetivamente.
Este aumento da permeabilidade intestinal associado à maior abundância de bactérias gram-negativas na flora intestinal de mulheres com DG vai facilitar a translocação para a circulação de LPS, proporcionando um aumento da sua concentração a nível sistémico. (5,23,35,39,40 Os LPS são endotoxinas capazes de provocar uma endotoxemia metabólica e induzir inflamação de baixo grau, através de mecanismos mediados pelos recetores Toll-like 4 (TLR4). (5,40 A inflamação crónica de baixo grau desempenha um papel importante na fisiopatologia da DG, uma vez que citocinas pró-inflamatórias, como o fator de necrose tumoral α (TNF-α), interleucina 6 (IL-6) e interleucina 1β (IL-1β), aumentam a fosforilação da serina do substrato do recetor de insulina 1 (IRS-1), reduzindo assim a sinalização de insulina. (5,38
2. Probióticos
2.1. Mecanismos de ação dos probióticos na DG
A suplementação com probióticos pode ajudar na regulação da disbiose intestinal associada à DG, favorecendo a produção de AGCC e reduzindo os níveis de LPS. Deste modo, os probióticos podem contribuir para a prevenção e tratamento da DG através de mecanismos que envolvem o aumento da secreção de GLP-1, a diminuição da inflamação e do stress oxidativo e a alteração da expressão de genes envolvidos no metabolismo da glicose. (5,7
2.1.1. Papel dos probióticos na secreção de GLP-1
A maior produção de AGCC induzida pelos probióticos, nomeadamente de butirato, promove o aumento de secreção de GLP-1 a nível das células L intestinais. (41 Como já referido, o GLP-1 é uma incretina que estimula a secreção de insulina pelas células β pancreáticas, contribuindo para a homeostase do metabolismo da glicose. (5,7
2.1.2. Papel dos probióticos na inflamação
Os probióticos, mediante a maior produção de AGCC, contribuem para a integridade da camada mucosa do intestino, aumentando a expressão de genes que codificam proteínas que constituem as tight junctions (ocludina e zonula occludens-1) (5,7 e promovendo a secreção de muco. (5 Assim, vão provocar uma diminuição da permeabilidade intestinal capaz de reduzir a translocação de LPS e patobiontes para a circulação sistémica e prevenir a endotoxemia metabólica que está na origem da inflamação de baixo grau e da resistência à insulina induzida pela disbiose intestinal. (5,7,40 Adicionalmente, a suplementação com probióticos parece também diminuir o número de bactérias gram-negativas, reduzindo a concentração de LPS e a inflamação a nível intestinal. (5,7,40
Os AGCC desempenham ainda um efeito direto na supressão da resposta inflamatória, reduzindo a produção de TNF-α, IL-6 e IL-1β. (42 Deste modo, níveis mais elevados de butirato, propionato e acetato vão inibir a fosforilação do IRS-1, aumentando a sensibilidade à insulina. (5,38
Gestantes com DG suplementadas com probióticos apresentam níveis significativamente mais baixos de marcadores inflamatórios, como proteína C reativa (PCR), (43-50 TNF-α, (44,45,48,49 e IL-6, (45,48,49 corroborando o efeito anti-inflamatório dos probióticos.
2.1.3. Papel dos probióticos no stress oxidativo
O excesso de espécies reativas de oxigénio, como radicais livres, contribuem para a resistência à insulina por inibição da captação de glicose estimulada pela insulina nos tecidos periféricos, ao interferirem com o IRS-1 e com o transportador de glicose 4 (GLUT-4).38
O potencial papel hipoglicemiante dos probióticos pode ser conseguido pela diminuição do stress oxidativo, mediante o aumento dos níveis de antioxidantes capazes de eliminar espécies reativas de oxigénio e a inibição da peroxidação. (7 Este efeito benéfico resulta, possivelmente, da maior produção de AGCC, nomeadamente de butirato, pelo microbiota intestinal. (46,47,51
Ensaios clínicos e meta-análises confirmam os efeitos antioxidantes dos probióticos, demonstrando uma redução significativa de marcadores de stress oxidativo, como o malondialdeído14,43,44,46-50,52 e um aumento da capacidade antioxidante total14,43,50,52 e de peptídeos antioxidantes, como a glutationa, (14,48,50 em mulheres com DG.
2.1.4. Papel dos probióticos na expressão génica
Os probióticos podem influenciar a expressão génica de proteínas importantes no metabolismo da glicose, melhorando a sinalização de insulina e a captação de glicose. Isto ocorre, por um lado, pelo aumento de proteínas envolvidas em vias de sinalização de insulina, como o IRS-1, o recetor de insulina β (IR-β) e a proteína quinase B (Akt), e, por outro, pelo aumento da expressão de GLUT-4, responsável pela captação intracelular de glicose. (7 Além disso, os probióticos podem melhorar a sensibilidade à insulina através do aumento da expressão de PPAR-γ, (7,52 um regulador da sinalização de insulina com expressão reduzida na DG. (38
Os probióticos podem também aumentar a expressão génica de recetores de vitamina D nas células intestinais, proporcionando níveis significativamente mais elevados de 25-hidroxivitamina D, tal como demonstrado num ensaio clínico em grávidas com DG. (46 A maior disponibilidade de vitamina D pode contribuir para a homeostasia da glicose durante a gestação, uma vez que estimula a secreção de insulina ao ligar-se a recetores presentes nas células β pancreáticas e melhora a sensibilidade à insulina promovendo a expressão de recetores de insulina. (46,53
2.2. Probióticos na prevenção da DG
A evidência de que mulheres que desenvolvem DG apresentam uma disbiose intestinal desde o primeiro trimestre de gravidez, ainda antes do diagnóstico da doença, fundamenta a hipótese de que a modulação do microbiota intestinal pode ser um potencial mecanismo de prevenção da DG. (16,20,21
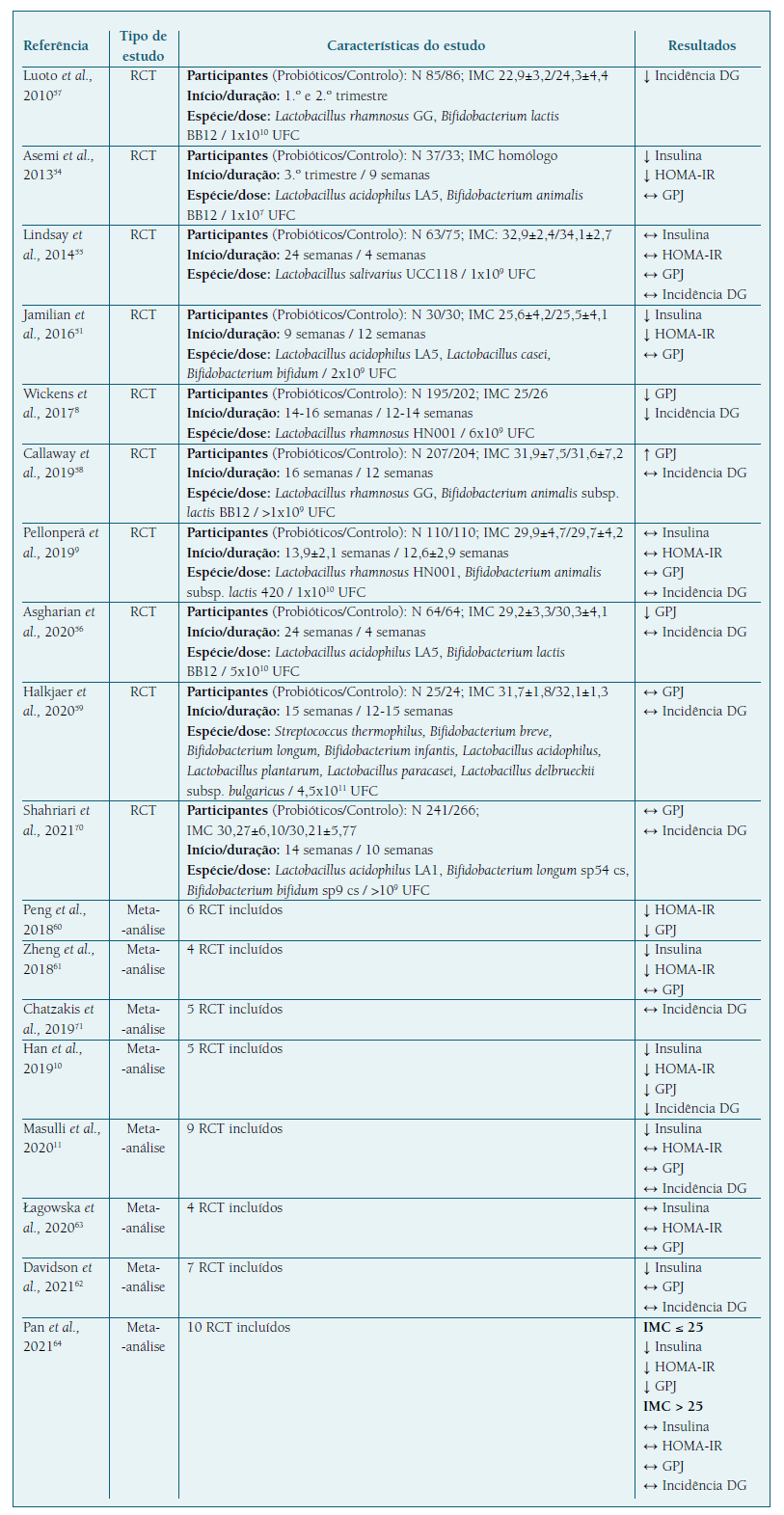
Ensaios clínicos realizados em grávidas sem DG mostraram que a suplementação com probióticos parece melhorar a resistência à insulina no segundo e terceiro trimestres de gravidez. (51,54 No entanto, em grávidas com excesso de peso ou obesidade este impacto positivo nos níveis séricos de insulina e marcadores de resistência à insulina não foi significativo. (9,55 Por outro lado, dos nove ensaios clínicos que avaliaram a glicémia em jejum em grávidas sem DG, apenas dois relataram uma redução dos níveis de glicose plasmática, (8,56 assim como apenas dois dos oito ensaios clínicos que avaliaram a incidência da DG, demostraram uma redução significativa do risco de desenvolver DG em grávidas que utilizaram probióticos8,57 (Quadro I).
De notar que os dois ensaios clínicos que detetaram uma menor incidência de DG em mulheres suplementadas com probióticos, Wichens et al. e Luoto et al., foram realizados em populações de grávidas com IMC mais baixo, comparativamente aos estudos que evidenciaram uma falta de eficácia dos probióticos na prevenção da DG. (8,9,55-59 Assim, é possível que a suplementação com probióticos seja apenas potencialmente útil na redução do risco de DG em mulheres magras, com uma desregulação metabólica mais ligeira, sendo clara a ausência de eficácia em gestantes com excesso de peso ou obesidade. Por outro lado, foram aplicados critérios diagnósticos distintos dos utilizados por outros estudos e dos recomendados em Portugal, proporcionando uma prevalência de DG na população em estudo muito diferente dos 13,4% descritos, atualmente, a nível global, o que torna os seus resultados não representativos e generalizáveis. (1,2,8,57
Meta-análises confirmam o papel dos probióticos na diminuição da resistência à insulina em grávidas normoglicémicas. (10,11,60-62 No entanto, este efeito benéfico dos probióticos não será clinicamente significativo, uma vez que a maioria destes estudos não detetou uma diminuição significativa dos níveis de glicose plasmática. (11,61-63 De referir que o IMC pode condicionar o impacto dos probióticos no metabolismo da glicose em mulheres sem DG, verificando-se numa meta-análise uma descriminação de resultados de acordo com o peso materno. (64 Apesar disso, carece evidência sobre o impacto dos probióticos na redução da incidência da DG, com apenas uma das cinco meta-análises a demonstrar uma diminuição significativa do número de casos da doença no grupo de mulheres submetidas à intervenção probiótica10 (Quadro I).
2.3. Probióticos no tratamento da DG
No tratamento da DG, os probióticos surgem como uma potencial abordagem complementar à alteração do estilo de vida, com o intuito de auxiliar no controlo glicémico e reduzir a necessidade de medidas farmacológicas. (48,65
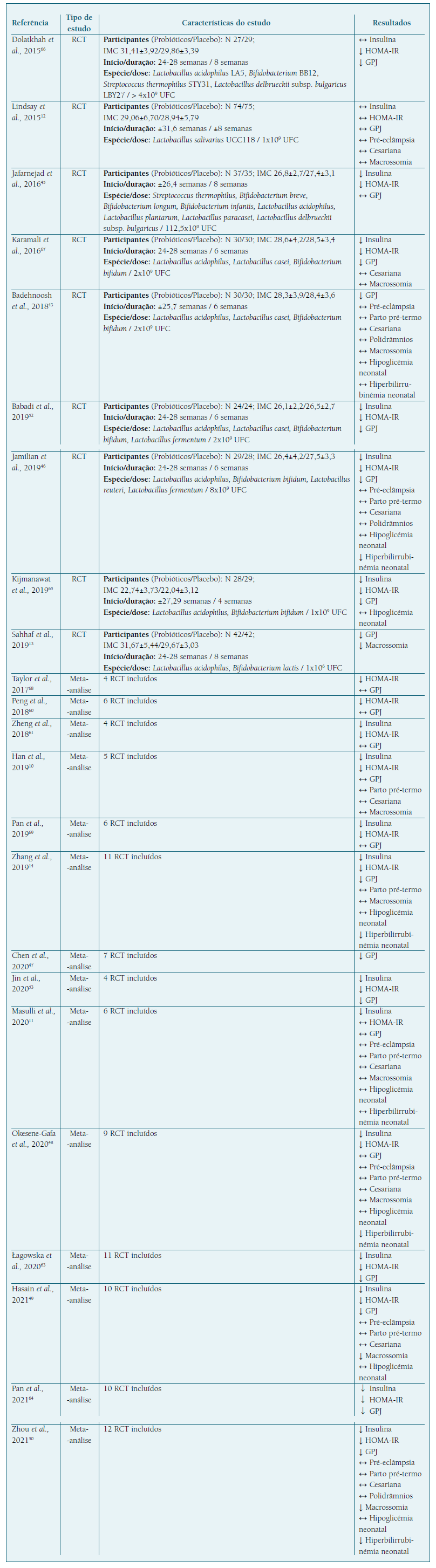
A maioria dos ensaios clínicos com probióticos, realizados em gestantes com DG apenas sujeitas a terapêutica nutricional e atividade física, mostrou uma diminuição significativa dos níveis séricos de insulina, marcadores de resistência à insulina45,46,52,65-67 e da glicose plasmática em jejum, (13,43,46,52,65-67 tanto em mulheres com peso normal, como com excesso de peso ou obesidade. No entanto, apesar do aparente efeito benéfico dos probióticos no metabolismo da glicose durante a gravidez, o seu uso não teve impacto na redução da necessidade de antidiabéticos orais ou insulina, (12,43 nem afetou a idade gestacional média de início desta terapêutica. (12
Para além disso, na generalidade dos ensaios clínicos, a suplementação com probióticos não afetou os desfechos materno-fetais e neonatais associados à DG, como taxa de cesariana, (12,43,46,67 parto pré-termo, (43,46 pré-eclampsia, (12,43,46 polidrâmnios43,46 e hipoglicémia neonatal. (43,46,65 Apesar disso, e de forma não consensual, (12,43,67 em dois ensaios clínicos, o uso de probióticos foi associado à diminuição significativa do risco de macrossomia13 e de hiperbilirrubinémia neonatal46 (Quadro II).
Em meta-análises foi unânime o efeito benéfico dos probióticos no metabolismo da insulina. (10,11,14,48,50,53,60,61,63,64,68,69 Contudo, o seu efeito hipoglicemiante em mulheres com DG é inconsistente, verificando-se uma divisão de resultados em relação ao papel dos probióticos na redução da glicémia plasmática em jejum. (10,11,14,47-50,53,60,61,63,64,68,69 Tal como demonstrado nos ensaios clínicos, as meta-análises reforçam a inexistência de efeitos significativos dos probióticos na redução da taxa de cesariana, (10,11,48-50 parto pré-termo, (10,11,14,48-50 pré-eclâmpsia, (11,48-50 polidrâmnios50 e hipoglicémia neonatal. (11,14,48-50 No entanto, três das quatro meta-análises que avaliaram o risco de hiperbilirrubinémia neonatal evidenciaram um efeito protetor dos probióticos na ocorrência desta complicação, (14,48,50 assim como duas das seis meta-análises que avaliaram o risco de macrossomia mostram um redução deste desfecho com utilização de probióticos49,50 (Quadro II).
2.4. Segurança dos probióticos na gravidez
Ensaios clínicos com mulheres grávidas não relataram efeitos adversos associados ao uso de probióticos ao longo da gestação, sugerindo que a suplementação com probióticos é uma abordagem segura e bem tolerada durante a gravidez. (8,9,12,13,43,45,46,51,52,54-59,65-67,70 Contudo, uma revisão sistemática e meta-análise, que inclui 7 ensaios clínicos, detetou um risco aumentado de pré-eclâmpsia com administração de probióticos em grávidas sem DG. (62
Conclusão
Mulheres que desenvolvem DG apresentam diferenças taxonómicas, funcionais e na diversidade do microbiota intestinal desde o primeiro trimestre de gravidez, ainda antes do diagnóstico da doença. Esta disbiose intestinal caracteriza-se por uma menor diversidade α e maior diversidade β, evidenciando-se, a nível taxonómico, um aumento da razão Firmicutes/Bacteroidetes, com um aumento da abundância de bactérias gram-negativas e uma diminuição de bactérias gram-positivas produtoras de AGCC.
Este desequilíbrio do microbiota intestinal pode desempenhar um papel importante na fisiopatologia da DG, através de mecanismos que envolvem os AGCC e os LPS bacterianos na secreção de incretinas e indução de um estado inflamatório de baixo grau. A suplementação com probióticos pode ajudar na regulação da disbiose intestinal inerente à DG e proporcionar alterações potencialmente benéficas na homeostase da glicose, como o aumento de GLP-1, a alteração da expressão de genes envolvidos no metabolismo da glicose e a diminuição da inflamação e do stress oxidativo.
Durante a gestação, os probióticos parecem reduzir a resistência à insulina, no entanto, o seu impacto na diminuição dos níveis de glicose plasmática é limitado. Em grávidas saudáveis, os probióticos não reduzem de forma significativa a incidência de DG. Em grávidas com DG, a suplementação com probióticos não tem impacto na redução da necessidade de medidas farmacológicas, não afeta a idade gestacional média de início desta terapêutica e não reduz a ocorrência da maioria dos desfechos adversos associados à doença, sendo apenas evidente a diminuição do risco de hiperbilirrubinémia neonatal.
Dada esta falta de evidência de efeitos benéficos clinicamente significativos e o potencial risco de pré-eclâmpsia associado à sua utilização, o uso de probióticos na prevenção e tratamento da DG não é apoiado pela evidência científica atual.