Introdução
A gravidez, pelas inerentes alterações biológicas, psicológicas e sociais, constitui uma fase de elevada vulnerabilidade no desencadear ou descompensar da doença mental, como depressão, perturbações de ansiedade ou do sono e psicoses1.
A evidência mais recente estima que cerca de 20% das mulheres sofrem de depressão pré-natal e em 19% daquelas sem depressão, o início da perturbação depressiva ocorre nas primeiras semanas após o parto1,2.
A depressão pré-natal não tratada é também um dos fatores de risco mais relevantes para a depressão pós-parto e pode ter efeitos adversos no neurodesenvolvimento infantil além de consequências potencialmente devastadoras, como o suicídio e o infanticídio3. Os suicídios representam até 20% de todas as mortes no pós-parto e constituem uma das principais causas de mortalidade periparto, estando muito associados à escassez de tratamento atempado com psicofármacos3.
Relativamente às perturbações psicóticas, cerca de 10% das mulheres grávidas que necessitam de internamento por psicose desenvolvem sintomas psicóticos no pós-parto3.
A incidência de psicose pós-parto é de 0,1 a 0,25% na população em geral, mas as mulheres com doença bipolar têm um risco aumentado de psicose pós-parto e uma em cada cinco tem uma recaída psicótica no período pós-parto. Há também um alto risco de recaída em mulheres com história pessoal ou familiar de psicose pós-parto3.
O diagnóstico de perturbações psiquiátricas na gestação permanece subestimado, assim como as consequências materno-fetais resultantes da ausência do seu tratamento4.
Tendo em conta os avanços científicos internacionais neste âmbito, nos últimos anos, em parte relacionados com a criação da subespecialidade em psiquiatria perinatal, torna-se prioritária uma revisão da literatura atual de forma a elaborar princípios gerais de prescrição de psicofármacos na gravidez e pós-parto de aplicação fácil e rápida no contexto clínico. Mais se acrescenta que, a nível nacional, não existem revisões atualizadas e exaustivas neste contexto, passíveis de utilização multidisciplinar pelas especialidades de Medicina Geral e Familiar, Obstetrícia, Psiquiatria e Neonatologia.
Metodologia
Foi realizada uma pesquisa bibliográfica durante o mês de abril de 2021 na base de dados da PubMed, combinando os termos MesH “Pregnancy” e “Psychotropic Drugs”. Foram selecionados artigos publicados nos últimos 5 anos (2016-2021), priorizando meta-análises, revisões sistemáticas e ensaios clínicos controlados e randomizados, nas línguas portuguesa e inglesa. No total, foram selecionados 16 artigos, tendo os restantes sido excluídos por não se adequarem aos critérios de seleção estabelecidos pelas autoras. Foi ainda consultada bibliografia em livros técnico-científicos de relevo para o tema em estudo.
Psicofármacos na gravidez e amamentação
Ao longo dos anos, a abordagem da gravidez em mulheres com patologia psiquiátrica foi alvo de controvérsias, havendo momentos na história em que foi altamente desencorajada a continuação da gravidez, dependendo do diagnóstico psiquiátrico5.
De facto, os estudos dedicados à psicofarmacologia das doenças mentais na gravidez são relativamente recentes5.
Atualmente é consensual que a gravidez não protege contra doenças psiquiátricas e pode até aumentar o risco geral se a medicação for interrompida. A saúde mental da mãe influencia o bem-estar fetal, os resultados obstétricos e o desenvolvimento infantil. A ausência de tratamento adequado da depressão, psicose ou perturbação bipolar na grávida pode prejudicar a gestante, porque conduz a autocuidados deficientes, incumprimento da vigilância obstétrica ou até suicídio, risco de complicações obstétricas e do desenvolvimento do feto como aborto espontâneo, pré-eclâmpsia1, anomalias placentárias, restrição de crescimento fetal, parto pré-termo, baixo peso ao nascer, hipoglicemia neonatal, entre outras3,6,7, bem como danos ao recém-nascido, variando de negligência até ao infanticídio3.
Por outro lado, o risco de teratogenicidade constitui uma das maiores preocupações relacionadas com a toma crónica de psicofármacos durante a gestação, uma vez que estes atravessam a placenta, contactam com o líquido amniótico5 e alcançam o sistema nervoso central fetal, podendo alterar o seu desenvolvimento in útero e eventualmente provocar até efeitos após o nascimento8.
O período de maior risco situa-se entre a 8.a e a 12.a semana da gravidez, quando os principais órgãos fetais estão a ser formados3,4, pelo que deve, sempre que possível, ser evitada a instituição de psicofármacos no primeiro trimestre. Se for necessário o uso de psicofármacos durante este período, estes deverão ser usados na dose mínima indispensável4.
Outras preocupações relacionadas com os psicofármacos na gravidez são os fenómenos de toxicidade e abstinência neonatais que podem ocorrer no recém-nascido e são muitas vezes genericamente designados na literatura de fenómenos de “má adaptação neonatal” ou de “síndrome comportamental neonatal”9.
A toxicidade neonatal está relacionada com a exposição fetal no terceiro trimestre a psicofármacos com semi-vida mais longa (antidepressivos, antipsicóticos, benzodiazepinas, lítio e lamotrigina). Os sintomas (hipertermia, sudorese, hiperreflexia, rigidez e diarreia) desenvolvem-se imediatamente após o nascimento e estão associados a concentrações plasmáticas elevadas do psicofármaco no recém-nascido. Este fenómeno pode ser difícil de distinguir clinicamente de outro denominado de abstinência neonatal. Este último tipicamente surge 8-48 horas após o nascimento e inclui recusa alimentar, vómitos, hipo ou hipertonia e alteração do sono. Está relacionado com psicofármacos (antidepressivos, benzodiazepinas, antipsicóticos) com semi-vida mais curta, pelo que as concentrações plasmáticas são baixas no recém-nascido9.
Os diagnósticos diferenciais de toxicidade e abstinência neonatais incluem quadros infecciosos e doenças neurológicas no recém-nascido, particularmente na presença de febre ou início dos sintomas 48 horas após o nascimento9.
As alterações neurocomportamentais e na saúde física a longo prazo (perturbações do espectro do autismo, perturbações de ansiedade, perturbação de hiperatividade e défice de atenção, síndrome das pernas inquietas...) têm também sido associadas aos psicofármacos, embora de forma inconsistente, devido aos seus potenciais efeitos directos no feto com modificações a nível genético e epigenético9,13.
A “Food and Drug Administration” (FDA) desenvolveu uma classificação da segurança reprodutiva de vários fármacos. Tal classificação inclui cinco categorias de risco - A, B, C, D e X - de acordo com o grau de risco na gestação evidenciado em estudos animais e humanos4,7. De acordo com esta classificação, nenhum psicofármaco foi aprovado pela FDA para uso durante a gestação, já que todos eles atravessam a placenta em maior ou menor percentagem4.
As próprias orientações mais recentes da FDA salientam que a classificação clássica não deve ser usada como padrão, sendo preferível recomendações específicas para cada fármaco (estas mudanças entraram em vigor em 2015 para todos os novos fármacos e serão implementadas ao longo do tempo para outros fármacos mais antigos). As principais razões para que a classificação ABCDX tenha sido posta em causa assenta no facto de ser extremamente simplista7 e nem sempre representar um método confiável para apoiar a prescrição médica4,10,11.
O crescente reconhecimento do impacto das doenças mentais perinatais na saúde pública motivou também sociedades científicas, como o Colégio Americano de Obstetras e Ginecologistas e a Academia Americana de Pediatria, a estabelecerem recomendações para o rastreio organizado de sintomatologia psiquiátrica durante a gravidez e no pós-parto8.
I. Antidepressivos
Os antidepressivos estão indicados no tratamento isolado ou complementar da depressão, perturbações de ansiedade e outras patologias psiquiátricas4.
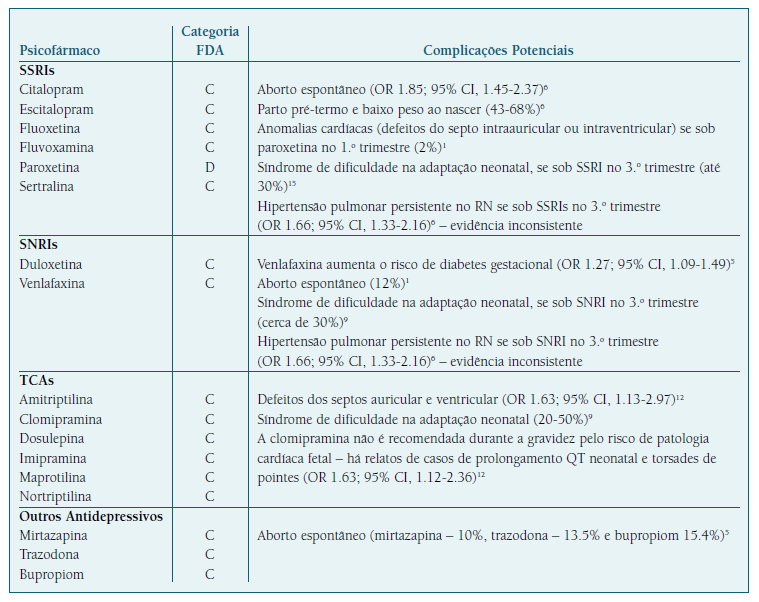
No Quadro I encontram-se as classes farmacológicas dos antidepressivos comercializados em Portugal.
A maioria dos estudos não controla a influência da doença psiquiátrica, por si só, nos riscos materno-fetais, mas sabe-se que os comportamentos e fatores de risco associados à doença psiquiátrica também podem influenciar alguns dos riscos encontrados. Os estudos que consideraram estes fatores não sugerem risco aumentado com a toma de inibidores selectivos da recaptação da serotonina (SSRIs) e apenas recomendam, se possível, que se evite o uso de paroxetina4,7.
Dentro dos SSRIs, a sertralina parece ter a menor taxa de passagem placentária3,4.
Embora existam menos dados sobre os inibidores da recaptação da serotonina e noradrenalina (SNRIs) comparativamente com os SSRIs, estes parecem comparáveis no seu perfil de segurança12. Apesar de estudos iniciais sugerirem que a exposição aos SNRIs se associava a anomalias congénitas como fenda palatina, hérnia diafragmática e deformidades dos membros, estabeleceu-se mais tarde que a exposição pré-natal a estes fármacos não aumentava a taxa de malformações congénitas nem de anomalias do neurodesenvolvimento12.
Existem, atualmente, dados insuficientes para considerar a mirtazapina uma opção de primeira linha, apesar desta apresentar propriedades antieméticas e existirem relatos da sua utilização em casos de hiperemese13.
A trazodona não deve ser considerada no tratamento da insónia na grávida13, mas em doses baixas (50-100 mg) tem dados de segurança aceitáveis na amamentação8.
Decorrente da vasta experiência com os antidepressivos tricíclicos, a sua segurança tem sido estabelecida ao longo dos anos3,4. Estes antidepressivos, como classe, não são, no entanto, considerados como primeira linha no tratamento farmacológico de perturbações de ansiedade/humor na gravidez, sobretudo pelos seus efeitos colaterais (hipotensão ortostática significativa). Destes, a nortriptilina é o fármaco preferencial durante a gestação devido aos reduzidos efeitos anticolinérgicos e hipotensores3,4,13.
O fenómeno de “má adaptação neonatal” constitui uma preocupação relativa ao uso de fármacos antidepressivos na gravidez. A sintomatologia inclui sintomas ligeiros e geralmente transitórios (taquipneia, taquicardia e tremor), resolvendo espontaneamente nos primeiros dias após o nascimento. Contudo, em 13% dos casos, os sintomas podem ser graves e configurar uma entidade clínica severa de síndrome de abstinência neonatal, carecendo de cuidados neonatais especializados14.
No caso particular dos SSRIs, o fenómeno de “má adaptação neonatal” (engloba a síndrome de abstinência e a síndrome/toxicidade serotoninérgica) ocorre em até 30% dos recém-nascidos expostos in útero a esta classe de antidepressivos15.
Adicionalmente, a síndrome de abstinência neo-natal é mais frequente com fármacos com tempos de semi-vida plasmáticos curtos14, como é o caso da fluvoxamina e paroxetina16. Contrariamente, SSRIs com tempos de semi-vida mais longos, como a sertralina, citalopram e fluoxetina16podem cursar com síndromes serotoninérgicas do neonato, resultantes da toxicidade serotoninérgica14.
No recém-nascido, a síndrome serotoninérgica geralmente ocorre logo após o nascimento, mas também pode apresentar um padrão clínico bifásico relacionado com a acumulação plasmática de metabolitos ativos do antidepressivo. Clinicamente inclui a presença de clónus associado a irritabilidade, hipertonia, tremores e febre baixa15.
A amamentação pode também prolongar a toxicidade serotoninérgica no recém-nascido, particularmente se a mãe estiver medicada com a fluoxetina (apresenta um metabolito ativo, a norfluoxetina com uma semi-vida plasmática que varia de 4 a 16 dias)15,16.
Alguns estudos relatam que grávidas medicadas com antidepressivos podem ter recém-nascidos com maior probabilidade de desenvolver episódios convulsivos durante o período neonatal. No entanto, devido ao número limitado de estudos atualmente disponível, é difícil chegar a conclusões absolutas sobre os efeitos potenciais dos antidepressivos na ocorrência de convulsões neonatais17. Além disso, a maioria dos estudos não avalia o impacto de fatores como a psicopatologia materna ou outras comorbilidades psiquiátricas, que por si só podem estar associadas a complicações perinatais13. Este facto invalida também a assunção de que as perturbações do espectro do autismo, ansiedade e perturbação de hiperatividade e défice de atenção sejam mais comuns em crianças expostas a antidepressivos in útero8.
Existe alguma controvérsia relativamente ao impacto da exposição pré-natal a antidepressivos no desenvolvimento cognitivo das crianças, não tendo sido, no entanto, associada a alterações em parâmetros neurocognitivos como o quociente de inteligência (QI) ou a linguagem8. A própria depressão materna pode ter efeitos adversos mais óbvios no neurodesenvolvimento da criança3.
II. Ansiolíticos/sedativos e hipnóticos
Benzodiazepinas e Análogos
As benzodiazepinas são fármacos usados como adjuvantes no tratamento de perturbações depressivas, de ansiedade e do sono4 e a sua prescrição durante a gravidez tem aumentado nas últimas décadas18,19.
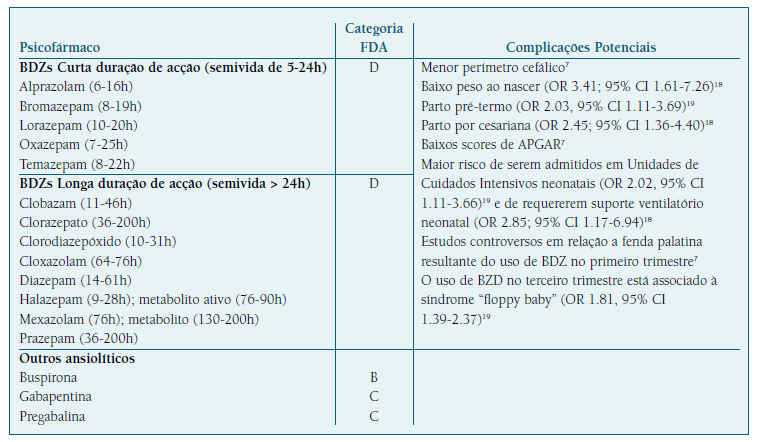
No Quadro II estão sistematizadas as classes farmacológicas das benzodiazepinas e outros ansiolíticos.
A maioria dos resultados de estudos acerca do uso de benzodiazepinas durante a gravidez é algo contraditória3. A exposição no primeiro trimestre às benzodiazepinas tem sido associada a um aumento do risco de fenda palatina, embora revisões recentes tenham descredibilizado esta causalidade e reconhecem a influência do frequente uso concomitante de álcool e substâncias ilícitas4,7,8,13. Apesar disso, é recomendável que a grávida evite a sua utilização durante o primeiro trimestre (quando ocorre o encerramento dos lábios e da fenda palatina) podendo esta classe farmacológica ser mais vantajosa posteriormente4.
O clorodiazepóxido tem sido associado a teratogenicidade, principalmente no primeiro trimestre4.
Os estudos relativos ao uso de diazepam durante a gestação são controversos, mas alguns mostram aumento do risco de malformações congénitas como fenda palatina, lábio leporino, hérnia inguinal e estenose pilórica, particularmente se prescrito no primeiro trimestre4.
As benzodiazepinas foram associadas também a sintomas de “má adaptação neonatal”, podendo os sintomas persistir até um mês após o nascimento8. Na sua generalidade, estas situações são incomuns e maioritariamente observadas em mulheres medicadas com benzodiazepinas em doses elevadas e por períodos prolongados4,13.
A maioria dos médicos recomenda reduzir e/ou suspender todos os fármacos benzodiazepínicos durante a gravidez, embora esta seja uma medida controversa pelo risco de agravamento da ansiedade na grávida e puérpera, sobretudo em mulheres com história de crises de pânico e perturbação obsessivo-compulsiva13.
Embora o alprazolam e o bromazepam apresentem as semi-vidas mais curtas (Quadro II), o facto de possuírem metabolitos ativos, leva a que o lorazepam seja a benzodiazepina preferida durante a gravidez e a amamentação, devido não apenas à sua semi-vida relativamente curta, mas também por não apresentar metabolitos ativos. Fármacos de ação curta são preferíveis durante a amamentação, para limitar os efeitos sedativos nos bebés após as mamadas7,18,19.
Gabapentina e pregabalina
A gabapentina, embora não esteja formalmente aprovada para o tratamento da ansiedade, é considerada uma alternativa segura no controlo dos sintomas ansiosos durante a gravidez. Agrupando todos os dados disponíveis, estima-se que o risco de malformações em recém-nascidos expostos apenas à gabapentina seja inferior àquele observado na população em geral13. No entanto, um estudo recente relata associação deste fármaco com parto pré-termo, baixo peso ao nascimento e necessidade de cuidados intensivos neonatais logo após o nascimento7.
Assim como a gabapentina, a pregabalina pode ter alguma utilidade na redução da sintomatologia ansiosa. Apesar de menos estudada na gravidez, também não existe associação conhecida com aumento do risco de malformações fetais7.
Outros ansiolíticos: antipsicóticos, hidroxizina, zolpidem e buspirona
Fármacos antipsicóticos em baixas doses, como a quetiapina e a olanzapina, podem ser utilizados no tratamento da perturbação de ansiedade e do sono em situações particulares. A quetiapina tem uma taxa relativamente baixa de passagem placentária bem como a olanzapina que atravessa a placenta humana em menos de 20%3,4.
A hidroxizina tem evidência de segurança reprodutiva limitada, mas tranquilizadora8.
O zolpidem não foi associado a um risco aumentado de malformações congénitas e tem uma excreção mínima no leite materno, podendo ser usado na amamentação8.
Embora a melatonina seja uma opção relativamente inócua na mulher não grávida, existem ainda poucos dados sobre seu uso durante a gravidez8.
III. Antipsicóticos
Os antipsicóticos são utilizados no tratamento das perturbações do espectro da esquizofrenia, bipolares e outras psicoses, sendo também frequentemente usados off-label nas perturbações depressivas, do sono e ansiedade12.
Não há evidências claras de que os antipsicóticos apresentem potencial teratogénico importante3,4.
No Quadro III referidos os antipsicóticos e as suas potenciais complicações.
Devido à longa história na utilização de antipsicóticos típicos, existem consideráveis dados sobre a segurança reprodutiva destes fármacos13. Entre os antipsicóticos disponíveis, a evidência de segurança é superior para os de elevada potência e, destes, o haloperidol é o melhor estudado relativamente ao uso durante a gestação. O haloperidol não evidenciou aumento do risco de malformações fetais, incluindo no primeiro trimestre de gestação. Já os antipsicóticos de baixa potência, como a cloropromazina, deverão ser evitados4,13.
Relativamente aos antipsicóticos atípicos ou de segunda geração, embora existam menos dados disponíveis sobre o seu perfil de segurança durante a gravidez, vários estudos de grande dimensão mostraram que, como classe, não parecem associar-se a qualquer tipo de malformação congénita13. A única exceção prende-se com a risperidona, que foi associada a um pequeno aumento na taxa de malformações congénitas (cardíacas, renais, genitais, auditivas e atrésia das coanas)8,12,13. Esta associação também pode ser aplicável à paliperidona, que é o principal metabolito ativo da risperidona8,13.
A clozapina é um antipsicótico de segunda linha, frequentemente utilizado no tratamento da esquizofrenia refractária20 e associa-se a agranulocitose no adulto, sendo também recomendada a monitorização dos leucócitos no recém-nascido4.
De notar que existe um risco aumentado de diabetes gestacional associado ao uso da maioria dos antipsicóticos atípicos, relacionado com os seus efeitos metabólicos adversos (particularmente a olanzapina e a quetiapina)7,8,13.
Os antipsicóticos de tipo depot (formulações injectáveis de longa duração) devem ser evitados durante a gestação, no sentido de limitar o tempo de exposição do feto ao fármaco.4
IV. Estabilizadores de humor
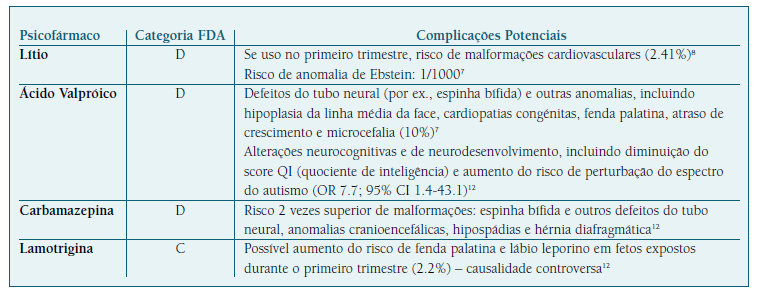
No Quadro IV estão reportadas as complicações dos principais fármacos estabilizadores de humor comercializados em Portugal.
Nenhum estabilizador de humor é claramente seguro na gravidez.3 Entre os estabilizadores de humor, o lítio é considerado de primeira linha e mais seguro para as mulheres grávidas, apresentando menor risco teratogénico do que os anticonvulsivantes. Entre os anticonvulsivantes, a lamotrigina é a mais segura21.
A prescrição de ácido valpróico está fortemente desaconselhada em mulheres em idade fértil, sendo que se for da vontade da mulher engravidar a curto-médio prazo, o ácido valpróico deve ser suspenso pelo menos seis meses previamente à gravidez e substituído por um esquema terapêutico mais seguro7,13.
Pela preocupação crescente relacionada com os riscos inerentes ao uso do ácido valpróico, a Agência Europeia do Medicamento procedeu à revisão de segurança deste medicamento no sentido de minimizar os riscos da sua utilização. Neste âmbito, o Infarmed emitiu em 2018 uma Circular Normativa alertando para a avaliação e prescrição consciente do valproato/ácido valpróico, visando garantir a segurança da sua utilização, particularmente em mulheres em idade fértil e estabeleceu algumas recomendações/medidas dirigidas aos profissionais de saúde e às próprias pacientes22,23.
As informações sobre a segurança reprodutiva de outros anticonvulsivantes, como a oxcarbazepina e o topiramato, são limitadas. Estes fármacos, geralmente não são de primeira linha no tratamento da doença bipolar e, portanto, devem ser evitados durante a gravidez7.
Os antipsicóticos atípicos, pelo seu efeito estabilizador de humor, também desempenham um papel importante no tratamento de mulheres com perturbação bipolar13.
Abordagem multidisciplinar perinatal
Os médicos ginecologistas/obstetras e de medicina geral e familiar devem, em cada consulta de saúde materna e de puerpério, supervisionar e quantificar a sintomatologia psiquiátrica. Esta triagem pode ser efetuada através de questionários padronizados e validados para a população portuguesa (Escala de Ansiedade, Depressão e Stress - EADS-21; Inventário de Sintomas Psicopatológicos - BSI; Escala de Depressão Pós-parto de Edimburgo - EPDS). Naquelas mulheres em que for identificada psicopatologia, no momento da avaliação inicial, o médico deve envolver a grávida/puérpera no planeamento do esquema terapêutico, tendo em conta também as suas preferências de tratamento8. Poderá ser necessária a articulação com os cuidados diferenciados de psiquiatria e psicologia perinatal3,4.
Na abordagem da psicopatologia perinatal, as recomendações de tratamento devem ser sempre individualizadas. Ao desenvolver um plano de tratamento, o médico deve considerar a história psiquiátrica detalhada da gestante ou puérpera: critérios de diagnóstico aplicados de forma correta, esquemas terapêuticos anteriores que falharam, modalidades de tratamento que resultaram na obtenção da compensação psicopatológica, quadro clínico atual, história de saúde mental em gestações anteriores, história familiar de doença psiquiátrica, história social, história de uso/abuso de substâncias e o cronograma durante o qual o esquema de tratamento é proposto13.
As equipas de neonatologia devem também estar devidamente informadas acerca de toda a medicação psiquiátrica realizada durante a gravidez, antecipando potenciais complicações no recém-nascido e assegurando uma estreita monitorização nas primeiras 48 horas de vida14.
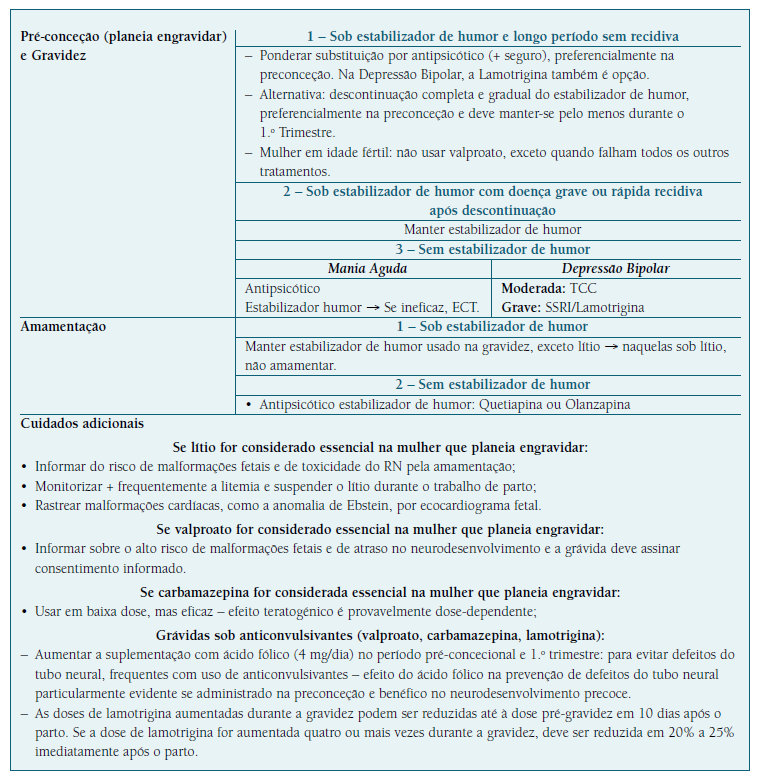
Nos Quadros IV, V, VI, VII e VIII estão descritas as diretrizes principais na abordagem psicofarmacológica no período perinatal.
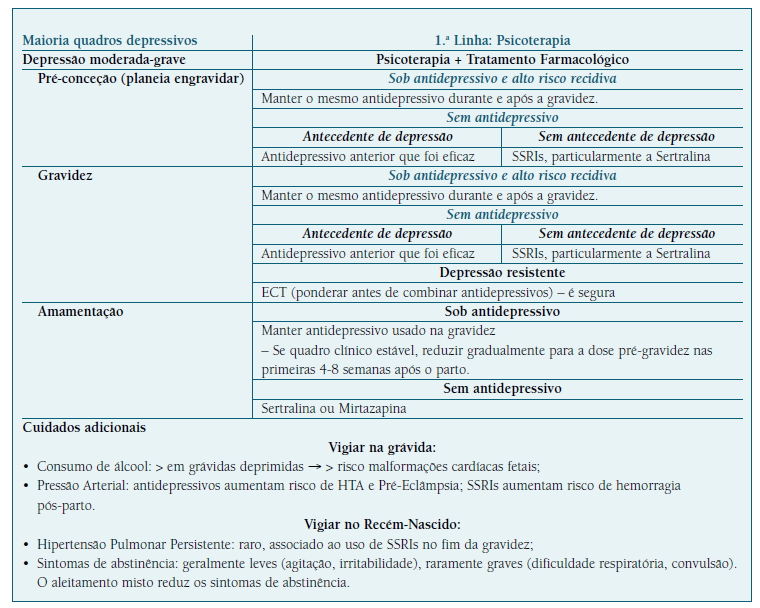
Quadro V Princípios gerais na prescrição de antidepressivos durante a pré-conceção, gravidez e amamentação.3,4,7
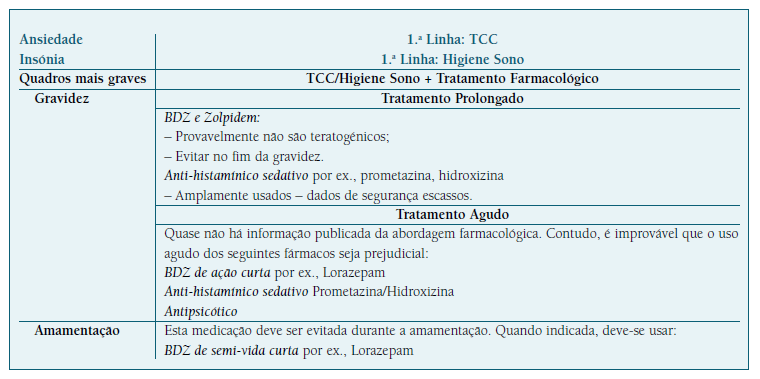
Quadro VI Princípios gerais na prescrição de ansiolíticos/sedativos e hipnóticos durante a gravidez e amamentação.3,4,7
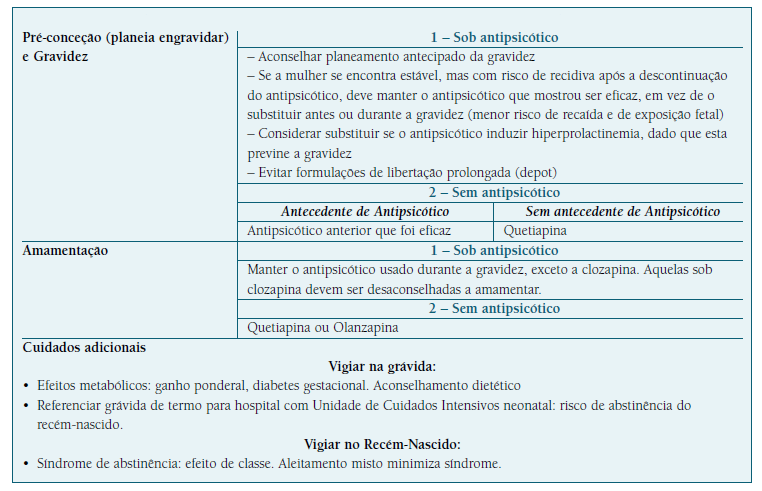
Quadro VII Princípios gerais na prescrição de antipsicóticos durante a pré-conceção, gravidez e amamentação.3,4,7
Conclusões
Embora em crescimento, os dados sobre a segurança de psicofármacos durante a gravidez continuam a ser limitados, principalmente devido ao facto dos estudos não conseguirem eliminar de forma total o viés dos fatores de risco e comportamentos frequentemente associados à população psiquiátrica e que podem influenciar os outcomes materno-fetais. Ainda assim, a maioria dos estudos bem controlados é tranquilizante, especialmente no que se refere à utilização perinatal de antidepressivos.
Gerir adequadamente a depressão e outras comorbilidades durante a gravidez e no pós-parto é essencial e implica a formação de equipas multidisciplinares perinatais.
A necessidade de equilíbrio entre o bem-estar materno e o risco de complicações fetais, devido à exposição medicamentosa neste período, deve assentar numa medicina baseada na evidência, que estabelece o perfil de segurança de cada fármaco proposto à mulher grávida.
Contribuição dos autores
Catarina Morais da Fonseca: conceptualização, metodologia, investigação, análise formal, validação, escrita do manuscrito original, revisão e edição, visualização. Ana Filipa Silva: investigação, análise formal, validação, escrita do manuscrito original, revisão e edição. Maria do Céu Ferreira: investigação, análise formal, validação, escrita do manuscrito original, revisão e edição.