Introdução
ADGT é considerada uma das doenças ginecológicas e obstétricas com melhor taxa de cura1. Consiste numa gravidez inviável que resulta de uma fertilização incorreta e da proliferação anómala de tecido trofoblástico nas vilosidades placentárias. (2 Engloba um espectro de tumores, com origem na placenta, que inclui anomalias benignas como molas hidatiformes parciais (MHP), molas hidatiformes completas (MHC), nódulo do leito placentar e nódulo placentar expansivo e anomalias malignas, como mola hidatiforme invasiva (MHI), coriocarcinoma, tumor trofoblástico do leito placentar (TTLP) e tumor trofoblástico epitelioide (TTE) (3),(4.
A incidência da DGT em países desenvolvidos é de cerca de 1 por 714 nascimentos.5 As formas mais comuns de apresentação são as molas hidatiformes, que, apesar de serem benignas, podem evoluir para formas malignas3),(6.
A suspeita do diagnóstico é estabelecida pela apresentação clínica, pela realização de ecografia pélvica e pela medição dos níveis sanguíneos de β-hCG3),(7),(8. Na maioria dos casos, as mulheres apresentam-se assintomáticas, no entanto a clínica pode incluir hemorragia vaginal abundante, útero com tamanho superior para a idade gestacional e a presença de quistos teca-luteínicos ováricos pela exposição a elevados valores de β-hCG. (8 Associadamente, algumas mulheres desenvolvem, também, pré-eclâmpsia, hiperémese gravídica e hipertiroidismo. (8),(9 Por sua vez, o diagnóstico definitivo é estabelecido por confirmação histológica e o tratamento depende da evolução da anomalia e prognóstico associado7.
No passado, a DGT estava associada a morbilidade e mortalidade significativas. Atualmente, através da melhoria das condições socioeconómicas, das mudanças dos estilos de vida e, principalmente, dos avanços na monitorização médica, a incidência da DGT diminuiu significativamente e as taxas de cura são superiores a 90%, mesmo na presença de metástases9),(10.
A compreensão dos fatores de risco permite aos profissionais de saúde identificarem as mulheres grávidas que podem estar em maior risco de desenvolver DGT, o que possibilita um diagnóstico mais precoce. A avaliação dos fatores de prognóstico influencia o desfecho clínico e a progressão da doença, individualizando o tratamento ao tipo de anomalia e tornando-o cada vez mais eficaz11.
Materiais e métodos
Foi realizada uma revisão com base numa pesquisa bibliográfica em diferentes bases de dados, como a Pubmed e Google Scholar, entre julho e dezembro de 2023. A pesquisa baseou-se nas seguintes associações de palavras: Gestational Trophoblastic Disease/Risk factors of Gestational Trophoblastic Disease/Prognostic factors of Gestational Trophoblastic Disease/FIGO staging for Gestational Trophoblastic Neoplasia. Apenas foram consideradas publicações em língua portuguesa e inglesa, com datas de publicação entre o ano 2000 e 2023, permitindo, com esta janela temporal de publicação, conhecer a evolução do conhecimento sobre a patologia. Com base na leitura do título e/ou abstract de 115 artigos (após remoção de duplicados) foram selecionados 40 artigos e três livros de referência na área da Ginecologia e Obstetrícia, o Beckmann and Ling’s Obstetrics and Gynecology 8th Edition12, Comprehensive Ginecology 8th Edition 1 e Manual de Ginecologia - Volume I13, que cumprem os objetivos a que o presente artigo se propõe.
Resultados e discussão
1. Fatores de Risco
Os principais fatores de risco identificados são a idade materna precoce e avançada e o antecedente de gravidez molar. Fatores como o número de partos, antecedentes de abortos e uso de contracetivos orais revelam poder ter alguma influência no desenvolvimento da DGT, no entanto com menos incidência e em estudo para confirmação. Outros fatores como hábitos tabágicos, consumo de álcool, dieta, estados socioeconómicos e exposição a herbicidas ainda apresentam uma evidência muito limitada no desenvolvimento de DGT11),(14),(15.
O maior fator de risco associado ao desenvolvimento das formas benignas da DGT, precursoras de formas malignas, é a idade materna avançada. O risco associado estabelece-se de forma bimodal. Isto é, em comparação com o risco para o grupo etário dos 21-35 anos, o risco de MHC é quase o dobro para as mulheres com menos de 21 anos e mais de 35 anos e cerca de sete vezes superior para mulheres com mais de 40 anos9),(16. No extremo superior da idade materna, o aumento do risco traduz-se na gametogénese e fertilização anormais16, devido à formação anormal da zona pelúcida do óvulo das mulheres que facilita a penetração do espermatozoide e promove o desenvolvimento de uma mola hidatiforme17. O mecanismo associado à idade materna precoce pode associar-se a possíveis defeitos endócrinos no período perimenarca que aumentam a predisposição da ovulação de ovócitos anormais resultando no desenvolvimento de molas18.
Por outro lado, comparando os tipos de mola hidatiformes, a MHC é mais comum nos extremos da idade reprodutiva, enquanto a MHP é mais frequente após os 20 anos e a sua incidência aumenta com a idade13),(17.
O antecedente de gravidez molar apresenta um risco de cerca de 1 a 2 % quando é apenas um antecedente, enquanto dois antecedentes de gravidez molar aumentam o risco de recorrência para cerca de 15 a 20%2),(6. Correspondendo o antecedente de gravidez molar a um risco 10 a 20 vezes superior ao da população em geral9. O risco de recorrência de uma MHC é superior ao de MHP, sendo que, na maioria dos casos a recorrência é do mesmo tipo histológico6. O aumento do risco de recorrência de uma gravidez molar sugere a existência de uma predisposição genética da mulher para o desenvolvimento anormal destas gravidezes19),(20. Atualmente, já foram identificadas mutações em 2 genes maternos, NLRP7 e KHDC3L, que estarão na origem da ocorrência de molas hidatiformes recorrentes e relacionadas com a síndrome Mola Hidatiforme Familiar6),(21),(22.
As apresentações malignas da DGT podem ter diferentes origens, sendo que cerca de 50 a 80% dos casos evoluem a partir de mola hidatiforme23. Deste modo, o antecedente de gravidez molar apresenta relevância não só pela sua recorrência, como também pela possível progressão para formas malignas de apresentação.
Quanto ao número de partos, os estudos defendem que se correlaciona inversamente com o risco de desenvolver neoplasia gestacional do trofoblasto (NGT), devido à falta de exposição prévia ao processo de gravidez, o que pode resultar numa maior vulnerabilidade às anormalidades associadas à NGT na formação da placenta11.
Antecedentes de abortos de repetição podem estar associados ao aumento do risco do desenvolvimento de molas hidatiformes, porém, considerar este antecedente como um fator de risco para a persistência e progressão da doença para formas malignas é controversa24.
O uso de contracetivos orais é um fator que gera discussão sobre o seu efeito no desenvolvimento de DGT. Inicialmente considerava-se que a toma de contracetivos orais aumentava o risco, contudo, novos estudos foram realizados e refutaram essa afirmação25.
Atualmente parece não existir qualquer associação entre o uso de contracetivos orais e o surgimento de DGT13. No entanto, ainda estão a ser realizados diversos estudos com o intuito de relacionar a toma de contracetivos orais e o desenvolvimento de NGT, durante a monitorização de β-hCG, após uma gravidez molar25),(26.
2. Prognóstico
2.1. Molas Hidatiformes
O prognóstico das molas hidatiformes é estabelecido pela variação dos valores séricos de β-hCG após remoção cirúrgica do tecido trofoblástico anómalo. Se os valores circulantes de β-hCG decrescerem progressivamente no tempo até atingirem valores normais, então a mola hidatiforme presente é considerada benigna e o prognóstico de cura é bom. Se os valores subirem ou estabilizarem em valores anormais, na ausência de uma nova gravidez, a mola hidatiforme é maligna e o prognóstico é determinado pela associação de diferentes fatores13),(27.
Os fatores de pior prognóstico relacionados com o maior risco de desenvolvimento de NGT pós-molar incluem idade superior a 40 anos, níveis de β-hCG pré-evacuação superiores a 100.000 IU/L, tamanho uterino aumentado (superior ao tamanho considerado normal às 20 semanas de gestação viável) e a presença de quistos teca-luteínicos ováricos de diâmetro superior a 6 centímetros3),(6.
2.2. Neoplasias Gestacional do Trofoblasto
O prognóstico de uma NGT é muito bom, mesmo na presença de metástases. A taxa de cura ronda os 100% em mulheres de baixo risco e cerca de 80% das mulheres tratadas com quimioterapia de agente único ou poliquimioterapia conseguem voltar a engravidar2),(7.
Os principais indicadores de prognóstico das neoplasias da DGT incluem o tipo histológico da neoplasia, os níveis séricos de β-hCG pré-tratamento e a extensão da disseminação da doença11. Outros fatores consistem no intervalo da gravidez até ao início do tratamento com quimioterapia, na natureza da gravidez prévia e no eventual insucesso do tratamento inicial aplicado.
Quanto ao tipo histológico, os de pior prognóstico são os TTLP e os TTE que apresentam as maiores taxas de mortalidade entre as diferentes formas malignas da DGT, contudo são os mais raros. Cerca de 30% dos TTLP evoluem desfavoravelmente e 15% destes tornam-se fatais com metastização locorregional e à distância bem como taxas elevadas de recidivas28. No caso dos TTE, o comportamento maligno é agressivo, 40% dos tumores são diagnosticados em fase de disseminação extrauterina e no mínimo 10% são fatais28. Por outro lado, apesar do coriocarcinoma apresentar elevado risco metastático com potencial proliferativo e invasivo (metástases pulmonares em cerca de 80% dos casos) (29, é das neoplasias com melhor prognóstico pela capacidade de cura e melhor resposta à terapêutica30.
Os níveis séricos de β-hCG pré-tratamento são um fator de prognóstico dominante. Quanto mais elevados os valores, maior é o risco de resistência ao tratamento de primeira linha e aos tratamentos de quimioterapia de agente único. A medição de β-hCG é um marcador específico para diagnóstico e monitorização das respostas ao tratamento, traduzindo quantitativamente a carga tumoral, devido à sua elevada especificidade ao tumor8),(9),(30),(31.
O fator de extensão e disseminação da doença correlaciona-se com o número e localização das metástases, refletindo a progressão do tumor31. Os pulmões são o local mais comum de metastização, em cerca de 80% das neoplasias metastizadas8 e na maioria dos casos, é o primeiro órgão metastizado por disseminação pela via hematogénica32. Com a evolução da neoplasia, simultaneamente às metástases pulmonares, surgem metástases noutros órgãos, como rim, baço, trato gastrointestinal, fígado e cérebro. As metástases relacionadas com um pior prognóstico são as hepáticas e cerebrais. As metástases hepáticas são responsáveis por hemorragias maciças intra-abdominais que podem colocar em risco de vida as mulheres3),(8. As metástases cerebrais surgem em cerca de 10% das neoplasias metastizadas e estão associadas a dano neurológico por necrose central e hemorragia intracerebral8),(32),(33.
O intervalo da gravidez até ao início do tratamento com quimioterapia é um marcador de prognóstico que correlaciona proporcionalmente o intervalo de tempo com a probabilidade do desenvolvimento de malignidade do tumor, ou seja, quanto maior o intervalo, mais avançado será o grau de malignidade31 e menor a taxa de sobrevivência34.
A existência de gravidezes prévias não molares (de termo, abortos e ectópicas) são um fator de pior prognóstico do que a existência de gravidezes prévias molares34),(35. Na maioria dos casos, a mola hidatiforme benigna ou a MHI desenvolvem-se após uma gestação que resultou em aborto, enquanto, a maioria dos casos de coriocarcinoma ocorrem após uma gestação de termo24.
Assim, apesar de antecedente de gravidezes molares constituir um fator de risco para o desenvolvimento da DTG, no caso de estabelecimento do prognóstico, o antecedente de gravidez de termo torna-se um fator com maior relevância por se associar ao surgimento de formas de apresentação com maior gravidade como o coriocarcinoma.
O insucesso do tratamento anterior é um fator não só de pior prognóstico como também um preditor do tipo de tratamento futuro a realizar, ou seja, a escolha do tipo de quimioterapia a administrar após uma tentativa de tratamento depende do tipo administrado previamente, variando, assim, consoante se trate de agente único ou poliquimioterapia32),(36.
2.2.1. Sistemas de classificação
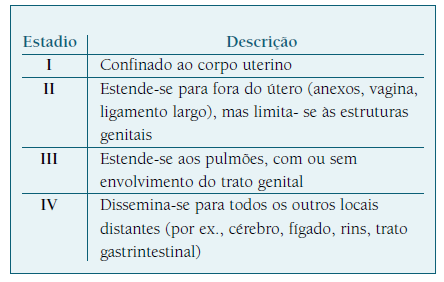
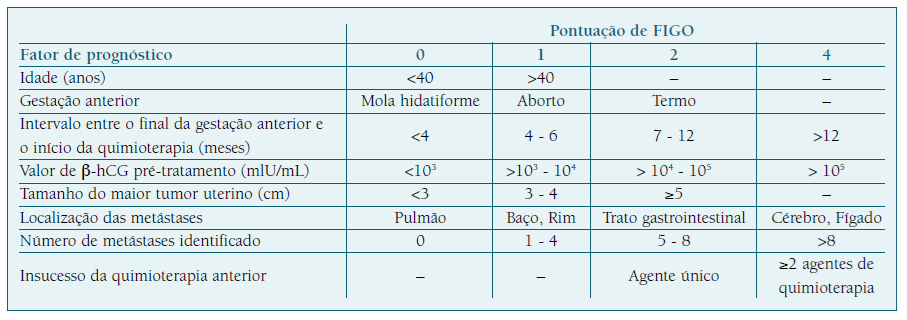
O prognóstico das formas malignas da DGT é estabelecido pela correlação entre o sistema de estadiamento de FIGO (Quadro I), que associa os estadios (I, II, III, IV) referentes à distribuição anatómica da doença, e o score de risco da OMS. Este score apresenta-se na forma de uma tabela (Quadro II) composta por oito fatores que, associados, permitem calcular o risco da neoplasia desenvolver quimiorresistência a terapias de agente único16),(31),(37. A classificação é apresentada pelo estadio em numeração romana - I, II, III ou IV - seguida do valor numérico resultante do cálculo dos fatores de prognóstico da tabela16.
Os doentes são estratificados em duas categorias em que um score inferior ou igual a 6 indica baixo risco de resistência a quimioterapia de agente único como metotrexato ou actinomicina-D, e um score superior a 6 indica alto risco de resistência a quimioterapia de agente único, exigindo um tratamento com poliquimioterapia intravenosa, como a combinação de etoposido, metotrexato, actinomicina-D, ciclofosfamida e vincristina (EMA-CO) (3),(16),(31),(37-39.
Dentro de cada categoria ainda é possível subdividir os doentes de acordo com a resistência e risco.
Esta classificação teve como principal objetivo permitir, no momento do diagnóstico de neoplasia, prever a resposta do tumor ao tipo de quimioterapia, determinar o prognóstico associado e evitar o tratamento inadequado31. A taxa de cura para mulheres de baixo risco (score abaixo ou igual a 6) é de cerca de 100%, com taxas de recorrência menores que 5%, e, para mulheres de alto risco (score acima de 6) é de 94%7),(40.
Contudo, este sistema de classificação não é aplicável às formas raras de neoplasia de TTLP e TTE39. Nestes casos, o estadiamento e o prognóstico são determinados pela associação do sistema de estadiamento de FIGO (Quadro I) e o intervalo de tempo entre o diagnóstico e a última gravidez8),(28. Pelo sistema anatómico de FIGO, os estadios II-IV apresentam pior prognóstico do que o estadio I. Enquanto tumores em estadio I de doença localizada podem apenas necessitar de tratamento cirúrgico por curetagem ou receção miometrial, tumores de estadios II a IV, com invasão difusa uterina associada, implicam tratamento cirúrgico por histerectomia com linfadenectomia associado a poliquimioterapia, e ainda possível salpingectomia bilateral com ooforectomia diferida4),(38),(40),(41. Quanto ao intervalo de tempo entre o diagnóstico e a última gravidez, acima dos 48 meses o prognóstico é pior e a taxa de sobrevivência menor4.
Doentes com pior prognóstico, independentemente do estadio anatómico, devem ser submetidas a quimioterapia agressiva à base de cisplatina ou até a tratamentos experimentais de quimioterapia ou imunoterapia, simultaneamente ao tratamento cirúrgico3),(38),(40.
Para além do estadio de FIGO avançado e intervalo da última gravidez superior a 48 meses16, podem surgir outros fatores de pior prognóstico nestes tumores, como a presença de células neoplásicas com clarificação citoplasmática, elevado índice mitótico (>5/10 campos de maior ampliação), invasão miometrial em profundidade (>1/3 interno), necrose de coagulação extensa e invasão linfovascular28.
A taxa de cura nestes tumores é de aproximadamente 100% em doença não metastática e de 50 a 60% em doença metastática3.
3. Complicações
Associado à DGT devem-se realçar não só as complicações orgânicas causadas pelo tumor (benigno ou maligno) e pelas metástases e as complicações iatrogénicas provocadas pelos tratamentos, como também, é de grande importância o impacto psicológico e psicossocial que advém do diagnóstico e de todo o seguimento.
Perante o diagnóstico de DGT, a mulher confronta-se com uma inesperada mudança de planos. A esperança e a alegria de uma gravidez são substituídas pela necessidade de adaptação e resiliência para lidar com uma doença potencialmente grave, sobre a qual pouco devem saber42),(43.
O impacto psicológico pode manifestar-se clinicamente por distúrbios de humor, ansiedade, fadiga, raiva, confusão e problemas sexuais, afetando não só a mulher individualmente, como também o casal e a sua relação43.
Conclusão
A DGT é atualmente uma entidade rara, dado que a evolução da medicina permitiu a otimização do seu diagnóstico e tratamento. Contudo as inúmeras particularidades que apresenta e o impacto físico e psicológico nas doentes justificam o estudo pormenorizado das suas caraterísticas.
Como fatores de risco, a idade materna avançada e os antecedentes de gravidez molar revelam-se os mais importantes para a identificação das mulheres com maior probabilidade de desenvolver a doença. O reconhecimento dos fatores de risco é imperativo na criação de protocolos de triagem eficazes para a realização de um diagnóstico precoce.
Após o diagnóstico, é a correlação dos fatores de prognóstico, que permite prever o curso da doença, quer em anomalias benignas como malignas, e adaptar as decisões terapêuticas à doente. A análise dos fatores de prognóstico permite distinguir as mulheres com fatores de prognóstico mais desfavoráveis que necessitem de tratamento mais agressivo, das que apresentam bom prognóstico e que podem ser acompanhadas de forma menos invasiva11.
Deste modo, torna-se essencial um diagnóstico rápido e tratamento apropriado para atuar sobre a doença e as suas complicações orgânicas bem como um acompanhamento psicológico desde o início de todo o processo. Este seguimento deve ser realizado em centros especializados que permitem providenciar às doentes um tratamento multidisciplinar, melhorando as taxas de sobrevivência e a qualidade de vida. A centralização do tratamento em centros de referência também é importante por permitir a criação de uma base de dados nacionais ao reunir todos os casos diagnosticados e realizar mais estudos para conhecimento da doença13),(43.