Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Angiologia e Cirurgia Vascular
versão impressa ISSN 1646-706X
Angiol Cir Vasc vol.10 no.1 Lisboa mar. 2014
CASO CLÍNICO
Síndrome da veia cava superior: caso clínico*
Superior vena cava syndrome: Case report
Sandrina Figueiredo Bragaa,c,*, Daniel Brandãoa, Pedro Pinto Sousaa, Jacinta Camposa, Alexandra Canedoa, Pedro Brandãoa, João Carlos Motab e Luís Vougab
a Serviço de Angiologia e Cirurgia Vascular, Centro Hospitalar de Vila Nova de Gaia/Espinho EPE, Vila Nova de Gaia, Portugal
b Serviço de Cirurgia Cardiotorácica, Centro Hospitalar de Vila Nova de Gaia/Espinho EPE, Vila Nova de Gaia, Portugal
c Departamento de Anatomia, Faculdade de Medicina, Universidade do Porto, Porto, Portugal
Resumo
A Síndrome da Veia Cava Superior (SVCS) surge quando há diminuição ou obstrução do ?uxo de sangue através da veia cava superior (VCS) e pode cursar com muito debilitantes. Embora classicamente associada a etiologias malignas, o aumento do número de procedimentos endovenosos (cateteres venosos centrais, pacemakers, cardio-desfibriladores) fez aumentar a percentagem de casos de etiologia benigna, que manifestações clínicas actualmente correspondem a 40%. O tratamento endovascular tem ganho crescente popularidade, mas nem sempre é exequível ou conduz a melhoria clínica a longo prazo, pelo que por vezes o tratamento cirúrgico é necessário.
Os autores descrevem o caso clínico de um doente com SVCS, relacionado com colacação prévia de pacemaker. Após tentativa infrutífera de tratamento endovascular, o doente foi submetido a reconstrução cirúrgica, com resolução da sintomatologia.
Palavras-chave: Síndrome da veia cava superior; Trombose venosa; Pacemaker; Cirurgia
Abstract
Superior Vena Cava Syndrome (SVCS) occurs when there is a reduction or blockage of blood ?ow through the superior vena cava (SVC) and may be associated with debilitating clinical manifestations. Although classically associated with malignant etiologies, increasing number of intravenous procedures (central venous catheters, pacemakers) have raised the percentage of cases of benign etiology, which currently account for 40%. Endovascular management of SVCS has gained increasing popularity, although it is not always feasible or leads to long-term clinical improvement, so sometimes surgical treatment is necessary.
The authors present a patient with superior vena cava syndrome due to pacemaker leads. After unsuccessful attempt of endovascular treatment, the patient underwent surgical reconstruction with resolution of symptoms.
Key-words: Superior vena cava syndrome; Venous thrombosis; Pacemaker; Surgery
Introdução
A Síndrome da Veia Cava Superior (SVCS) surge quando há diminuição ou obstrução do fluxo venoso da cabeça, pescoço e extremidades superiores através da veia cava superior (VCS), por trombose ou compressão extrínseca desta1,2.
A primeira descrição de SVCS foi publicada por William Hunter em 1757, que descreveu o caso clínico de um doente com obstrução da VCS associada a aneurisma aórtico sifilítico1,3. Os aneurismas da aorta mantiveram-se como a segunda causa de SVCS, depois das neoplasias torácicas malignas primárias, até 19001. A incidência de mediastinite sifilítica e tuberculosa diminuiu drasticamente a partir do início do século XX1,3,4. As neoplasias pulmonares e os tumores mediastínicos primários tornaram-se as causas mais frequentes1. Entre as causas malignas encontram-se a neoplasia do pulmão (50% dos casos), os mesoteliomas, os linfomas, os timomas, a metastização mediastínica (tumores da mama e tumores das células germinativas), tumores da tireóide (medulares e foliculares), teratomas e angiossarcomas1,4. Nas últimas duas décadas, o aumento exponencial de procedimentos endovenosos (cateteres venosos centrais, pacemakers, cardio-desfibriladores implantados) fez disparar os casos de SVCS de etiologia benigna, que actualmente correspondem a 40%1,4,5. As causas benignas mais frequentes são: procedimento endovenoso prévio (a principal causa), fibrose mediastínica, doença granulomatosa fúngica como a histoplasmose e tumores benignos1,4. A prevalência de SVCS devido a pacemaker está descrita entre 1:40000 a 1:2505,6. A SVCS nesses doentes começa inicialmente com um processo de trombose, com sintomatologia mínima. O stress mecânico induzido pelos fios de pacemaker leva a inflamação da parede da veia6. A lesão endotelial permanente inicia uma reacção fibrótica que, eventualmente, leva à redução significativa do lúmen da VCS e suas tributárias, com o desenvolvimento da SVCS5. Os factores predisponentes para o desenvolvimento de SVCS são a trombofilia, terapêutica hormonal e a infecção1,6. O intervalo médio entre a inserção de pacemaker e o desenvolvimento de sintomatologia é de 48 meses5. Os sintomas, que podem ser muito debilitantes, geralmente começam com sensação de «preenchimento» da cabeça ou do pescoço (81%), ortopneia (72%), lipotímia (34%) e problemas visuais1-3,5,7 (25%). As cefaleias intensas com compromisso da qualidade de vida também são características5. Outros sintomas como dispneia, disfagia, disfunção cognitiva, disfonia e edema da glote com risco de asfixia também podem ocorrer4. Os sinais apresentados são edema da face e do pescoço (97%), desenvolvimento de circulação colateral no tórax (91%), cianose facial (56%) e edema do membro superior1,3,5 (53%). A gravidade da síndrome da VCS depende da velocidade de progressão da obstrução e do grau de desenvolvimento de colateralização3,5,6.
Caso clínico
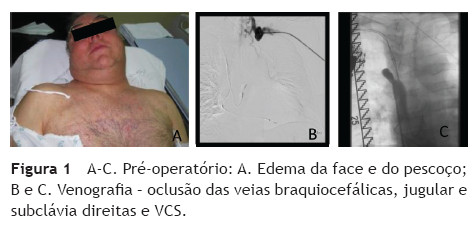
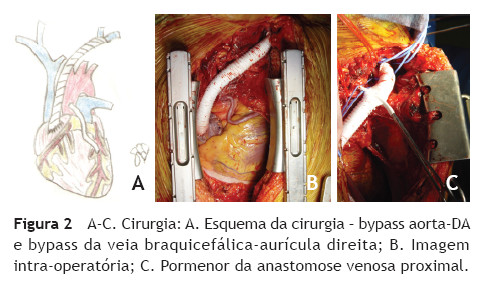
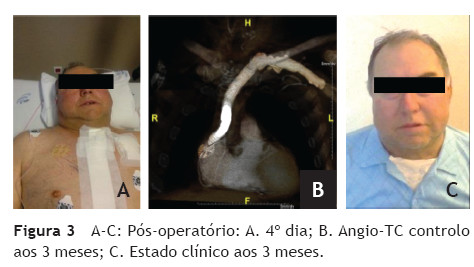
Doente de sexo masculino, 65 anos, com antecedentes de DM, HTA, dislipidemia, tromboses venosas superficiais (TVS) e tromboses venosas profundas (TVP) de repetição do membro superior direito após colocação de pace-maker ipsilateral em 2010 por Doença do Nó Sinusal. O estudo protrombótico demonstrou um défice de proteína S. Foi seguido em Consulta externa e hipocoagulado cronicamente desde 2011. Em 2012, iniciou quadro de edema progressivo da face e do pescoço, com posterior desenvolvimento de circulação colateral no tórax, alterações visuais, cefaleias intensas, apneia do sono, disfagia e ortopneia (fig. 1A). Realizou angioTC que demonstrou trombose das veias subclávia e jugular direitas e oclusão com atrofia da VCS e das veias braquiocefálicas. O restante estudo imagiológico e analítico excluiu malignidade. O doente foi submetido a tentativa de tratamento endovascular, sem sucesso, por incapacidade de transpor quer a oclusão braquiocefálica esquerda por abordagem braquial ipsilateral, quer a oclusão da VCS por abordagem femoral direita (figs. 1B e C). Constatou-se um padrão venográfico Tipo III de Stanford e Doty. Por apresentar sintomatologia extremamente limitante, foi decidida intervenção cirúrgica. O doente realizou estudo pre-operatório (ecocardiograma de sobrecarga e coronariografia) que revelou estenose > 70% do terço proximal da artéria descendente anterior (DA), com bom leito distal. Foi submetido a cirurgia, sob anestesia geral e heparinização sistémica (100 IU/kg de peso corporal), por esternotomia mediana, sem necessidade de hipotermia e sem circulação extra-corporal. Procedeu-se inicialmente a revascularização miocárdica, através de bypass da aorta ascendente para a DA, com veia grande safena. Seguidamente, foram isoladas as veias jugular e subclávia esquerdas e constatou-se permeabilidade do início da veia braquicefálica esquerda, imediatamente após a confluência das veias jugular e subclávia, por um trajecto com cerca de 1 cm. Observou-se completa fibrose do restante trajecto da veia braquiocefálica esquerda, de toda a veia braquicefálica direita e da VCS. Realizou-se bypass da confluência das veias jugular e subclávia esquerdas para o apêndice auricular direito, clampado tangencialmente e após exérese de trabéculas. As anastomoses foram realizadas com prolene 4/0 e o conduto usado foi uma prótese de ePTFE reforçado externamente de 14 mm de diâmetro. O pós-operatório decorreu sem complicações e o doente teve alta ao 7º dia, com melhoria franca e gradual da sintomatologia (fig. 2). Aos 3 meses de pós-operatório apresenta bypass permeável na angio-TC de controlo, sem recorrência dos sintomas, mantendo hipocoagulação crónica (fig. 3).
Discussão
O diagnóstico imagiológico da SVCS é vital para confirmar a suspeita clínica e na avaliação e planeamento do tratamento4. Os métodos imagiológicos não invasivos possíveis são a tomografia computadorizada (TC) e a ressonância magnética nuclear4,7 (MRN). Como métodos invasivos e permanecendo como o «goldstandard» no diagnóstico desta patologia está a venografia, que permite a visualização directa da obstrução venosa e o padrão de colateralização4. Foram descritos quatro padrões de SVCS, segundo a classificação venográfica de Stanford e Doty1,4. No Tipo 1 observa-se obstrução parcial da VCS, mantendo-se fluxo anterógrado na VCS e na veia ázigos1,4. No Tipo 2 há estenose >90% da SVC com fluxo anterógrado na veia ázigos1,4. O Tipo 3 corresponde a oclusão da VCS com inversão do fluxo através da veia ázigos1,4. O Tipo 4 representa oclusão da VCS e da veia ázigos, com desenvolvimento de circulação venosa colateral na parede torácica1,4. Nos tipos 1 e 2 advoga-se o tratamento endovascular e nos tipos 3 e 4 o tratamento cirúrgico1. Os sintomas tendem a ser mais graves quando a VCS está ocluída inferiormente à confluência da veia ázigos4.
No passado, a SVCS era considerada uma emergência médica4. Para a maioria dos doentes actualmente isso já não se verifica, sobretudo pelo estabelecimento mais indolente do quadro4. O risco de morte na SVCS está associado a obstrução da via aérea (edema da laringe, traqueia ou brônquios) e edema cerebral e coma4.
O tratamento é puramente sintomático e dependente da causa subjacente2,4. Tradicionalmente, o tratamento médico inicial incluiu restrição de fluidos, evitar posições de pendência da cabeça, esteróides sistémicos (prednisolona ou dexametasona), radioterapia (carcinoma do pulmão de células não pequenas) ou quimioterapia4 (carcinoma do pulmão de pequenas células). Os diuréticos também foram utilizados no passado, com escasso benefício4. A maioria dos doentes não responde à hipocoagulação isolada, que parece ser eficaz apenas nos casos de menor gravidade6. O objectivo do tratamento médico é reduzir a pressão hidrostática na parte superior do tronco e na cabeça. No entanto, essas terapias podem levar 2-4 semanas para demonstrar alguma eficácia, com altos índices de complicações e taxas de recorrência de sintomas relatadas entre 20% e 50%4.
O tratamento endovascular pode proporcionar um alívio rápido dos sintomas, restaurando o retorno venoso, independentemente da etiologia, e é considerada frequentemente como opção de primeira linha2. As opções de tratamento disponíveis são múltiplas, incluindo a angioplastia transluminal percutânea, a colocação de stents metálicos e a trombólise farmacológica ou mecânica6,8,9. As opções mais utilizadas, com boas taxas de permeabilidade são a angioplastia e o stenting8-12. Complicações graves tais como tamponamento (1,4%) e hemotórax (0,3%) podem ocorrer durante o procedimento endovascular4,5,9,10. As complicações tardias da colocação de stent são a migração e fractura do stent, com risco hemorrágico acrescido, sobretudo em doentes hipocoagulados5,11,12. Decorrem estudos para avaliar a permeabilidade a longo prazo e a necessidade de reintervenção condicionada pela terapêutica endovascular, mas os resultados de permeabilidade a curto e médio prazo são favoráveis2,4,5,8-13.
Quando o tratamento endovascular não é exequível e em casos seleccionados, como na SVCS associada a pacemaker, cirurgia assume um papel fulcral1. Os doentes devem ter reserva cardiopulmonar adequada para a cirurgia, que geralmente obriga a esternotomia mediana7. A preparação anestésica também tem algumas particularidades: a via aérea deve ser assegurada por tubo endotraqueal de duplo lúmen, para permitir selectivação de ventilação pulmonar se necessário7. O acesso venoso central deve ser colocado na veia femoral e removido em 48-72 h7. A fluidoterapia deve ser administrada judiciosamente, para minimizar o risco de edema intracraniano7. A primeira reconstrução cirúrgica da VCS ocorreu em 1951 e desde então tem sido realizada no contexto de SVCS de etiologia benigna ou maligna, mesmo quando há invasão tumoral directa da VCS3,5,7,14. A cirurgia pode ser realizada com baixo risco, excelente alívio sintomático e boa permeabilidade a longo prazo7. Actualmente, a opção mais em voga consiste em Síndrome da veia cava superior: caso clínico ignorar a oclusão e realizar um bypass venoso entre uma veia, mais frequentemente a jugular ou a braquiocefálica, e a VCS ou o apêndice auricular direito1,4. A cirurgia tecnicamente mais fácil e com melhores resultados é o bypass da veia braquicefálica direita ao apêndice auricular direito1,7,15. O bypass direito é preferencial pois tem um trajecto mais rectilíneo, com menor angulação e mais curto do que o esquerdo1,5,7,15. A veia braquiocefálica direita, se disponível, deve ser escolhida em detrimento da jugular por apresentar maior calibre e maior débito (1000 mL/min), com menor risco de trombose do bypass1,5. O outflow no apêndice auricular direito implica menor dissecção, com consequente menor risco de lesão, e apenas clampagem tangencial, ao contrário da VCS1. Os enxertos rectos são preferenciais aos enxertos bifurcados, pois além da maior simplicidade técnica, têm taxas de permeabilidade superiores e a colateralização existente entre ambos os lados garante que a reconstrução unilateral é suficiente para aliviar os sintomas na generalidade dos doentes1,5,14,15. As opções de conduto autólogo são o enxerto espiralado de veia grande safena (EEVGS) e a veia femoral1,5. O EEVGS mostrou excelentes resultados a longo prazo, com relatos de permeabilidade de 88% aos 10 anos1,5. Contudo, o procedimento para obtenção do conduto é moroso e obriga a segmentos longos e adequados de veia grande safena, nem sempre disponíveis1,5. A veia femoral também demostrou ser um bom conduto, mas a utilização de uma veia profunda associa-se à ocorrência de trombose venosa e de síndrome pos-trombótica em até 50% dos casos, sobretudo em doentes com trombofilia1,5. Os alo-enxertos e os enxertos criopreservados são usados raramente, em casos de imunossupressão em doentes transplantados1. A prótese de ePTFE externamente reforçada é o material protésico preferencial e deve ser de grande diâmetro (12-16 mm) e o mais curto possível1,4,5,14,15.
Quando o conduto utilizado é autólogo preconiza-se hipocoagulação para manter um INR entre 2-3 durante 3 meses1. Os enxertos protésicos requerem hipocoagulação oral crónica1,5,14,15. Estas próteses estão facilmente disponíveis para utilização imediata e apresentam boas taxas de permeabilidade (70% aos 2 anos), constituindo a primeira opção de conduto em vários centros de referência1,5,7,14,15.
Conclusão
O melhor tratamento para a SVCS de longa duração devido a pacemaker ainda é a cirurgia5. A utilização de próteses de ePTFE representa uma boa opção de conduto, desde que com um tamanho adequado1,5,7,14,15. Estas próteses estão facilmente disponíveis para utilização «off-the-shelf», em comparação com enxertos criados a partir de veia grande safena, enxertos criopreservados ou veia femoral7,15. A cirurgia pode ser realizada com baixo risco, excelente alívio sintomático e boa permeabilidade a longo prazo7.
Vários estudos confirmam que a maioria dos doentes com SVCS, quer de etiologia benigna, quer de etiologia maligna, apresenta boas taxas de permeabilidade de bypass, o que justifica uma abordagem cirúrgica agressiva, mesmo nos casos de malignidade5,7,14,15.
A hipocoagulação crónica promove a permeabilidade a longo prazo e deve ser rotineiramente instituída5,14.
Bibliografia
1. Gloviczki P, Kalra M. Superior vena cava obstruction: Surgical treatment. Chapter 61. Em: Rutherford RB, et al. Vascular surgery. 7a ed. Philadelphia: Saunders; 2010. p. 963-73. [ Links ]
2. Lautena A, Strauchb J, Junga C, et al. Endovascular treatment of superior vena cava syndrome by percutaneous venoplasty. Heart Lung Circ. 2010;19:681-3. [ Links ]
3. Picquet J, Blin V, Dussaussoy C, et al. Surgical reconstruction of the superior vena cava system: Indications and results. Surgery. 2009;145:93-9. [ Links ]
4. Ganeshan A, Honb L, Warakaulle D, et al. Superior vena caval stenting for SVC obstruction: Current status. Eur J Radiol. 2009; 71:343-9. [ Links ]
5. Deo S, Burkhart H, Araoz P, et al. Innominate vein-right atrial bypass for relief of superior vena cava syndrome due to pacemaker lead thrombosis. J Cardiovasc Surg. 2010;25:752-5. [ Links ]
6. Klop B, Scheffer G, McFadden E, et al. Treatment of pacemaker-induced superior vena cava syndrome by balloon angioplasty and stenting. Neth Heart J. 2011;19:41-6. [ Links ]
7. Okereke I, Kesler K. Superior vena cava and innominate vein reconstruction in thoracic malignancies: Single-vein reconstruction. Semin Thorac Cardiovasc Surg. 2012;23:323-5. [ Links ]
8. Moini M, Auguste M, Schoukroun G, et al. Endovascular treatment of superior vena cava obstruction helping permanent pacing. Arch Cardiovasc Dis. 2011;104:258-60. [ Links ]
9. Gray B. Is stenting for superior vena cava syndrome supercali fragilisticexpialidocious? Catheter Cardiovasc Interv. 2011;77: 740-1. [ Links ]
10. Canales J, Cardenas J, Dougherty K, et al. Single center experience with percutaneous endovascular repair of superior vena cava syndrome. Catheter Cardiovasc Interv. 2011;77: 733-9. [ Links ]
11. Park H, Kim W, Cho J, et al. Multiple pacing lead-induced Superior vena cava syndrome: successful treatment by balloon angioplasty. J Cardiovasc Electrophysiol. 2005;16:221-3. [ Links ]
12. Sabharwal N, Rowland E, Curry P, et al. Treatment of superior vena cava obstruction secondary to pacemaker wires with balloon venoplasty and insertion of metallic stents. Eur Heart J. 2002;23:1465-70. [ Links ]
13. Roman K, Alcibar-Villa J, Blanco-Mata R, et al. Percutaneous treatment of superior vena cava syndrome after pacemakers electrodes implantation and/or surgical correction of congenital heart disease. Rev Esp Cardiol. 2012;65:965-7. [ Links ]
14. Sekine Y, Suzuki H, Saitoh Y, et al. Prosthetic reconstruction of the superior vena cava for malignant disease: Surgical techniques and outcomes. Ann Thorac Surg. 2010;90:223-8. [ Links ]
15. Okereke I, Kesler K, Rieger K, et al. Results of superior vena cava reconstruction with externally stented-polytetrafluoroethylene vascular prostheses. Ann Thorac Surg. 2010;90:383-7. [ Links ]
Correio eletrónico: sandrinafigueiredo@portugalmail.pt (S. Figueiredo Braga).
Notas
*Apresentado no XIII Congresso Nacional da Sociedade Portuguesa de Angiologia e Cirurgia Vascular.
Recebido a 5 de julho de 2013;
Aceite a 27 de outubro de 2013














