Introdução
Os linfomas cutâneos primários são um grupo heterogéneo e raro de linfomas não Hodgkin, que se manifestam na pele, sem evidência de envolvimento extra-cutâneo à data do diagnóstico.
A última atualização da classificação dos linfomas cutâneos primários proposta pela Organização Mundial de Saúde e pela Organização Europeia para a Investigação e Tratamento do Cancro (WHO-EORTC), efetuada em 2018, considera essencialmente dois grandes grupos de linfomas cutâneos primários: os de células T e os de células B, sendo os primeiros mais frequentes, correspondendo a cerca de 75%-80% dos casos.1
Seguidamente à micose fungóide, as doenças linfoproliferativas primárias cutâneas CD30+ constituem o subgrupo mais frequente de linfomas cutâneos primários de células T, sendo responsáveis por cerca de 25% dos casos.1 Este subgrupo inclui a papulose linfomatóide e o linfoma cutâneo primário de células grandes anaplásicas, que parecem corresponder a um espectro amplo da mesma doença, apresentando, muitas vezes, características histopatológicas e imunofenotípicas sobreponíveis, o que pode dificultar o diagnóstico das lesões borderline.1,2
Atualmente, não existem terapêuticas curativas para estas neoplasias, que apresentam um curso clínico crónico e recorrente, requerendo diferentes regimes terapêuticos.
O brentuximab vedotina (BV) é um conjugado anticorpo-fármaco (CAF) constituído por um anticorpo monoclonal específico para a proteína CD30, que está ligada de forma covalente ao agente anti-microtúbulo monometil auristatina E (MMAE). Estudos não clínicos sugerem que a atividade biológica de BV resulta de um processo de várias etapas. A ligação do CAF ao CD30 expresso na superfície celular inicia a internalização do complexo CAF-CD30, que depois transita para o compartimento lisosómico. Dentro da célula, a MMAE, é libertada através de clivagem proteolítica. A ligação da MMAE à tubulina desagrega a rede de microtúbulos dentro da célula, induzindo a morte celular por apoptose.
O antigénio CD30 é expresso tipicamente nas células tumorais do linfoma de Hodgkin e do linfoma cutâneo primário de células grandes anaplásicas CD30+.3 No entanto, não é específico destas situações, podendo também ser expresso em células não tumorais ativadas e em células tumorais de outras neoplasias, como a micose fungóide e a síndrome de Sézary, geralmente de forma variável e com menor intensidade. Atualmente, o BV está aprovado pela Food and Drug Administration (FDA) e pela European Medicines Agency (EMA) para o tratamento de doentes adultos com linfomas cutâneos primários de células T CD30+, refratários a pelo menos uma linha terapêutica sistémica. Tem sido usado sobretudo para o tratamento de doentes adultos com linfoma cutâneo primário de células grandes anaplásicas e de doentes com micose fungóide CD30+.3
Casos Clínicos
Caso 1
O primeiro caso é referente a um doente do sexo masculino, de 82 anos de idade, com o linfoma cutâneo primário de células grandes anaplásicas (T2cN0M0) diagnosticado em dezembro de 2016. À data do diagnóstico, observavam-se múltiplos nódulos e pápulas eritemato-violáceas atingindo as faces posterior e lateral do membro inferior direito. Não havia adenomegalias, hepatomegalia ou esplenomegalia. O estudo medular, com mielograma e biopsia óssea, não revelou envolvimento da medula óssea pelo linfoma. Iniciou tratamento com metotrexato 10 mg/semana em maio de 2017, com incrementos sucessivos da dose até 20 mg/semana, não tendo ocorrido resposta clínica significativa após 6 meses de tratamento, com aparecimento de múltiplos nódulos e tumores no terço superior da face lateral da coxa direita. Em março de 2018 fez radioterapia local das lesões da coxa direita (dose total de 12 Gy, em três frações, com eletrões de energia mista de 4 e 6 MeV), com resposta completa. Um mês mais tarde surgiu nódulo eritematoso vegetante, com exulceração, no 1/3 inferior da face interna da perna direita, com cerca de 1 x 2 cm, cuja biopsia revelou recidiva do linfoma de células grandes anaplásicas CD30+. O estudo da medula óssea com biopsia, mielograma, imunofenotipagem por citometria de fluxo e pesquisa de rearranjos no gene ALK (2p23) por FISH) foi negativo, afastando a possibilidade de se tratar de um linfoma sistémico de células grandes anaplásicas CD30+ com envolvimento cutâneo. Em face do agravamento progressivo, com aparecimento de nódulos eritemato-violáceos na face lateral da coxa direita (zona previamente irradiada) e de pápulas e nódulos na face lateral da perna direita (Fig. 1A), foi decidido iniciar tratamento com BV 1,8 mg/m2 a cada 3 semanas. Após 2 administrações, observou-se a resolução quase completa das lesões cutâneas (Fig. 1B). Completou 5 ciclos de tratamento com BV em maio de 2019, com remissão clínica completa. Como efeitos laterais, verificou-se o desenvolvimento de neuropatia grau 1 logo após o 2ª ciclo, que persistiu no tempo e de neutropenia grau 3 entre o 2º e o 3º ciclo, que resolveu com espaçamento de 1 mês entre as administrações. Durante o período de neutropenia teve pneumonia, tratada em ambulatório. Por estes motivos, foi decidido não realizar terapêutica de manutenção. O doente abandonou a consulta tendo falecido noutro hospital em agosto de 2019, por quadro sético.
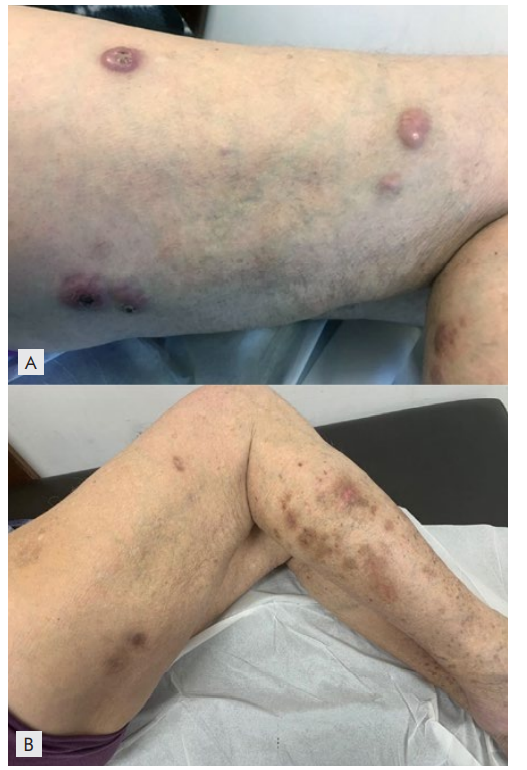
Figura 1A e 1B: Lesões cutâneas antes (A) e após (B) tratamento com brentuximab vedotina (BV) no doente 1. A) Nódulos eritemato-violáceos, alguns com crosta sero-hemorrágica, na face lateral externa da coxa direita previamente à terapêutica com BV. B) Máculas hiperpigmentadas residuais após 2 ciclos de BV.
Caso 2
O segundo caso clínico refere-se a um doente do sexo masculino, de 71 anos de idade, com o diagnóstico de linfoma cutâneo primário de células grandes anaplásicas (T3bN0M0) desde novembro de 2016. Ao exame objetivo, observavam-se placas eritematosas, com bordo bem definido e descamativo, com clareamento central, dispersas por praticamente toda a superfície corporal, atingindo predominantemente as pernas. O doente não apresentava adenomegalias, hepatomegalia ou esplenomegalia. O estudo medular, com mielograma e biopsia óssea, não revelou envolvimento da medula óssea pelo linfoma. Iniciou tratamento com metotrexato 20 mg/semana. Três meses depois, devido à progressão da doença, aumentou a dose de metotrexato para 30 mg/dia, no entanto não se verificou melhoria significativa das lesões cutâneas, pelo que suspendeu a terapêutica 3 meses após o incremento da dose. Posteriormente, introduziu-se BV 1,8 mg/m2 a cada 3 semanas, tendo efetuado 5 ciclos, entre julho e outubro de 2017, sem resposta clínica (Fig.s 2, A e B). Após o 3º ciclo desenvolveu neuropatia periférica sensorial ao nível das mãos e dos pés (grau 1), mantendo-se em vigilância. Subsequentemente, devido ao agravamento clínico foi submetido a irradiação corporal com feixe de eletrões (6 MeV, 4 vezes/semana, 1 Gy local/dia, na dose total de 30 Gy), que completou em janeiro de 2018, com remissão completa. Cerca de seis meses depois houve novamente recidiva clínica, tendo feito tratamento com PUVA oral (108 sessões, na dose de 8,8 J/cm2), que concluiu em março de 2020, com boa resposta. Atualmente, setembro de 2020, mantém apenas lesões cutâneas maculares residuais; persiste neuropatia sensitiva, com hipostesia acentuada nos dedos dos pés e nas pontas dos dedos das mãos, sem parestesias, que não respondeu ao tratamento com gabapentina.
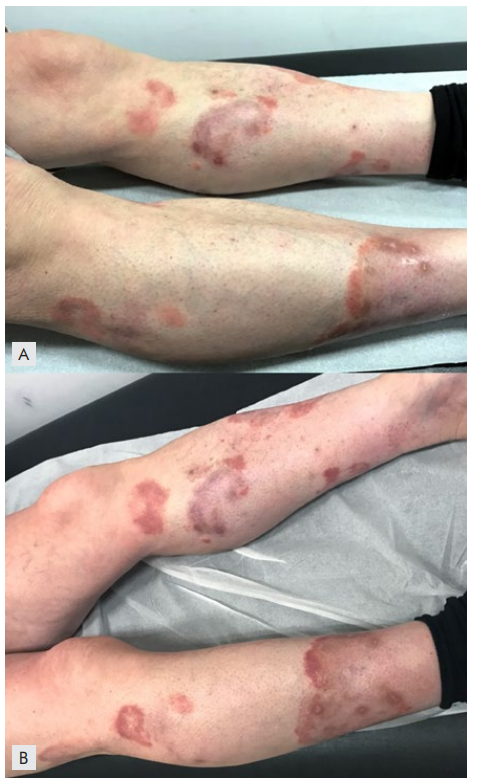
Figura 2A e 2B: Lesões cutâneas antes (A) e após (B) tratamento com 5 ciclos de brentuximab vedotina (BV) no caso 2. A) Múltiplas placas eritematosas, com limites bem definidos e bordo mais evidente, com descamação ligeira, nos membros inferiores; previamente à terapêutica com BV. B) Persistência das lesões após 5 ciclos de BV.
Discussão
O tratamento do linfoma cutâneo primário de células grandes anaplásicas deve ser adaptado de acordo com o tamanho e a extensão dos tumores. No caso de lesões solitárias ou agrupadas, a excisão cirúrgica e a radioterapia são consideradas como terapêuticas de primeira linha. Em pacientes com lesões cutâneas multifocais, o tratamento recomendado é o metotrexato em baixa dose (5-25 mg/dia), embora em casos selecionados (com poucas lesões) a radioterapia também possa ser utilizada.4,5
O BV foi aprovado para o tratamento de doentes adultos com linfomas cutâneos primários de células T CD30+, resistentes a pelo menos uma terapêutica prévia, tendo por base diversos estudos, incluindo ensaios clínicos de fase II e III.6-8
Segundo o ensaio clínico de fase III (ALCANZA), que comparou a terapêutica com BV com a terapêutica escolhida pelo médico (metotrexato ou bexaroteno), que incluiu 128 doentes com linfoma cutâneo primário de células T CD30+ (micose fungóide CD30+ e linfoma cutâneo primário de células grandes anaplásicas) previamente tratados, a resposta global com duração de pelo menos 4 meses foi superior para o braço da terapêutica com BV comparativamente ao braço da terapêutica escolhida pelo médico (56,3% versus 12,5%, respetivamente).8 Os doentes incluídos apresentavam pelo menos 10% de células neoplásicas com positividade para CD30.
A eficácia do BV foi avaliada em vários subtipos de linfoma não-Hodgkin, incluindo vários linfomas cutâneos primários de células T.9 Todos estes estudos incluíram doentes com uma ampla variação de níveis de expressão de CD30, tendo-se verificado que a resposta não estaria diretamente relacionada com os níveis de expressão de CD30 pelas células neoplásicas.9
Estudos comprovam que 70% dos doentes com linfomas cutâneos de células T, incluindo a micose fungóide, responderam à terapêutica com BV, e que os diferentes valores de expressão de CD30 (< 10%, 10%-50% e 50%) não tinham relação com o grau de resposta, embora os doentes com <5% de expressão de CD30 tivessem menor resposta comparativamente a doentes com >5% de expressão.10,11
Os efeitos secundários associados ao BV mais frequentemente observados são a neuropatia periférica sensorial, toxicidade hematológica, hepatotoxicidade e alterações gastrointestinais, entre outros.8
A neuropatia, que se pode manifestar por hipoestesia, hiperestesia, parestesia, desconforto, sensação de ardor, dor neuropática ou fraqueza, constitui um motivo de preocupação e exige monitorização. Os doentes que sofram novo episódio ou agravamento da neuropatia periférica pré-existente podem necessitar de adiar, reduzir a dose ou até mesmo descontinuar o tratamento. É reversível na maioria dos casos, no entanto, há descrição na literatura de manutenção/progressão da neuropatia.6-8Não foi demonstrada relação entre a expressão de CD30 e o grau da neuropatia.7
Do ponto de vista cutâneo, Duvic M et al, relata que a terapêutica com BV pode estar ocasionalmente associada a fenómenos inflamatórios das lesões tumorais e da pele circundante (“tumor flare”) que resolvem com a continuidade do tratamento. Os doentes com elevada expressão de CD30 nas células de linfoma podem também apresentar queixas de prurido e de ardência ao nível das lesões. Foram também descritas reações exantemáticas pruriginosas em cerca de 24% dos doentes, tratadas apenas com corticoterapia tópica.7
Assim, torna-se necessária uma monitorização clínica e analítica cuidada durante o tratamento com BV. Adicionalmente, alguns autores defendem a utilização de doses inferiores (1,2 mg/m2) de BV em doentes com linfomas cutâneos primários CD30+ para minimizar a incidência de efeitos adversos.12
Os dois casos clínicos apresentados são ilustrativos de respostas divergentes à terapêutica com BV. No primeiro caso observou-se a remissão completa da doença, enquanto que no segundo caso não houve benefício clínico, tendo o doente necessitado de realizar outras terapêuticas subsequentes. Em ambos os casos, verificou-se o aparecimento de neuropatia periférica sensorial, que persistiu no tempo. Um dos doentes teve pneumonia durante o período de neutropenia. Não foram registados outros efeitos secundários graves.
Apesar das lesões cutâneas dos doentes com linfoma cutâneo primário de células grandes anaplásicas CD30+ poderem ter uma evolução recorrente e de estarem descritos alguns casos com remissão espontânea, o envolvimento dos membros inferiores com lesões múltiplas, tal como observado nos dois casos descritos, está associado a um curso clínico mais agressivo.
Assim, o BV poderá constituir uma alternativa terapêutica válida para o tratamento de linfomas cutâneos primários de células T CD30+, com pelo menos uma linha terapêutica prévia. Aplica-se sobretudo a casos de linfomas cutâneos primários de células grandes anaplásicas e casos de micose fungóide CD30+ em estadio avançado e/ou refratários a outras terapêuticas.














