Introdução
O Sistema Respiratório constitui a principal interface entre o ser humano e o meio ambiente. Naturalmente, qualquer exposição inalatória significativa, com múltiplas particularidades distintas no que diz respeito ao tipo de substâncias inaladas, à sua concentração, às suas dimensões, aos seus aspetos físico-químicos e à sua interação com a biologia humana, é passível de provocar danos a curto ou longo prazo.
Particular atenção tem vindo a ser dada às exposições ambientais e aos efeitos da poluição atmosférica sobre a Saúde, de tal forma que muitas doenças (respiratórias e não só) parecem apresentar uma fração epidemiológica de risco que pode ser atribuída ao ambiente interior ou exterior.
As agressões inalatórias diárias sofridas a nível individual, bem como os mecanismos potenciais de exposição ambiental sofrida in utero, podem resultar no aumento da incidência e prevalência de várias patologias, onde se destaca a asma brônquica, a doença pulmonar obstrutiva crónica (DPOC), vários tipos de neoplasias (nomeadamente alguns cancros de pulmão e do sistema hematopoiético) e algumas doenças cardiovasculares, apenas para citar alguns dos exemplos mais reconhecidos.
A exposição a inúmeros agentes ambientais e ocupacionais tem um impacto significativo na saúde humana e a própria forma como surgem todos os dias riscos emergentes, novas tecnologias de trabalho e novas substâncias poluentes leva a que, no futuro, uma parcela cada vez mais significativa das doenças respiratórias (entre outras) seja atribuída a estas situações (Huang, Ghio, and Maier 2012).
Principais patologias respiratórias de etiologia profissional
Pneumoconioses
As pneumoconioses são um grupo de doenças ocupacionais provocadas pela inalação de poeiras minerais (quer sejam fibras ou partículas) e pela subsequente resposta pulmonar a esta inalação (Banks and Parker 1998, Ghio 2012).
Milhões de trabalhadores continuam a executar tarefas diárias com elevado risco para o desenvolvimento de pneumoconioses, especialmente silicose, asbestose e pneumoconiose do trabalhador do carvão (PTC - Coal Workers’ Pneumoconiosis - CWP). A associação com outras doenças, nomeadamente, neoplasias da pleura e do pulmão, tuberculose e doença pulmonar obstrutiva crónica (DPOC), causam habitualmente um elevado nível de incapacidade.
Trata-se de um problema com grande expressão mundial atual: por exemplo, na China, as pneumoconioses correspondem a cerca de 80% de todas as doenças ocupacionais respiratórias, enquanto no Vietname, cerca de 75,7% do total de casos de doença ocupacional com compensação pertence a este grupo nosológico. No Brasil, 6,6 milhões de trabalhadores encontram-se provavelmente expostos a poeiras contendo sílica cristalina respirável (ILO 2013).
A Organização Mundial da Saúde (OMS) estima que pelo menos 1,7 milhões de trabalhadores nos Estados Unidos estão expostos à sílica e 10% estão em risco de desenvolver silicose (Ahasic and Christiani 2011).
Estudos epidemiológicos em países em desenvolvimento mostraram que entre 30% a 50% dos trabalhadores de indústrias primárias e de sectores de alto risco podem sofrer de silicose ou outras pneumoconioses (ILO 2013).
Há três critérios major para o diagnóstico de uma pneumoconiose: uma exposição suficiente a uma poeira mineral indutora da doença, durante um período de latência apropriado; o reconhecimento de um padrão radiológico que vai ao encontro do estabelecido em termos internacionais e a comprovação da ausência de uma patologia que possa mimetizar uma pneumoconiose, nomeadamente a fibrose pulmonar idiopática, as micobacterioses e as doenças intersticiais pulmonares relacionadas com doenças do colagénio (Banks and Parker 1998).
As principais pneumoconioses têm um elevado impacto na saúde dos trabalhadores, pois vão desencadear uma resposta fibrogénica pulmonar, enquanto um outro grupo menos frequente de pneumoconioses se pode considerar como hipo ou afibrogénica e se relaciona essencialmente com a deposição de partículas inorgânicas inaladas, sem a subsequente resposta fibrogénica progressiva. A este nível, citam-se a estanose, a siderose, a antracose e a baritose, entre outras (Cordeiro 1995).
Uma abordagem possível na avaliação de um doente com pneumoconiose passa por incluir uma história clínica (com ênfase na história de doença respiratória, história ocupacional e tabágica), exame físico, testes de função pulmonar (espirometria, volumes pulmonares e capacidade de difusão) e radiografia de tórax (Ghio 2012).
A tomografia computorizada do tórax, nomeadamente com algoritmo de alta resolução (TCAR), é muito útil na avaliação do doente com pneumoconiose, devido à sua maior sensibilidade e capacidade de caracterização pulmonar, bem como devido a situações em que se exige um diagnóstico diferencial mais complexo. A TCAR é particularmente útil na criação de uma categorização precisa das alterações do parênquima em cada tipo de pneumoconiose (Akira 2002, Savranlar et al. 2004, Begin et al. 1991).
Apesar das pneumoconioses poderem ser definidas em termos histopatológicos, raro é que seja necessária a obtenção de uma biópsia, (Ghio 2012) exceto quando o diagnóstico diferencial se revela difícil.
Na ausência de exame patológico do tecido pulmonar, os critérios habitualmente aceites recomendam que o diagnóstico de pneumoconiose seja estabelecido após uma análise cuidadosa de todos os achados clínicos relevantes, bem como a existência de uma história fidedigna de exposição e um intervalo de tempo adequado entre esta e a deteção das alterações (Ghio 2012, 1986).
O Comité ad hoc da Assembleia Científica em Saúde Ambiental e Ocupacional da American Thoracic Society (ATS), considerou os seguintes achados clínicos como sendo de valor reconhecido para a asbestose, mas também extensíveis à outras pneumoconioses: evidência radiográfica torácica de pequenas opacificações, um padrão restritivo de compromisso pulmonar com capacidade vital forçada abaixo do limite inferior do normal, uma capacidade de difusão abaixo do limite inferior do normal e crepitações auscultatórias pulmonares não modificáveis através de tosse (Ghio 2012).
A patogénese das pneumoconioses baseia-se essencialmente numa resposta alveolar, com produção de citocinas inflamatórias, espécies reativas de oxigénio (ROS) e enzimas proteolíticas, levando à subsequente alteração pulmonar (Fujimura 2000).
Nas pneumoconioses fibrogénicas a resposta patogénica é similar entre si: após a fagocitose das partículas inaladas, os macrófagos são ativados e libertam vários mediadores inflamatórios, causando uma resposta inflamatória com lesão celular e disrupção da matriz extracelular. Segue-se uma fase de reparação, em que fatores de crescimento estimulam o recrutamento e proliferação de células mesenquimatosas, provocando neovascularização e re-epitelização das áreas mais afetadas; durante esta fase, os mecanismos de reparação observados são anormais ou não controlados e levam ao desenvolvimento de fibrose concomitante. Adicionalmente, o recrutamento neutrofílico observado pode contribuir para uma amplificação da resposta alveolar ao secretar fator de necrose tumoral alfa (TNFα) ou interleucina-1. Vários estudos demonstram que os macrófagos alveolares de indivíduos com silicose ou pneumoconiose do trabalhador do carvão, libertam espontaneamente quantidades significativas de fatores de crescimento tais como o PDGF (fator de crescimento derivado das plaquetas), IGF (fator de crescimento insulin-like) e FGF (fator de crescimento dos fibroblastos) (Brichet et al. 1999).
Vários fatores podem influenciar o risco de desenvolvimento de uma pneumoconiose: suscetibilidade individual, natureza e duração da exposição, dimensão, morfologia da superfície e caraterísticas físico-químicas das partículas inaladas, entre outras (Brichet et al. 1999).
Silicose
A silicose é uma Pneumoconiose que resulta da inalação de poeiras contendo sílica sob a forma de dióxido de sílica (SiO2) em fração respirável, sendo que a forma mais frequente de sílica cristalina é o quartzo, seguida pela cristobalite e tridimite (Brichet et al. 1999, Leung, Yu, and Chen 2012). A sílica amorfa, presente por exemplo nas terras diatomáceas, só constitui risco se calcinada por exposição a temperaturas elevadas (Greenberg, Waksman, and Curtis 2007).
Diversos tipos de exposição ocupacional podem desencadear silicose. Destacam-se trabalhos na indústria extrativa, fundições de ferro, aço ou outros metais onde se utilizam moldes de areia, cerâmicas, produção de tijolos refratários, fabricação de vidros (tanto na preparação como também no uso de jato de areia usado para sua opacificação), perfuração de rochas na indústria da construção, decapagem com jato de areia, execução de trabalho em mármore, ardósia, granito e outras pedras decorativas, fabricação de material abrasivo, fabricação de cimento, escavação de poços, construção civil, tratamento de jeans por jato de areia e trabalho com próteses dentárias (Leung, Yu and Chen 2012).
O granito, uma das rochas mais abundantes em Portugal, contém 25-40% de sílica (Greenberg, Waksman and Curtis 2007).
A apresentação clínica e a evolução da silicose estão muito dependentes da interação entre o hospedeiro e o ambiente ocupacional. Assim, a silicose pode apresentar-se sob diversas formas: silicose crónica (simples ou complicada), silicose acelerada e silicoproteinose (Santos et al. 2010, Greenberg, Waksman and Curtis 2007, Leung, Yu and Chen 2012).
A silicose aguda ou silicoproteinose desenvolve-se de forma aguda após exposições maciças a sílica cristalina e mimetiza a proteinose alveolar, com presença de exsudato intra-alveolar rico em lipoproteínas que coram positivamente pela coloração PAS (Coloração ácido periódico-Schiff).
A silicose acelerada é similar à silicose crónica, mas desenvolve-se em períodos de tempo mais curtos, habitualmente 5 a 10 anos após o início da exposição profissional. A silicose crónica é a forma mais habitualmente observada a nível ocupacional, começando a ser aparente após um período de cerca de 10 a 15 anos de indução.
A silicose crónica simples manifesta-se pela presença de pequenos nódulos silicóticos, de predomínio nos lobos superiores do pulmão e nos gânglios linfáticos e constituídos por diversas camadas de tecido conjuntivo, com partículas de sílica cristalina no seu interior.
A silicose crónica complicada resulta da coalescência dos nódulos silicóticos, formando massas sob a forma de conglomerados fibróticos que ocupam áreas cada vez mais significativas do pulmão (fibrose maciça progressiva) e podem cavitar centralmente. Outras condições que podem estar também associadas à exposição ocupacional a sílica cristalina são a tuberculose e outras micobacterioses, a artrite reumatóide, a esclerodermia, a síndroma de Sjögren e a doença renal crónica. Em 1997 e posteriormente em 2009, a Agência Internacional de Investigação sobre o Cancro (IARC) classificou a cristobalite e também as suas outras formas cristalinas, como carcinogénio do Grupo I, tal como o fez o Programa Nacional de Toxicologia dos EUA (Leung, Yu and Chen 2012, Santos et al. 2010).
Habitualmente o diagnóstico é realizado pela conjugação de uma história clínica sugestiva com imagiologia torácica característica, nomeadamente através dos sistemas de classificação estandardizados sugeridos pela Organização Internacional do Trabalho (OIT) (ILO 2011). Raramente é necessária a realização de biópsias pulmonares, que são habitualmente muito esclarecedoras, mas cujo papel só se torna fundamental no diagnóstico diferencial com outros quadros clínicos. O líquido de lavagem broncoalveolar (LBA) apresenta geralmente uma celularidade aumentada com um padrão misto linfocítico/granulocítico com uma linfocitose de predomínio T-CD8, com diminuição da relação CD4:CD8 (Cordeiro 1995, Cordeiro et al. 2007).
O estudo funcional respiratório revela de forma mais frequente uma síndroma restritiva, associada a uma diminuição da capacidade de difusão (Leung, Yu, and Chen 2012, Santos et al. 2010). A prevenção é fundamental, uma vez que não existem terapêuticas com sucesso significativo.
Asbestose
Amianto ou asbesto é um termo geral aplicado a um grupo heterogéneo de minerais silicatados e hidratados de magnésio e que têm em comum uma tendência para separar-se em fibras (Dodson and Hammar 2005).
As principais formas de amianto são crisótilo (amianto branco - forma serpentina); crocidolite (amianto azul); grunerite (amosite, amianto castanho); actinolite; antofilite e tremolite (2006).
Estas fibras, inaladas e transportadas para o interior do sistema respiratório, podem desenvolver diversos tipos de patologia, em que se destaca a formação de placas pleurais, o espessamento pleural difuso, a asbestose, que constitui uma Pneumoconiose com resposta fibrogénica pela inalação de amianto, o derrame pleural benigno induzido por amianto e várias formas de neoplasia (cancro do pulmão e mesotelioma pleural maligno).
O consumo máximo de amianto na Europa ocorreu um pouco antes de 1980, sendo usado em inúmeras situações, em que se destacam as suas propriedades ignífugas, de resistência à tração e isolantes térmicas e acústicas. A proibição total da utilização e comercialização de produtos que contenham amianto (pela aplicação da Diretiva 1999/77/CE da Comissão Europeia) deu-se apenas a 1 de janeiro de 2005 (2006).
Todas as variedades de amianto têm um potencial cancerígeno. O Valor Limite de Exposição (VLE) segundo o Decreto-Lei n.º 266/2007, de 24 de julho, é fixado em 0,1 fibras/cm3 para todos os tipos de fibras de amianto (UONIE/ACSS 2008).
O diagnóstico clínico das doenças relacionadas com o amianto é baseado na entrevista detalhada ao doente, dados ocupacionais de exposição ao amianto, período de latência considerado adequado, sinais e sintomas, achados radiológicos e exames complementares de diagnóstico compatíveis. A confirmação histopatológica é necessária na suspeita de doenças malignas relacionadas com o amianto e na eventualidade da existência de outros diagnósticos diferenciais (Tossavainen 1997).
A asbestose é definida como uma fibrose pulmonar intersticial difusa que é consequência da exposição ao amianto. Nem os aspetos clínicos, nem as alterações pulmonares observadas são suficientemente diferentes das de outras causas de fibrose intersticial que permitam o diagnóstico seguro sem uma história de exposição significativa a poeiras de amianto no passado ou a deteção de fibras ou corpos de amianto no tecido pulmonar muito em excesso do que é usualmente visto na população em geral (Tossavainen 1997).
A asbestose é geralmente provocada por níveis relativamente altos de exposição, associados a sinais radiológicos de fibrose do parênquima pulmonar. A sua clínica, inespecífica, engloba tosse seca, dispneia de esforço e fervores auscultatórios tele-expiratórios de predomínio basal. Na radiografia torácica é habitualmente aparente a presença de infiltrados reticulo-micronodulares nas bases pulmonares (Pipavath, Godwin and Kanne 2010). A Tomografia Computorizada de Alta Resolução (TCAR) permite uma caracterização mais precoce da doença, observando-se de modo geral, espessamentos dos septos inter e intra-lobares na periferia do pulmão, estrias parenquimatosas estendendo-se entre a pleura e o pulmão, aspetos em “favo de mel”, atelectasias discais e densidades parenquimatosas subpleurais (Begin 1999). Em cerca de 10% dos indivíduos com asbestose histologicamente comprovada, a radiografia torácica é normal.
O diagnóstico patológico de asbestose é raramente obtido, mas exige a prova da presença de uma doença pulmonar intersticial com corpos de amianto em tecido humano (dois ou mais por cm2 por campo microscópico) (Ghio 2012).
A exposição ao amianto é geralmente referida em termos de dose total ou cumulativa. A dose final é resultante do tempo de exposição (em anos) e da intensidade da exposição, tal como definido pela concentração média de fibras por centímetro cúbico (f/cm3) de ar do local de trabalho. Somente as fibras superiores a 5 μm de comprimento são contadas. Assim, um indivíduo exposto a duas fibras/cm3 durante dez anos, teria uma exposição total de 20 (Dodson and Hammar 2005). Os critérios do Relatório do Consenso de Helsínquia afirmam que a asbestose “pode ocorrer” com exposições na ordem de 25. Não há nenhuma evidência convincente de que a asbestose ocorra com exposições inferiores a dez (Tossavainen 1997, Dodson and Hammar 2005).
O líquido de lavagem broncoalveolar (LBA) obtido por broncofibroscopia é uma ferramenta útil na asbestose, não só para avaliar a presença de uma alveolite linfocítica (e/ou neutrofílica) moderada, maior nas fases precoces e menor em doença mais avançada, e geralmente associada a relação CD4:CD8 aumentada, mas essencialmente para identificar e quantificar as fibras de amianto. Supõe-se que o número de corpos asbestósicos encontrados no LBA reflete a sua concentração no pulmão (Begin 1999, Cordeiro et al. 2007). A recuperação de mais do que um corpo asbestósico/ml de LBA indica uma alta probabilidade de exposição ocupacional substancial ao amianto (1986).
Os corpos asbestósicos (ou ferruginosos) podem ser vistos ao microscópio em LBA, expetoração induzida e tecido pulmonar. Estes são corpos em forma de halter, com cerca de 20 a 150 μm de comprimento, constituídos por fibras cobertas por uma camada de mucopolissacarídeos. O pigmento de ferro (que resulta da degradação da hemoglobina) fá-los parecer acastanhados (Ahasic and Christiani 2011, 1986). O amianto anfíbolo forma a maioria dos corpos asbestósicos e é mais persistente no organismo do que o crisótilo (1986).
O estudo funcional respiratório revela habitualmente alterações similares às de outras pneumoconioses: síndroma restritiva e diminuição da capacidade de difusão.
Mais uma vez, a prevenção e legislação de âmbito ocupacional desempenham um importante papel, uma vez que não existe terapêutica específica para a doença (Dodson and Hammar 2005).
Pneumonite de Hipersensibilidade de etiologia ocupacional
A pneumonite de hipersensibilidade (PH), também apelidada previamente por alguns autores de alveolite alérgica extrínseca (AAE), é uma doença pulmonar complexa causada por uma reação imunitária desencadeada após a exposição respiratória a uma ampla variedade de antigénios, incluindo microrganismos, proteínas de origem vegetal e animal e compostos químicos. Cerca de 300 agentes já foram identificados como potencialmente causadores da doença (Ho and Kuschner 2012, Hirschmann, Pipavath, and Godwin 2009, Agostini et al. 2004, Fink et al. 2005).
Ao longo dos últimos 10 a 15 anos tem havido um crescente interesse nesta patologia, tendo inclusive sido criado um grupo de estudo da PH, e publicado um importante documento de trabalho revelando a cooperação entre o National Heart, Lung and Blood Institute dos EUA e o Departamento de Doenças Raras do National Institutes of Health dos EUA (Fink et al. 2005, Lacasse, Girard, and Cormier 2012).
Este grupo definiu a PH como uma doença pulmonar que manifesta sintomas de dispneia e tosse e que é resultante da inalação de um antigénio ao qual o doente tinha sido previamente sensibilizado. Algumas considerações se colocam: (1) A PH é uma doença pulmonar com ou sem manifestações sistémicas (tais como a febre e a perda de peso), (2) é causada pela inalação de um antigénio ao qual o indivíduo (por exemplo, o trabalhador) está sensibilizado, (3) a sensibilização e exposição isoladas na ausência de sintomas não definem a doença, uma vez que muitos indivíduos expostos desenvolvem uma resposta imune que se manifesta pela presença de anticorpos IgG para o antigénio em causa, muitas vezes com a presença de grande número de linfócitos nos seus pulmões, mas nunca vêm a desenvolver doença clínica (Lacasse, Girard, and Cormier 2012).
Pensa-se que na Europa, as PH representem cerca de 4 a 15% de todas as doenças intersticiais pulmonares, e destas um número significativo pode ser correlacionado com o trabalho (Thomeer et al. 2001, Lacasse, Girard, and Cormier 2012). Por exemplo, durante a sua vida, um agricultor tem uma probabilidade entre 0,5 a 3% de desenvolver PH (Bang et al. 2006).
Historicamente, investigadores portugueses têm desenvolvido valiosos trabalhos nesta área, nomeadamente na suberose e na doença pulmonar do criador de aves (Winck et al. 2004, Morais et al. 2004). As principais causas de PH podem ser divididas em três grandes categorias (agentes microbianos, proteínas animais e químicos com baixo peso molecular) (Ho and Kuschner 2012).
No Quadro 1, apresentam-se alguns dos agentes etiológicos implicados.
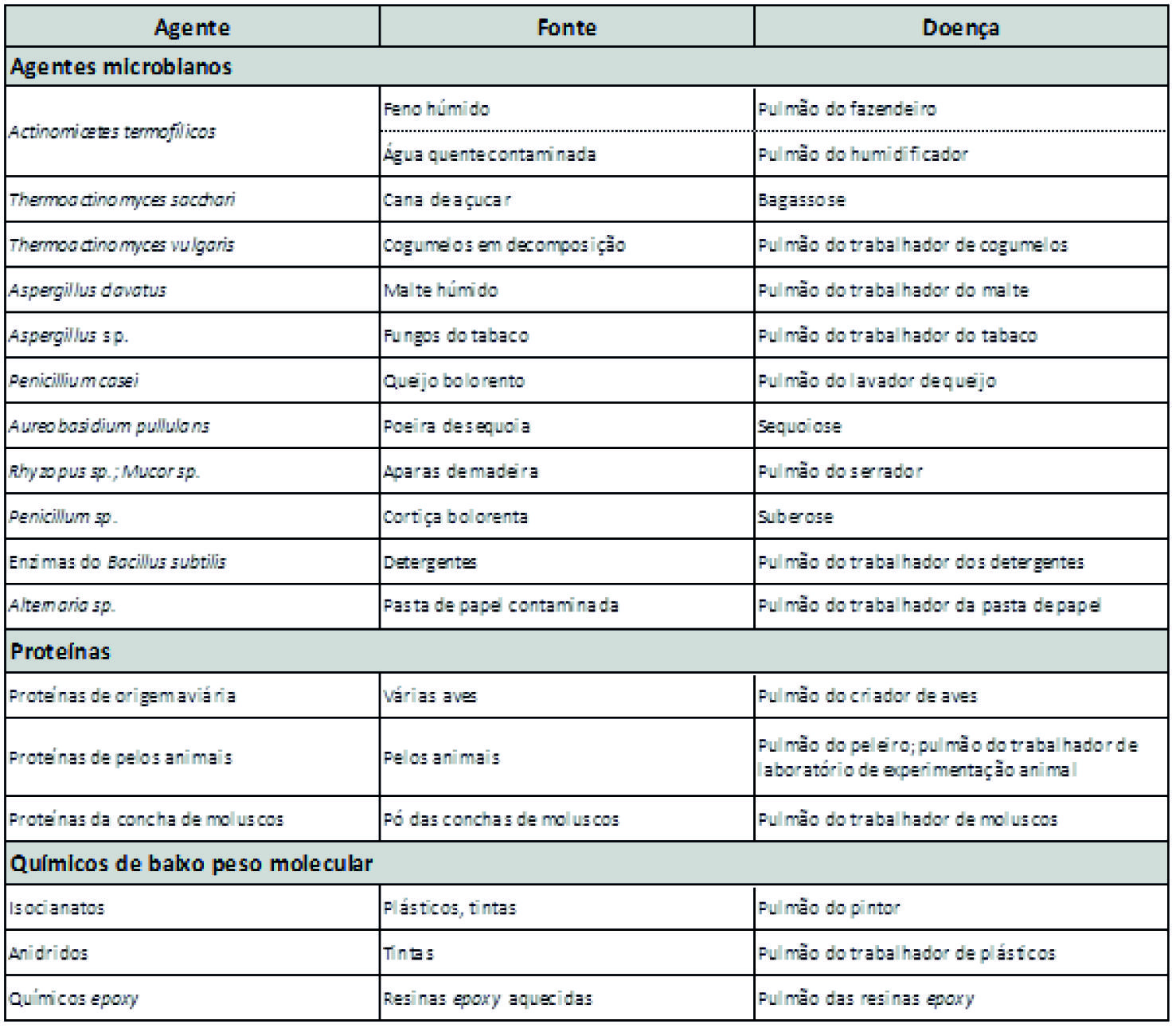
Quadro 1 Causas ocupacionais de Pneumonite de Hipersensibilidade Adaptado de Ho, 2012 e de Salvaggio, 1998 (Ho and Kuschner 2012, Salvaggio, Vockroth, and Lopez 1998).
A clínica da doença pode assumir formas mais agudas, com febre e mal-estar geral e por vezes uma síndroma de tipo gripal (flu-like), formas subagudas e crónicas, com dispneia de esforço, baqueteamento digital, fervores e ralas à auscultação pulmonar. Contudo, Lacasse e col. referem, após estudo de coortes significativas de doentes, que existem sobretudo dois subgrupos (doença aguda e doença crónica), sendo difícil estabelecer critérios precisos para as formas subagudas (Lacasse, Girard, and Cormier 2012). Os mesmos autores preconizaram seis preditores significativos para a presença de PH (exposição a um agente etiológico conhecido, precipitinas positivas, recorrência sintomatológica, crepitações inspiratórias à auscultação, sintomatologia após 4-8 horas do início da exposição e perda de peso). A presença dos seis preditores identificou corretamente 98% de toda a coorte estudada, enquanto nenhum doente apresentou ausência de todos os preditores.
No estudo da PH e após uma cuidadosa história clínica ocupacional e ambiental, destacam-se as seguintes características (Akira 2002, Ho and Kuschner 2012, Salvaggio, Vockroth, and Lopez 1998, Lacasse, Girard, and Cormier 2012, Costabel, Bonella, and Guzman 2012, Zacharisen and Fink 2011, Thaon et al. 2006):
• Radiografia torácica habitualmente normal nas fases mais precoces, ou então com infiltrados bilaterais simulando por vezes pneumonia nas formas agudas. Podem estar presentes alterações do tipo reticulo-micronodular.
• TCAR com nodulação centrilobular, áreas de hiperatenuação em “vidro despolido” de predomínio não inferior, com possível padrão em mosaico com áreas de encarceramento aéreo; em fases avançadas com reticulação, bronquiectasias de tração e áreas em “favo”, traduzindo fibrose.
• Estudo da função respiratória com padrão restritivo e diminuição da capacidade de difusão, com a exceção do pulmão do fazendeiro, que pode assumir um padrão obstrutivo preferencial.
• Presença de anticorpos IgG positivos para os antigénios causadores da doença (previamente conhecidos como precipitinas, por serem determinados através de técnicas de imunoprecipitação). Estes não são patognomónicos, uma vez que muitos trabalhadores expostos apresentam positividade para estes anticorpos, sem doença aparente.
• Possibilidade da presença de positividade em testes de provocação com o agente específico (embora não haja critérios estandardizados, ao contrário do que acontece na asma ocupacional).
• LBA revelando habitualmente uma linfocitose > 30%. A inexistência de linfocitose no LBA exclui, em princípio, a doença ativa. A relação CD4:CD8 é habitualmente baixa, mas já foram observadas situações em que sucede o contrário, apresentando valores próximos dos presentes na sarcoidose (Cormier et al. 1986, Lacasse, Girard, and Cormier 2012).
A terapêutica da PH está intimamente ligada à rápida evicção do estímulo etiológico ocupacional, desempenhando aqui um papel preponderante as atividades de Saúde e Segurança no Trabalho, nomeadamente no que toca à prevenção primária e secundária. Em termos farmacológicos, é essencialmente utilizada a corticoterapia sistémica oral, em formas agudas graves ou em formas crónicas com repercussão funcional ou rapidamente progressivas, com resultados diversos consoante as séries clínicas referenciadas. Poderão igualmente ser usados fármacos imunossupressores, tais como a azatioprina (Costabel, Bonella, and Guzman 2012, Lacasse, Girard, and Cormier 2012, Salvaggio, Vockroth, and Lopez 1998).
Asma Ocupacional
A asma ocupacional é uma doença caracterizada por limitação variável do fluxo aéreo e/ou hiper-reatividade das vias aéreas, devidas a causas e condições atribuíveis a um ambiente de trabalho em particular e não a estímulos encontrados fora do local de trabalho. A asma ocupacional é a doença pulmonar respiratória mais comum em países desenvolvidos (Mapp and Boschetto 2003, Vandenplas and Malo 2003, Baur et al. 2012, Tarlo et al. 2008, Baur and Sigsgaard 2012, Henneberger et al. 2011, Nicholson, Cullinan, and Burge 2012).
É sabido que um largo espectro de exposições ocupacionais pode induzir um agravamento de uma asma brônquica pré-existente, nomeadamente a poeiras, aeroalergéneos do ambiente indoor e outdoor e detergentes e soluções de limpeza (Szema 2012).
Mais de 250 agentes foram associados etiologicamente à asma ocupacional. Os mais frequentes são os di-isocianatos, farinha e pó de diversos grãos, partículas em suspensão de alimentos (principalmente peixes), resinas, látex, partículas animais (especialmente de animais de laboratório), aldeídos e pós de madeira (Ribeiro and Tarlo 2012, Tan and Bernstein 2014).
A prevalência da asma relacionada com o trabalho não é conhecida, tendo-se estimado que cerca de 10 a 15% de toda a asma brônquica do adulto possa ser atribuída ao local de trabalho, incluindo-se nestes números os casos de asma ocupacional e de asma exacerbada pelo local de trabalho (Blanc and Toren 1999). Outros autores referem valores na ordem dos 5-25% do total de casos (Baur et al. 2012). Os custos europeus totais atribuíveis à asma relacionada com o trabalho não são conhecidos em detalhe, mas estima-se que possam atingir 1,2 mil milhões de euros/ano (Baur and Sigsgaard 2012).
Especificamente, várias definições têm sido propostas ao longo dos anos por diversos autores, havendo precisamente alguma área de indefinição no que toca à distinção entre asma ocupacional provocada por estímulos existentes apenas nos locais de trabalho e/ou também fora deles. Assim, de forma mais globalmente aceite, o termo asma ocupacional refere-se especificamente a asma provocada pelas exposições observadas no local de trabalho (Lemiere et al. 2013).
Algumas definições mais abrangentes e por isso mais inespecíficas, referem um termo geral de asma relacionada com o trabalho (work-related asthma), que inclui a asma ocupacional e a asma exacerbada pelo trabalho (work-exacerbated asthma) (Lemiere et al. 2013, Vandenplas and Malo 2003).
Malo e Vandenplas sugeriram em 2011 um esquema que considera algumas outras síndromas clínicas observáveis em ambiente laboral, como se pode ver na Figura 1.
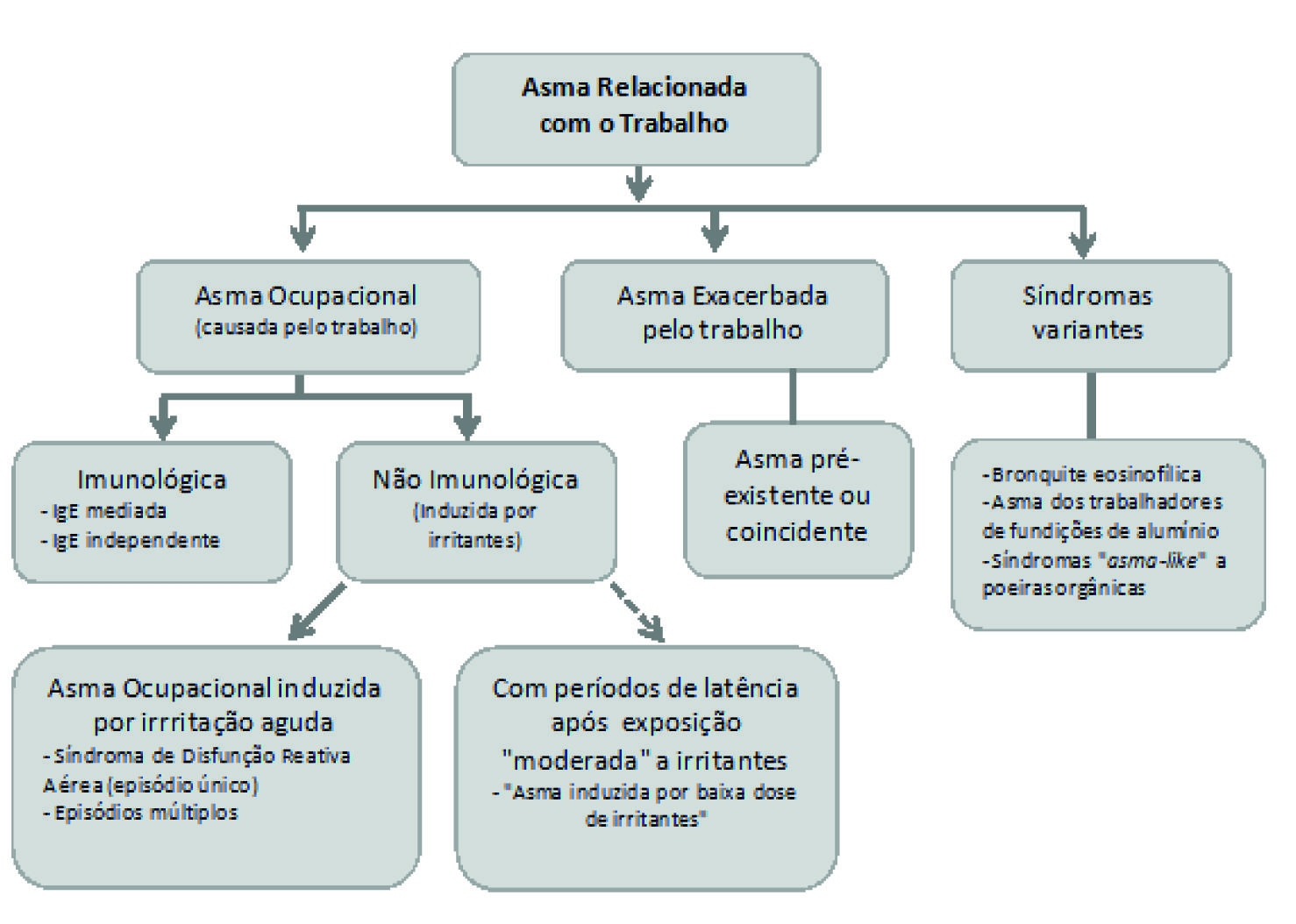
[Adaptado de Malo e Vandenplas, 2011 (Malo and Vandenplas 2011)]
Figura 1 Esquema sugerido para definição de asma relacionada com o trabalho.
Dois tipos de asma ocupacional podem ser distinguidos, dependendo se são ou não mediados por mecanismos imunológicos: asma ocupacional imunológica e asma ocupacional não imunológica. Na primeira, observa-se habitualmente um período de latência durante o qual se processa a exposição e sensibilização ao agente ocupacional responsável. Dentro desta categoria encontra-se a asma ocupacional causada por todos os compostos de alto peso molecular e ainda alguns de baixo peso molecular (anidridos ácidos, sais de platina, alguns corantes). Nestas situações, estabeleceu-se um mecanismo imunológico IgE dependente inequívoco; de igual modo se encontra nesta categoria a asma ocupacional provocada por compostos de baixo peso molecular, através de mecanismos imunológicos não completamente conhecidos (di-isocianatos, cedro vermelho ocidental, acrilatos). Nas Guidelines do American College of Chest Physicians, esta última forma é conhecida como asma ocupacional induzida por sensibilizadores (“sensitizer-induced”) (Tarlo et al. 2008, Bernstein et al. 2006, Vandenplas and Malo 2003).
A nomenclatura proposta pela Academia Europeia de Alergia e Imunologia Clínica sugere que a asma ocupacional mediada por mecanismos imunológicos (qualquer que seja a sua natureza exata) e que resulta em hipersensibilidade alérgica clínica, seja conhecida como asma ocupacional alérgica (Johansson et al. 2001).
A asma ocupacional não imunológica é essencialmente caracterizada pela ausência de um período de latência, que seria necessário para a habitual resposta imunológica após uma sensibilização do hospedeiro. Com efeito, a sintomatologia pode ocorrer poucas horas após uma única exposição irritante no local de trabalho; a entidade clínica mais descrita neste tipo de asma ocupacional é a síndroma de disfunção reativa das vias aéreas, que cursa com início das queixas (tosse, dispneia, pieira) nas primeiras 24 horas após a exposição, as quais não aliviam significativamente fora do local de trabalho, não havendo qualquer período de latência prévio e sendo comprovada a presença de um padrão obstrutivo e/ou hiper-reatividade brônquica inespecífica (Bernstein et al. 2006, Mapp and Boschetto 2003, Vandenplas and Malo 2003).
A asma exacerbada pelo trabalho descreve um agravamento de uma asma pré-existente, manifestando-se habitualmente por aumento da frequência ou severidade dos sintomas e/ou do consumo de fármacos para o seu tratamento.
O diagnóstico da asma ocupacional é um processo complexo, havendo necessidade de estabelecer nexos de causalidade inequívocos entre uma determinada exposição profissional e o advento das queixas, excluindo outras causas não observáveis a nível laboral. O diagnóstico da asma ocupacional deve ser investigado antes de aconselhar o trabalhador a abandonar o seu local de trabalho, já que a evicção da exposição prolongada pode influenciar a fiabilidade dos procedimentos de diagnóstico (Mapp and Boschetto 2003). As implicações médico-legais a este nível são muito importantes.
Assim, o diagnóstico resulta essencialmente da integração de dados relativos à história clínica e ocupacional do doente, testes cutâneos de alergia, sempre que possível, pesquisa de IgE específica (nos casos de asma ocupacional imunológica IgE mediada), medições seriadas da função ventilatória no local de trabalho e fora deste, estudo funcional respiratório com provocação inespecífica e por vezes, se necessário, com o agente laboral suspeito.
Doença Pulmonar Obstrutiva Crónica (DPOC) de etiologia ocupacional
A DPOC é uma doença frequente, evitável e tratável e é caracterizada por uma obstrução persistente das vias aéreas, que é geralmente progressiva e está associada a uma resposta inflamatória crónica aumentada na sequência da inalação de partículas ou gases nocivos onde se podem encontrar seguramente diversos estímulos ocupacionais, não obstante a etiologia principal ser o fumo do tabaco. As exacerbações e co-morbilidades contribuem para a gravidade global da doença. A obstrução persistente resulta de uma combinação de doença difusa das pequenas vias aéreas e destruição do parênquima pulmonar (GOLD 2014).
O termo “Bronquite Profissional” ou “Bronquite Industrial” muito usado sobretudo no Século XX e fazendo ainda parte, historicamente do léxico pneumológico, refere-se essencialmente à presença de queixas crónicas de tosse, dispneia e expetoração abundante em trabalhadores expostos a riscos inalatórios e é um pouco mais redutora do que a denominação “DPOC de etiologia profissional” pois esta última já envolve outras características, não apenas clínicas, no seu diagnóstico e supõe, também, a presença de limitação ventilatória obstrutiva demonstrável e fenómenos de destruição parenquimatosa pulmonar tipicamente associados, nomeadamente algumas formas de enfisema (Sunyer et al. 2005, Zock et al. 2001, Korn et al. 1987, Bakke et al. 1991).
A DPOC é uma síndroma com muitos fenótipos e com uma projeção mundial em constante crescimento. Por exemplo, na Europa estima-se uma prevalência de cerca de 5 a 10% (consoante os critérios usados para o seu diagnóstico) e uma mortalidade de 18/100000 habitantes. Recentemente, o Programa BOLD (Burden of Obstructive Lung Diseases) documentou, em estudos espirométricos realizados a nível internacional, prevalência substancial da doença em nunca fumadores (3-11%), o que está provavelmente relacionado com as exposições profissionais e/ou ambientais, bem como com o envelhecimento da população (Buist et al. 2007). Em Portugal, num estudo efetuado na região de Lisboa, estimou-se uma prevalência de DPOC de 14,2%, em adultos com mais de 40 anos de idade (Barbara et al. 2013).
O Global Burden of Disease Study da OMS projetou que a DPOC, que ficou em sexto lugar como causa de morte em 1990, se vai tornar a terceira maior causa de morte no mundo em 2020; uma projeção mais recente estima que a DPOC será a quarta principal causa de morte em 2030 (Mathers and Loncar 2006, GOLD 2014, Lopez et al. 2006).
Tal como no cancro de pulmão ocupacional, a DPOC ocupacional é em tudo sobreponível à DPOC de outras etiologias, nomeadamente a tabágica, o que coloca especial dificuldade na estratificação do risco atribuível entre vários fatores causais sinérgicos e concomitantes, o que pode, por exemplo, dificultar a atribuição médico-legal de incapacidade (Burge 1999).
Entre as principais dificuldades no estudo da DPOC ocupacional referem-se:
• Os trabalhadores doentes são em tudo indistinguíveis dos casos de DPOC não ocupacional;
• Em geral, no início da prática laboral, observa-se em média, um melhor estado de saúde (“efeito do trabalhador saudável”) com valores espirométricos que podem até ser mais altos do que o expectável;
• Os estudos prospetivos podem mostrar um abandono mais precoce pelos trabalhadores que desenvolvem maior agravamento funcional, a que corresponde mudança de trabalho ou aposentação precoces (Burge 1999).
Nos agentes etiológicos ocupacionais mais frequentemente observados, destacam-se:
• Poeiras orgânicas (trabalho em corte e processamento de madeiras, exposição a poeiras de cereais, trabalho agrícola e na pecuária, trabalho em silos, havendo frequentemente contaminação microbiológica concomitante por endotoxinas e micotoxinas);
• Fumos e poeiras metálicas (alumínio, ósmio, cádmio, vanádio, usados sobretudo no trabalho metalúrgico, na indústria do aço, produção de zinco e soldadura de diversos tipos);
• Fumos da combustão diesel;
• Poeiras mistas, contendo minerais e material orgânico (indústria extrativa e construção) (Diaz-Guzman, Aryal, and Mannino 2012).
Por outro lado, o fumo de tabaco ambiental pode, também, ser considerado uma causa de DPOC em nunca fumadores, nomeadamente em países sem legislação mais restritiva (Salvi 2014).
Cancro do pulmão de etiologia ocupacional
Historicamente, o nexo de causalidade entre exposições ocupacionais e cancro de pulmão começou a ser estabelecido no Século XIX, com a exposição a radão (Yu, Tse, and Qiu 2012). Desde aí, inúmeras outras exposições têm sido relacionadas com este tipo de neoplasia, que é uma das mais frequentes em termos ocupacionais. De facto, a International Agency for Research on Cancer (IARC) classifica 107 agentes como carcinogénios humanos confirmados (Grupo 1), dos quais 26 exercem os seus efeitos a nível pulmonar; destes, apenas dois não o são por via de exposição ocupacional - o carvão usado no aquecimento das casas e na cozinha e o tabagismo ativo (Yu, Tse, and Qiu 2012).
Estima-se que 10-25% dos cancros do pulmão em todo o mundo ocorrem em não-fumadores, ou seja, indivíduos que fumaram menos de 100 cigarros em toda a vida. O tipo histológico mais frequente é o adenocarcinoma. A exposição ao fumo de tabaco ambiental (particularmente em mulheres) e a exposição a agentes carcinogénios no local de trabalho (particularmente em homens) são os dois mais importantes fatores de risco (Couraud et al. 2012, De Matteis et al. 2013).
O cancro do pulmão é o cancro ocupacional mais bem estudado e a exposição prévia a carcinogénios ocupacionais é um dos seus mais importantes determinantes (Yu, Tse, and Qiu 2012).
São numerosos os agentes em que já existe evidência epidemiológica suficiente para estabelecer nexos de causalidade inequívocos entre exposição ocupacional e cancro do pulmão. No Quadro 2 mencionam-se os principais.
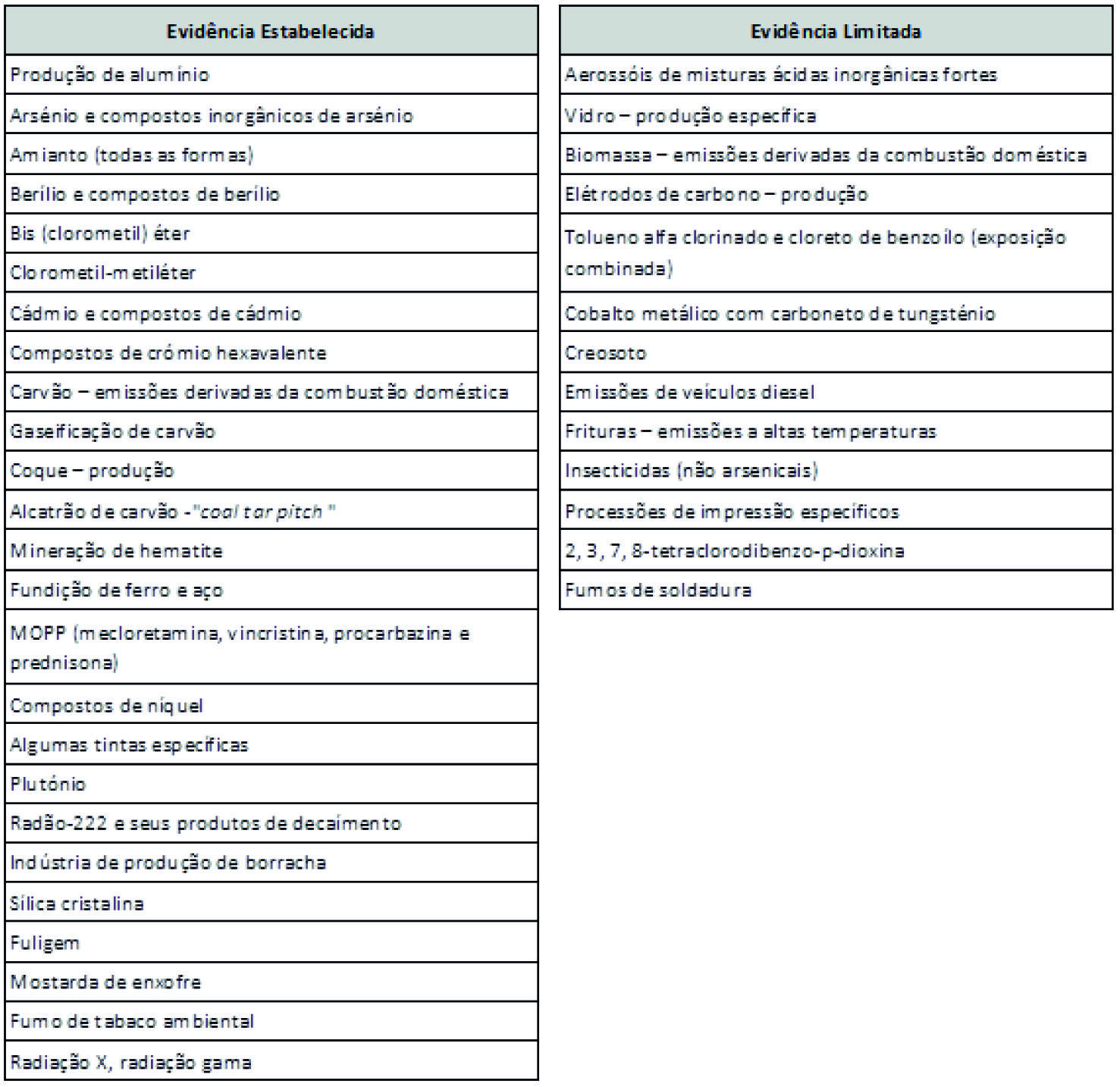
Adaptado de Cogliano (Cogliano et al. 2011) e de European Lung White Book (2013)
Quadro 2 Causas ocupacionais de Cancro de Pulmão.
Entre as várias exposições ocupacionais mais relacionadas com cancro ocupacional, destacam-se algumas:
Amianto: é um dos riscos ocupacionais mais minuciosamente caracterizados e investigados, quer no que toca à etiologia do cancro do pulmão quer da pleura (mesotelioma pleural) (Lenters et al. 2011). Inúmeros modelos de avaliação de risco têm sido desenvolvidos na tentativa de fornecer informações confiáveis sobre os riscos de cancro de pulmão no local de trabalho. Os próprios métodos de amostragem e análise do amianto têm mudado dramaticamente ao longo dos anos.
Globalmente, a cada ano, cerca de 125 milhões de pessoas ainda estão expostas ocupacionalmente ao amianto (WHO 2006). Exposição por inalação, e em menor extensão, por ingestão, ocorre na mineração e na moagem de amianto (ou outros minerais contaminados com amianto), no fabrico ou na utilização de produtos que contenham amianto, na construção, na indústria automóvel, nas atividades de remoção de amianto (incluindo o transporte e eliminação de resíduos contendo estas fibras) (IARC 2009).
A associação entre a exposição ao amianto e o risco de cancro de pulmão é basicamente linear, exceto em exposições muito elevadas. Muitos estudos demonstram que o risco relativo para cancro de pulmão aumenta entre 1% e 4% por fibra-ano/mL de exposição, correspondendo a uma duplicação do risco nos valores de 25-100 fibras-ano/mL. No entanto, um estudo de elevada qualidade mostrou uma duplicação do risco com valores de exposição de apenas cerca de 4 fibras-ano/mL. O tipo histológico e a localização do cancro do pulmão não são úteis na diferenciação de outros cancros de pulmão não induzidos pelo amianto. A presença de placas pleurais, corpos de amianto ou fibras de amianto são úteis como marcadores de exposição prévia. Todos os tipos de amianto estão potencialmente associados com cancro de pulmão. Por outro lado, relativamente ao risco oncológico pulmonar, a interação entre o amianto e o tabagismo apresenta caraterísticas que o situa entre aditivo e o multiplicativo (Nielsen et al. 2014).
O mesotelioma pleural é um tumor raro que ocorre nas células mesoteliais que recobrem a membrana pleural. Os casos não associados a exposição ocupacional ou ambiental a amianto são raríssimos, com uma incidência anual estimada de 1 a 2 por milhão nos EUA (Begin et al. 1992). A sua relação causa-efeito foi inicialmente descoberta após estudos de Wagner e col. na África do Sul, em casos com exposição ambiental e ocupacional (Wagner, Sleggs, and Marchand 1960). De uma forma geral, as populações com exposição a amianto (sobretudo crocidolite) têm um risco cerca de 5 a 20 vezes superior de desenvolvimento de mesotelioma (Begin et al. 1992). Trata-se de um tumor que ocorre mais frequentemente após a exposição a fibras anfíbolas, face ao amianto crisótilo. O risco estimado de mesotelioma associado a um aumento de uma unidade (em fibras/ano) no que toca a exposição a fibras anfíbolas de amianto é considerável (IARC 2009).
Radão - O radão-222 é um gás radioativo que ocorre naturalmente e é responsável por cerca de metade da exposição humana mundial a radiação. A exposição crónica ao radão e seus produtos de decaimento é estimada como a segunda principal causa do cancro do pulmão (após o tabaco). A radiação ionizante emitida durante o decaimento radioativo do radão e seus compostos relacionados pode induzir uma variedade de efeitos citogenéticos que resultam num aumento do risco de carcinogénese (Robertson et al. 2013).
Taxas elevadas de cancro de pulmão têm sido relatadas a partir de vários estudos de coorte e caso-controlo de mineiros expostos ao radão e seus produtos de decaimento. Estes estudos incluem principalmente mineiros de urânio, mas também da mineração de ferro, fluorite e outros metais. Fortes evidências de relações exposição-resposta foram obtidas a partir de vários desses estudos, apesar de algumas incertezas que afetam as estimativas da exposição das populações em estudo. Vários estudos caso-controlo do cancro do pulmão têm sugerido também um risco maior entre os indivíduos que vivem em habitações com valores de exposição mais elevados, havendo uma sinergia entre exposição ocupacional e ambiental (IARC 1988).
Sílica Cristalina - Devido à extensa ocorrência natural de sílica cristalina na crosta terrestre e os amplos usos dos materiais em que é um constituinte, os trabalhadores podem ser expostos à sílica cristalina numa grande variedade de indústrias e profissões (IARC 2009).
Berílio - É um dos metais mais leves, com um dos pontos de fusão mais elevados e com uma grande condutividade térmica, o que o tornou amplamente usado na indústria de armamento, nuclear, de telecomunicações, em ligas metálicas resistentes, em prótese dentária e na indústria aeroespacial e automóvel.
A IARC classifica o berílio como carcinogénio do grupo 1, uma vez que foram realizados vários estudos envolvendo exposições ocupacionais a este metal, nomeadamente em unidades de processamento de berílio (Sanderson, Petersen, and Ward 2001, Steenland and Ward 1991, Ward et al. 1992, IARC 2009).
Fumo de tabaco ambiental - uma vez que em muitos países só mais recentemente foram adotadas leis de proteção antitabágica nos espaços públicos e locais de trabalho, muitos cancros pulmonares ocupacionais podem resultar especificamente da exposição a fumo de tabaco ambiental.
Desde 1981, mais de 50 estudos epidemiológicos examinaram a associação entre o fumo de tabaco ambiental e cancro do pulmão, resultando na conclusão de que a exposição de não fumadores é causalmente associada com um aumento de risco de cancro do pulmão, o que levou a IARC a classificar o fumo de tabaco ambiental como carcinogénio do grupo 1 (IARC 2004).
Fumos da Combustão de diesel - Vários estudos, incluindo uma revisão internacional pela IARC, demonstraram que as emissões dos veículos a diesel aumentam o risco de cancro do pulmão, com um OR de 1,8 (IC 95%: 1,2-2,6) (Pintos et al. 2012, Benbrahim-Tallaa et al. 2012).
Em conclusão, a patologia respiratória de etiologia ocupacional representa uma vasta e heterogénea família de potenciais quadros clínicos de gravidade muito variável, mas passíveis de induzir significativa morbilidade e mortalidade nas populações afetadas.
Só o seu reconhecimento precoce e sobretudo a adoção e o investimento em medidas de Prevenção Primária (e também Secundária) poderá modificar o quadro atual que se observa a nível mundial. Tem aqui papel preponderante, na área respiratória, a atuação médica, nomeadamente da especialidade de Medicina do Trabalho, Pneumologia, Imunoalergologia, Medicina Interna (entre outras) e a atuação não médica, desenvolvida por todos os outros profissionais diferenciados e potencialmente envolvidos na abrangente e multidisciplinar área da Saúde Ocupacional.














