Introdução
O carcinoma colorretal (CCR) é a terceira neoplasia maligna mais diagnosticada em Portugal, e a segunda neoplasia mais mortal do país.1
O fígado é local mais frequente de metastização, sendo que 20 a 30% dos pacientes apresentam metástases hepáticas no momento do diagnóstico e cerca de 70% apresentam doença metastática documentada na altura da morte.2,3,4,5,6,7,10,11,12A ressecção cirúrgica das metástases hepáticas é considerada o tratamento de eleição para estes doentes, mas apenas 20% deles reúnem critérios para a cirurgia;9,14,15para estes as opções terapêuticas para controlo de doença local e aumento de sobrevida são limitadas, tendo como pilar terapêutico esquemas de quimioterapia. Contudo, um dos grandes desafios na gestão da doença é a crescente proporção de pacientes com envolvimento hepático preferencialmente hepático que mantém uma boa capacidade funcional, tendo esgotado todas as opções terapêuticas.4,16,19Nestes pacientes quimiorrefratários, o uso de terapêuticas loco-regionais como a RE com Ítrio-90 (90Y) torna-se relevante para aumentar o tempo livre de progressão de doença e a sobrevida.7 A RE consiste na libertação de microesferas radioactivas (sendo o 90Y a fonte de radiação mais habitual) nos ramos arteriais hepáticos responsáveis pela irrigação tumoral ou nas artérias hepáticas lobares. A posição de administração e atividade são previamente calculados, visando otimizar a dose de radiação tumoral e poupar o tecido hepático).17,18Esta radiação causa necrose, fibrose e diminuição significativa da vascularização tumoral, culminando frequentemente em lesões sem viabilidade.4,5Vários estudos demonstram que a RE melhora a resposta ao tratamento de QT, atrasando a progressão hepática da doença e permitindo que pacientes excessivamente tratados possam ter uma pausa terapêutica sem comprometer a estabilidade da doença, com uma intervenção segura e bem-tolerada.14,18
O papel da RE com 90Y no tratamento de pacientes com mhCCR permanece ainda por esclarecer; para a adequada seleção dos pacientes torna-se imperativo definir o lugar desta intervenção na sequência dos regimes terapêuticos e estabelecer os fatores preditivos de sucesso desta intervenção.2,4,12,19
Este estudo pretende avaliar os outcomes associados à RE com 90Y em doentes com mhCCR irressecáveis e quimiorrefratárias e determinar quais os fatores com impacto no sucesso desta intervenção.
Materiais e Métodos
Desenho do estudo
Foi realizado um estudo populacional, observacional, retrospetivo, analítico-descritivo, de base hospitalar.
Após a aprovação do comité de ética, foram selecionados e incluídos para este estudo todos os doentes com metastização hepática de CCR intervencionados com RE com microesferas 90Y (80% de resina e 20% de vidro) no serviço de Radiologia de Intervenção em articulação com o Serviço de Medicina Nuclear do IPO-Porto, entre janeiro de 2011 até março de 2020.
Atribuiu-se um código único a cada processo clínico analisado, de modo a assegurar o sigilo e a confidencialidade dos doentes. Os dados foram recolhidos através da consulta do processo clínico informatizado de cada doente e do respetivo processo físico. A informação recolhida foi registada e organizada em formato digital com recurso ao Statistical Package for the Social Sciences® (SPSS), versão 25, para o Microsoft® Windows.
Foram colhidas várias informações retrospetivas sobre os pacientes, nomeadamente dados demográficos (idade e sexo); características da doença, como extensão, distribuição e estabilidade tumoral; esquemas terapêuticos prévios à RE; e fatores que possam interferir no prognóstico, tais como invasão linfática e vascular na peça cirúrgica do tumor primário, presença de mutação K-RAS, metástases síncronas ou metácronas (diagnosticadas depois da neoplasia primária) e valores séricos de antigénio carcinoembrionário (CEA) ao diagnóstico, antes, e após a RE. Foram também colhidas informações sobre complicações pós-intervenção, que foram categorizadas pelo sistema de classificação da Common Terminology Criteria for Adverse Events (CTCAE), versão 5.0.21
Critérios de elegibilidade dos pacientes
Foram incluídos todos os pacientes com: idade ≥18anos; adenocarcinoma do cólon ou do reto comprovado histologicamente; metástases hepáticas confirmadas histologicamente e consideradas irressecáveis; ausência de resposta a tratamentos prévios ou sem indicação para outras terapêuticas locais; bom estado funcional (com uma classificação na escala do Eastern Cooperative Oncology Group (ECOG) máxima de dois); critérios de admissão e de elegibilidade para serem sujeitos à RE (funções renal, hepática e hematológica dentro dos parâmetros de elegibilidade para a realização do procedimento de forma segura); follow-up ao longo de um ano com TC de controlo aos três, seis e doze meses ou até ao falecimento do doente. Foram excluídos todos os pacientes com contraindicações para a RE: presença de doença hepática documentada, nomeadamente cirrose classificada como Child-Pugh B ou superior, hipertensão portal, abcessos hepáticos, sarcoidose ou tuberculose hepática; artérias colaterais hepáticas não embolizáveis que pudessem permitir a distribuição extra- hepática das microesferas; shunts hepatopulmonares que excedessem os 20%; ascite grave e gravidez).3,7,8,9,16
Avaliação clínica pré-radioembolização
Todos os pacientes foram considerados para RE por decisão unânime de uma equipa multidisciplinar. Foram recolhidos, antes do procedimento, dados referentes à história clínica, exame físico e análises laboratoriais dos pacientes selecionados (hemograma, aspartato aminotransferase (AST), alanina aminotransferase (ALT), fosfatase alcalina (FA), bilirrubina total (BT) e o marcador tumoral CEA). Os doentes aprovados foram inicialmente sujeitos a work-up, consistindo na realização de uma TC abdominal para avaliação dos achados imagiológicos relacionados com a anatomia hepática e vascular e caracterização das lesões hepáticas para posterior comparação com a TC realizada após o procedimento. Foi também efetuada uma angiografia hepática de forma a avaliar a anatomia vascular do fígado e colaterais,3,8,9,10,12,13,16,19com administração de macro-agregados de albumina com Tecnésio99 para posterior averiguação de shunts gastro-intestinais e hepato- pulmonares através de TC de emissão de fotão único (SPECT).3,7,8,9,10,12,13,16,19
Descrição do procedimento
Os doentes aprovados para tratamento, após work-up e dosimetria adequada, num prazo de uma a três semanas foram submetidos a tratamento. A RE consistiu em obtenção de acesso arterial hepático selectivo, utilizando técnicas de angiografia. Todos os tratamentos foram efetuados num angiógrafo Integris V5000, PHILIPS. Inicialmente foi efetuada punção da artéria femoral (60% dos casos) ou da radial esquerda (40% casos), cateterizada a aorta e efetuada sempre uma aortografia abdominal e uma arteriografia do tronco celíaco. Posteriormente, depois de identificadas as variantes anatómicas da circulação hepática, foi efetuada a seletivação da artéria hepática (direita e/ou esquerda) e/ou seus ramos segmentares, de acordo com a distribuição da doença hepática. A selectivação do local para administração das microesferas foi conseguido com recurso a microcateter. Após confirmação angiográfica da posição correcta do microcateter, a administração das microesferas radioativas foi efetuada utilizando os dispositivos próprios dos fornecedores. As micoresferas utilizadas foram SIR- Spheres® Y-90 de resina da Sirtex Medical (80% dos casos) e TheraSphereTM Y-90 vidro da Boston Scientific (20% dos casos). A confirmação da correta distribuição da atividade foi posteriormente avaliada por SPECT. Todos os tratamentos foram planeados em conjunto pelos Serviços de Radiologia de Intervenção e de Medicina Nuclear. Os médicos de Radiologia de Intervenção que realizaram os procedimentos tinham mais de cinco anos de experiência em Angiografia e técnicas de tratamentos loco- regionais de embolização hepática, bem como formação especifica por centros certificados. A equipa de Medicina Nuclear foi constituída por dois médicos especialistas com competência para esta técnica após formação adequada do manuseamento e cálculo de dosimetria. A atividade libertada variou entre 0,70 Gigabequerel GBq (em caso de administração unilobar) e 2,90 GBq.
Análise estatística
As variáveis contínuas foram representadas sob a forma de média e desvio-padrão (DP) quando a sua distribuição era normal e sob a forma de mediana e amplitude interquartil (AIQ) quando a sua distribuição não era normal. As variáveis categóricas foram representadas através da frequência relativa (%) e absoluta (n). A normalidade da distribuição das variáveis contínuas foi analisada com recurso ao teste Shapiro-Wilk. O sucesso da RE foi definido pela presença de resposta parcial, resposta completa ou doença estável, através de avaliação por tomografia computadorizada aos três, seis e doze meses de seguimento, com base nos critérios Response Evaluation Criteria in Solid Tumours (RECIST 1.1).20 Os testes Qui-quadrado, Fisher’s, teste-t para amostras independentes e Mann-Whitney foram usados para estabelecer associações significativas entre as variáveis recolhidas e o sucesso da RE. A regressão logística binária multivariada foi usada para detetar factores preditivos de sucesso desta técnica. A função de sobrevivência Kaplan- Meier permitiu estudar a sobrevivência mediana após a RE. O teste log-Rank foi usado para estudar diferenças na distribuição de sobrevivência entre doentes com e sem sucesso após a RE. Toda análise estatística foi realizada com recurso ao SPSS, versão 25, com um nível de significância α definido a 0,05.
Resultados
Avaliação descritiva
Este estudo incluiu um total de trinta e dois doentes diagnosticados com mhCCR com doença irressecável e quimiorrefratária, submetidos a RE; dois deles foram excluídos do estudo por não estarem disponíveis dados de análise no follow-up. Assim, foram analisados trinta doentes (n=30); as suas características demográficas e clínicas no momento do diagnóstico estão representadas na Tabela 1. A maioria dos doentes eram do sexo masculino (63,3%; n=19) e a idade média foi de 61,5 anos (mínimo 32 anos e máximo 90 anos). As origens mais frequentes do tumor primário do CCR foram o cólon sigmoide (40,0%; n=12) e o reto (33,3%; n=10). 73,3% (n=22) dos doentes possuía metástases ao diagnóstico (estádio IV). A maioria (76,7%; n=23) apresentava metastização hepática bilobar, tendo sido submetidos a RE bilobar; os restantes (23,3%, n=7) tinham metástases unilobares, tendo sido submetidos a RE unilobar. Todos os pacientes foram submetidos a apenas a uma sessão de RE. 20,0% (n=6) apresentava metástases extra-hepáticas (pulmonares, retroperitoneais, ganglionates supra e infradiafragmáticas e carcinomatose peritoneal). A maioria dos doentes encontrava-se no estadio ECOG 0 (56,7%; n=17).
Tabela 1: Características demográficas, clínicas e laboratoriais no momento do diagnóstico e terapêuticas instituídas previamente à realização de radioembolização.
| Característica | 70.N = 30 |
| Sexo, % (n) | 73.|
| Masculino | 76.63,3 (19) |
| Feminino | 79.36,7 (11) |
| Idade (anos), média +/- DP | 82.61,5 +/- 13,5 |
| Origem primária, % (n) | 85.|
| Cólon sigmoide | 88.40,0 (12) |
| Reto | 91.33,3 (10) |
| Cólon ascendente | 94.16,7 (5) |
| Cólon descendente | 97.6,7 (2) |
| Cólon transverso | 100.3,3 (1) |
| Estádio ao diagnóstico, % (n) | 103.|
| I | 106.0 (0) |
| II | 109.10,0 (3) |
| III | 112.16,7 (5) |
| IV | 115.73,3 (22) |
| Metástases hepáticas ao diagnóstico, % (n) | 118.73,3 (22) |
| Metastização extra-hepática, % (n) | 121.20,0 (6) |
| Níveis de CEA ao diagnóstico, % (n)* | 124.|
| < 20 ng/mL | 127.48,1 (13) |
| ≥ 20 ng/mL | 130.51,9 (14) |
| Mutação K-RAS, % (n)** | 133.56,7 (17) |
| Tempo entre diagnóstico e metastização, % (n) | 136.|
| < 1 ano | 139.73,3 (22) |
| 1 - 2 anos | 142.13,3 (4) |
| > 2 anos | 145.13,3 (4) |
| Resseção cirúrgica da neoplasia primária, % (n) | 148.80,0 (24) |
| Invasão vascular (peça cirúrgica do tumor primário), % (n) | 151.53,3 (16) |
| Invasão linfática ao diagnóstico (peça cirúrgica do tumor primário), % (n) | 154.66,7 (20) |
| ECOG, % (n) | 157.|
| 0 | 160.56,7 (17) |
| 1 | 163.36,7 (11) |
| 2 | 166.6,7 (2) |
| Ablação percutânea prévia, % (n) | 169.16,7 (5) |
| QT sistémica prévia, % (n) | 172.100 (30) |
| 1 esquema | 175.26,67% (8) |
| 2 esquemas | 178.40% (12) |
| ≥ esquemas | 181.33,33% (1) |
| QE prévia, % (n) | 184.6,7 (2) |
| Bevacizumab prévio, % (n) | 187.56,7 (17) |
| Tempo entre o diagnóstico e a RE, % (n) | 190.|
| < 1 ano | 193.13,3 (4) |
| 1 - 2 anos | 196.16,7 (5) |
| > 2 anos | 199.70,0 (21) |
| Metastização hepática, % (n) | 202.|
| Unilobar | 205.23,3 (7) |
| Bilobar | 208.76,7 (23) |
| Estabilidade da doença, % (n) | 211.|
| Estável | 214.30,0 (9) |
| Progressão | 217.70,0 (21) |
| Valores laboratoriais, mediana +/- AIQ | 220.|
| ALT (U/L) | 223.27,0 +/- 36 |
| AST (U/L) | 226.30,0 +/- 24 |
| FA (U/L) | 229.141,0 +/- 121 |
| BT (μmol/L) | 232.10,3 +/- 5 |
| Níveis de CEA pré-RE, % (n) | 235.|
| < 20 ng/mL | 238.43,3 (13) |
| ≥ 20 ng/mL | 241.56,7 (17) |
DP, desvio-padrão; CEA, antigénio carcinoembrionário; ALT, alanina aminotransferase; AST, aspartato aminotransferase; FA, fosfatase alcalina; BT, bilirrubina total; ECOG, Eastern Cooperative Oncology Group; QT, quimioterapia; QE, quimioembolização; RE, radioembolização; N, número de doentes com dados disponíveis; *N=28; **N=27; AIQ, amplitude interquartil.
As características clínicas dos doentes antes e após a realização de RE estão apresentadas nas Tabelas 1 e 2. Todos (n=30) os doentes fizeram esquemas de quimioterapia (QT) prévios à RE, nomeadamente: 26,67% (n=8), 40% (n=12) e 33,33% (n=10) foram submetidos a 1, 2 e 3 ou mais esquemas de QT pré-RE, respectivamente. Após a RE, dois (6,7%) doentes possuíam doença ressecável após a técnica e três (10%) reuniram critérios para ablação percutânea; 70,0% (n=21) realizaram quimioterapia.
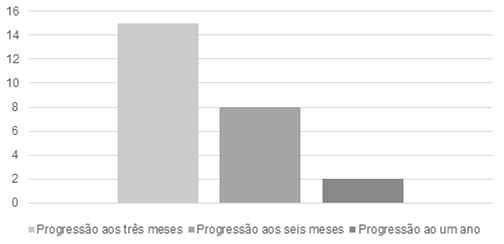
Metade (n=15) dos doentes mostrou progressão imagiológica da doença aos três meses, 26,7% (n=8) aos seis meses e 6,7% (n=2) aos doze meses, estando estes valores representados na Tabela 3 e no Gráfico 1. Cinco pacientes (16,7%) não mostraram progressão da doença até ao final do follow-up. Aos seis meses após a RE a taxa de mortalidade foi de 10,0% (n=3) e de 33,3% (n=10) aos doze meses. Nenhum doente faleceu aos três meses após a RE. O tempo médio de sobrevivência no primeiro ano após a RE foi de 9,0 meses (IC 95%, 8,2-9,8).
Tabela 2: Outcomes clínicos após a realização de radioembolização.
| Característica | 250.|
| Níveis de CEA pós-RE, % (n)* | 253.|
| < 20 ng/mL | 256.50,0 (14) |
| ≥ 20 ng/mL | 259.50,0 (14) |
| Ressecção efetuada, % (n) | 262.6,7 (2) |
| Procedimentos pós-RE, % (n) | 265.|
| QT sistémica | 268.70,0 (21) |
| Ablação percutânea | 271.10,0 (3) |
| Bevacizumab | 274.36,7 (11) |
| QE | 277.3,3 (1) |
CEA, antigénio carcinoembrionário; RE, radioembolização; QT, quimioterapia; QE, quimioembolização; *N (número de doentes com dados disponíveis) = 28.
Tabela 3: Análise descritiva da proporção de pacientes com progressão, doença estável, resposta parcial ou resposta completa após RE, com base na resposta tomográfica aos três meses de seguimento, segundo os critérios RECIST 1.1.
| Avaliação da TC | 283.Aos três meses | 284.Aos seis meses | 285.A um ano |
| Progressão | 288.50,0 (15) | 289.26,7 (8) | 290.6,7 (2) |
| Doença estável | 293.26,7 (8) | 294.16,7 (5) | 295.10,0 (3) |
| Resposta parcial | 298.20,0 (6) | 299.6,7 (2) | 300.3,3 (1) |
| Resposta total | 303.3,3 (1) | 304.0,0 (0) | 305.3,3 (1) |
Complicações
As complicações associadas à RE foram categorizadas de acordo os critérios da classificação CTCAE, v5.0, conforme previamente referido. Foram registadas: dor abdominal (40,0 %; n=12), astenia (36,7%; n=11), náuseas e vómitos (30%; n=9), anorexia (20%; n=6), febre (13,3%; n=4), e alterações dos hábitos intestinais (6,7%; n=2), tratando-se de complicações ligeiras e que não implicaram um aumento da vigilância, nem alteraram o curso normal do período pós-intervenção, sendo categorizadas como grau 1. Foram ainda reportados dois casos (6,7%) de úlcera gástrica induzida por radiação: num caso a sequela foi ligeira e não interferiu nas atividades diárias do paciente, sendo categorizada como grau 2; no outro caso foi necessária antrectomia gástrica para correção da complicação, resultando uma sequela severa, permanente e que limitou gravemente a vida do paciente (tendo sido este o primeiro doente tratado nesta instituição com recurso a esta técnica terapêutica), sendo categorizada como grau 4. Em relação a toxicidade bioquímica, documentou-se hiperbilirrubinemia em 36,7% (n=11), avaliada 1 mês após RE, de grau 1 em seis casos, grau 2 em quatro casos e grau 3 num caso.
Avaliação de fatores preditivos de sucesso
A Tabela 4 compara e associa a presença de determinadas características clínicas e laboratoriais, bem como os outcomes após a RE, com o sucesso da técnica estabelecido com base na avaliação por TC. A presença de um estádio igual ou inferior a 3 (p<0,040) e a ausência de invasão vascular (p=0,028) e linfática (p=0,020) no momento diagnóstico, bem como um tempo livre de metastização superior a um ano desde o diagnóstico (p=0,036) associaram-se de forma significativa ao sucesso da RE. Valores de CEA inferiores a 20 ng/mL no momento do diagnóstico (p=0,035) e após a RE (p=0,023) também foram significativamente associados ao sucesso da RE. Para definir os fatores preditivos de sucesso após a RE, introduzimos as variáveis atrás referidas (que atingiram significância estatística na análise comparativa univariada) num modelo de regressão logística multivariada; contudo, o modelo não foi estatisticamente significativo (X2=0,001; p=1,000) e não permitiu estabelecer preditores de sucesso após a RE.
O tempo médio de sobrevivência dos doentes com sucesso após a RE foi de 9,4 meses (IC 95%, 1,8-17,1) e dos doentes sem sucesso foi de 8,9 meses (IC 95%, 7,5-10,2). A distribuição da sobrevivência (Gráfico 2) não diferiu significativamente entre os grupos (p=0,810).
Discussão
A maioria dos pacientes com um período longo entre o diagnóstico e a RE foram submetidos a múltiplos tratamentos antes e após a RE: todos fizeram esquemas de quimioterapia previamente à RE, estando 70% deles em progressão de doença quando foram selecionados para esta intervenção, por falência dos regimes previamente instituídos. Após a RE, 70% dos pacientes foram orientados para reiniciar a quimioterapia. Assim, tal como noutros estudos, a RE não contraindicou o uso de terapêuticas subsequentes, nomeadamente a reinstituição do regime de quimioterapia após o procedimento.4,7,8
Tabela 4: Análise comparativa das características da amostra com o sucesso da radioembolização.
| Característica | 323.Sucesso da RE 324. 325. | 326. 327. 328.||
| Sim (n=15) | 329.Não (n=15) | 330.Valor P | 331. 332.|
| Sexo, % (n) | 333.334. | 335. | 0,705 | 336. 337.
| Masculino | 338.66,7 (10) | 339.60,0 (9) | 340. 341. 342.|
| Feminino | 343.33,3 (5) | 344.40,0 (6) | 345. 346. 347.|
| Idade (anos), média +/- DP | 348.63,5 +/- 14,1 | 349.59,5 +/- 13,0 | 350.351. 352. |
| Localização primária, % (n) | 353.354. | 355. | 0,569 | 356. 357.
| Cólon sigmoide | 358.26,7 (4) | 359.53,3 (8) | 360. 361. 362.|
| Reto | 363.40,0 (6) | 364.26,7 (4) | 365. 366. 367.|
| Cólon ascendente | 368.20,0 (3) | 369.13,3 (2) | 370. 371. 372.|
| Cólon descendente | 373.6,7 (1) | 374.6,7 (1) | 375. 376. 377.|
| Cólon transverso | 378.6,7 (1) | 379.0,0 (0) | 380. 381. 382.|
| Estádio ao diagnóstico, % (n) | 383.384. | 385. | 0,040* | 386. 387.
| I | 388.0,0 (0) | 389.0,0(0) | 390. 391. 392.|
| II | 393.20,0 (3) | 394.0,0 (0) | 395. 396. 397.|
| III | 398.26,7 (4) | 399.6,7 (1) | 400. 401. 402.|
| IV | 403.53,3 (8) | 404.93,3 (14) | 405. 406. 407.|
| Metástases hepáticas ao diagnóstico, % (n) | 408.53,3 (8) | 409.93,3 (14) | 410.0,013* | 411. 412.
| Metastização extra-hepática, % (n) | 413.20,0 (3) | 414.20,0 (3) | 415.1,000 | 416. 417.
| Mutação K-RAS, % (n) | 418.57,1 (8) | 419.64,3 (9) | 420.0,699 | 421. 422.
| Resseção cirúrgica da neoplasia primária, % (n) | 423.80,0 (12) | 424.80,0 (12) | 425.1,000 | 426. 427.
| Invasão vascular ao diagnóstico, % (n) | 428.33,3 (5) | 429.73,3 (11) | 430.0,028* | 431. 432.
| Invasão linfática ao diagnóstico, % (n) | 433.46,7 (7) | 434.86,7 (13) | 435.0,020* | 436. 437.
| Ablação percutânea prévia, % (n) | 438.13,3 (2) | 439.20,0 (3) | 440.0,624 | 441. 442.
| QT sistémica prévia, % (n) | 443.100 (15) | 444.100 (15) | 445.1,000 | 446. 447.
| QE prévia, % (n) | 448.6,7 (1) | 449.6,7 (1) | 450.1,000 | 451. 452.
| Bevacizumab prévio, % (n) | 453.53,3 (8) | 454.60,0 (9) | 455.0,713 | 456. 457.
| ECOG, % (n) | 458.459. | 460. | 0,510 | 461. 462.
| 0 | 463.46,7 (7) | 464.66,7 (10) | 465. 466. 467.|
| 1 | 468.46,7 (7) | 469.26,7 (4) | 470. 471. 472.|
| 2 | 473.6,7 (1) | 474.6,7 (1) | 475. 476. 477.|
| Tempo entre diagnóstico e metastização, % (n) | 478.479. | 480. | 0,036* | 481. 482.
| < 1 ano | 483.53,3 (8) | 484.93,3 (14) | 485. 486. 487.|
| 1 - 2 anos | 488.20,0 (3) | 489.6,7 (1) | 490. 491. 492.|
| > 2 anos | 493.26,7 (4) | 494.0,0 (0) | 495. 496. 497.|
| Tempo entre diagnóstico e a RE, % (n) | 498.499. | 500. | 0,536 | 501. 502.
| < 1 ano | 503.20,0 (3) | 504.6,7 (1) | 505. 506. 507.|
| 1 - 2 anos | 508.13,3 (2) | 509.20,0 (3) | 510. 511. 512.|
| > 2 anos | 513.66,7 (10) | 514.73,3 (11) | 515. 516. 517.|
| Estabilidade da doença, % (n) | 518.519. | 520. | 0,690 | 521. 522.
| Estável | 523.33,3 (5) | 524.26,7 (4) | 525. 526. 527.|
| Progressão | 528.66,7 (10) | 529.73,3 (11) | 530. 531. 532.|
| Níveis de CEA ao diagnóstico, % (n) | 533.534. | 535. | 0,035* | 536. 537.
| < 20 ng/mL | 538.60,0 (9) | 539.26,7 (4) | 540. 541. 542.|
| ≥ 20 ng/mL | 543.26,7 (4) | 544.66,7 (10) | 545. 546. 547.|
| Níveis de CEA pré-RE, % (n) | 548.549. | 550. | 551. 0,269 | 552. 553. 554.
| < 20 ng/mL | 555.53,3 (8) | 556.33,3 (5) | 557. 558. 559.|
| ≥20 ng/mL | 560.46,7 (7) | 561.66,7 (10) | 562. 563. 564.|
| Níveis de CEA pós-RE, % (n) | 565.566. | 567. | 0,023* | 568. 569.
| < 20 ng/mL | 570.66,7 (10) | 571.26,7 (4) | 572. 573. 574.|
| ≥20 ng/mL | 575.26,7 (4) | 576.66,7 (10) | |
RE, radioembolização; DP, desvio-padrão; CEA, antigénio carcinoembrionário; ECOG, Eastern Cooperative Oncology Group; QT, quimioterapia; QE, quimioembolização. *Valor P≤0,05, indicando características associadas ao sucesso a RE.
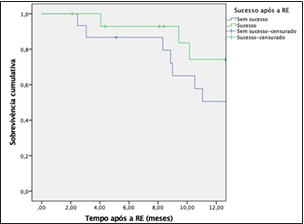
Gráfico 2: Tempo médio de sobrevivência através da função Kaplan- Meier para doentes com e sem sucesso após a radioembolização. O seguimento dos pacientes foi efetuado ao longo de 12 meses. O tempo médio de sobrevivência dos doentes com sucesso após a radioembolização foi de 9,4 meses e dos doentes sem sucesso foi de 8,9 meses. A distribuição do tempo médio de sobrevivência não diferiu significativamente entre grupos (p=0,810). RE, radioembolização.
A redução dimensional das metástases hepáticas para posterior ablação percutânea ou ressecção cirúrgica das mesmas foi notada em três e dois pacientes, respetivamente, compreendendo uma percentagem de 10 e 6,7%, respetivamente, e de 16,7% no total dos procedimentos, semelhante à reportada noutros estudos.3,7
Metade dos pacientes deste estudo mostraram progressão de doença na TC de controlo aos três meses. No entanto, avaliar o sucesso da técnica apenas pelo comportamento da doença na TC pode não ser o método mais fiável, dado que a escala RECIST 1.1 utilizada avalia a progressão de doença apenas pela diferença do tamanho das lesões antes e após a RE, não considerando o facto de que é usual a presença de edema, necrose ou hemorragia peritumoral.3,8,16,18Assim, o aumento do tamanho das lesões pode falsear os resultados e definir como progressão uma doença que se encontra estável.3,8,16,18Desta forma, sugere-se que, em estudos futuros, na definição de resposta à RE sejam incluídos não só estudos por TC, mas também estudos de avaliação da resposta metabólica, como uma tomografia por emissão de positrões (PET-TC), tal como é sugerido por vários autores.3,8,18
A análise estatística da relação entre os vários parâmetros e o sucesso da RE (com base na avaliação por TC, segundo critérios RECIST 1.1), permitiu apontar eventuais fatores preditores de sucesso desta terapêutica. Assim, na amostragem em análise, um estádio inferior ou igual a três ao diagnóstico, a ausência de invasão vascular e linfática, valores laboratoriais de CEA inferiores a 20 ng/mL e um tempo até à metastização igual ou superior a 1 ano foram variáveis clínicas associadas ao sucesso da intervenção. Também se verificou que doentes com posterior confirmação de sucesso da RE apresentaram níveis de CEA inferiores a 20 ng/mL. É de reportar, de igual forma, que outros estudos já tinham estabelecido uma relação entre a eficácia da RE e os níveis de CEA, invasão linfática e presença de metástases ao diagnóstico.3,12,18,19No entanto, apesar destes resultados promissores, quando introduzidas num modelo de regressão logística multivariada, as variáveis não foram estatisticamente significativas para serem consideradas como preditores de sucesso da RE. O pequeno número de pacientes avaliados e as suas mortes precoces tiveram um grande impacto na análise multivariada dos potenciais fatores de prognóstico. Pretende-se assim atualizar estes dados em coortes maiores, com períodos de seguimento mais longos para avaliar o impacto destes fatores na sobrevida da população e o papel que poderão ter no auxílio da seleção de doentes para esta intervenção. Está descrita que a sobrevida média para pacientes com metastização hepática de CCR (mhCCR) é cerca de 30 meses2,9,13sob esquemas de quimioterapia crónicos e que a doença não tratada tem uma sobrevida média de 6 a 12 meses.4,9
O tempo médio de sobrevivência dos doentes com sucesso após a radioembolização foi de 9,4 meses e dos doentes sem sucesso foi de 8,9 meses. Apesar de não se verificar diferenças estatisticamente significativas entre os grupos (p=0,810), os valores obtidos foram observados resultados semelhantes a outros estudos publicados sobre a RE na população em estudo. Em estudos retrospetivos, semelhantes a este, Kennedy et al.14 descreveu uma sobrevida média de 9,6 meses em pacientes com múltiplos regimes de quimioterapia; Jakobs et al.10 10,5 meses; e Martin et al.18 8,9 meses. Em estudos prospetivos, Hendlisz et al.8 compararam pacientes com esquemas de RE adicionados a quimioterapia e pacientes com regimes constituídos unicamente por quimioterapia e obtiveram 10 meses de sobrevida com RE vs 7,3 meses sem RE. Bester et al.7 e Seidensticker et al.16 desenvolveram estudos entre pacientes que foram submetidos a RE e um grupo de controlo gerido com o melhor cuidado paliativo possível (MCPP). No primeiro, foi descrito uma sobrevida de 11,9 meses com RE vs. 6,6 meses para doentes com MCPP e, no segundo, 8,3 meses com RE vs. 3,5 meses com MCPP. A RE foi, no geral, bem-tolerada. A taxa de complicações e toxicidade é consistente com outros estudos previamente publicados e foram, na sua maioria, sintomas ligeiros, facilmente geridos e reversíveis com tratamento de suporte. Não se registou qualquer morte associada à RE nos primeiros três meses após a intervenção e, as mortes registadas subsequentemente até ao final do seguimento foram relacionadas com a progressão da doença. Apenas dois doentes (6,7%) tiveram uma complicação grave, a úlcera gástrica induzida por RE; esta incidência é também semelhante à encontrada na literatura.7
As limitações deste estudo relacionam-se com o número
de pacientes intervencionados com este tipo de tumor e a sua natureza retrospetiva (dado que esta população é muito específica e reduzida), bem como com o facto de ter sido efetuado seguimento de apenas um ano. A ausência de grupos de controlo para comparar a magnitude do efeito da RE (vs ausência de RE vs quimioterapia) é outra limitação a assinalar. A definição de vários grupos, com diferentes associações terapêuticas, poderia auxiliar a estabelecer o possível papel da RE na escalada terapêutica das mhCCR. No entanto, devido ao mau prognóstico associado a esta patologia, a realização de tais estudos torna-se difícil.
Em suma, a RE é uma terapêutica bem-tolerada, com resultados objectivos em metade dos doentes tratados e com um aumento não significativo do tempo de sobrevivência dos doentes. Existem factores de prognóstico de resposta à RE que foram identificados e que podem ajudar a selecionar melhor os doentes a tratar. A introdução desta técnica numa fase mais precoce do tratamento oncológico destes doentes, poderia levar a resultados mais promissores, nomeadamente na redução da sobrevida livre de progressão a nível hepático.5





![Tomografia por Emissão de Positrões com [18F]-FDG e Diabetes Mellitus - Protocolo de Abordagem](/img/pt/next.gif)