INTRODUÇÃO
Nos últimos anos, tem-se verificado uma maior preocupação por parte da população em adotar estilos de vida saudáveis, conduzindo à maior procura de suplementos alimentares (SA), que contribuem para a manutenção do seu estado de saúde. No entanto, os SA diferem dos medicamentos, não podendo alegar menções profiláticas ou de tratamento de sintomas ou patologias e não estão abrangidos pela legislação que regulamenta os medicamentos (1).
Os SA definem-se como géneros alimentícios que se destinam a complementar e ou suplementar o regime alimentar normal e que constituem fontes concentradas de determinadas substâncias nutrientes ou outras com efeito nutricional ou fisiológico, estremes ou combinadas, comercializadas em forma doseada, tais como cápsulas, pastilhas, comprimidos, pílulas e outras formas semelhantes, saquetas de pó, ampolas de líquido, frascos com conta- gotas e outras formas similares de líquidos ou pós que se destinam a ser tomados em unidades medidas de quantidade reduzida (1).
Apesar de poderem conter na sua composição diversos ingredientes, a legislação europeia ainda só harmonizou as vitaminas e os minerais que podem estar presentes nos SA, respetivas formas em que podem ser adicionados e valores de referência do nutriente (VRN) (1-3). Estes produtos não estão sujeitos a um controlo por parte do INFARMED, já que o organismo responsável pelos mesmos é a Direção Geral de Alimentação e Veterinária (DGAV). Assim, segundo o Decreto- Lei (DL) n.º 136/2003, alterado e rescrito pelo DL n.º 118/2015, de 23 de junho, para colocar um SA no mercado português apenas é exigida uma notificação à DGAV, do rótulo, bem como o preenchimento de um formulário que atesta que o operador responsável pela colocação do produto no mercado conhece o produto e reconhece a sua legislação base e enquadramento legal (1, 4).
Vários estudos têm sido realizados para caracterizar a população consumidora de SA e todos eles observam elevadas percentagens de consumo (5, 6). Num estudo realizado à população portuguesa, em 2018, dois milhões e 259 mil indivíduos referiram ter consumido vitaminas e/ou outros suplementos nos últimos 12 meses, representando 26,4% dos residentes no Continente com 15 e mais anos. Esta percentagem tem vindo a aumentar desde 2013, quando o consumo de SA representava 13,0% (7). Para além disso, a maioria dos consumidores acredita que, por se tratarem de produtos naturais, os SA são isentos de riscos, não dando conhecimento ao médico do seu consumo (5). Assim, apesar do seu uso ser seguro, quando feito de forma adequada, os SA, em particular os que contêm plantas, podem acarretar riscos, principalmente se utilizados de forma indiscriminada ou excessiva (8). Problemas como contaminações (ex.: metais pesados, pesticidas, microorganismos), ou incorreção na identificação de espécies podem acontecer. A presença dos SA em diversos canais de venda (ex.: farmácias, hipermercados, lojas de dietética, online) pode dar aos consumidores uma falsa sensação de segurança, não havendo em muitos destes locais a presença de um profissional de saúde qualificado para o aconselhamento. Por último, fatores diretamente relacionados com o consumidor (ex.: idade, funcionamento hepático e/ou renal) podem alterar o perfil de risco/benefício de utilização de um SA (9).
Por esse motivo, torna-se importante analisar as informações presentes no rótulo de um SA, que podem orientar o consumidor para um uso correto do mesmo. Informações essas que muitas vezes estão ausentes, como as precauções de uso (ex.: algumas plantas não são seguras em pessoas com doença pré-existente); interações com medicamentos; e reações adversas (10).
Os SA utilizados a nível do Sistema Nervoso Central são muito procurados atualmente, uma vez que, por exemplo, a performance cognitiva tornou-se um importante problema de saúde pública (11). Para além disso, o envelhecimento da população está relacionado com o aumento da prevalência de problemas como ansiedade, insónia e depressão (12). As plantas medicinais que atuam para alguns dos problemas encontram-se entre as mais utilizadas na Europa, como a valeriana (Valeriana officinalis), a camomila (Matricaria recutita), a erva-cidreira (Melissa officinalis) e o hipericão (Hypericum perforatum) (13).
OBJETIVOS
Analisar, do ponto de vista legal e científico, a informação disponibilizada na rotulagem de SA à base de plantas, comercializados em Farmácias Comunitárias e Ervanárias/Lojas Dietéticas, para alguns problemas do Sistema Nervoso Central (ansiedade, perturbações do sono e depressão).
METODOLOGIA
Estudo observacional, descritivo, transversal, onde as Farmácias Comunitárias e Ervanárias/Lojas Dietéticas de Vila Nova de Famalicão foram contactadas de forma a obter o seu consentimento para participação no estudo. Foram visitadas 5 Farmácias Comunitárias e 3 Ervanárias/Lojas Dietética, entre os meses de julho e agosto de 2019, para proceder à recolha da rotulagem dos SA que cumpriam os seguintes critérios de inclusão: terem informações na embalagem sobre o uso para situações de ansiedade, perturbações do sono, e depressão (ex.: através de alegações de saúde); terem na lista de ingredientes plantas medicinais descritas na literatura para uso nas situações a estudar; SA comercializados nas várias formas doseadas tal como descrito no DL n.º 136/2003. Excluíram-se do estudo SA repetidos, e apenas com vitaminas e minerais na sua composição.
Obteve-se uma amostra de 44 SA, tendo a recolha das informações presentes na rotulagem sido realizada em formulário próprio (Tabela 1). O formulário integra itens como: identificação do SA; avaliação da conformidade com o DL n.º 136/2003, de 28 de junho, que transpôs a Diretiva n.º 2002/46/CE, alterado e rescrito pelo DL n.º 118/2015, de 23 de junho (nomeadamente, o artigo 6.º - Rotulagem) e avaliação da presença de outras informações científicas que possam auxiliar no aconselhamento/decisão de compra do SA. Os dados obtidos foram analisados recorrendo ao software informático SPSS® versão 26.0.
RESULTADOS
A amostra em estudo é constituída por 44 SA à base de plantas utilizados em situações de ansiedade, perturbações do sono e depressão. Desses 44 SA, 12 foram recolhidos em 5 farmácias comunitárias (27,3%) e
32 recolhidos em 3 ervanárias/lojas dietética (72,7%). Verificou-se que 43,2% dos SA analisados são constituídos apenas por uma planta e 56,8% contêm misturas de plantas na composição. As plantas presentes nos SA encontram-se assinaladas na Tabela 2. A planta mais utilizada nos SA recolhidos para situações de depressão é a rodiola (Rhodiola rosea); e, nas situações de ansiedade e perturbações do sono, são a passiflora (Passiflora incarnata) e a valeriana. A valeriana surge em maior número nos SA com misturas de outras plantas medicinais. A informação sobre a forma galénica (forma de apresentação) do SA está presente em todos os rótulos analisados, sendo que as cápsulas, comprimidos e soluções orais, surgiram num maior número de produtos, em 34,1%, 31,8% e 25,0%, respetivamente.
Relativamente à análise das menções obrigatórias nos rótulos (Artigo 6.º- Rotulagem), segundo o DL nº 136/2003, de 28 de junho, alterado e republicado pelo DL n.º 118/2015, de 23 de junho, verificou-se o total cumprimento da legislação para os itens Denominação “Suplemento Alimentar”, Composição do SA e Toma Diária Recomendada do SA. Para os restantes itens (Não Exceder a Toma Diária Recomendada, Não Substitui um Regime Alimentar Variado e Guardar Fora do Alcance das Crianças), verificou-se uma taxa de incumprimento de 4,5%, ou seja dois SA.
No que diz respeito a outras informações que, não sendo obrigatórias, podem auxiliar o profissional de saúde no aconselhamento do SA ou informar melhor o consumidor sobre a sua escolha, as rotulagens dos 44 SA recolhidos foram analisadas face à presença de 9 parâmetros, relacionados com o ponto de vista científico, em particular com a segurança dos SA (ex.: reações adversas; interações; contradindicações, aconselhamento, gravidez/amamentação, entre outros) (Tabela 3). Os itens foram divididos em três categorias: itens em que a presença da informação é superior à ausência (>70%); itens em que a presença e a ausência são equivalentes (45 a 65%); e itens em que a presença é inferior à ausência (< 30%).
Os itens em que a presença é superior à ausência são: o Nome Científico (97,7%); e Parte da Planta (79,5%). Os itens em que a presença e a ausência são equivalentes são: as Contraindicações (61,4%); Indicações/ Efeitos do SA (52,3%); e Gravidez e/ou Amamentação (50,0%). Por fim, os itens em que a presença é inferior à ausência são: a Padronização dos Extratos (29,5%); as Informações Extra de Aconselhamento (15,9%); as Interações (11,4%); e as Reações Adversas (11,4%) (Tabela 3).
Tabela 1: Formulário de Recolha da Informação Disponibilizada na Rotulagem de Suplementos Alimentares à Base de Plantas
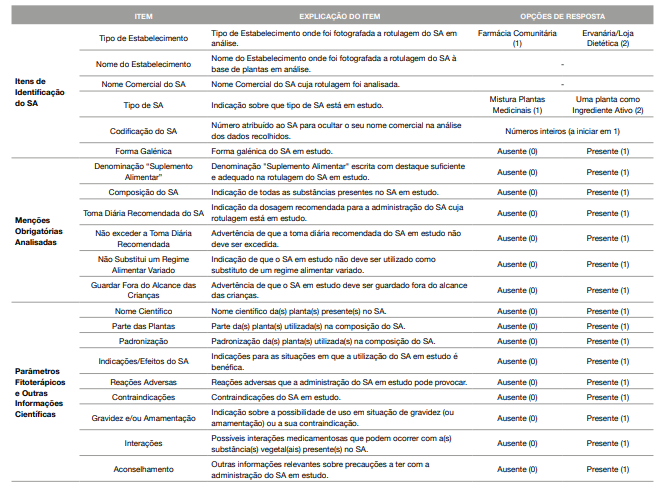
SA: Suplemento Alimentar
Tabela 2: Plantas Medicinais encontradas nos 44 Suplementos Alimentares recolhido
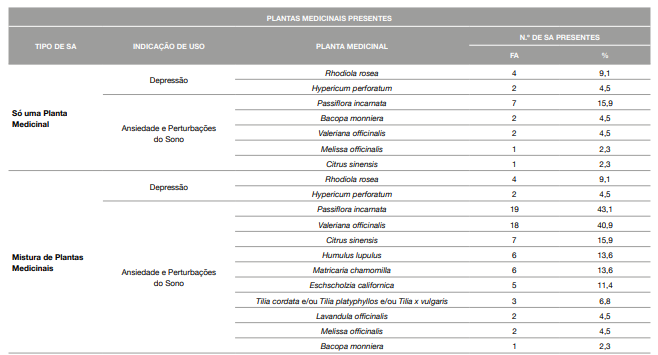
%: Percentagem
FA: Frequência Absoluta
SA: Suplemento Alimenta
Tabela 3: Presença ou ausência dos 9 parâmetros fitoterápicos ou informações científicas na rotulagem dos Suplementos Alimentares à base de plantas
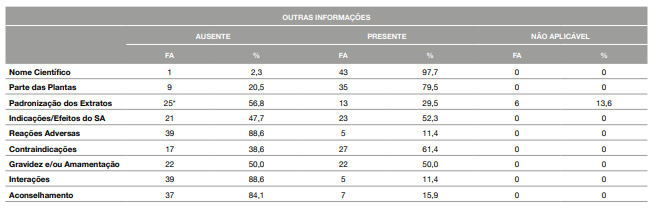
*Foram incluídos na categoria de Ausente, 4 SA que continham na sua composição misturas de plantas, em que umas apareciam como extratos e outras não.
%: Percentagem
FA: Frequência Absoluta
SA: Suplemento Alimenta
DISCUSSÃO DOS RESULTADOS
Apesar dos estudos existentes sobre SA, pouca atenção tem sido dada aos desafios de regulamentação destes produtos (14). A falta de harmonização entre países e o tipo de informação a colocar nos rótulos dos SA têm sido alvo de discussão, por exemplo, no Canadá, em que 71% da população reporta usar produtos naturais (que incluem vitaminas, minerais, produtos fitoterápicos, produtos de Homeopatia e de outras Medicinas Tradicionais, probióticos, prebióticos e outros produtos como enzimas, aminoácidos e ácidos gordos) (15). Neste país, foram implementadas medidas regulamentares que exigem a inclusão de mais informações na cartonagem dos produtos, incluindo potenciais interações e reações adversas (16).
A rotulagem dos SA deve obedecer ao estabelecido no DL n.º 136/2003, de 28 de junho, que transpôs a Diretiva n.º 2002/46/CE, alterado e republicado pelo Decreto-Lei n.º 118/2015, de 23 de junho e no Regulamento (UE) n.º 1169/2011, do Parlamento Europeu e do Conselho, de 25 de outubro e suas alterações, relativo à informação ao consumidor sobre os géneros alimentícios. O Regulamento (UE) nº1169/2011 estabelece a base para garantir um elevado nível de defesa do consumidor no que se refere à informação sobre os géneros alimentícios. Assim, analisando os resultados obtidos sobre a presença das menções obrigatórias analisadas, verifica-se a ausência de 3 itens em 2 SA, que pertencem ao mesmo laboratório e foram ambos recolhidos em ervanárias/lojas dietéticas, o que pode indicar um maior cuidado por parte das farmácias com os laboratórios que as fornecem. Relativamente à questão das misturas de plantas medicinais, verificou-se que 56,8% dos SA analisados combinavam vários ingredientes ativos de origem vegetal. No entanto, não existem estudos que avaliem a eficácia e segurança da maioria das associações de plantas medicinais comercializadas. Para além disso, a inclusão de várias plantas no mesmo SA dificulta a avaliação da contribuição individual que cada uma pode ter na ocorrência de potenciais interações, não estando excluída a hipótese de as próprias plantas que compõem a mistura interagirem entre si. Em relação aos itens em que a presença foi superior à ausência, verificam-se percentagens elevadas de informações como o nome científico, que é um requisito essencial para a identificação da espécie vegetal e deve estar escrito de forma correta; e a indicação da parte da planta utilizada, visto que a presença e concentração dos compostos bioativos pode variar consideravelmente com este parâmetro (17).
No que diz respeito aos itens em que a presença e ausência são equivalentes, é de salientar que os 61,4% de presença de informação sobre contraindicações podem ser enganadores, pois 11 dos 27 SA que continham esta informação apenas referiam “Hipersensibilidade a um dos componentes”. A título de exemplo, 7 desses 11 SA tinham na sua composição valeriana e, por esse motivo, poderiam também ter referido a contraindicação a crianças menores de 12 anos (18). A presença de “Indicações/Efeitos do SA” ocorreu em 52,3% dos SA, o que demonstra que os laboratórios têm adotado outras estratégias para esse item, por exemplo, o nome comercial dado ao SA, as imagens, as alegações de saúde, ou até as próprias cores da embalagem. Importa realçar que estas alegações de saúde implicam uma relação entre uma categoria de alimentos, um alimento ou um dos seus constituintes (nutriente ou outra substância) e um determinado efeito benéfico na saúde. O Regulamento (CE) n.º 1924/2006 de 20 de Dezembro é aplicável às alegações nutricionais e de saúde sobre os alimentos feitas em comunicações comerciais, quer na rotulagem, quer na apresentação ou na publicidade dos alimentos a fornecer como tais ao consumidor final. Desta forma, só podem ser utilizadas as alegações autorizadas; que cumpram as condições de uso da alegação; e que cumpram as disposições presentes no Regulamento (CE) n.º 1924/2006 de 20 de Dezembro. Entre outros princípios gerais, as alegações não devem ser falsas, ambíguas ou enganosas; incentivar ou justificar o consumo excessivo de um dado alimento; nem suscitar dúvidas acerca da segurança e/ou da adequação nutricional de outros alimentos. Para além disso, não podem referir alterações das funções orgânicas que possam suscitar receios no consumidor ou explorar esses receios, quer textualmente, quer através de representações pictóricas, gráficas ou simbólicas. Neste estudo, todas as alegações encontradas relativas a vitaminas do complexo B, magnésio, melatonina, etc. estavam autorizadas. No caso das plantas, é possível manter algumas alegações de saúde na rotulagem, desde que não se referirem à saúde e desenvolvimento das crianças, ou à redução de risco de uma doença; terem sido submetidas à EFSA (Autoridade Europeia de Segurança Alimentar) em tempo oportuno (antes de 2009), e não terem sido rejeitadas. Também nas alegações encontradas relativas a plantas não se verificaram alegações exageradas que por vezes são descritas em estudos semelhantes (19). Outro dado observado é a ausência da informação, em metade dos SA analisados, de que a utilização do SA não está recomendado a grávidas e/ou lactantes. De salientar que 9 dos 22 SA que não continham essa informação têm na composição passiflora que pode estimular a contração uterina e, por esse motivo, está contraindicada a grávidas (20).
Os itens em que a presença é inferior à ausência dizem respeito a dados cuja ausência também é mencionada noutros estudos (10,19), como a padronização dos extratos, que está relacionada com a qualidade do SA, pois só com extratos padronizados é que é possível assegurar que o teor dos compostos bioativos é ajustado a valores previamente definidos, controlando os vários fatores que influenciam a sua concentração e garatindo assim uma concentração mínima desses compostos (17). Os 13,6% de SA em que se refere que o parâmetro da padronização não é aplicável dizem respeito a suplementos, cuja rotulagem não mencionava a utilização de extratos e, consequentemente, não podiam indicar essa informação. Outros itens em que a presença é inferior à ausência são: as informações extra de aconselhamento, por exemplo, de precauções especiais de uso dos SA; as interações, cuja presença é importante pois se os consumidores não reportam a utilização de SA ao profissional de saúde, a ocorrência de interações entre os SA e a medicação prescrita é provável (21); e as reações adversas, descritas na literatura como maioritariamente leves, tais como, dores de cabeça, náuseas ou fadiga (21).
O estudo possui limitações, principalmente no que diz respeito à amostra, que não permite efetuar inferências para um contexto nacional. Além disso, a escassez de trabalhos semelhantes limitou a discussão com outros estudos. Quanto a perspetivas futuras, seria interessante alargar a análise da rotulagem a outros locais de venda, tais como, hipermercados e websites de venda online, de forma a comparar os resultados obtidos; e alargar a análise a outros ingredientes ativos presentes nos SA, por exemplo, vitaminas e minerais.
CONCLUSÕES
Com este trabalho, conclui-se que a maioria dos SA cumpre os requisitos legais analisados, nomeadamente, quanto ao artigo 6º - Rotulagem, descrito no DL que regulamenta os suplementos. Verificou-se ainda a ausência de informações na rotulagem, que podem influenciar uma escolha informada do consumidor e um uso seguro dos produtos. Uma das regras mais importantes em rotulagem alimentar é que o consumidor não seja induzido em erro. Porém, não sendo muitas das informações obrigatórias na rotulagem, uma vez que se tratam de géneros alimentícios, é importante que tanto a população no geral, como os profissionais de saúde estejam informados quando ao uso de SA. Importa refletir sobre a necessidade de harmonização entre países quanto às informações a colocar nos SA, sempre com vista à segurança e qualidade do produto. É necessário igualmente um trabalho permanente em equipa, quer da entidade fiscalizadora em Portugal (ASAE), quer da entidade regulamentadora (DGAV), que se justifica pelo grande número de SA que entram diariamente no mercado.














