INTRODUÇÃO
O ácido aristolóquico (AA) é um composto natural tóxico (1-3), proveniente da família de uma herbácea perene, Aristolochiaceae, que inclui mais de 500 espécies (4) como Aristolochia manshuriensis, Aristolochia fangchi, Radix Aristolochiae, Aristolochiae fructus, Aristolochiae herba, Asari radix et rizoma. No entanto, o AA encontra-se mais abundantemente nas espécies Aristolochia e Asarum (5-8). Este pertence à família de ácidos nitrofenantrol carboxílicos (7, 9, 10) e é uma mistura de dois ácidos estruturalmente semelhantes: ácido 8-metoxi-6-nitro-fenanidro- (3,4-d) -1,3-dioxolo-5-carboxílico (AAI) e o ácido 6-nitro-fenanidro- (3,4-d) -1,3-dioxolo-5-carboxílico (AAII) (11-15).
As espécies que contém AA são utilizadas há mais de 2000 mil anos, essencialmente na medicina tradicional chinesa (4,14). Todas as partes da planta são utilizadas na preparação de ervas medicinais, incluindo raízes, caules e as folhas (9), tendo estas fins terapêuticos antimicrobianos, anti-inflamatórios, antineoplásicos, comummente utilizados no tratamento de picadas de cobras, doenças como eczema, arterite, gota (2, 5, 11, 14, 16), problemasginecológicos e obstetrícia (12, 14, 16, 17). De fato, o seu primeiro uso na obstetrícia para estimular a expulsão da placenta, durante o parto, foi responsável pelo nome “Aristos lokos” ou “excelente entrega” (4). Contudo, o efeito deste composto pode variar de relativamente benigno a significativamente tóxico consoante a dosagem (11). O seu efeito tóxico começou a ser estudado quando nos meados dos anos 90, um grupo de aproximadamente 100 mulheres belgas saudáveis desenvolveu rapidamente insuficiência renal após a toma de um suplemento alimentar para perda de peso, contendo AA (10, 18). Foi ainda verificado que uma única dose alta ou a administração contínua de uma dose baixa de AA pode levar a uma reação tóxica (5), uma vez que a sensibilidade de cada indivíduo ao tóxico depende de fatores como a via de administração, características da planta ou parte utilizada (22), quantidade ingerida (23), bem como género, idade, fatores genéticos e atividade das enzimas responsáveis pela catalisação da biotransformação desta substância e os aspetos que as influenciam do mesmo (5, 9).
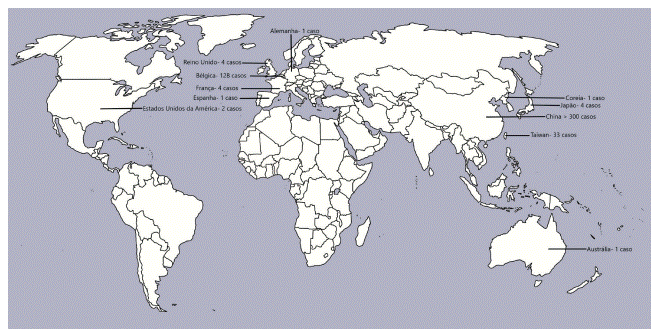
A nefropatia por ácido aristolóquico (AAN) é um termo usado que inclui qualquer forma de nefropatia intersticial tóxica causada por AA (4, 9, 11, 15). Semelhante a esta patologia ocorre também a nefropatia endémica nos Balcãs (BEN) (4, 11), sendo esta derivada de intoxicação alimentar crónica por AA, não apenas através de ervas ou dietas, mas também através de alimentos e água potável contaminados com este composto (10). Ambas as patologias têm alta associação à ocorrência de carcinoma urotelial do trato urinário superior (UTUC) (2-4, 9, 11, 19, 20). Em 2002, o AA foi classificado como carcinogénico do grupo I pela International Agency for Research on Cancer (IARC) (2, 7, 9, 10, 14). Em 2008 a prevalência de AAN registada a nível mundial contava com 128 casos na Bélgica, 4 na França, 4 no Reino Unido, 1 na Espanha, 1 na Alemanha, 2 nos Estados Unidos da América, 1 na Coreia, 6 no Japão, 116 na China e 33 em Taiwan (21). Posteriormente, em 2017 foi publicada uma revisão da literatura na qual foram reunidos todos os casos conhecidos de intoxicação por AA desde 1993 a 2013 (9). Todos os dados de prevalência encontrados apresentam-se compilados na Figura 1, não existindo registo de casos ocorridos em Portugal.
Neste sentido, pretende-se com este artigo rever as formas de exposição do AA, a sua metabolização e efeitos genotoxicos e carcinogénicos com breve referência aos conhecimentos sobre dose-resposta.
Formas de Exposição ao Ácido Aristolóquico
O ácido aristolóquico proveniente de plantas da família Aristolochia, além de presente em preparações terapêuticas da medicina chinesa e suplementos alimentares adquiridos via internet, poderá também ser encontrado na água subterrânea e ainda em vários alimentos por via de contaminação, tais como grãos de milho e trigo (2, 4, 7, 9, 10, 18). Neste último caso, a contaminação pode ocorrer através do solo, uma vez que os AAs são termicamente estáveis, não fotossensíveis e resistentes à degradação total pelas bactérias do solo, logo persistem no solo e são absorvidos pelas plantas circundantes através da absorção pelas raízes, acumulando-se e contaminando os seus grãos (4, 7, 10) ou pela mistura de sementes de Aristolochia com estes grãos (9, 11). Ambas as formas levam à contaminação do pão, uma vez que o mesmo é preparado a partir de farinha derivada dos grãos contaminados, entrando assim na cadeia alimentar humana (9, 18). O AA foi descrito como altamente persistente no metabolismo das células vegetais e está presente em produtos alimentícios por um longo período (9).
Processo de Metabolização do Ácido Aristolóquico
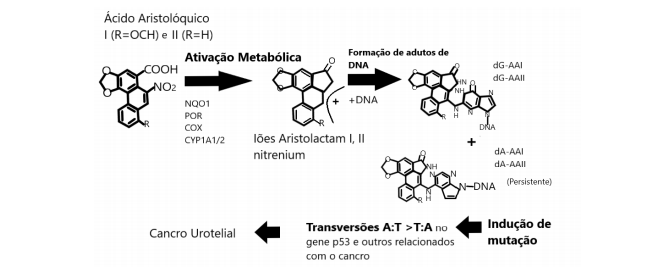
Todas as exposições humanas conhecidas ao AA resultaram da ingestão oral (9). Após ingerido é absorvido no trato gastrointestinal e distribuído por todo o corpo (1, 9). O ácido aristolóquico é transformado em N-hidroxiaristolactam (AL-NOHs) por meio da reação de nitrorredução, isto é redução parcial do grupo nitro (-NO2 que nas estruturas de AA desempenha um papel importante na mutagenicidade observada no DNA) (10) acompanhada do fecho do anel (1, 2, 4, 20). Posteriormente é convertido em intermediários reativos, aristolactam- nitrenium, que são iões cíclicos eletrofílicos com cargas positivas deslocalizadas. Esta reação ocorre através da atividade das enzimas citosólicas e microssomais como citocromo P450 (CYP) 1A1, CYP1A2,
NAD (P) H, quinona oxidoredutase (NQO1) e xantina oxidase (1, 4, 20). Durante este processo e em conduções aeróbicas, o constituinte AAI é desmetilado em AAIa e depois reduzido a aristolactam Ia (Figura 2), enquanto que o constituinte AAII é reduzido apenas em condições anaeróbicas a aristolactam II (11).
Por fim, as formas de redução de AAI e AAII ligam-se preferencialmente aos grupos amina exocíclicos de bases purinas no DNA para formar adutos de AA-DNA, que são responsáveis por transversões de A > T que podem bloquear a transcrição e replicação do DNA no gene supressor de tumor p53 (11). Este processo leva à paragem do ciclo celular e à apoptose (20), provocando doença renal e cancro (1, 2, 18). Após a etapa de metabolização dos metabolitos AA (aristolactam I e aristolactam II), descobriu-se que os adutos de RNA e AA são excretados na urina e nas fezes, contudo existe também acumulação nos tecidos alvo (9) (Figura 3).
Sabe-se ainda que nem todos os pacientes com adutos de DNA derivado do ácido aristolóquico apresentam mutações no gene P53. Isso indica que a mutagenicidade induzida por Aristolochia não se deve apenas à formação de adutos de DNA. Portanto, outros mecanismos podem estar envolvidos ou outros agentes genotoxicos podem estar presentes na planta (20).
Alguns desses mecanismos genotoxicos poderão ser o aumento significativo dos níveis de óxido nítrico (NO), o aumento na concentração intracelular de Ca2+ (24) das células tubulares renais que leva à formação de espécies reativas de oxigênio ou a indução da autofagia dependente do gene 5, que promove a apoptose das células tubulares renais, embora seja uma hipótese controversa, uma vez que estudos sugerem que a autofagia induzida pelo ácido aristolóquico I pode atenuar a apoptose (20).
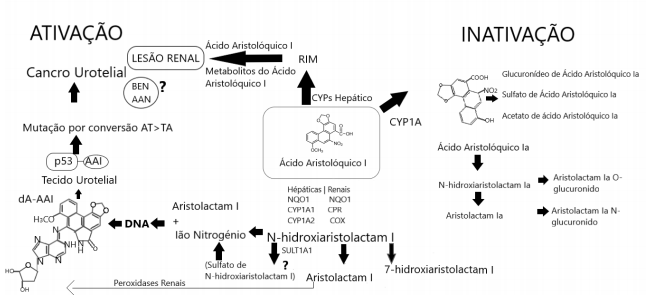
Figura 2 Via proposta para ativação metabólica e desintoxicação do ácido aristolóquico I (AAI), levando a lesão renal e urotelial
Efeitos Adversos e Manifestações Clínicas Provenientes da Ingestão de Ácido Aristolóquico
O termo "nefropatia por ácido aristolóquico" (AAN) é usado para incluir qualquer forma de nefropatia intersticial (13), podendo ser acompanhada por carcinoma urotelial do trato superior (UTUC) em quase metade dos casos (2, 6, 11, 15), causada pela ingestão de plantas contendo ácidos aristolóquicos (AA) (9, 10, 15). Esta insuficiência é caracterizada por fibrose intersticial extensa com atrofia, perda de túbulos e hiperplasia do urotélio, localizada principalmente no córtex superficial (2, 5) (Tabela 1).
Os sintomas apresentam um quadro clínico de hipertensão leve, anemia grave, aumento da creatinina sérica, diminuição da taxa estimada de filtração glomerular, proteinúria, glicosúria e/ou leucocitúria. A microalbuminúria e proteinúria do tipo tubular podem servir como indicadores de rastreamento precoce (2, 9, 11, 24).
Para diagnóstico, os indivíduos têm de apresentar insuficiência renal, bem como pelo menos dois dos seguintes critérios: (i) uma histologia renal exibindo fibrose intersticial com gradiente corticomedular; (ii) uma história de consumo de produtos à base de plantas que demonstrou a presença de AA; e (iii) a presença de adutos de AA-DNA (ou a transversão específica A:T > T:A no gene p53) numa amostra de tecido renal ou de um tumor urotelial (4, 9).
Apesar de irreversível (2, 4), é frequentemente feita terapia com glicocorticóides de forma a retardar a progressão (11). Contudo, quando existe evolução para doença renal crónica é necessário recorrer à hemodiálise (12% dos casos) ou transplante renal (88% dos casos) (1, 11, 15).
A forma ambiental da AAN é a Doença Endémica dos Balcãs (BEN), observado em pacientes que vivem em países dos territórios dos Balcãs ao longo do rio Danúbio (4, 9, 11), incluindo Sérvia, Roménia,
Croácia, Bulgária, Bósnia e Herzegovina (7). A intoxicação alimentar crónica por AA ocorre devido à contaminação dos solos agrícolas e água nos quais AA livres são libertados durante a decomposição da Aristolochia ou pela mistura das suas sementes com grãos destinados ao consumo (2, 7, 9-11, 18).
É descrita como uma doença renal aglomerada de caráter familiar, não hereditária (2) e lentamente progressiva (9), associada ao carcinoma urotelial do trato urinário superior (UTUC) (2, 4, 10). Caracteriza-se mor- fologicamente como fibrose intersticial hipocelular extensa, associada a atrofia tubular envolvendo raios medulares que diminuem de intensi- dade da medula externa e do labirinto cortical para o córtex interno (4). Os sinais clínicos e sintomas de BEN são inespecíficos e frequentemente permanecem latentes por anos, até que se inicie declínio da função renal, ocorrendo fraqueza, dor lombar leve e palidez da pele e posteriormente anemia associada a uma perda significativa da função renal e proteinúria tubular (9).
Os quadros clínicos da BEN podem variar entre apenas nefropatia tubo- intersticial crónica levando à doença crónica tubular; ou apresentam simultaneamente UTUC (unilateral ou bilateral) com insuficiência renal e histopatologia típica de BEN; ou deterioração inicial da função renal seguida de UTUC (unilateral ou bilateral) (4).
Embora BEN e AAN compartilhem características semelhantes, diferem na progressão clínica, visto que no BEN o AA é ingerido em pequenas doses através de contaminação alimentar e na AAN o AA é ingerido em doses mais altas intencionalmente (9). Desta forma, é explicado o tempo de exposição ao AA distinto entre ambas as doenças para a manifestação de declínio da função renal ou tubular, sendo de 20 a 30 anos para a BEN em comparação com 2 anos para a AAN (13, 20).
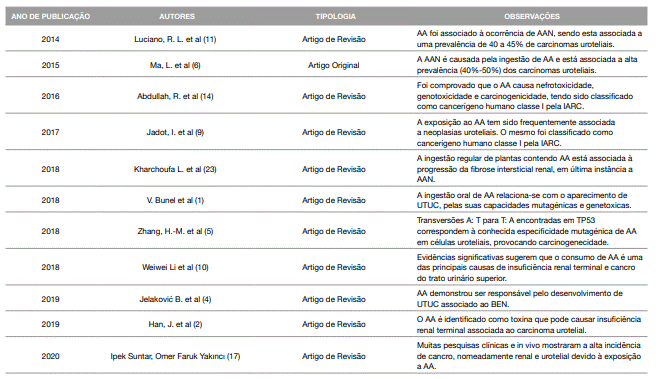
Tabela 1: Quadro Síntese: Estudos que Retratam a Evidência Entre o Efeito Tóxico do Ácido Aristolóquico e a Ocorrência de Nefropatia/ Cancro
AA: Ácido aristolóquico
AAN: Nefropatia por ácido aristolóquico
BEN: Nefropatia endémica nos Balcãs
IARC: International Agency for Research on Cancer
UTUC: Carcinoma urotelial do trato urinário superior
Exposição ao Ácido Aristolóquico e Cancro
Como mencionado anteriormente, o AA foi classificado como carcinogénico do grupo I pela IARC (2, 7, 9, 10, 14). Desta forma, a sua ingestão está relacionada com o desenvolvimento de carcinoma urotelial do trato urinário superior (UTUC) (2, 4, 9, 11, 25, 26), um subconjunto raro de malignidades uroteliais que ocorrem na pelve renal e no ureter superior (2). Verificou-se que as taxas de mutação somática são surpreendentemente altas, excedendo outros tipos de cancro, como o cancro de pulmão associado ao tabagismo (20). Atualmente nenhuma terapia demonstrou capacidade de diminuir a incidência deste cancro que afeta aproximadamente 50% dos pacientes com AAN, sendo estes aconselhados a recorrer à nefroureterectomia bilateral preventiva (6, 11).
Apesar da relação evidente entre a ingestão de AA e UTUC, estudos investigam a possibilidade da ocorrência de carcinogénese noutros órgãos e tecidos como células renais (2, 4, 19), fígado (3) e bexiga (2, 5, 9).
Relativamente à ocorrência de carcinogénese nestes tecidos, já foi concluído que o consumo de AA está amplamente relacionado com a hepatocarcinogenecidade em Taiwan, na China e por toda a Ásia (3, 19, 27) e observou-se também alto risco de carcinogenicidade nos tecidos da bexiga associada à AAN e UTUC (5).
Relação Dose-Resposta
Ainda não existe consenso de qual ou se existe dose máxima segura relativamente ao consumo do ácido aristolóquico, diferindo com a subespécie da planta e a parte da mesma que é utilizada, bem como com as características dos indivíduos. Uma dose alta única ou a administração contínua de uma dose baixa de AA pode levar a uma reação tóxica (5). No caso do grupo de cerca de 100 mulheres belgas, a dose estimada consumida de AA foi de 25 mg/kg em média durante treze meses, por outro lado na China os doentes diagnosticados com AAN revelaram uma exposição intermitente de 1 a 10 anos com valores estimados entre 0,7 e 1,5 mg/dia (26). Num outro estudo as ingestões diárias estimadas (EDIs) de AA foram 1,7 x 10-3 a 30 µg/kg/dia (14).
ANÁLISE CRÍTICA
Apesar de usualmente utilizadas para fins terapêuticos já foi comprovado que as plantas da família Aristolochia têm um efeito tóxico devido à sua alta composição em ácido aristolóquico. Os valores das doses de AA que provocam toxicidade encontrados nesta pesquisa foram controversos e inconclusivos, existindo ainda alguns pesquisadores que acreditam que o AA pode induzir mutações genéticas irreversíveis, portanto essa genotoxicidade não tem uma "dose segura" (5).
Devido a vários avisos sobre os efeitos tóxicos dos AAs pela Food and Drug Administration (FDA) dos Estados Unidos da América (EUA), pela European Medicines Agency (EMA) (9) e pelas autoridades reguladoras de outros países, a venda e o uso de produtos que contêm AA foram proibidos ou restritos na sua maioria (2), como aconteceu na Austrália, Canadá, Nova Zelândia e em muitos países asiáticos (por exemplo, Japão) (14). Além destas entidades, também a European Food Safety Authority (EFSA) emitiu um Compêndio de produtos botânicos relatados como contendo substâncias de possível preocupação para a saúde humana quando usadas em alimentos e suplementos alimentares, no qual se inseria o ácido aristolóquico (28). Desde 2004, a União Europeia (EU) não aprovou quaisquer medicamentos à base de plantas com AA, banindo-os e proibindo a sua vendo na maioria dos países (2, 11). Contudo os suplementos alimentares que contêm plantas que não constem na lista de plantas permitidas pela EU e respetivas partes colocados no mercado, puderam ser comercializados até ao seu esgotamento (29).
No entanto nos países endémicos como é frequente a contaminação por AA através do solo ou das próprias sementes destas plantas, desenvolveram-se técnicas para a possível redução deste ácido nos alimentos como a adição de magnésio, ácido ascórbico, cisteína, ácido cítrico ou glutationa durante o cozimento. No caso da água deve-se ferver num recipiente de aço inoxidável (Fe) com algumas frutas cítricas, como o limão (ácidos cítrico e ascórbico) (10).
Dois dos métodos de cocção mais utilizados na região dos Balcãs para a redução da concentração de AA na massa de farinha são cozer e ferver em água, com a obtenção de percentagens de redução dos níveis de AAI e AAII em aproximadamente 30% e 20%, respetivamente (10), sendo o AAI o composto principal, mais tóxico e carcinogénico (5, 6, 13).
CONCLUSÕES
Verificou-se o cumprimento do objetivo desta revisão da literatura, observando-se uma relação direta entre os efeitos tóxicos derivados do consumo de AA como nefrotoxicidade, genotoxicidade e carcinogenicidade. Estes efeitos refletem-se principalmente na ocorrência de AAN e UTUC, mas também no desenvolvimento de cancros noutros tecidos (6, 10, 18).
Ainda que tenha sido proibido a venda e o uso de produtos à base de plantas da família Aristolochia, estão disponíveis na internet em mais de 100 sites sem avaliação de segurança toxicológica pré-comercialização, podendo ser adquiridos com bastante facilidade. Em Portugal, os produtos desta planta encontram-se também disponibilizados online, como são exemplo produtos que contenham “Cipó-mil-homens” (Aristolochia cymbiphera), sob a forma de sementes e preparados para infusão, apesar da advertência por parte da INFARMED, relativamente às reações adversas provocadas por esta espécie (30).
O seu uso ainda permitido sob a supervisão de praticantes de medicina chinesa, uma vez que populações asiáticas acreditam que os fitoterápicos tradicionais são mais naturais e seguros que os medicamentos ocidentais.
Os efeitos nefrotóxicos do AA são irreversíveis e os seus efeitos carcinogénicos podem demorar até trinta anos a manifestar-se após a exposição inicial do indivíduo, podendo tornar-se num grande problema de saúde pública nos próximos anos.
Por fim para controlar a toxicidade do AA, a presença e as doses mínimas tóxicas de AA em materiais e preparações medicinais deve ser mais estudada, assim como os métodos para desintoxicação eficaz, descontaminação de alimentos e/ou medicamentos que possam reduzir toxicidade do AA.