INTRODUÇÃO
As neuropatias diabéticas (ND) periféricas constituem um grupo heterogéneo de distúrbios resultantes de danos no sistema nervoso periférico, manifestando-se frequentemente como dor e/ou alterações da sensibilidade nas extremidades. A hiperglicemia prolongada, stress oxidativo, inflamação e dislipidemia são considerados fatores importantes na fisiopatologia da ND (1).
Atualmente os doentes com pé diabético isquémico ou neuroisquémico ultrapassam os 60% (por oposição à prevalência de 30% há cerca de 20 anos atrás). A mortalidade excessiva associada a esta complicação da Diabetes Mellitus (DM) carece de atenção. Os índices de mortalidade podem superar os 50% ao fim de 5 anos. Em doentes amputados, esses índices podem atingir os 70%. Assim, urge a necessidade de terapêuticas eficazes, modificadoras de prognóstico e que proporcionem melhor qualidade de vida (2).
O Ácido alfa lipoico (AAL) é um antioxidante derivado do ácido caprílico. Esta substância é sintetizada na mitocôndria, atua como cofator na atividade enzimática para a lise de nutrientes, elimina espécies reativas de oxigénio (superóxido, singletos de oxigénio, radicais hidroxilo) através do grupo ditiol. Desta forma, sua utilização é potencialmente benéfica nas condições associadas a stress oxidativo, tais como síndromes isquémia-reperfusão ou lesão associada a radiação (3). O AAL simultaneamente regenera outros antioxidantes como a vitamina C e E, potenciando a síntese de glutationa. Para além disso, inibe a atividade da KB cinase, enzima que ativa o fator nuclear KB.
Vários estudos prospetivos controlados por placebo avaliaram a eficácia do AAL, administrado por via intravenosa ou por via oral, em doentes com ND dolorosa (4-8).
O AAL administrado por via intravenosa diariamente durante três semanas foi associado à redução da dor, parestesias e dormência em comparação com infusões de placebo (4).
Quando administrado por via oral, em doses de 600, 1200 ou 1800 mg o AAL tem sido associado a uma redução nos sintomas da neuropatia (dor em pontada, dor tipo queimadura, parestesias e dormência durante o sono) em comparação com o placebo. O benefício do AAL não diferiu pela dose. Contudo, doses superiores a 600 mg por dia foram limitadas pelo aumento de eventos adversos (náuseas, vómitos e vertigens) sem aumento da eficácia. Não há estudos de longo prazo que avaliem o efeito do AAL na progressão da ND, embora a evidência em sumários de decisão clínica aponte para algum efeito na redução da dor (1).
METODOLOGIA
Objetivos: Compreender se o AAL per os é eficaz no controlo sintomático da ND.
Materiais e métodos
Conforme ilustrado na Tabela 1, definiu-se PICO:
• População - doentes com DM e ND;
• Intervenção - AAL por via oral;
• Comparador - outro tratamento, farmacológico ou não farmacológico, ou placebo, para a ND;
• Outcome - controlo sintomático da ND.
Utilizaram-se os termos MeSH “alpha lipoic acid” e “diabetic neuropathy” para a pesquisa bibliográfica nas guidelines da American Diabetes Association (ADA) e International Working Group on the Diabetic Foot (IWGDF), bem como nas bases de dados PUBMED e Cochrane.
Pesquisaram-se revisões sistemáticas (RS), ensaios clínicos aleatorizados (ECA) e metanálises publicados entre Novembro de 2012 e Janeiro de 2024, na língua inglesa. Foram excluídos os artigos que não se enquadram no objetivo deste trabalho.
Para classificação do nível de evidência dos resultados utilizou-se a Strentght Of Recomendation Taxonomy (SORT) (9).
RESULTADOS
O AAL é mencionado nas guidelines da ADA 2024 como opção eficaz e passível de ser considerado no tratamento da ND, embora não esteja aprovado para esta patologia (10). Não houve menção nas guidelines do IWGDF 2023 (11).
Resultaram 105 artigos da pesquisa nas bases de dados Cohcrane e PUBMED.
Após triagem por título e resumo, obtiveram-se onze estudos para leitura integral: duas RS (Tabela 2) e oito ECA (Tabela 3).
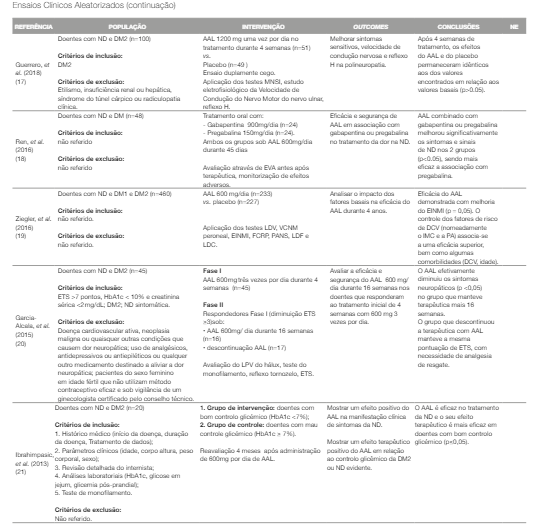
As RS concluem que não há diferenças significativas entre o AAL e o placebo no controlo sintomático da ND, com um nível de evidência 2. Nos ECA (20-460 participantes), a posologia utilizada varia, doses diárias de 570 a 1800mg e duração do tratamento de 2 semanas a 12 meses. Os instrumentos de avaliação da ND utilizados são diversos, desde escalas de avaliação subjetiva da dor a testes de cariz laboratorial, nomeadamente estudos electrofiológicos ou electromiográficos.
Didangelos, et al. (2021) mostraram que a associação de AAL (570mg) com outros suplementos, nomeadamente superóxido dismutase, acetil L-carnitina e vitamina B12, melhora significativamente o controlo sintomático (n=43) em comparação com o placebo (n=42) durante 12 meses de tratamento. Foram incluídos doentes com DM com pelo menos 4 anos de evolução e tratamento com metformina, com controlo glicémico aceitável (hemoglobina glicada (HbA1C) 6,5-7,5%).
Foram excluídos doentes com patologia cardiovascular aguda ou crónica grave, renal e cerebrovascular (14).
Ren, et al. (2016) demonstraram a mesma eficácia na associação de AAL com gabapentinóides, principalmente com 150mg diárias de pregabalina, em detrimento de 900mg diários de gabapentina, com 24 participantes em cada braço, durante 45 dias de tratamento. Não tivemos acesso aos critérios de inclusão e exclusão aplicados (18). A eficácia do tratamento com AAL isoladamente foi demonstrada em seis ECA (15-19, 21).
El-Nahas, et al. (2020) constataram que a utilização de 1200mg de AAL divididas em duas tomas por dia durante 6 meses (n=100) é eficaz em comparação com o placebo (n=100). Foram incluídos doentes com DM-2 e excluídos os doentes com deficiência de vitamina B12, etilismo, abuso de drogas, hipotiroidismo, distúrbios paraneoplásicos, doença cerebrovascular, parkinsonismo, urémia e patologia músculo- esqueléticas agudas ou crónicas (15).
Won, et al. (2020) provaram que o ácido gama-linoleico (n=48) não é inferior à terapêutica com AAL 600 mg uma vez por dia durante 12 semanas (n=52). Foram incluídos apenas doentes com DM tipo 2. Foram excluídos doentes com neuropatia causada por distúrbios progressivos ou degenerativos que interfiram na avaliação da gravidade da ND, hipertensão não controlada, amputação prévia do pé ou da perna, doença cardíaca, pulmonar, gastrointestinal, hematológica ou outra endocrinológica clinicamente significativa, transplantados (16). Guerrero, et al. (2018) sugerem que o diagnóstico precoce pode favorecer a eficácia do AAL. No entanto, não foi verificada melhoria clínica significativa com 1200 mg por dia de AAL (n=51) durante quatro semanas, em comparação com o placebo (n=49). Foram incluídos apenas diabéticos tipo 2 e foram excluídos doentes com etilismo, insuficiência renal ou hepática, síndrome do túnel cárpico ou radiculopatia clínica (17).
O estudo com maior janela temporal e maior número de participantes, de Ziegler, et al. (2016), mostrou que o tratamento com 600mg por dia de AAL durante 4 anos foi eficaz (Δ Escala de Incapacidade atribuída a Neuropatia dos Membros Inferiores ≥ 2 pontos). Como fatores preditores de melhoria e prevenção da progressão da ND foram apontados: idade igual ou superior a 55 anos, IMC<30 Kg/m2, sexo masculino, pressão arterial normal, história de doença cardiovascular, DM tipo 2, insulinoterapia, DM diagnosticada há pelo menos 10 anos e ND com mais de 3 anos de evolução.
Não foram mencionados critérios de inclusão e exclusão. Este estudo incluiu doentes com DM tipos 1 e 2 (19).
Garcia-Alcala, et al. (2015) verificaram que a descontinuação do AAL se associou a maior necessidade de analgesia de resgate. Neste estudo foram incluídos doentes com DM tipo 2; ND sintomática (Escala Total de Sintomas >7 pontos), HbA1c < 10%, creatinina sérica <2 mg/dL. Foram excluídos doentes com patologia cardiovascular, neoplasia maligna ou quaisquer outras condições que causem dor neuropática; uso de analgésicos, antidepressivos ou antiepiléticos ou qualquer outro medicamento destinado a aliviar a dor neuropática; pacientes do sexo feminino em idade fértil que não utilizam método contraceptivo eficaz e sob vigilância de um ginecologista certificado pelo colégio da especialidade. Inicialmente 45 doentes foram submetidos a tratamento com AAL 1800 mg divididas em três tomas por dia durante 4 semanas (Fase I). Posteriormente, os doentes que responderam favoravelmente ao tratamento na Fase I (n=33), cuja pontuação pela Escala Total de Sintomas diminuiu 3 ou mais valores, foram divididos em dois braços (Fase II). No grupo que prosseguiu tratamento com AAL 600 mg por dia durante 16 semanas (n=16), os sintomas de ND permaneceram controlados, enquanto no grupo submetido a cessação do AAL (n=17) se verificou necessidade de terapêutica analgésica adicional (20). Ibrahimpasic, et al. (2013) concluíram que 600 mg de AAL por dia é eficaz no tratamento da ND, com resultados mais promissores quanto melhor o controlo glicémico. Foram incluídos doentes com DM tipo 2, cujo histórico médico fosse conhecido (início da doença, duração da doença, tratamento de dados), bem como parâmetros clínicos (idade, corpo altura, peso corporal, sexo) e análises laboratoriais (HbA1c, glicose em jejum, glicemia pós-prandial), com ND (diagnosticado através do teste de monofilamento) (21).
ANÁLISE CRÍTICA
A confiança nos resultados é limitada pela curta duração dos estudos e reduzido número de participantes. Quando comparado com outros tratamentos farmacológicos (vitamina B12 ou ácido gama linoleico), não houve diferença significativa.
Os instrumentos de avaliação de sintomas da ND foram diferentes entre os estudos. Nos ECA seria importante avaliar outros outcomes orientados para o doente e não para a doença, como morbi-mortalidade, redução de custos e qualidade de vida.
A variabilidade na posologia referida nos estudos limita a adoção de uma estratégia de tratamento universal.
A associação de melhor controlo metabólico (IMC, pressão arterial e glicémia) a uma eficácia superior do AAL deve ser cuidadosamente interpretada, uma vez que este controlo metabólico pode, per se, contribuir para a melhoria dos sintomas da ND, tendo-se de admitir como fator de confundimento nestes estudos. Para além disso, a seleção de uma população com paucipatologia e razoável controlo glicémico pode ter influenciado os resultados de alguns ECA. Nalguns estudos, não foram conhecidos os critérios de inclusão nem de exclusão, sendo um obstáculo à interpretação dos dados.
As guidelines da ADA mencionam pela primeira vez em 2024 a possibilidade de utilização do AAL na ND dolorosa, alertando para o facto desta substância farmacológica não estar aprovada para a ND. O facto de até à data não haver menção do AAL nas guidelines da ADA e IWGDF corrobora a ausência de dados para a decisão clínica. Contudo, as guidelines do IWGDF carecem de atualização, estando prevista para 2023. Subindo na pirâmide da evidência, nos sumários de decisão clínica (DynaMed e UpToDate) já é referido o AAL (1, 7). Pelo seu mecanismo farmacológico, poderá ser racional a utilização de AAL em doentes selecionados, com ND e pé isquémico ou doença cardiovascular ou com dor (1, 2). A existência concomitante de doença arterial periférica não foi mencionada nos estudos referidos. A ausência de doentes com DM tipo 1 na maioria dos estudos referidos limita a aplicabilidade do AAL neste grupo de diabéticos.
Foi atribuído nível de evidência 2 a todos os estudos representados nas Tabelas 1 e 2. As RS, revelaram alguma inconsistência de resultados, característico das RS atualizadas e de alta qualidade. A qualidade dos ECAS é aferida pela alocação oculta, avaliação de métricas orientadas para o doente (avaliação de sintomas) e não para a doença, poder estatístico adequado, tendo sido detetados resultados consistentes e coerentes em pelo menos seis ECA. Assim, a recomendação para a utilização de AAL na ND é de SORT B (9).
CONCLUSÕES
A recomendação para a utilização de AAL no controlo sintomático da ND tem evidência limitada (SORT B), com interesse no tratamento de forma individualizada (potencial benefício acrescido em doentes com dor neuropática e doença cardiovascular).
Seriam necessários estudos com maior número de participantes, ensaios clínicos aleatorizados, com a avaliação de outcomes centrados no doente, tais como alívio sintomático, morbilidade, mortalidade, redução de custos e qualidade de vida, para obter uma conclusão mais cabal.