INTRODUÇÃO
A Diabetes Gestacional (DG) define-se como um subtipo de intolerância aos hidratos de carbono (HC), diagnosticada pela primeira vez no decurso da gestação, estando associada a complicações maternas e fetais graves (1). Em 2013, a Organização Mundial da Saúde (OMS) definiu que a DG é diferenciada da Diabetes na gravidez por apresentar valores glicémicos intermédios entre os níveis considerados normais na gravidez e valores que excedem os limites diagnósticos para a população não grávida (2). Atualmente, o diagnóstico da DG, segundo o consenso de 2017, faz-se quando a mulher apresenta uma glicemia plasmática em jejum na primeira visita pré-natal igual ou superior a 92 mg/dl, mas inferior a 126 mg/dl. Na presença de um resultado normal, a grávida fará uma prova de tolerância oral à glicose (PTOG) 75 g às 24-28 semanas de gestação (1).
Segundo as estimativas de 2017 da Federação Internacional de Diabetes (IDF), a DG afeta aproximadamente 14% das gestações em todo o mundo, representando aproximadamente 18 milhões de nascimentos anualmente (3). Os fatores de risco conhecidos englobam sobrepeso/obesidade, prática de um padrão alimentar ocidentalizado e pobre em micronutrientes, idade materna avançada, histórico familiar de resistência à insulina e/ou diabetes e pertencer a etnias asiáticas não-hispânicas (4).
Embora a DG, maioritariamente, se solucione após o parto, podem surgir consequências com um elevado impacto na saúde da mãe e da criança, incluindo aumento do risco de diabetes mellitus tipo 2 (DM2), doença cardiovascular (DCV) e obesidade futura na mãe, DCV, DM2 e/ou DG na descendência. Contribui, assim, para um ciclo intergeracional de obesidade e diabetes com grande impacto na saúde da população como um todo (5).
Têm sido demonstradas intervenções nutricionais em mulheres com DG e os seus efeitos na redução da necessidade de tratamento farmacológico, na melhoria da glicemia e dos parâmetros relacionados (6). Torna-se, por isso, pertinente sistematizar a evidência mais recente acerca da eficácia das intervenções dietéticas e nutricionais na DG.
METODOLOGIA
Protocolo da Revisão Sistemática
O presente estudo foi realizado considerando as recomendações propostas pelo Preferred Reporting Items for Systematic Reviews and Meta-Analyses (PRISMA) para a realização de revisões sistemáticas (7). A qualidade dos estudos foi avaliada com a ferramenta Cochrane risk of bias tool (RoB2) (8).
Pesquisa Bibliográfica
A pesquisa dos artigos foi realizada no dia 30 de maio de 2023, no motor de pesquisa PubMed. Foi utilizada a expressão de pesquisa utilizando as seguintes palavras-chave: “gestational diabetes” AND “nutrition”.
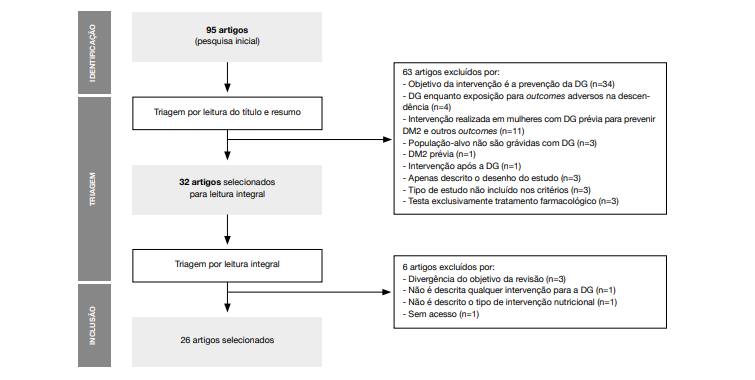
Os critérios de inclusão focaram-se em artigos publicados nos últimos 5 anos (2018-2023), relativos a estudos do tipo ensaios clínicos randomizados (ECR), realizados em mulheres grávidas com diagnóstico de DG e referentes a qualquer intervenção nutricional e/ou dietética no tratamento da DG. Foram obtidos 95 artigos científicos. Numa primeira triagem, 63 artigos foram excluídos, de forma independente por dois revisores (MC, EP), com base na leitura do título e do resumo. Foram considerados os seguintes critérios de exclusão: i) estudos que avaliaram a DG enquanto fator de risco para DM2 e outras patologias, mas não como outcome principal, ii) estudos em que o outcome fosse a prevenção da DG, iii) estudos que testaram exclusivamente o tratamento farmacológico, iv) estudos em que o outcome principal seja o feto e não o controlo da DG na própria grávida.
Os restantes estudos foram analisados na sua forma integral (n=32) e 6 publicações adicionais foram excluídas de acordo com os critérios assinalados na Figura 1 . Finalmente, 26 artigos foram considerados, preenchendo os critérios de inclusão (Figura 1).
RESULTADOS E DISCUSSÃO
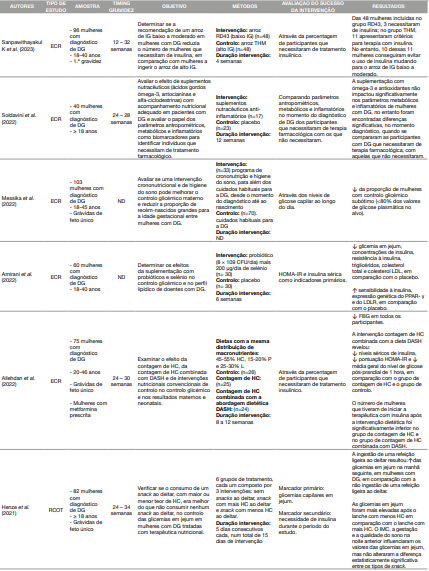
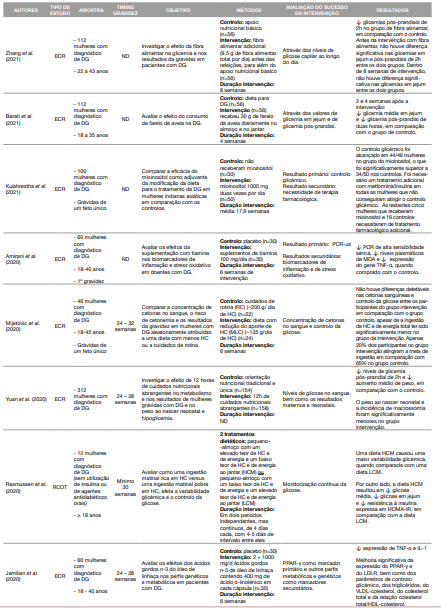
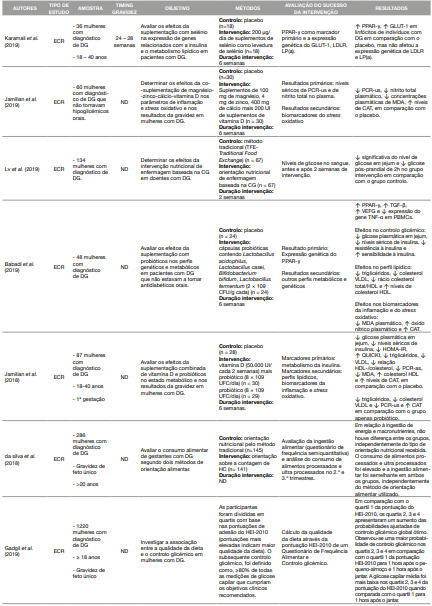
Para sistematização dos estudos incluídos na revisão, construiu-se uma tabela onde se colocou o nome do primeiro autor e ano de publicação do estudo, tipo de estudo, características da amostra estudada, momento da gravidez durante o qual ocorreu a intervenção, objetivo do estudo, descrição sumária da sua metodologia, forma de avaliação do sucesso da intervenção e resultados. Os estudos foram organizados do mais recente para o mais antigo (Tabela 1).
A revisão abrangeu mulheres provenientes de diferentes localizações geográficas e com idades compreendidas entre os 18 e 46 anos.
Os estudos variaram em relação ao tamanho da amostra, o método de diagnóstico, as semanas de intervenção e o momento da gravidez. No global, os estudos apresentavam elevada qualidade, ou seja, baixo risco de viés em todos os domínios, como seria expectável em estudos experimentais. No entanto, uma pequena proporção das publicações apresentou “algumas preocupações” no risco de viés, nomeadamente, por falha na adesão à intervenção por parte das participantes, por possíveis diferenças na medição dos resultados entre os grupos e falhas na medição dos resultados por subestimação (Tabela 2). As intervenções nutricionais mostraram-se eficazes em cerca de 88% dos estudos incluídos, o que reforça a importância e o impacto das respetivas intervenções para o tratamento da DG. As intervenções baseavam-se na prescrição de alimentos ou padrões alimentares, na prescrição de um plano alimentar associado a outros estilos de vida ou em suplementação. A Tabela 3 esquematiza tais resultados.
Tabela 1 Resumo das características dos ensaios incluídos na presente revisão sistemática das intervenções dietéticas em grávidas com Diabetes Gestacional
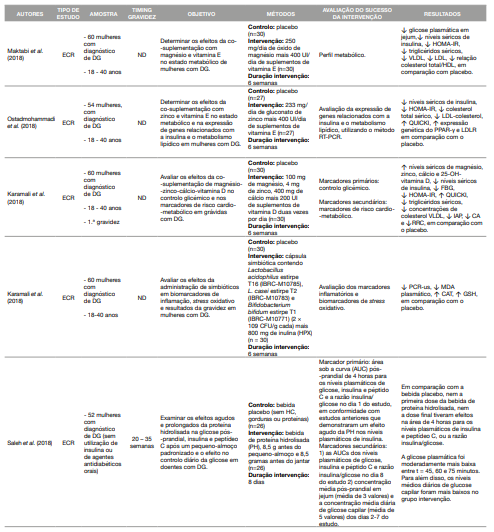
CA: Coeficiente aterogénico
CAT: Capacidade antioxidante total
CG: Carga glicémica
DASH: Dietary Approaches to Stop Hypertension
DG: Diabetes gestacional
ECR: Estudo clínico randomizado
FBG: Fasting blood glucose
GLUT-1: Transportador de glicose tipo 1
GSH: Glutationa
HbA1c: Hemoglobina glicada
HC: Hidratos de carbono
HDL: Colesterol de lipoproteínas de alta densidade
HOMA-IR: Modelo de homeostase de avaliação - resistência à insulina
IAP: Índice aterogénico do plasma
IG: Índice glicémico
IL-1: Interleucina 1
LDL: Colesterol de lipoproteínas de baixa densidade
LDLR: Recetor de LDL
LP(a): Lipoproteína (a)
MDA: Malondialdeído
ND: Não disponível
PBMCs: Células mononucleares do sangue periférico
PCR: Proteína C reativa
PCR-us: Proteína C reativa ultra sensível
PPAR-γ: Peroxisome proliferator-activated receptor gamma
QUICKI: Índice quantitativo de verificação da sensibilidade à insulina
RCOT: Randomised crossover trial
RRC: Razão de risco cardíaco
RT-PCR: Transcrição reversa seguida de reação em cadeia da polimerase
TGF-β: Fator de transformação do crescimento beta
TNF-α: Fator de necrose tumoral alfa
VLDL: Colesterol de lipoproteínas de muita baixa densidade
Tabela 2 Resumo do risco de enviesamento para ECR (Cochrane risk of bias tool (RoB2))
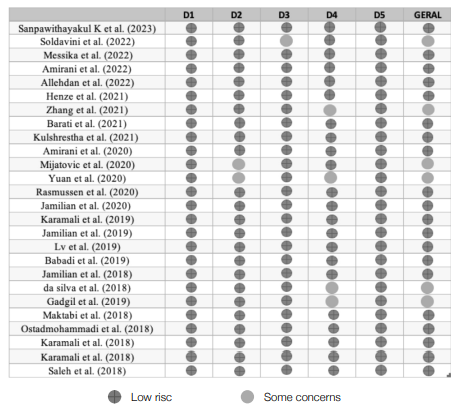
D1: Randomization process
D2: Deviations from intended intervention
D3: Missing outome data
D4: Measurement of the outcome
D5: Selection of the reported result
Tabela 3 Eficácia das diferentes intervenções dietéticas e nutricionais
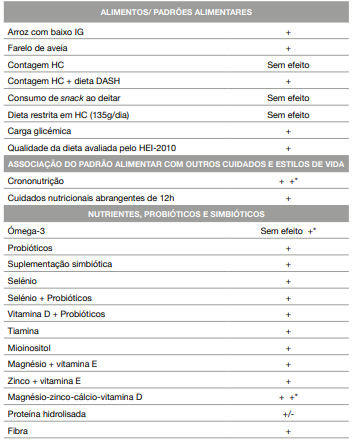
DASH: Dietary Approaches to Stop Hypertension
HC: Hidratos de Carbono
HEI-2010: Healthy Eating Index 2010
IG: Índice glicémico
*Quando aparece mais do que um símbolo na mesma linha, corresponde ao número de estudos onde aquela intervenção foi testada.
Intervenções Baseadas em Alimentos, Padrões Alimentares e Estilos de Vida
A procura de intervenções que sejam adjuvantes no controlo metabólico da DG continua muito premente, tal como foi possível comprovar com esta revisão sistemática.
Perante o elevado número de publicações científicas neste domínio, optou-se por restringir aos estudos publicados nos últimos 5 anos, sendo por isso estudos maioritariamente conduzidos após o último consenso para o tratamento da DG, elaborado por Almeida et al. (2017). O controlo da ingestão de hidratos de carbono, quer seja através da restrição da quantidade total (9), pela aplicação do método de contagem de hidratos de carbono (10, 11) ou pela restrição de alimentos de elevada carga glicémica (12, 13) continua a ser uma das estratégias mais utilizadas. O estudo conduzido por Allehdan et al. (11) associou a contagem de HC com a dieta DASH num dos braços do seu estudo, tendo verificado que este grupo apresentou um maior consumo de fibras e uma dieta com menor índice glicémico (IG), em comparação com a dieta de contagem de HC e a dieta de controlo. A ingestão de fibra pode atrasar o esvaziamento gástrico, retardar a taxa de digestão dos HC e, subsequentemente, reduzir a taxa de absorção de glicose e dos níveis de insulina no plasma, diminuindo assim os níveis de glicose pós-prandial (14, 15).
Também Gadgil et al. (16) estudaram o papel de uma abordagem da qualidade da dieta, como um todo, usando o instrumento HEI2010, que é um índice da qualidade da dieta e inclui 12 componentes, 9 dos quais avaliam a adequação da dieta. Os restantes 3 avaliam componentes da dieta que devem ser consumidos com moderação (17). Os resultados do estudo revelaram que a qualidade global da dieta, medida pelo HEI-2010, teve uma pontuação média de 44 no Quartil 1 e 62 no Quartil 4, sendo que uma pontuação de 100 representa a qualidade ideal da dieta. Verificaram um aumento da probabilidade de um controlo glicémico global ótimo e de um controlo glicémico para 1h após pequeno-almoço e 1h após jantar, nos quartis 2, 3 e 4 da pontuação do HEI-2010, em comparação com o quartil 1. Por seu turno, Henze et al. (18) centraram o seu estudo em apenas uma refeição: a ceia. Revelaram que o consumo de uma refeição ligeira ao deitar, com ou sem HC estava associado a níveis ligeiramente mais elevados de glicemia em jejum, em comparação com a ausência da refeição ligeira ao deitar. É o primeiro estudo a avaliar o efeito de pequenas refeições ao deitar e o seu efeito nas glicemias em jejum, em mulheres com DG. Assim, este estudo sugere que parece não haver vantagem em adicionar um lanche com menos ou mais HC ao deitar em mulheres com DG para melhorar a hiperglicemia em jejum. Este facto tem especial interesse em mulheres obesas com DG, em que pode não ser oportuno um lanche extra, para prevenir um aumento exagerado de peso gestacional.
A crononutrição é uma temática que tem cativado a atenção de muitos investigadores, incluindo os que se dedicam a esta patologia. Messika et al. (19) estudaram o efeito de uma intervenção crononutricional e de higiene do sono no controlo glicémico materno. Sabe-se que o relógio circadiano controla a atividade da maioria das enzimas, hormonas e sistemas de transporte envolvidos no metabolismo da glicose. No entanto, as diretrizes atuais para a DG aconselham essencialmente a frequência e o conteúdo das refeições e não as relacionam com a hora de acordar e/ou de dormir ou a duração do sono.
Os resultados demonstraram que uma intervenção crononutricional e de higiene do sono provocou uma redução significativa do risco de desenvolver um controlo glicémico subótimo, principalmente devido à diminuição da ingestão de HC no intervalo da noite.
O estudo de Rasmussen et al. (20) avaliou o impacto de uma ingestão matinal rica em HC versus uma ingestão matinal pobre em HC e os seus resultados corroboram que o horário e a composição adequados das refeições, para além da ingestão global de alimentos devem ser tidos em consideração na prescrição da terapêutica nutricional para mulheres com DG (21).
Intervenções Baseadas em Suplementos
A maioria dos estudos incluídos nesta revisão testaram a eficácia de suplementos na dieta. A suplementação com ácidos gordos ómega-3 foi testada em dois estudos distintos (22,23). A ingestão de ómega-3 pode diminuir a produção de citocinas inflamatórias, que se encontram aumentadas em mulheres com DG, através da inibição da ativação do fator nuclear kappaB (NF-кB) - um ativador crítico de genes envolvidos na inflamação e na imunidade (24). Além disso, pode aumentar a expressão genética dos recetores ativados por proliferadores de peroxissoma tipo gama (PPAR-γ) o que, por sua vez, reduz a produção de marcadores inflamatórios (25). Os PPAR possuem um papel essencial na manutenção da homeostase metabólica (26). Enquanto no estudo de Soldavini (22) e colaboradores não foi demonstrado benefício na suplementação, o estudo de Jamilian et al. (23) mostrou que a suplementação com AG n-3 do óleo de linhaça, durante 6 semanas a mulheres com DG, teve efeitos benéficos na expressão de genes relacionados com a insulina, lípidos e inflamação, controlo glicémico, lípidos, marcadores inflamatórios e stress oxidativo.
Evidências crescentes indicam uma alteração na composição da microbiota intestinal durante a gravidez, especialmente em mulheres com DG (27). Relativamente aos benefícios no controlo glicémico, no perfil lipídico e nos marcadores inflamatórios, estes resultam do aumento da produção de ácidos gordos de cadeia curta (AGCC) pelos probióticos após a fermentação (28). Os estudos de Babadi et al. (29), de Karamali et al. (30), Amirani et al. (31) e Jamilian et al. (32) corroboraram estes efeitos benéficos, tendo alguns destes estudos associado um prebiótico ou um micronutriente ao probiótico.
O selénio possui a capacidade de aliviar a resposta inflamatória através da diminuição da produção de espécies reativas de oxigénio (ERO), da inibição do NF-κβ, dos recetores toll-like e das vias p38 das proteínas quinases ativadas por mitogénio (MAPK) (33). Foi defendido que a inibição destas vias inflamatórias conduz a um aumento dos níveis de expressão genética do PPAR-γ (34), reduzindo a resistência à insulina. A suplementação com selénio mostrou ser adjuvante no controlo da DG (31, 33).
A hipovitaminose D está associada a níveis séricos mais elevados de biomarcadores inflamatórios, como a interleucina 6 (IL-6), o fator de necrose tumoral alfa (TNF-α) e a proteína C reativa (PCR) (35).
Foi demonstrado que a vitamina D e o recetor da vitamina D (VDR) modulam a microbiota intestinal. O aumento da expressão do VDR pode diminuir a disbiose microbiana, melhorar a função de barreira, aumentar a expressão de péptidos antimicrobianos, diminuir as citocinas pró-inflamatórias e aumentar a produção comensal de AGCC (36). Jamilian et al. (32) revelaram que a co-suplementação de vitamina D e probióticos conduziram a melhorias significativas no controlo glicémico, nas concentrações de lípidos, exceto colesterol total e colesterol de lipoproteínas de baixa densidade (LDL), e nos níveis de proteína C reativa ultra-sensível (PCR-us), capacidade antioxidante total (CAT) e malondialdeído (MDA).
Amirani et al. (37) demonstraram que a suplementação de tiamina em grávidas com DG, durante 6 semanas reduziu significativamente os níveis de PCR e MDA e a expressão genética do TNF-α. Uma investigação experimental demonstrou que a deficiência de tiamina estava associada a um aumento da expressão genética de citocinas pró-inflamatórias (38). Dados existentes revelam que a toma de um suplemento de tiamina pode reduzir a atividade de certas vias bioquímicas que conduzem a anomalias associadas à hiperglicemia (39).
Kulshrestha et al. (40) evidenciaram que a suplementação oral com mioinositol, quando iniciada logo após o diagnóstico de DG, é eficaz no controlo glicémico e diminui a necessidade de terapia farmacológica adicional, em mulheres indianas asiáticas. Estudos anteriores sugeriram que o inositol pode diminuir consideravelmente os níveis de insulina em mulheres com síndrome dos ovários poliquísticos (SOP) quando administrado como uma das duas formas isoméricas, mio-inositol ou D-quiro-inositol (41).
Maktabi et al. (42) constataram que a co-suplementação com magnésio e vitamina E em mulheres com DG melhorou significativamente o controlo glicémico e os perfis lipídicos. A concentração intracelular de magnésio está associada à modulação da ação da insulina e estão relacionadas com o metabolismo da glicose (43). Já a vitamina E, para além dos seus efeitos antioxidantes, possui um papel na modulação da expressão genética do PPAR- γ, que está envolvido no metabolismo lipídico (44).
Ostadmohammadi et al. (45) verificaram que a co-suplementação com zinco e vitamina E melhorou significativamente o metabolismo da insulina, o perfil lipídico e os níveis de expressão genética do PPAR-γ e do recetor de LDL (LDLR). Os iões de zinco suprimem as proteínas tirosina fosfatases associadas à cascata de sinalização da insulina, ativando assim a cascata de sinalização da insulina, o que conduz à captação de glicose, ao aumento da síntese de glicogénio e à diminuição da gliconeogénese (46).
Jamilian et al. (47) verificaram que a co-suplementação de magnésiozinco-cálcio-vitamina D em mulheres com DG reduziu os biomarcadores da inflamação e do stress oxidativo, nomeadamente diminuição da PCR sérica, do nitrito total plasmático e dos níveis de MDA, e do aumento dos níveis de CAT. Karamali et al. (48) provaram que a cosuplementação de magnésio-zinco-cálcio-vitamina D também possui efeitos benéficos nos perfis metabólicos das mulheres com DG, como a melhoria da sensibilidade à insulina e alguns perfis lipídicos.
Limitações da Evidência Existente
Não obstante a mais-valia que nos parece constituir esta sistematização da evidência mais recente relativamente à terapêutica nutricional na DG, concordamos com os autores dos diversos estudos, que manifestaram incapacidade do controlo total do cumprimento das intervenções por parte das grávidas, particularmente quando a intervenção se baseia em padrões alimentares e/ou outros estilos de vida, bem como a dificuldade que existe em conduzir estudos com intervenções mais longas e com maiores tamanhos amostrais das respetivas prescrições nutricionais e na reduzida duração e amostragem das intervenções.
CONCLUSÕES
Existem cada vez mais dados científicos, que apoiam os benefícios da terapêutica dietética para o tratamento da DG. Apesar da heterogeneidade entre os estudos, a maioria dos artigos publicados nos últimos cinco anos, refere resultados positivos no perfil lipídico, no controlo glicémico, no estado inflamatório, no stress oxidativo, bem como na composição e na atividade da microbiota intestinal.
As intervenções, no geral, tiveram uma duração e um tamanho amostral reduzidos, o que pode constituir uma limitação. Dado o elevado número de mulheres com DG, é importante que os novos estudos que visam avaliar possíveis mudanças na dieta deste grupo de mulheres, se concentrem em amostras maiores e em intervenções que ocorram imediatamente após o diagnóstico, além de um acompanhamento prolongado ao longo do tempo.
No entanto, foram observados resultados positivos em cerca de 88% das publicações, o que demonstra o impacto e a importância da intervenção nutricional na DG.
CONTRIBUIÇÃO DE CADA AUTOR PARA O ARTIGO
EP e MC: Foram responsáveis por definir o objetivo do estudo e estabelecer a metodologia de pesquisa. Conduziram a pesquisa bibliográfica e seleção dos artigos. Durante o processo de análise dos estudos selecionados; JC: Desempenhou um papel fundamental na tomada de decisão nas situações em que as outras duas autoras apresentaram dúvidas relativamente à inclusão de algum artigo; MC: Escreveu a primeira versão do artigo. Todas as autoras leram atentamente a versão inicial do artigo e contribuíram para a redação da versão final. A versão submetida foi aprovada por todas.