Introdução
A doença cardiovascular é considerada a principal causa de morte na Europa, sendo responsável por cerca de 4 milhões de mortes a cada ano.1
A terapêutica antiplaquetária com fármacos como o ácido acetilsalicílico (AAS), vulgarmente conhecido como aspirina, e como o clopidogrel é largamente utilizada para prevenção secundária de eventos cardiovasculares e cerebrovasculares.2 De facto, indicações da European Society of Cardiology, a aspirina na dose de 75-100 mg/dia deve ser utilizada como prevenção secundária nas seguintes situações: síndromes coronárias agudas e doentes com doença aterosclerótica evidente mesmo que sem eventos prévios (síndrome coronária crónica ou doença arterial periférica sintomática). No acidente vascular cerebral (AVC) isquémico não-cardioembólico e no acidente isquémico transitório (AIT) as guidelines referem a possibilidade de utilizar aspirina, clopidogrel ou ambos. O clopidogrel deve ainda ser utilizado em conjunto com a aspirina nos primeiros 12 meses após enfarte agudo do miocárdio, e poderá ser mantido se o doente apresentar um alto risco isquémico.3
O AAS permite a diminuição da incidência destes eventos e da mortalidade através da inibição da função da cicloxigenase (COX)-1 e da síntese de tromboxano (Tx).4,5) No entanto, está associado a efeitos gastrointestinais adversos bem conhecidos. Uma baixa dose de AAS associou-se, em alguns estudos, a um risco duas vezes superior de hemorragia gastrointestinal (GI) quando comparado com placebo.6-8 Na verdade, uma limitação major ao uso do AAS está associada com o aparecimento de doença ulcerosa péptica, incluindo úlceras hemorrágicas, devido à inibição da formação de prostaglandinas na mucosa gastrointestinal.9,10
O clopidogrel é um agente antiagregante cujos efeitos ocorrem através de um mecanismo diferente, sendo recomendado em situações de intolerância ou contraindicação ao AAS.3) Este fármaco impede a agregação plaquetária, inibindo irreversivelmente a ligação da adenosina difosfato (ADP), substância que é libertada nas plaquetas durante a sua ativação e que amplifica o processo de agregação.11
O ensaio CAPRIE (Clopidogrel versus Aspirin in Patients at Risk of Ischaemic Events), que incluiu cerca de 19 000 participantes, abriu portas, em 1996, para o debate entre aspirina, clopidogrel e risco hemorrágico. Este ensaio evidenciou que o clopidogrel estava associado a menos eventos adversos gastrointestinais quando comparado com a aspirina.12 Efetivamente, o mecanismo de ação do clopidogrel não está associado à inibição da síntese de prostaglandinas, levantando à hipótese de um possível papel de proteção gastrointestinal.12 Contudo, evidências mais recentes mostraram uma provável associação a hemorragia gastrointestinal recorrente.13,14)
McQuaid e Laine et al publicaram em 2006 uma revisão sistemática sobre este tema, no entanto, desde essa altura surgiram novas evidências que justificam a pertinência de uma atualização nesta área.8
Assim, esta revisão pretendeu avaliar as evidências mais recentes sobre a eventual superioridade do clopidogrel na redução do risco hemorrágico GI em doentes tratados com AAS ou clopidogrel para prevenção cardiovascular e cerebrovascular secundária.
Métodos
Foi realizada uma pesquisa por três investigadores independentes de normas de orientação clínica e artigos científicos nas bases de dados PubMed, Cochrane Library, DARE (Database of Abstracts of Review of Effects), National Guideline Clearinghouse, Canadian Medical Association Practice Guidelines, Infobase e Evidence Based Medicine Online. Foram incluídas publicações de 1 de janeiro de 2000 a 28 de agosto de 2020, nas línguas inglesa e portuguesa. Os termos MeSH utilizados foram Clopidogrel, Aspirin e Gastrointestinal Hemorrhage.
Tabela 1: Estruturação da pergunta de investigação de acordo com o modelo PICO.
| População | Doentes em prevenção cardiovascular secundária com apenas um antiagregante |
| Intervenção | Tratamento com clopidogrel ou AAS |
| Comparação | Tratamento com AAS (se grupo de intervenção com clopidogrel) ou clopidogrel (se grupo de intervenção com AAS) |
| Outcome | Hemorragia gastrointestinal ou patologia gastrointestinal |
A estruturação da pergunta de investigação segundo o modelo PICO está descrita na Tabela 1.
Foram usados como critérios de exclusão artigos que incluíssem doentes tratados com dupla antiagregação ou antiagregação associada a hipocoagulação, estudos em animais, artigos repetidos ou incluídos em revisões sistemáticas previamente selecionadas e meta-análises, artigos de revisão, estudos que não respondam à pergunta de investigação estruturada e artigos redigidos noutras línguas que não o português e o inglês.
Foi realizada uma análise qualitativa através do uso da escala Strenght Of Recommendation Taxonomy (SORT) da American Family Physician. Esta escala avalia a quantidade, qualidade e consistência dos estudos, com recursos a níveis de evidência e a força de recomendação. Quanto aos níveis de evidência, o nível 1 consiste em estudos com boa qualidade e orientados para o doente. O nível 2 diz respeito a evidência de qualidade limitada, orientada para o doente. O nível 3 traduz outras evidências (artigos de opinião, guidelines de consenso, extrapolações, prática comum, evidências orientadas para doenças ou series de casos). Relativamente às forças de recomendação, um estudo com grau de recomendação A traduz evidência consistente e de elevada qualidade orientada para o doente (baseada em mortalidade, morbilidade, melhoria de sintomas, qualidade de vida e redução de custos). Um grau de recomendação B assenta em evidência inconsistente ou de qualidade limitada orientada para o doente. Por último, um grau de recomendação C fundamenta-se em evidência baseada em consensos, prática clínica, opiniões de peritos, orientada para a doença ou estudos de series de casos para diagnóstico, tratamento, prevenção ou rastreio.
Resultados
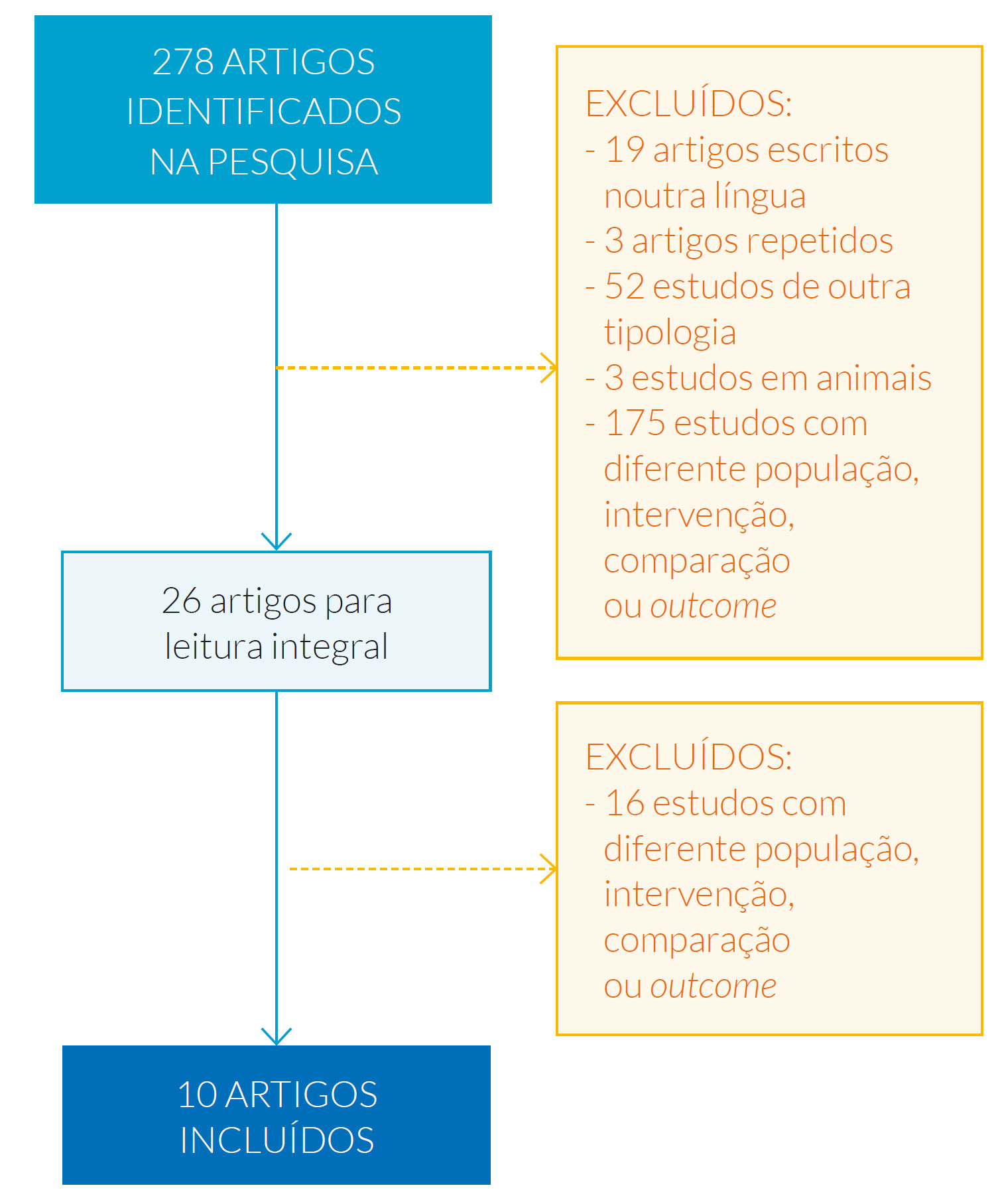
Da pesquisa inicial foram obtidos 278 resultados, tendo sido incluídas 10 publicações conforme descrito na Fig. 1.
Os dez artigos selecionados incluem uma revisão sistemática, quatro ensaios clínicos randomizados, três estudos coortes retrospetivos, um estudo coorte prospetivo e um estudo caso-controlo prospetivo, cujas características estão resumidas nas Tabelas 2, 3 e 4.
Tabela 2: Revisão sistemática.
| Referência | Métodos | Resultados | NE |
|---|---|---|---|
| McQuaid, KR e Laine L (2006)8 | 25 ensaios clínicos randomizados:
|
De acordo com resultados do ensaio CAPRIE:
|
1 |
n - amostra; AAS - ácido acetilsalicílico; NE - nível de evidência atribuído pelos autores; GI - gastrointestinal; RR - risco relativo; IC - intervalo de confiança
A revisão sistemática de McQuaid e Laine publicada em 2006 teve como objetivo principal determinar o risco absoluto e relativo de efeitos adversos clinicamente significativos com a toma dos agentes antiplaquetários AAS e clopidogrel.8 Foram selecionados artigos que incluíssem doentes a fazer terapêutica antiplaquetária para prevenção cardiovascular primária e secundária com AAS em baixa dose (75-325 mg/dia ou 150-325 mg em dias alternados) ou clopidogrel e que reportassem informação sobre hemorragia, mortes não-cardiovasculares, descontinuação por efeitos adversos ou outros sintomas. Mais especificamente, foram incluídos ensaios com: pelo menos um ramo tratado com AAS em baixa dose ou clopidogrel e um ramo de comparação com placebo, AAS em baixa dose (comparado com clopidogrel), clopidogrel (comparado com AAS) ou AAS combinado com clopidogrel. Os outcomes primários avaliados foram hemorragia major, hemorragia GI major ou hemorragia intracraniana.
Os autores avaliaram 25 ensaios clínicos randomizados, dos quais apenas um confrontou diretamente o AAS com o clopidogrel em cerca de 19 000 doentes. Os autores concluíram que em comparação com o clopidogrel, o AAS aumenta o risco de hemorragia GI, mas não aumenta significativamente o risco de outros tipos de hemorragia. No entanto, o aumento absoluto na incidência anual de hemorragias GI major com AAS versus clopidogrel é de 1,2 doentes por cada 1000 implicando que seriam necessários tratar anualmente 883 doentes com clopidogrel em vez de AAS para prevenir uma hemorragia GI major. Os autores defendem assim que a utilização de clopidogrel em vez do AAS em baixa dose com o objetivo de diminuir o risco hemorrágico não representa uma abordagem custo-eficaz.
Tabela 3: Ensaios clínicos randomizados.
| Referência | Métodos | Resultados | NE |
|---|---|---|---|
| Ng FH et al (2004)11 | Doentes entre 18 e 85 anos medicados com AAS em baixa dose para prevenção CV secundária, cuja EDA revelou úlceras >3 mm de diâmetro e >10 erosões gástricas ou duodenais (n=129): Duração: 8 semanas |
Nenhum doente em nenhum dos grupos teve um episódio de hemorragia GI. O sucesso do tratamento foi alcançado em 93,9% dos doentes sob clopidogrel e em 95,0% dos doentes sob AAS (p=1,00). | 2 |
| Chan FKL et al (2005)13 | Doentes medicados com AAS para prevenção secundária e que tiveram hemorragia de úlcera GI, após cicatrização da úlcera (n=320): Duração: 12 meses |
A incidência cumulativa de hemorragia GI por úlcera durante um período de 12 meses foi 7,9% (IC 95% 3,4- 12,4; p=0,001) significativamente maior nos doentes medicados com clopidogrel (8,6% (IC 95% 4,1-13,1)) vs AAS + esomeprazol (0,7% (IC 95% 0-2,0)). | 1 |
| Lai KC et al (2006)15 | Doentes com hemorragia de úlcera GI secundária a AAS, após a sua cicatrização (n= 170): Duração: 52 semanas |
A incidência cumulativa de recorrência de hemorragia devido a úlceras GI foi 13,6% (IC 95% 9,3-20,9; p=0,0019) significativamente maior com clopidogrel (13,6%) vs AAS + esomeprazol (0%). | 1 |
| Luo JC et al(2011)16 | Doentes com doença ulcerosa péptica, não hemorrágica, secundárias a AAS (n=218): Duração: 12 semanas |
Nenhum dos grupos apresentou hemorragia GI relacionada com úlceras. Não houve diferença estatisticamente significativa entre ambos os grupos relativamente à taxa de sucesso do tratamento (AAS + rabeprazol 86,2% vs clopidogrel + rabeprazol 90%, p=0,531). | 2 |
NE - nível de evidência atribuído pelos autores; AAS - ácido acetilsalicílico; CV - cardiovascular; EDA - endoscopia digestiva alta; n - amostra; GI - gastrointestinal; vs - versus; IC - intervalo de confiança
O ensaio clínico randomizado de Ng e colaboradores publicado em 2004 teve como principal objetivo testar a hipótese de que o clopidogrel seria superior ao AAS na cicatrização das úlceras e erosões tratadas com omeprazol.11 Participaram no estudo doentes entre os 18-85 anos, medicados com AAS em baixa dose (80-160 mg/dia) para prevenção secundária de doença cardiovascular e cerebrovascular, que realizaram endoscopia digestiva alta (EDA) por apresentarem dispepsia ou hemorragia GI e que apresentaram úlceras com diâmetro igual ou superior a três mm e mais de 10 erosões gástricas ou duodenais. Todos os 129 doentes selecionados foram randomizados para tratamento com AAS (n=60) ou clopidogrel 75 mg/dia (n=69), ambos em associação com omeprazol 20 mg/dia durante oito semanas. No fim do estudo foi repetida a EDA e o sucesso do tratamento foi definido como o desaparecimento das úlceras e pela presença de menos do que cinco erosões no estômago ou duodeno.
Nenhum doente teve um novo episódio de hemorragia GI e o sucesso do tratamento foi alcançado em 93,9% (IC 95% 88,0%-99,8%) dos doentes sob clopidogrel e em 95,0% (IC 95% 89,3%-100,0%) dos doentes sob AAS (p=1,00).
Chan e colaboradores publicaram em 2005 um estudo que incluía doentes a fazer AAS para prevenção cardiovascular secundária (CV) com antecedentes de úlcera hemorrágica.13 Após a cicatrização das úlceras, os 320 doentes selecionados foram randomizados para tratamento com 75 mg/dia de clopidogrel e placebo de esomeprazol duas vezes por dia (n=161) ou 80 mg de AAS e 20 mg de esomeprazol duas vezes por dia (n=159) durante 12 meses. O endpoint primário foi a recorrência de úlcera hemorrágica e o secundário foi a existência de hemorragia GI baixa.
A incidência cumulativa de hemorragia GI por úlcera durante um período de 12 meses foi 7,9% (IC 95% 3,4-12,4; p=0,001) significativamente maior nos doentes medicados com clopidogrel (8,6% (IC 95% 4,1-13,1)) vs AAS + esomeprazol (0,7% (IC 95% 0-2,0)). Por outro lado, a incidência cumulativa de hemorragia GI baixa não foi estatisticamente diferente (p=0,98 com clopidogrel (4,6% (IC 95% 1,3-7,9)) vs AAS + esomeprazol 4,6% (IC 95% 1,3-8,0)).
Em 2006, Lai e colaboradores realizaram um estudo semelhante ao de Chan e colaboradores, com a duração total de 52 semanas e envolvendo doentes em prevenção secundária.15 Os 170 doentes selecionados com antecedentes de hemorragia GI superior foram randomizados para tratamento com clopidogrel 75 mg/dia (n=84) ou AAS 100 mg/dia associado a esomeprazol 20 mg/dia (n=86). À semelhança dos resultados demonstrados por Chan e colaboradores (2004), foi observada uma incidência cumulativa de recorrência de hemorragia devido a úlceras GI 13,6% (IC 95% 9,3-20,9; p=0,0019) significativamente maior nos doentes tratados com clopidogrel (13,6%) comparativamente aos tratados com AAS e esomeprazol (0%).
Anos mais tarde, em 2011, Luo e colaboradores realizaram um ensaio clínico randomizado com o objetivo de comparar a taxa de cura em doentes com doença ulcerosa péptica não hemorrágica secundária a AAS medicados com inibidor da bomba de protões (IBP) e AAS ou IBP e clopidogrel.16 Participaram no estudo 218 doentes a fazer AAS para prevenção CV primária ou secundária, com sintomas de dispepsia e com doença ulcerosa péptica evidenciada através de EDA. Após a EDA, todos os doentes foram medicados com rabeprazol 20 mg/dia e randomizados para tratamento com AAS 100 mg/dia (n=109) ou com clopidogrel 75 mg/dia (n=109). A duração do tratamento e do estudo foi de 12 semanas e o endpoint primário foi a taxa de sucesso do tratamento da doença ulcerosa péptica definido pelo desaparecimento das úlceras gástricas e duodenais no fim do período de follow-up. O endpoint secundário foi a ocorrência de hemorragia por úlcera.
Nenhum dos grupos apresentou hemorragia GI relacionada com úlcera e não houve diferença estatisticamente significativa entre ambos relativamente à taxa de sucesso do tratamento (AAS 86,2% vs clopidogrel 90%, p=0,531).
Tabela 4: Estudos coorte e caso-controlo.
| Referência | Métodos | Resultados | NE |
|---|---|---|---|
| Hsiao FY et al (2009)17 Estudo coorte retrospetivo | Doentes hospitalizados por complicações GI major antes do início de tratamento com antiplaquetários (n=14 627):
|
Após ajuste, o risco de hospitalização por complicações GI major tornou-se significativamente menor nos doentes sob clopidogrel vs AAS (HR=0,83 (IC 95% 0,74-0,92)). | 2 |
| Tsai YW et al (2011)18 Estudo coorte retrospetivo | Doentes com história de hemorragia GI a quem foi prescrita terapêutica antiplaquetária após SCA à data de alta (n=3580):
|
Após ajuste de variáveis, os doentes a fazer clopidogrel (HR=0,23 (IC 95% 0,14-0,36)) e clopidogrel + IBP (HR=0,70 (IC 95% 0,32-0,96)) apresentaram menor risco para outcomes GI. | 2 |
| González-Pérez A et al (2016)19 Estudo coorte retrospetivo com análise caso-controlo | Doentes com 50-84 anos hospitalizados por evento coronário e que sobreviveram aos primeiros 30 dias (n=27 707). Casos:
|
Terapêutica atual com clopidogrel associada a aumento significativo no risco de hemorragia GI alta (OR 2,17 (IC 95% 1,35-3,49); p<0,01) e baixa (OR 1,86 (IC 95% 1,34-2,57); p<0,01). AAS em baixa dose associado a aumento não significativo no risco de hemorragia GI alta (OR 1,31 (IC 95% 0,76-2,27); p=0,33) e sem associação significativa com o risco de hemorragia GI baixa (OR 0,96 (IC 95% 0,68-1,35); p=0,80). | 2 |
| Tsai TJ et al (2012)20 Estudo coorte prospetivo | Doentes com sintomas dispépticos a fazer clopidogrel ou AAS no último mês antes da EDA (n=215):
|
Os utilizadores de clopidogrel apresentaram uma frequência significativamente superior de pontos hemorrágicos (25,5% vs 10,1%, p=0,004) e úlceras pépticas (38,7% vs 23,9%, p=0,027). As erosões foram significativamente superiores no grupo tratado com AAS (53,2% vs 38,7%, p=0,040). | 2 |
| Nagata Net al (2014)21 Estudo caso-controlo prospetivo | Casos: ≥ 18 anos, nacionalidade japonesa e hospitalizados de urgência por início de hemorragia GI baixa aguda, contínua ou frequente (n= 319). Controlos: ≥ 18 anos, nacionalidade japonesa e rastreio de cancro colorretal ou vigilância pós-polipectomia (n=3358). Exposição: Tratamento com AINEs, AAS em baixa dose, tienopiridinas ou outros antiplaquetários. Duração: 4 anos | A utilização isolada de AAS em baixa dose (OR ajustado = 1,3 (IC 95% 0,9-2,0); p=0,21) ou de tienopiridinas (OR ajustado = 2,4 (IC 95% 0,9-5,9);p=0,07) não foi associada significativamente a hemorragia GI baixa. | 2 |
NE - nível de evidência atribuído pelos autores; GI - gastrointestinal; n - amostra; AAS - ácido acetilsalicílico; IBP - inibidor da bomba de protões; CV - cardiovascular; EDA - endoscopia digestiva alta; vs - versus; HR - hazard ratio; OR - odds ratio; ≥ - maior ou igual; AINEs - anti-inflamatórios não esteroides
Progredindo para estudos com menor nível de evidência integrados nesta revisão, em 2009 Hsiau e colaboradores publicaram um estudo coorte retrospetivo baseado numa base de dados nacional de Taiwan.17 Teve como objetivo avaliar o risco de hospitalização recorrente por complicações GI major (úlcera péptica, hemorragia ou perfuração) em doentes com elevado risco GI com necessidade de terapêutica contínua com antiplaquetários (AAS ou clopidogrel) com ou sem IBP. Incluiu 14 627 doentes com antecedentes prévios de hospitalização por complicações GI major de úlcera péptica ou hospitalização por hemorragia GI major ou perfuração detetada na cirurgia, que tivessem iniciado AAS em doses inferiores a 325 mg/dia ou clopidogrel 75 mg/dia entre janeiro de 2001 e dezembro de 2006. Estes doentes foram estratificados em quatro subgrupos de acordo com a terapêutica utilizada: AAS em baixa dose (n=11 463), AAS associado a IBP (n=538), clopidogrel 75 mg (n=2036) ou clopidogrel associado a IBP (n=590). O follow-up terminou após a primeira recorrência de complicações GI ou após o fim do período de estudo.
Verificou-se que o risco de hospitalização por complicações GI major tornou-se significativamente menor nos doentes sob clopidogrel versus AAS (hazard ratio (HR) = 0,83 (IC 95% 0,74-0,92)). Relativamente aos doentes a fazer AAS, o risco foi significativamente menor nos doentes a fazerem IBP em associação (HR=0,80 (IC 95% 0,67-0,95)). Pelo contrário, não houve diferença estatisticamente significativa em doentes a fazer clopidogrel, com ou sem IBP (HR=1,10 (IC 95% 0,90-1,34)).
Utilizando a mesma base de dados de Taiwan, em 2011 Tsai e colaboradores selecionaram 3580 doentes com história de úlceras GI a quem foi prescrita terapêutica antiplaquetária após síndrome coronária aguda à data de alta entre janeiro de 2001 e dezembro de 2006.18 Assim, 1052 doentes foram medicados com clopidogrel associado a IBP, 1325 com clopidogrel e 1203 com AAS associado a IBP. À semelhança dos resultados encontrados por Hsiau e colaboradores (2009), os doentes tratados com clopidogrel (HR=0,23 (IC 95% 0,14-0,36)) e clopidogrel associado a IBP (HR=0,70 (IC 95% 0,32-0,96)) apresentaram menor risco para outcomes GI.
Em 2016, González-Pérez e colaboradores procuraram determinar o risco hemorrágico associado à toma de AAS ou clopidogrel em doentes previamente hospitalizados por eventos coronários através de um estudo coorte com análise caso-controlo.19 Recorreram a uma base de dados do Reino Unido e identificaram 27 707 doentes com 50-84 anos, hospitalizados por evento coronário entre 2000 e 2007 e que sobreviveram aos primeiros 30 dias. Os doentes foram seguidos até alcançarem um endpoint (acidente vascular cerebral (AVC) hemorrágico e hemorragia GI alta ou baixa), até morrerem ou ser alcançado o fim do estudo em 2011.
Foram considerados como casos os doentes diagnosticados com AVC hemorrágico (n=70), com hemorragia GI alta (n=152) ou com hemorragia GI baixa (n=316). Como controlo foram considerados 1000 doentes para o grupo de AVC hemorrágico, 1000 para o da hemorragia GI alta e 2000 para o da hemorragia GI baixa.
Verificou-se que a terapêutica atual com clopidogrel foi associada a aumento significativo no risco de hemorragia GI alta (OR 2,17 (IC 95% 1,35-3,49); p<0,01) e baixa (OR 1,86 (IC 95% 1,34-2,57); p<0,01). Pelo contrário, AAS em baixa dose foi relacionado com aumento não significativo do risco de hemorragia GI alta (OR 1,31 (IC 95% 0,76-2,27); p=0,33) e não teve associação significativa com o risco de hemorragia GI baixa (OR 0,96 (IC 95% 0,68-1,35); p=0,80).
Tsai e colaboradores publicaram em 2012 um estudo coorte prospetivo que pretendeu investigar as características dos achados endoscópicos em doentes medicados com clopidogrel submetidos a EDA por sintomas GI e comparar as características das lesões GI altas em doentes sintomáticos medicados com AAS ou clopidogrel.20 Foram incluídos 215 doentes com sintomas dispépticos a fazer clopidogrel ou AAS no último mês antes da EDA. Destes, 106 foram tratados com clopidogrel e 109 com AAS.
Constatou-se que os utilizadores de clopidogrel apresentaram uma frequência significativamente superior de pontos hemorrágicos (25,5% vs 10,1%, p=0,004) e úlceras pépticas (38,7% vs 23,9%, p=0,027). Por sua vez, as erosões foram significativamente superiores no grupo tratado com AAS (53,2% vs 38,7%, p=0,040).
Por fim, Nagata e colaboradores publicaram em 2014 um estudo caso-controlo prospetivo cujo objetivo era avaliar o risco de hemorragia GI baixa associado ao tratamento com anti-inflamatórios não esteroides (AINEs), AAS em baixa dose, tienopiridinas (ticlopidina ou clopidogrel) ou outros antiplaquetários.21 Assim, foram selecionados como casos 319 doentes, com idade igual ou superior a 18 anos, de nacionalidade japonesa e hospitalizados de urgência por início de hemorragia GI baixa aguda, contínua ou frequente. Como controlo, foram estudados 3358 doentes com idade igual ou superior a 18 anos, de nacionalidade japonesa e integrados no rastreio de cancro colorretal ou vigilância pós-polipectomia. Todos os indivíduos foram expostos a tratamento com AINEs, AAS em baixa dose, tienopiridinas ou outros antiplaquetários durante quatro anos.
Comprovou-se que a utilização isolada de AAS em baixa dose (OR ajustado = 1,3 (IC 95% 0,9-2,0); p=0,21) ou de tienopiridinas (OR ajustado = 2,4 (IC 95% 0,9-5,9);p=0,07) não foi significativamente associada a hemorragia GI baixa.
Discussão
Os dez artigos incluídos nesta revisão baseada na evidência apresentam elevada heterogeneidade a nível do objetivo do estudo, da população incluída e dos outcomes avaliados.
A revisão sistemática incluiu 25 ensaios clínicos randomizados, mas apenas um comparava diretamente a ação do AAS com o clopidogrel, tendo demonstrado um risco relativo aumentado de hemorragia GI em doentes tratados com AAS. Contudo, uma análise pormenorizada do mesmo sugere um tratamento custo-eficaz mais favorável através da utilização de AAS associado a IBP em vez de clopidogrel com o intuito de diminuir o risco hemorrágico GI. Tendo em conta o desenho do estudo e o número de doentes incluídos, os autores atribuíram um nível de evidência 1 a esta revisão sistemática.
Por sua vez, dois dos ensaios clínicos randomizados, a que os autores concederam nível de evidência 1, apontam para um risco significativamente maior de hemorragia GI em doentes medicados com clopidogrel comparativamente a AAS associado com IBP. No entanto, os outros dois ensaios clínicos randomizados, com nível de evidência 2 conferido pelos autores, comparam o tratamento com AAS associado a IBP com a terapêutica com clopidogrel em associação com IBP e não demonstram diferenças estatisticamente significativas entre os grupos.
Relativamente aos estudos coorte analisados, com menor nível de evidência atribuído pelos autores, dois sugerem que o risco de hospitalização por complicações GI major é significativamente menor em doentes tratados com clopidogrel, enquanto outros dois apontam para um risco significativamente maior de hemorragia gastrointestinal com clopidogrel.
No que concerne à hemorragia GI baixa, o estudo coorte retrospetivo com análise caso-controlo e o estudo caso-controlo prospetivo são concordantes em confirmar que não há associação estatisticamente significativa com tratamento com AAS. Contudo, são contraditórios relativamente ao tratamento com clopidogrel, com um dos estudos a afirmar que há aumento significativo do risco de hemorragia GI baixa.
Conclusão
Assim, após análise de todos os estudos, não foi estabelecida uma relação consensual que favoreça a escolha do clopidogrel, pelo que se conclui que atualmente não existe evidência científica de superioridade do clopidogrel em relação ao AAS no que concerne à redução do risco hemorrágico GI. Esta afirmação tem força de recomendação B, pois a evidência disponível sobre esta temática carece de estudos metodologicamente adequados, robustos e de alta qualidade que validem a evidência encontrada.