Introdução
A rinite é uma inflamação da mucosa nasal, da qual resultam sintomas como a obstrução nasal, esternutos, rinorreia ou prurido nasal. As rinites não infeciosas, têm sido classificadas em Rinite Alérgica (RA) e Rinite Não Alérgica (RNA), tendo em consideração a história clínica, a resposta aos testes cutâneos por picada e o doseamento dos níveis séricos de Imunoglobulina E para os alergénios inalantes específicos (sIgEe)1.
A RA constitui a entidade clínica mais comum das rinites não infeciosas. No entanto, a RNA também tem uma prevalência considerável1.
Alguns centros europeus têm sugerido que doentes com sintomas de rinite perene ou sazonal apresentam, em 47 a 62.5% dos casos, anticorpos IgE específicos séricos indetetáveis e testes cutâneos por picada negativos. Na maioria destes doentes, tem sido considerado o diagnóstico de Rinite Idiopática ou Rinite Não Alérgica com Eosinofilia (NARES) 2-5.
Evidências recentes têm sugerido que a abordagem clássica das rinites é incompleta, uma vez que, muitos dos doentes diagnosticados com RNA podem ser classificados como tendo um fenótipo de Rinite Alérgica Local (RAL) 2-6.
A primeira evidência de uma resposta alérgica localizada na mucosa nasal, com produção local de anticorpos IgE nos doentes com RNA, foi reportada, em 1975, por Huggins e Brostoff7. Em 2001/2002, um grupo australiano2 também relatou um aumento de produção local de anticorpos IgE na mucosa nasal de doentes com RA e RNA. Este fenómeno foi descrito como “entopia”, tratando-se de uma resposta alérgica restrita à mucosa nasal com ausência de uma resposta alérgica sistémica1-2. Estes achados levaram à identificação de um fenótipo distinto: a RAL, inicialmente considerada como RNA (com testes cutâneos por picada negativos) 1-6.
A RAL é uma resposta alérgica nasal localizada com ausência de atopia sistémica. Caracteriza-se pela produção local de anticorpos IgE específicos, por um padrão de resposta inflamatória TH2 durante a exposição a aeroalergénios e uma resposta positiva à prova de provocação nasal com alergénio, (PPNA) com libertação de mediadores inflamatórios nas secreções nasais (triptase e proteína catiónica eosinofílica) 8.
Segundo a literatura publicada, a prevalência da RAL é superior nos países do Sul da Europa (Portugal, Espanha, Itália, Grécia), representando entre 50 a 75% das rinites diagnosticadas inicialmente como RNA. No entanto, ainda é uma entidade clínica subdiagnosticada3-6. Nos países asiáticos, estima-se que a prevalência de RAL não seja superior a 20%9-10.
Material e Métodos
Revisão sistemática da literatura publicada sobre Rinite Alérgica Local, incidindo na sua abordagem diagnóstica e terapêutica, com vista à elaboração de um protocolo. A pesquisa foi efetuada recorrendo à base de dados online na PubMed. Foram englobados na pesquisa artigos publicados entre janeiro de 2000 e dezembro de 2021, recorrendo às seguintes palavras-chave: “allergic rhinitis”, “local allergic rhinitis”, “rhinitis diagnostic methods”, “rhinitis therapeutic approaches”.
A revisão foi restrita a estudos publicados em língua inglesa. Os artigos elegíveis foram selecionados com base em três etapas: título, resumo e publicação em texto completo.
Foram considerados artigos de revisão, metanálises e revisões sistemáticas, protocolos de atuação, estudos transversais e de coorte. Foram excluídos os estudos que apresentavam uma ou mais das seguintes características: estudos utilizando métodos não padronizados, estudos duplicados e sobrepostos, estudos publicados em outros idiomas que não o inglês.
Após aplicação dos critérios de inclusão, foram considerados 19 artigos para a elaboração do nosso protocolo.
Resultados
1. Definição e classificação da Rinite:
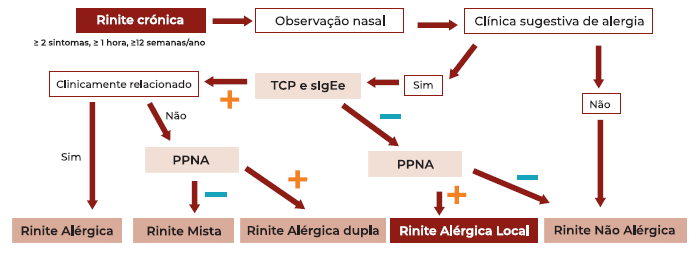
A classificação etiológica da Rinite Não Infeciosa divide-se em RA e RNA. A prevalência exata dos doentes com RNA é desconhecida, correspondendo a um grupo heterogéneo de patologias com manifestação nasal que, em alguns casos, encontram-se associadas a um fator desencadeante específico (“trigger”). Porém, na maioria, a causa é geralmente desconhecida, sendo as RNAs categorizadas como uma rinite idiopática ou vasomotora. A RNA com Síndrome de Eosinofilia (NARES) é considerada uma entidade nosológica distinta, na qual um subgrupo de doentes com RNA apresenta eosinofilia na mucosa nasal, com boa resposta ao tratamento tópico com corticóide nasal9. Nos últimos anos, vários estudos têm demostrado que uma percentagem significativa de doentes, com testes cutâneos por picada e doseamento sérico de IgE específica negativos, que seriam classificados como RNA, apresentaram sintomas nasais após a realização de uma PPNA3-4. Estudos mais recentes sugerem que ocorre produção local, a nível da mucosa nasal, de IgE específica nestes doentes, pelo que, uma nova entidade fenotípica foi proposta - a RAL, conduzindo a uma nova classificação etiológica da Rinite3-6,11 (Tabela 1).
Tabela 1 Classificação etiológica da Rinite (adaptado de Rondón et al. 11)
| 1. RINITE ALÉRGICA |
|---|
| Rinite Alérgica (com atopia sistémica) |
| Classificação clássica |
| - Tempo de exposição ao aeroalergénio: perene, sazonal, ocupacional |
| Classificação ARIA1 |
| - Duração dos sintomas: persistente, intermitente |
| - Severidade dos sintomas: ligeira, moderada, severa |
| Rinite Alérgica Local (sem atopia sistémica) |
| Classificação clássica |
| - Tempo de exposição ao aeroalergénio: perene, sazonal, ocupacional |
| Classificação ARIA1 |
| - Duração dos sintomas: persistente, intermitente |
| - Severidade dos sintomas: ligeira, moderada, severa |
| 2. RINITE NÃO ALÉRGICA |
| Infeciosa |
| Ocupacional |
| Induzida por fármacos |
| Hormonal |
| Irritativa |
| Gustatória |
| Emocional |
| Atrófica |
| NARES |
| Idiopática |
2. Rinite Alérgica Local - Epidemiologia e fisiopatologia:
A RAL apresenta uma maior prevalência nos países Mediterrânicos comparativamente aos países do Norte da Europa e países asiáticos12. A prevalência da RAL nas crianças tem sido pouco estudada, contudo, nos estudos realizados, parece semelhante à prevalência no adulto12-14.
Os alergénios mais frequentemente associados à RAL são: ácaros do pó doméstico (Dermatophagoides pteronyssinus), gramíneas, Alternaria alternata e, menos frequentemente, pêlo animal e Olea europaea (oliveira) 3-5. Pode ocorrer reatividade nasal a vários aeroalergénios, à semelhança do que acontece na RA 3,5,15.
Rondón et al., demonstraram que os doentes com RAL apresentam um infiltrado eosinofílico na mucosa nasal após exposição a aeroalergénio, havendo subitamente um aumento e posterior diminuição da triptase nas secreções nasais, enquanto a concentração da proteína catiónica eosinofílica (PCE) aumenta progressivamente nas 24 horas seguintes3,6. Por outro lado, os doentes com RAL apresentam um aumento significativo de IgEs nas secreções nasais nas 24 horas após exposição a aeroalergénio3. Estes achados imunológicos sugerem a ocorrência de um mecanismo IgE mediado.
A presença de IgE nas secreções nasais de doentes com RAL após exposição a aeroalergénios surge em 22 a 35% dos doentes3,4. Esta baixa deteção de IgE pode ser explicada pela baixa sensibilidade do método de diagnóstico aplicado, pelo que o doseamento de IgE nas secreções nasais se encontra reservado apenas para investigação e não como método de diagnóstico na prática clínica3,4,16.
A análise das secreções nasais por citometria de fluxo, dos doentes com RAL expostos a aeroalergénios, demonstrou um padrão de infiltrado inflamatório semelhante ao da RA, com aumento dos níveis de eosinófilos, basófilos, mastócitos, células T CD3+ e CD4+, sugerindo a ocorrência de uma resposta inflamatória TH2 IgE mediada3,4.
3. Manifestações clínicas:
A sintomatologia da RAL é semelhante à da RA. Os doentes podem apresentar-se com obstrução nasal, rinorreia, esternutos e prurido nasal, sendo, estes últimos três, mais frequentemente reportados na RAL3-5 (Tabela 2). Estes doentes podem apresentar ainda outras patologias extra-nasais, tais como, conjuntivite e asma. A maioria dos doentes com RAL reportam sintomatologia persistente, de gravidade moderada a grave, com associação a conjuntivite e asma (em até 50%)3-4,11.
4. Diagnóstico:
Algumas manifestações da RNA mimetizam sintomas da RA, mas a sua distinção é de enorme importância, uma vez que, a sua abordagem e tratamento podem ser distintos.
Rondón et al.11 propuseram uma nova abordagem diagnóstica para os doentes com sintomas de Rinite Alérgica que apresentem testes cutâneos por picada (TCP) e sIgEe negativos (Figura 1).
O diagnóstico da RAL pode ser confirmado através da deteção de IgE nas secreções nasais e/ou numa resposta positiva à PPNA. No entanto, a PPNA é o método de diagnóstico gold standard na RAL, pela sua elevada especificidade, sensibilidade e reprodutibilidade3-6,8.
4.1. Prova de provocação nasal com aeroalergénio:
A PPNA é uma técnica segura e bem tolerada, tanto pelo método de administração via spray nasal, como por micropipeta 17. Esta técnica apresenta uma elevada precisão diagnóstica, através de uma metodologia padronizada e validada para positividade com parâmetros cut-off18.
A PPNA, além de constituir o método de diagnóstico da RAL, também pode ser implementada noutras situações clínicas19 (Tabela 3).
Tabela 3 Indicações para realização de PPNA
| Indicações para realização da prova de provocação nasal com alergénio (PPNA) 19 |
|---|
| Diagnóstico: |
| Rinite alérgica persistente |
| Rinite alérgica intermitente |
| Rinite alérgica local |
| Rinite alérgica ocupacional |
| Correlação com sintomas extranasais |
| Diagnóstico diferencial de sintomas oculares |
| Aumento da evidência no diagnóstico de alergia alimentar |
| Monitorização clínica da eficácia da Imunoterapia |
Existem contraindicações absolutas para a realização da PPNA, sendo estas: rinossinusite aguda viral ou bacteriana, exacerbação aguda de doença alérgica, reação anafilática prévia a alergénio, doenças sistémicas com redução da capacidade pulmonar e gravidez. Como contraindicações relativas, que devem motivar o protelamento da PPNA, temos as seguintes: episódios de agudização da Rinite Alérgica (aguardar 2-4 semanas), cirurgia nasal (aguardar 6-8 semanas), tratamento com anti-histamínico (aguardar 3 dias), corticóide tópico nasal (aguardar 1 semana), corticóide oral com dose superior a 10mg (1-2 semanas), anti-inflamatórios não esteróides (1 semana), antihipertensores de ação central (3 semanas) e antidepressivos tricíclicos (1 semana) 19-20.
A solução utilizada na PPNA é composta por extrato de alergénio em concentração predefinida, diluída numa solução isotónica de pH neutro19-20.
Rondón et al.18 definiram um protocolo de PPNA com múltiplos alergénios, no qual utilizam as seguintes concentrações dos aeroalergénios mais comumente associados a RAL: soluções de Dermatophagoides pteronyssinus a 4µm/mL, Alternaria alternata a 0.25µm/mL, Olea europaea a 0.6µm/mL e gramíneas a 0.1µm/mL.
4.2. Protocolo da Prova de Provocação Nasal com Aeroalergénio (Figura 2):
A realização da PPNA exige determinadas condições que devem ser cumpridas para garantir a sua reprodutibilidade e semelhança às condições da vida diária:
a) Condições da sala
Os doentes devem ambientar-se às condições da sala onde se irá realizar a PPNA, 15-30 minutos antes do início da prova. Esta deve encontrar-se a uma temperatura de 20+/-1.5ºC, com um nível de humidade entre 40-60%15,19-20.
b) Pessoal qualificado e medicação de emergência
Deve ser colhido consentimento informado antes da realização da PPNA. O local da realização da prova deve ter uma sala de emergência e unidade de cuidados intensivos a 30 minutos. Na sala deverá existir um kit e fármacos de emergência19.
c) Alergénios
Os alergénios encontram-se disponibilizados já em soluções standard. As soluções utilizadas na PPNA devem ser isotónicas e de pH neutro15,19-20.
d) Técnica de aplicação de alergénios
A formulação com maior reprodutibilidade e facilidade de aplicação, é a formulação em spray para pulverização nasal, por permitir a dispensa de uma quantidade similar e padronizada entre doentes, sendo a dose dispensada exatamente de 50µL por pulverização.
A aplicação do spray é realizada com duas pulverizações, em cada narina, uma delas a nível do meato inferior e outra em direção ao meato médio19-20. Deverá ser evitada a inclinação em direção ao septo
nasal. Por forma a prevenir que os alergénios atinjam a via aérea inferior, deverão ser tomadas as seguintes medidas durante a aplicação do spray: 1. Inalação profunda, 2. Suspensão da respiração durante a aplicação do spray, 3. Expiração profunda após aplicação do spray15,19.
e) Avaliação de resultados
Todos os doentes são submetidos a uma avaliação com questionário de sintomatologia, rinoscopia, rinomanometria anterior e/ou rinometria acústica por forma a estabelecer o estado basal do doente. Após o período de aclimatização na sala de prova, efetua-se uma prova para exclusão de hiperreatividade da mucosa nasal com solução salina (duas pulverizações em cada narina). Os parâmetros de avaliação basal são repetidos após 10-15 minutos desta prova inicial. Se não ocorrerem alterações, prossegue-se para a PPNA. A reavaliação dos parâmetros é efetuada 10-15 minutos após a provocação com alergénio. Após a finalização da prova, os doentes ficam em vigilância durante 30 minutos, devido à possibilidade de ocorrência de reação alérgica.
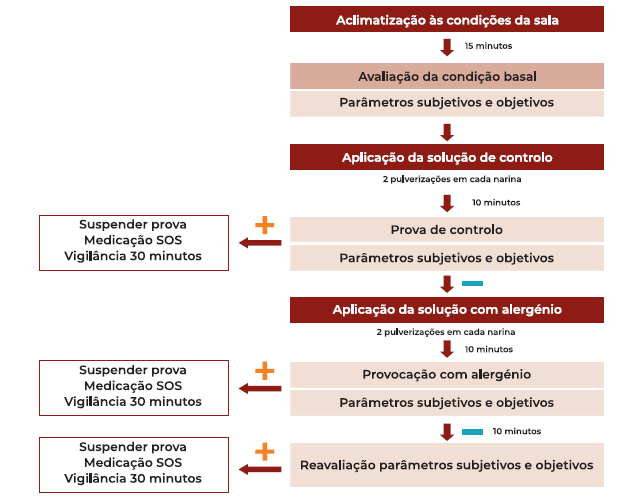
Figura 2 Protocolo da Prova de Provocação Nasal com Aeroalergénio (PPNA).Legenda: Parâmetros subjetivos: sintomas reportados pelo doente (obstrução nasal, rinorreia, esternutos, prurido nasal, sintomas oculares), classificados de acordo com gravidade (0 - nenhum; 1 - ligeiro; 2 - moderado; 3 - severo). Parâmetros objetivos: avaliação da permeabilidade nasal, com recurso a rinomanometria anterior ativa.
f) Critérios de positividade na PPNA
Na avaliação da resposta à prova de provocação nasal são considerados parâmetros subjetivos (sintomas) e objetivos (permeabilidade nasal) após provocação com alergénio.
A avaliação ideal dos parâmetros subjetivos é a proposta no Position Paper de Augé et al.19, que se baseou na escala Total Nasal Symptom Score e nos scores de Linder e Lebel, e assenta em cinco sintomas: esternutos, prurido nasal, rinorreia, obstrução nasal e sintomas oculares (Tabela 4). Os sintomas reportados são classificados de acordo com a gravidade descrita pelos doentes (0 - nenhum; 1 - ligeiro; 2 - moderado; 3 - severo). Os valores apontados para cada sintoma são somados, por forma, a obter o valor total, sendo a variação, deste valor, comparada antes e após a realização da PPNA.
Tabela 4 PPNA: Critérios subjetivos
| Critérios subjetivos |
|---|
| Obstrução nasal |
| Rinorreia |
| Esternutos |
| Prurido nasal |
| Sintomas oculares |
A permeabilidade nasal pode ser avaliada com os seguintes métodos objetivos: pico do fluxo inspiratório nasal (PNIF), rinomanometria anterior ativa, rinometria acústica ou rinomanometria de quatro fases19 (Tabela 5). Neste protocolo, os autores optaram pela utilização da rinomanometria anterior ativa, dado a sua sensibilidade, elevada especificidade e por constituir o método standard internacionalmente aceite para a avaliação objetiva da permeabilidade nasal19.
A avaliação da permeabilidade nasal através de rinomanometria anterior ativa é efetuada previamente à realização da PPNA e repetida após 10 minutos. Sendo avaliada a variação da permeabilidade nasal, comparativamente, entre as duas provas.
Tabela 5 PPNA: Critérios objetivos - Métodos complementares de diagnóstico
| Critérios objetivos | |
|---|---|
| Pico do fluxo inspiratório nasal (PNIF) | - Fácil execução, pouco dispendioso - Dependente da colaboração do doente e da capacidade pulmonar |
| Rinometria acústica | - Fácil e rápida execução - Não depende da colaboração do doente |
| Rinomanometria anterior ativa | - Sensível, elevada especificidade - Método standard para medição da permeabilidade nasal |
| Rinomanometria de quatro fases | - Método mais fiável para avaliação da permeabilidade e ventilação nasal |
Para que a PPNA seja considerada positiva (Tabela 6) é necessário que um dos seguintes critérios seja cumprido19:
Alteração significativa nos parâmetros subjetivos (≥5);
Alteração significativa nos parâmetros objetivos (≥40%);
Alterações moderada nos parâmetros subjetivos (≥3) e objetivos (≥20%).
Tabela 6 Positividade na Prova de Provocação Nasal com Aeroalergénio (PPNA)
| Método | Alteração significativa | Alteração moderada |
| Subjetivo (sintomas) | - Aumento ≥ 5 pontos no valor total da classificação de gravidade dos sintomas | - Aumento ≥ 3 pontos no valor total da classificação de gravidade dos sintomas |
| Objetivo | - Diminuição ≥ 40% na permeabilidade nasal | - Diminuição ≥ 20% na permeabilidade nasal |
5. Tratamento
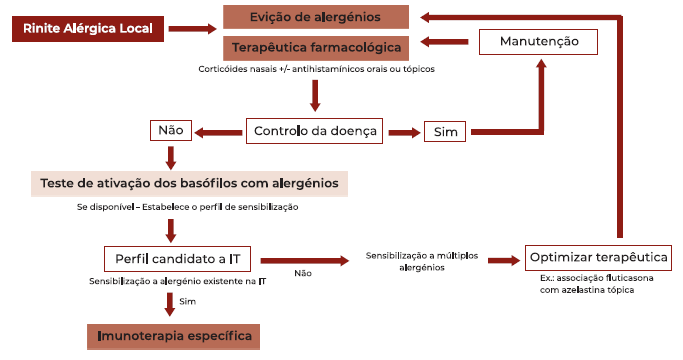
A correta distinção entre a RAL e a RNA é fundamental para a abordagem terapêutica desta nova entidade (Figura 3).
Apesar da inexistência de um estudo dirigido a comprovar a eficácia das medidas de evicção de alergénios e da farmacoterapia nos doentes com RAL, estes apresentam melhoria sintomática quando submetidos a corticoterapia tópica nasal e a antihistamínicos orais e tópicos3-4,10.
Esta é uma característica fenotípica da RAL em contraste a RNA. Esta característica poderá ser justificada pelas semelhanças clínicas e fisiopatológicas entre a RAL e a RA, que incluem o infiltrado inflamatório eosinofílico e a reatividade a alergénios.
Um estudo observacional e quatro ensaios clínicos duplamente cegos, controlados por placebo21-24 demonstraram evidência de melhoria com a utilização de imunoterapia específica (IT) na RAL. Seis meses após a IT, os doentes apresentavam diminuição da sintomatologia (nasal, ocular, pulmonar) e diminuição da utilização de medicação de crise, assim como, maior tolerância aos alergénios e melhoria da qualidade de vida.
O sucesso da IT na RAL encontra-se associado ao aumento dos níveis séricos de IgG4 específica e à diminuição da IgE nas secreções nasais.
Ainda não se encontra documentado se a IT na RAL modifica o curso clínico da doença16.
Discussão
O diagnóstico da Rinite Alérgica (RA) é baseado na história clínica, respostas positivas nos testes cutâneos por picada e positividade das IgE específicas séricas. No entanto, a associação na colheita de uma história clínica estruturada associada a sIgEe dirigidas eleva a precisão diagnóstica na RA, em comparação com a história clínica isoladamente.
Contudo, esta abordagem diagnóstica não permite o diagnóstico da RAL, na qual os TCP e as sIgEe são negativas, sendo necessário para o seu diagnóstico a realização de PPNA2-6.
O facto das séries de doentes com diagnóstico de RAL já terem um alargado período de seguimento e vigilância, sem evolução para RA, sustenta o conceito de que a RAL é uma entidade independente da RA, apesar das semelhanças na sintomatologia e na resposta terapêutica8.
Alguns autores defenderam a realização de pesquisa de IgE nas secreções nasais durante a exposição natural aos alergénios ou após a realização da PPNA, uma vez que, in vitro a deteção de sIgE apresenta uma elevada especificidade, apesar de ter uma baixa sensibilidade (entre 22 a 40%). A sua baixa sensibilidade pode ser explicada pelo efeito de diluição, por uma resposta não específica aos ácaros domésticos ou por outros motivos ainda não identificados8. Dada a sua baixa sensibilidade, a IgE detetada nas secreções nasais não constitui um bom método de diagnóstico para RAL, estando reservada a sua utilização para estudos de investigação3-4,16.
A PPNA é uma ferramenta diagnóstica de grande utilidade, com maior sensibilidade que outros métodos de diagnóstico, tais como, a deteção de sIgEe, triptase, proteína eosinofílica catiónica ou o teste de ativação dos basófilos, apesar do elevado tempo necessário para a sua execução3-6.
Rondón et al.15 definiram um protocolo com testagem de vários alergénios numa única sessão (PPNAm), com a utilização de um painel com os quatro alergénios mais comumente envolvidos na RAL, tendo concluído que este método seria igualmente útil, específico, sensível, reprodutível e com menor consumo de tempo que a testagem com um único alergénio. Demonstraram também que a PPNAm é 100% concordante com os resultados da PPNA e é segura, não tendo ocorrido nenhuma resposta inflamatória exacerbada comparativamente à PPNA. Num estudo prévio de Wierzbicki et al.25, no qual também foi utilizado um painel múltiplo de alergénios na PPNA para diagnóstico de RAL, em doentes inicialmente classificados com RNA perene, ocorreram sete resultados falsos positivos. Estes resultados discordantes podem dever-se à utilização de uma diferente solução de controlo (com desencadeante de resposta irritativa nasal) ou também à realização da prova apenas numa das fossas nasais. Algumas soluções de alergénios contêm conservantes que podem reagir com a mucosa nasal, pelo que é essencial fazer um controlo através de testagem com aplicação da solução de diluição na mucosa nasal, por forma a excluir hiperreatividade nasal19.
Por outro lado, no protocolo de Wierzbicki et al.25, também utilizaram uma concentração de alergénio (nomeadamente de D. pteronyssinnus) inferior à concentração recomendada para despoletar uma resposta positiva da mucosa nasal. Apesar da PPNAm ser essencial para o diagnóstico dos doentes com RAL mono e polissensibilizados a alergénios, não é possível medir a intensidade da resposta alérgica nasal. Esta só é possível através de uma PPNA com aumento progressivo da concentração de alergénio administrado na provocação até atingir uma concentração alvo que despolete a sintomatologia alérgica3-4.
Na avaliação da resposta à PPNA, existem diferentes escalas que facilitam a avaliação subjetiva da sintomatologia alérgica. A classificação da resposta pode ser baseada no relato dos sintomas nasais pelo doente - escala de Likert (0 - nenhum, 1 - ligeiro, 2 - moderado, 3 - severa), ou através da Escala Analógica Visual (VAS), na qual é reportada a severidade dos sintomas (ligeiro: 0-30mm; moderada: 31-70mm; severa: 71-100mm) A Total Nasal Symptom Score (TNSS) é uma escala que avalia quatro sintomas (rinorreia, obstrução nasal, esternutos, prurido nasal). No Position Paper de Augé et al.19 foi sugerido que a escala ideal para a avaliação dos sintomas de RA deveria conter os seguintes sintomas: rinorreia, obstrução nasal, esternutos, prurido nasal e sintomas oculares.
Apesar de não existir nenhum estudo dirigido para o efeito das medidas de evicção de alérgenios ou do tratamento médico nos doentes com RAL, estes, à semelhança da RA, apresentam boa resposta ao tratamento com corticóides nasais tópicos e com antihistamínicos tópicos ou orais16. Ao contrário da RNA, esta boa resposta ao tratamento farmacológico pode ser explicada pelas semelhanças no padrão inflamatório nasal de doentes com alergia local e sistémica.
Nos últimos anos tem sido considerado se a IT poderia ter um papel na RAL. A utilização de IT na RAL encontra-se suportada por 1 estudo observacional e 4 ensaios clínicos duplamente cegos, controlados por placebo21-24.
Esses estudos mostraram que a IT permite o controlo dos sintomas nasais, conjuntivais e brônquicos, com possibilidade de redução da medicação de resgate em doentes com RAL sensibilizados a pólens de gramíneas, bétulas e ácaros do pó doméstico. Além disso, a IT aumenta a qualidade de vida e a tolerância nasal e brônquica ao alergénio nos doentes com RAL. A IT é um tratamento seguro, tendo-se apenas verificado escassas reações ligeiras a moderadas durante a administração, tanto da solução com alergénio como com a solução placebo14.
Ainda não foi possível estabelecer associação da IT nos doentes com RAL com os seus efeitos a longo prazo, bem como, a sua capacidade de modificar o curso natural da doença. No entanto, nos casos de RAL refratários a medidas de prevenção e/ou corticóides e anti-histamínicos orais ou nasais, a IT pode ser administrada para reduzir os sintomas, diminuir a necessidade de medicação de resgate e melhorar a qualidade de vida16.
Conclusão
A Rinite Alérgica Local constitui um fenótipo distinto das rinites classicamente descritas, sendo ainda uma entidade subdiagnosticada, que afeta uma proporção significativa de doentes classificados com Rinite Não Alérgica (testes cutâneos por picada e IgE específica sérica negativos).
A implementação da prova de provocação nasal com aeroalergénio nos algoritmos diagnósticos da rinite é essencial para o reconhecimento precoce da Rinite Alérgica Local e para a prescrição de tratamento adequado, que ao contrário da Rinite Não Alérgica, apresenta boa resposta ao tratamento médico com corticóides nasais e/ou antihistamínicos orais ou tópicos.
Nos casos de Rinite Alérgica Local moderados a graves, refratários ao tratamento médico, a imunoterapia subcutânea com alergénio específico constitui um tratamento seguro e apresenta bons resultados, com controlo da sintomatologia, diminuição da necessidade de medicação de resgaste e melhoria da qualidade de vida.
Conflito de Interesses
Os autores declaram que não têm qualquer conflito de interesse relativo a este artigo.