Introdução
A perda auditiva congénita ou adquirida em idade pediátrica é relativamente comum com cerca de 1:1000 recém-nascidos (RN) a apresentar perda auditiva severa-profunda e 1:500 a desenvolver algum grau de perda auditiva durante a infância. 1-5
Para além da sua elevada prevalência, a perda auditiva em idade pediátrica traduz-se em desvios no normal desenvolvimento da criança, associando-se a alterações no desenvolvimento da linguagem verbal, nomeadamente atraso na aquisição da fala, limitação de capacidades cognitivas e prejuízo na comunicação e interação social da criança. 2-8
O diagnóstico deve ser o mais precoce possível, com vista a reduzir as previsíveis consequências nas várias etapas do desenvolvimento infantil. Ferramentas como o rastreio auditivo neonatal universal (RANU) 2, o seguimento regular em consulta de saúde infantil pelo médico assistente de Medicina Geral e Familiar ou de Pediatria, o reconhecimento, por estes profissionais, dos principais fatores de risco para a perda auditiva durante a infância e os protocolos de referenciação hospitalar, céleres, são essenciais para o prognóstico da criança com surdez.
Em Portugal, o Grupo de Rastreio e Intervenção da Surdez Infantil (GRISI) definiu como metas a identificação de todas as crianças com perda auditiva até aos 3 meses de idade e o início ideal da intervenção até aos 6 meses de idade. 2
Para o rastreio universal e diagnóstico, existem hoje equipamentos audiológicos de fácil acesso e manejo que permitem a avaliação objectiva, não invasiva e até automática da audição. As duas grandes estratégias utilizadas neste contexto são as Otoemissões Acústicas (OEA) e os Potenciais Evocados Auditivos (PEA). As OEA são sons originados na cóclea, nomeadamente em resposta a um estímulo auditivo, e que podem ser registados por um microfone no canal auditivo externo. Existem dois grandes grupos de OEAs, as espontâneas e as evocadas. Nestas últimas, identificamos as OEA transitórias e os produtos de distorção, podendo ambas ser testadas no rastreio auditivo neonatal com igual nível de eficiência. 9-11 Em resposta a um estímulo auditivo os PEA registam ondas com diferentes latências correspondendo a diferentes pontos da via auditiva desde a cóclea até ao córtex cerebral. São uma medida objetiva da função auditiva, permitindo estimar os limiares auditivos do examinado bem como contribuir para o topodiagnóstico. Tanto as OEA como os PEA, de forma isolada ou combinada, permitem identificar os RN com perda auditiva superior a 35 2 ou 40 dB HL. 5,6,9 Não obstante, mesmo as crianças que passem no teste de rastreio aplicado à nascença e, portanto, não apresentem evidência de perda auditiva neonatal, devem manter seguimento em consulta de saúde infantil, com monitorização de eventuais sinais de perda auditiva tardia e referenciação a consulta de especialidade se tal se mostrar indicado. 2,8,12
São os novos fatores de risco recentemente introduzidos na literatura médica que justificam a sugestão da revisão do algoritmo associado ao RANU. O objetivo do presente trabalho é elaborar e propor um algoritmo que permita o rastreio, diagnóstico precoce e referenciação célere da criança em risco para a perda auditiva, a aplicar não só na consulta de Vigilância de Saúde Infantil e Juvenil nos Cuidados de Saúde Primários, mas também nas consultas de Pediatria e Otorrinolaringologia.
Material e Métodos
Revisão da literatura através de pesquisa nos websites Pubmed, NCBI, da American Academy of Pediatrics (AAP) e da Direcção Geral de Saúde utilizando os termos “surdez infantil”, “infant hearing loss”, “neonatal screening”, “auditory screening” e “hearing risk factors”. Foram consultadas as Recomendações para o Rastreio Auditivo Neonatal Universal (RANU) do Grupo de Rastreio e Intervenção da Surdez Infantil - GRISI (2007) 2, as recomendações da AAP3,4, as recomendações do EUSCREEN Vision & Hearing 20215, as recomendações do The Joint Committee on Infant Hearing (JCIH) 6 e as recomendações da Societé Française de Pédiatrie13. Em temas introduzidos recentemente em RNs prematuros usámos a idade cronológica.
Resultados
Os principais fatores de risco para a perda auditiva em idade pediátrica que exigem referenciação a consulta de ORL foram identificados com base nas normas clínicas previamente existentes em Portugal 2 e nas recomendações de outras sociedades internacionais (Tabela 1).3,5,6 A literatura acrescenta ainda timings de reavaliação para diferentes situações clínicas, como por exemplo o alargamento até aos 6 anos de idade da avaliação audiológica seriada a crianças que foram submetidas a ECMO 14 ou crianças após infeção intra-uterina a citomegalovirus (CMV) (Tabela 2)15. Em contexto de consulta de Vigilância de Saúde Infantil e Juvenil, foram propostos sinais de alarme em diferentes etapas do desenvolvimento que devem motivar a referenciação a consulta de especialidade para realização de exame audiológico. 8,12
Proposta de revisão do RANU em Portugal
Fatores de Risco a incluir (Tabela 1)
Consanguinidade parental
Estudos populacionais no Médio Oriente demonstraram existir até 3.5x mais casos de perda auditiva em idade pediátrica nos descendentes de casais consanguíneos. 16,17 Os autores consideram, assim, pertinente a inclusão dos recém-nascidos de casais consanguíneos no grupo de risco do RANU em Portugal.
Infecção intra-uterina a vírus Zika
Os RN após infecção intra-uterina a vírus Zika (mãe com evidência laboratorial de infeção por Zika durante o parto e RN com evidência laboratorial de infecção) deverão ser incluídos no grupo de risco para RANU, conforme preconizado pelo JCIH 6, mesmo que assintomáticos. Este grupo de risco deverá preferencialmente ser avaliado com recurso a PEA. 6
Exposição intra-uterina a tóxicos e/ou tabaco
Seguindo as orientações da Société Française de Pédiatrie foram incluídos todos os recém-nascidos com exposição intra-uterina a tabaco e/ou tóxicos.
Estudos publicados demonstraram que recém-nascidos expostos a tabaco durante a gravidez apresentavam menores amplitudes de OEA 18,19. A exposição a tabaco intra-uterina foi recentemente associada a um risco acrescido de perda auditiva na infância 20 e adolescência 21.
A exposição intra-uterina a tóxicos como cocaína e/ou opióides mostrou, em vários estudos, estar associada a piores outcomes auditivos 22-26.
Internamento Unidade de Cuidados Intensivos Neonatais (UCIN) superior a 5 dias
Deverão ser incluídos todos os RN internados em UCIN com duração superior a 5 dias, independentemente de serem ou não submetidos a ventilação mecânica invasiva, tal como sugerido pelo JCIH. Foi estabelecida uma associação entre esta população e um risco acrescido de neuropatia auditiva. 6 O uso de aminoglicosídeos e a hiperbilirrubinémia são fatores de risco de neuropatia auditiva e a exposição ao ruído na UCIN, durante este período, poderá também contribuir para a perda auditiva. 6 O EUSCREEN sugere que este grupo seja avaliado por PEA. 5
De referir que a Société Française de Pédiatrie sugere também a inclusão dos prematuros com menos de 32 semanas de gestação no grupo de risco bem como todos os que apresentem complicações cerebrais relacionadas com a prematuridade13. Uma vez que se trata de um tema controverso pela sobreposição entre este grupo de recém-nascidos e os recém-nascidos com necessidade de internamento em UCIN ou com exposição a outros factores de risco já incluídos no grupo de risco 27-29, os autores optaram pela não inclusão deste factor de risco de forma isolada na tabela.
ExtraCorporeal Membrane Oxygenation (ECMO)
As crianças submetidas a ExtraCorporeal Membrane Oxygenation (ECMO) foram incluídas pelo JCIH pelo risco acrescido de perda auditiva de início tardio. 3,6,14
Síndrome Alcoólico Fetal
A Société Française de Pédiatrie recomenda a inclusão de todos os recém-nascidos com exposição intra-uterina a álcool documentada 13. Apesar da associação estabelecida entre o Síndrome Alcoólico Fetal e perda auditiva em idade pediátrica 30,31, estudos realizados a crianças diagnosticadas com doenças do espectro alcoólico fetal, nos últimos anos, não demonstraram prevalência aumentada de perda auditiva nesta população quando comparados com crianças saudáveis 32. Os autores consideram assim que devem ser incluídos os recém-nascidos diagnosticados com Síndrome Alcoólico Fetal no grupo de risco para perda auditiva.
Derivação ventrículo-peritoneal
Evidência recente sugere que 40% das crianças (até aos 18 anos, inclusive) desenvolve perda auditiva de pelo menos 15dB em 3 frequências consecutivas após colocação de derivação ventrículo-peritoneal. 33,34 Por este motivo, o EUSCREEN sugere que todas as crianças devem ser consideradas de risco para perda auditiva após colocação de derivação ventrículo-peritoneal, merecendo avaliação audiológica de acordo com o grau de colaboração da criança. 5
Trauma craniano que exija hospitalização
A AAP sugere que todas as crianças após traumatismo craniano que tenha exigido hospitalização tenham a sua audição avaliada, com particular interesse, mas de forma não exclusiva, nas fraturas com envolvimento temporal, ao contrário do recomendado atualmente em Portugal. 2-4
Tabela 1 Proposta de indicadores de risco para perda auditiva permanente congénita ou de início tardio / progressivo na Infância
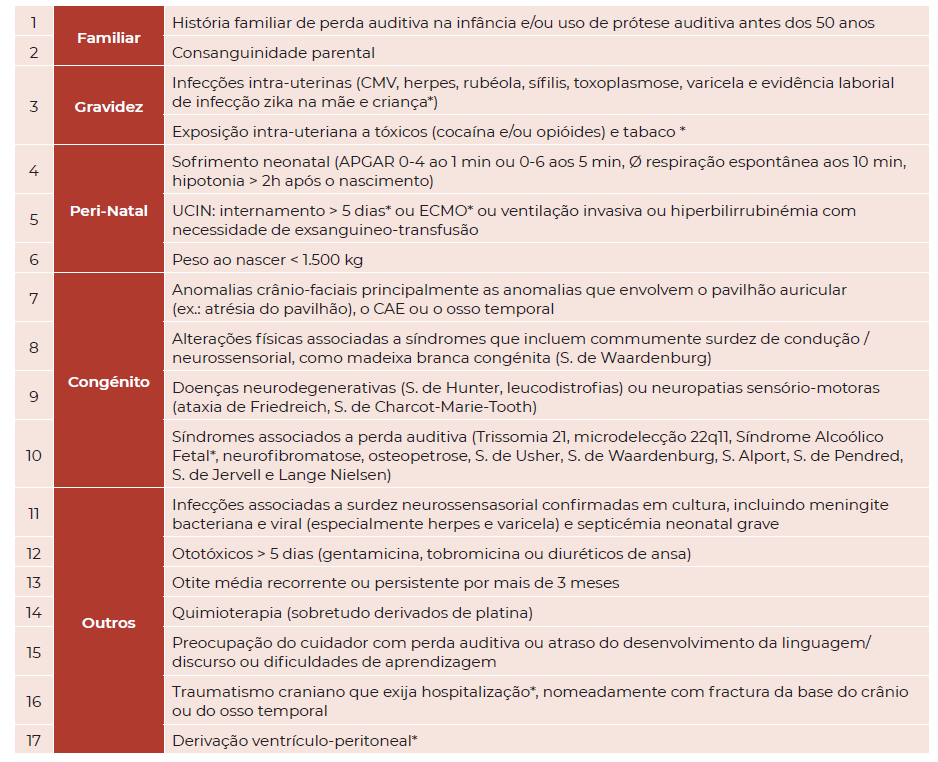
Legenda: CMV - Citomegalovírus; UCIN - Unidade de Cuidados Intensivos Neonatais; APGAR - Aparência, Pulso, Gesticulação, Actividade, Respiração; ECMO - Extra Corporeal Membrane Oxygenation; CAE - Canal Auditivo Externo. * Alteração sugerida às recomendações atuais.
Timings de reavaliação audiológica com consulta ORL (Tabela 2)
Com base no JCIH introduzimos a recomendação da avaliação até à idade escolar de crianças após ECMO e infecção intra-uterina a CMV. As crianças diagnosticadas com meningite bacteriana/viral e septicémia neonatal grave que tenham demonstrado algum grau de perda auditiva na avaliação audiológica à data da alta devem igualmente manter seguimento até à idade escolar, dado que existe risco de agravamento. 6
O JCIH recomenda reavaliação audiológica até aos 9 meses nos casos de outras infecções intra-uterinas (para além do CMV e Zika), internamento em UCIN superior a 5 dias ou com hiperbilirrubinémia com necessidade de exsanguíneotransfusão, com sofrimento neonatal e com suspeita ou confirmação de síndromes ou doenças neurológicas associadas a perda auditiva pelo risco de agravamento audiológico descrito neste período de tempo e que pode passar despercebido na primeira avaliação. 6 Nos casos em que se justifique por suspeita parental, da terapeuta da fala, da educadora ou de outro profissional que acompanhe o desenvolvimento da criança, a avaliação audiológica poderá eventualmente ser prolongada no tempo.
Realçamos ainda que crianças de risco por infecção intra-uterina a Zika, estadia em UCIN > 5 dias ou hiperbilirrubinémia com necessidade de exsanguineo-transfusão devem ser preferencialmente avaliadas com PEA. 6
Tabela 2 Timings de reavaliação por entidade clínica em consulta ORL com avaliação audiológica

Legenda: ECMO - Extra Corporeal Membrane Oxygenation; CMV - Citomegalovírus; APGAR - Aparência, Pulso, Gesticulação, Actividade, Respiração; CAE - Canal Auditivo Externo. * Alteração sugerida às recomendações atuais.
Algoritmo para rastreio auditivo de RN ou crianças de risco (Algoritmo 1)
À semelhança das normas clínicas atualmente em vigor em Portugal 2, todos os RN devem ser avaliados quanto à existência de fatores de risco para surdez infantil (tabela 1). Desta forma podemos organizar o rastreio auditivo neonatal universal em rastreio de crianças com risco e sem risco para a perda auditiva.
Os RN sem risco para perda auditiva devem ser avaliados com PEA ou OEA no primeiro mês de vida, tal como atualmente recomendado em Portugal. 2 Nos casos com resposta detetada por estes métodos a 40 dB HL ou menos, encaminha-se o RN para seguimento pelo Médico de Família ou Pediatra, de acordo com o descrito no algoritmo II. Nos RN sem resposta por PEA ou OEA a 40 dB HL ou mais, devemos realizar PEA e OEA antes dos 3 meses de vida para confirmação de surdez moderada a profunda, pois a abordagem combinada de PEA e OEA poderá diminuir a taxa de falsos negativos neste subgrupo. 3 Nos casos em que se confirme surdez moderada a profunda, devemos solicitar PEA completos, timpanograma e testes comportamentais e encaminhar a criança a consulta de surdez infantil para posterior estudo etiológico e orientação clínica, da reabilitação auditiva e socio-familiar.
Os RN de risco por Meningite bacteriana devem ser avaliados com PEA e OEA previamente à alta hospitalar e encaminhados a consulta de surdez infantil em menos de 15 dias caso se confirme perda auditiva, pelo risco de evolução para labirintite ossificante. 4,6 Todos os restantes RN de risco devem realizar PEA e OEA no primeiro mês de vida e devem ter avaliação audiológica terminada até aos três meses de vida4,6 pois a abordagem combinada de PEA e OEA poderá diminuir a taxa de falsos negativos nestes subgrupos. 3 Nos casos de risco em que não se confirme surdez moderada-profunda, as crianças devem ser reavaliadas de acordo com os intervalos sugeridos na tabela 2. Nos casos em que não exista resposta evocada a 40 dB HL ou mais, em um ou ambos os ouvidos, a orientação clínica é idêntica aos RN sem risco para perda auditiva que, de igual modo, não obtiveram resposta no RANU à nascença.
As crianças de qualquer idade em que, ao longo do seu desenvolvimento, se identifique um factor de risco para perda auditiva entre os enumerados na tabela 1 devem realizar rastreio auditivo à semelhança dos RN de risco com reavaliação de acordo com a tabela 2.
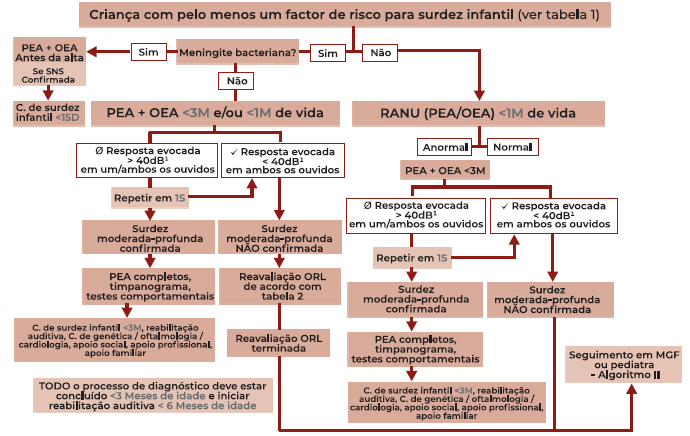
Figura 1 Esquema de organização para o rastreio auditivo de recém-Nascidos e crianças com factores de risco para perda auditiva. Legenda: PEA - Potenciais Evocados Auditivos; OEA - OtoEmissões Acústicas; C. - Consulta; D - Dias; S - Semanas; M - Meses; ORL - Otorrinolaringologia; RANU - Rastreio Auditivo Neonatal Universal; MGF - Medicina Geral e Familiar
Algoritmo para identificação de crianças em risco para perda auditiva, nomeadamente em consulta de Vigilância de Saúde Infantil e Juvenil nos Cuidados de Saúde Primários (Algoritmo 2)
As crianças acompanhadas em consulta de vigilância de saúde infantil e juvenil nos cuidados de saúde primários devem realizar despiste audiológico em consulta ORL caso seja identificado atraso do desenvolvimento (nomeadamente da fala) ou problemas comportamentais como as perturbações do espectro do autismo. 3,4
Face ao impacto negativo no desenvolvimento da criança, deve ser mantido elevado índice de suspeita de perda auditiva mesmo nas crianças aparentemente sem atrasos do desenvolvimento nem problemas comportamentais. Caso seja identificado algum factor de risco para perda auditiva em qualquer etapa de vigilância, a criança deve ser encaminhada a avaliação audiológica com consulta de ORL, em período inferior a 15 dias no caso da meningite bacteriana. 4
Tendo por base as sugestões de Yoshinaga-Itano C et al8 e do Programa Nacional de Saúde Infanto-Juvenil 12, em vigor em Portugal desde 2013, elaborámos uma lista de possíveis alterações ao normal desenvolvimento da criança que possam alertar para o maior risco para perda auditiva e exigir avaliação em consulta de ORL com despiste audiológico.
Realiza-se actualmente em alguns países europeus novo rastreio auditivo universal aos 4 anos. No entanto, por esta medida ainda carecer de evidência custo-benefício, optámos por não incluir esta sugestão no algoritmo desenhado. 35,36
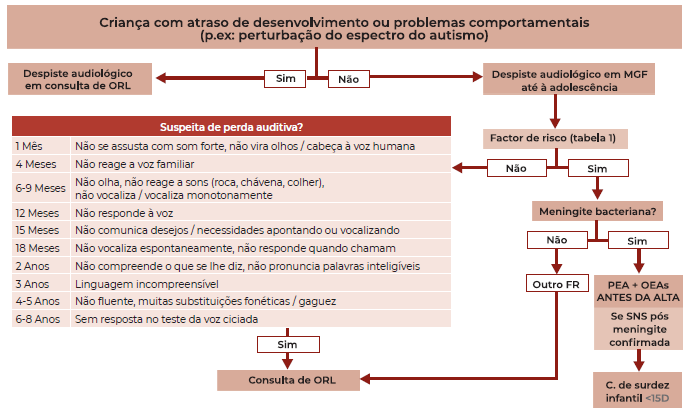
Figura 2 Esquema de organização para identificação de crianças em risco de perda auditiva em consulta de Vigilância de Saúde Infantil e Juvenil nos Cuidados de Saúde Primários. Legenda: PEA - Potenciais Evocados Auditivos; OEA - OtoEmissões Acústicas; C. - Consulta; ORL - Otorrinolaringologia; MGF - Medicina Geral e Familiar; SNS - Surdez Neurossensorial
Discussão
O presente algoritmo propõe estender o âmbito de referenciação do rastreio auditivo pediátrico em vigor à data em Portugal para outras idades pediátricas, e sugere actualizações às presentes orientações clínicas com a introdução de novos factores de risco e de intervalos de reavaliação de acordo com a entidade clínica.
No que diz respeito à introdução de novos fatores de risco, a infecção intra-uterina a vírus Zika somente foi associada a perda auditiva neonatal em 2016, pelo que não constava ainda das normas clínicas atualmente em vigor em Portugal. 2,5,6 Os autores consideram essencial a introdução deste factor de risco face à prevalência crescente desta patologia infecciosa no Brasil 37, cuja comunidade representa em Portugal 25,67% da comunidade imigrante residente em 2019. 38
Também de introdução recente, a ECMO apresenta tendência para crescimento exponencial nos últimos anos, tendo já sido submetidos a ECMO, desde 1989 até março de 2022, 46,667 RN, de acordo com o registo da Extracorporeal Life Support Organization. Os RN submetidos a ECMO, independentemente da duração do suporte extracorporal, são um subgrupo de maior risco de desenvolvimento de perda auditiva e esta poderá apresentar-se tardiamente, existindo na literatura correlações descritas até aos 13 anos de idade. 14 Sugerimos, assim, que sejam incluídos no grupo de risco das normas em vigor em Portugal e que mantenham vigilância audiológica em consulta ORL pelo menos até à idade escolar. 6 Após os 6 e até aos 13 anos deverá ser mantida vigilância pelo médico assistente, sendo referenciado para a consulta ORL em caso se suspeita de hipoacusia, reportada pelo próprio ou pelos cuidadores.
Existem outros riscos em contexto de internamento em UCIN, nomeadamente a exposição a ruído. Este poderá exceder os 45 dB médios recomendados pela AAP39-41 e estar relacionados com o grau de perda auditiva 6 meses após alta da UCIN. 42 Pela exposição ao ruido e pela coexistência de outras comorbilidades associadas a perda auditiva, como a hiperbilirrubinémia, exposição a ototóxicos, e ventilação mecânica invasiva) estes RN são um subgrupo de risco para perda auditiva. Na opinião dos autores e, contrariamente às normas atuais em vigor em Portugal2, deverão ser incluídos todos os RN com internamento em UCIN superior a 5 dias no subgrupo de risco do rastreio auditivo neonatal universal, independentemente das comorbilidades do RN. À semelhança do JCIH e do EUSCREEN e pelo risco de neuropatia auditiva, sugerimos que este subgrupo seja também preferencialmente avaliado por PEA. 5,6
No que diz respeito à introdução de novos intervalos de reavaliação, os autores propõem que algumas entidades, já incluídas nas normas em vigor em Portugal, devem merecer seguimento até à idade escolar (face ao risco acrescido de perda auditiva de início tardio), nomeadamente os RN após infecção intra-uterina a CMV, pois podem desenvolver perda auditiva pelo menos até à idade escolar. 15 As crianças diagnosticadas com meningite bacteriana/viral que tenham demonstrado algum grau de perda auditiva na avaliação audiológica à data da alta devem igualmente manter seguimento até à idade escolar, dado que existe risco de agravamento. 43
Estudos retrospectivos realizados em maternidades do serviço nacional de saúde português mostraram taxas de efectividade de rastreio neonatal entre 98-98.7%, sendo que 2% dos RN foram referenciados a consulta de ORL, o que está de acordo com os objectivos definidos pelo JCIH. 44,45 Ao introduzir novos factores de risco e sinais de alarme para consulta de saúde infantil e pediatria, o trabalho desenvolvido tem como objectivo aumentar a taxa de efectividade do RANU e ampliar e acelerar as referenciações à consulta de Surdez Infantil de forma a melhorar o prognóstico das crianças com surdez em Portugal.
O algoritmo desenvolvido pelos autores carece, ainda, de avaliação do impacto real na melhoria dos cuidados de saúde à população portuguesa e avaliação formal do seu custo-benefício em Portugal.
Existem alguns parâmetros introduzidos no algoritmo em discussão que carecem de estudos com amostras de maiores dimensões para que se estabeleça uma correlação mais forte entre o factor e o risco de perda auditiva em idade pediátrica a si associado. Neste grupo destacamos a exposição intra-uterina a tóxicos e/ou tabaco, como sugerido pela Societé Française de Pédiatrie13.
Consideramos também essencial a criação de uma base de dados nacional com os resultados auditivos de toda a população testada com perda auditiva identificada ou em risco para perda auditiva de forma a evitar atrasos no diagnóstico por absentismo ou por dificuldades na referenciação a consulta de especialidade. Trata-se também de uma forma prática, independente e pragmática de avaliar o impacto real dos cuidados de saúde na melhoria de qualidade de vida desta população enquanto avaliamos a eficiência na resolução e acompanhamento deste problema de saúde.
Conclusão
O algoritmo proposto é uma ferramenta que procura diagnosticar de forma mais precoce a perda auditiva em idade pediátrica através da identificação dos principais factores de risco associados a surdez nesta população, à luz do conhecimento científico actual. De igual forma, ampliámos os critérios de referenciação do rastreio auditivo pediátrico para outras idades pediátricas, procurando definir sinais de alarme para referenciação audiológica em consulta de pediatria e de saúde infantil pelo médico de família. Os autores procuram, portanto, acelerar e aumentar as referenciações à consulta de Surdez Infantil e, desta forma, melhorar os outcomes auditivos na população pediátrica portuguesa.
Agradecimentos
Agradeço à Filipa, à família e ao Serviço de ORL do CHULN: os pilares deste trabalho.
Conflito de Interesses
Os autores declaram que não têm qualquer conflito de interesse relativo a este artigo.















