Introdução
O seio maxilar pode ser afetado por patologia inflamatória, infeciosa ou neoplásica 1.
Os avanços da cirurgia endoscópica nasossinusal (CENS) das últimas décadas fizeram com que esta passasse a ser o tratamento de primeira linha para a maioria destas patologias (2,3. Apesar disso, existem zonas do seio maxilar cuja visualização e acesso por via endoscópica tradicional (antrostomia maxilar) representam um verdadeiro desafio. De entre estas, destacam-se a parede ântero-lateral e a porção anterior do pavimento deste seio 1,4.
O acesso a estas regiões do seio maxilar é particularmente importante nos casos de tumores nasossinusais benignos, tais como o papiloma invertido, cuja implantação ocorra nestas áreas. De facto, o sucesso terapêutico destes casos depende de uma completa exérese do tumor, assim como da mucosa e do periósteo na sua área de implantação e em torno desta 1,5. Abordagens externas ou abordagens endoscópicas mais extensas têm sido utilizadas para ultrapassar estas dificuldades no tratamento destas lesões 6,7,8. Contudo, estas abordagens associam-se frequentemente a uma elevada taxa de complicações, tais como parestesias faciais e dentárias, dor facial persistente, epífora, formação de crostas nasais ou síndrome de nariz vazio 8,9,10.
A abordagem endoscópica pré-lacrimal (AEPL) ao seio maxilar descrita por Zhou et al. 11 garante visualização e acesso à região anterior deste seio, preservando simultaneamente o corneto inferior e o canal nasolacrimal. Esta técnica minimamente invasiva tem demonstrado ser eficaz não só no tratamento de tumores nasossinusais localizados nas regiões anteriores do seio maxilar 1,12, mas também tem sido usada com sucesso para acesso às fossas pterigopalatina e infratemporal por via transmaxilar 4.
A AEPL tem uma baixa morbilidade associada, permitindo evitar muitas das complicações associadas a outras técnicas cirúrgicas. Ainda assim, a lesão do nervo alveolar anterior superior (NAAS) pode ocorrer durante este procedimento, o que poderá condicionar o aparecimento de parestesias no seu território de inervação 1,13.
Apesar das vantagens da AEPL, a sua utilização depende de uma anatomia favorável da região pré-lacrimal. Alguns trabalhos já publicados demonstram que esta apresenta uma grande variabilidade 3,6. A avaliação pré-operatória por tomografia computorizada (TC) dos seios perinasais é, portanto, fundamental para uma correta seleção dos doentes que poderão vir a beneficiar desta abordagem.
Com este trabalho pretendemos avaliar pela primeira vez a morfologia do recesso pré-lacrimal (RPL) na população portuguesa, focando-nos em aspetos importantes na seleção dos doentes e na predição de complicações associadas à AEPL.
Material e Métodos
Neste trabalho foi feita uma análise retrospetiva de imagens de TC de seios perinasais de 75 doentes adultos submetidos a septoplastia no Hospital Pedro Hispano no ano de 2023. Foram excluídos doentes que apresentavam patologia nasossinusal neoplásica ou patologia inflamatória extensa, doentes previamente submetidos a cirurgia endoscópica nasossinusal e doentes cujas TC apresentavam artefactos.
As imagens foram obtidas com o equipamento de tomografia computorizada multidetetor BrightSpeed 16 ( (General Electric Co.) e a análise das mesmas foi feita com recurso ao software PACS Synapse ( Versão: 7.2.000 (FUJIFILM Healthcare Americas Corporation).
Em todos os lados analisados foi avaliado o grau de pneumatização do seio maxilar utilizando os critérios descritos por Soyal e colegas (6). Para tal, inicialmente foram medidos os diâmetros máximos (vertical e transversal) de cada órbita e de cada seio maxilar (Figura 1). Seguidamente, para cada lado, foi calculada a razão entre o diâmetro máximo do seio maxilar e o diâmetro máximo da órbita ipsilateral (diâmetro máximo do seio maxilar/ diâmetro máximo da órbita). Nos casos em que o resultado era <0,5 o seio era classificado como hipoplásico, se fosse ≥ 0,5 e ≤ 1 era normal e se fosse > 1 era classificado como hiperplásico.
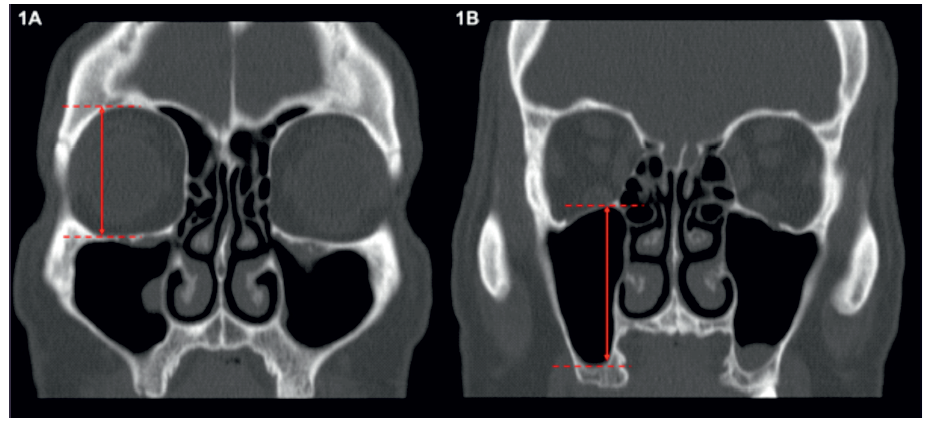
Figura 1 Demonstração da medição dos diâmetros verticais máximos da órbita direita (A) e do seio maxilar direito (B) para avaliação do grau de pneumatização do seio maxilar direito.
Os parâmetros morfométricos do RPL estudados neste trabalho foram todos analisados no plano axial correspondente à inserção do corneto inferior na apófise frontal da maxila (Figura 2).
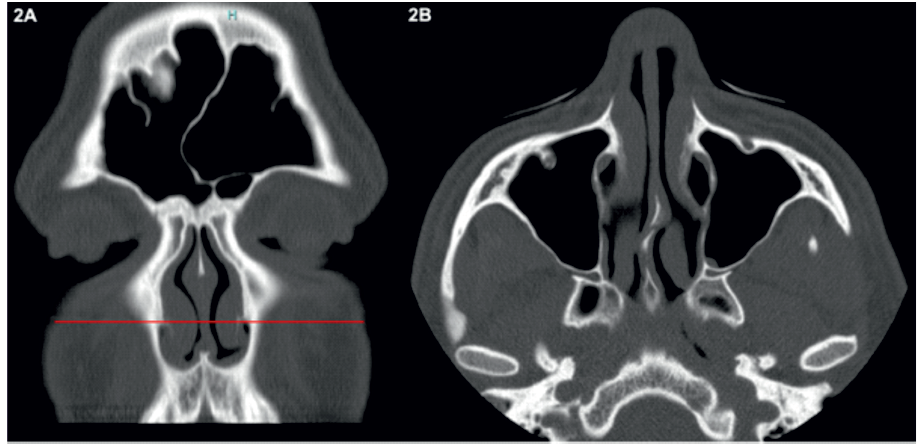
Figura 2 Exemplo de como foi selecionado o plano axial utilizado para estudar os parâmetros morfométricos do recesso pré-lacrimal.
O RPL foi considerado como estando ausente quando a parede anterior do canal nasolacrimal (CNL) se encontrava adjacente à face posterior da parede anterior do seio maxilar (Figura 3A). Nos casos em que este se encontrava presente, este foi classificado como anterior caso parte do RPL se encontrasse anteriormente ao CNL ou como lateral caso o RPL se encontrasse totalmente lateralmente ao CNL (Figuras 3B e 3C).
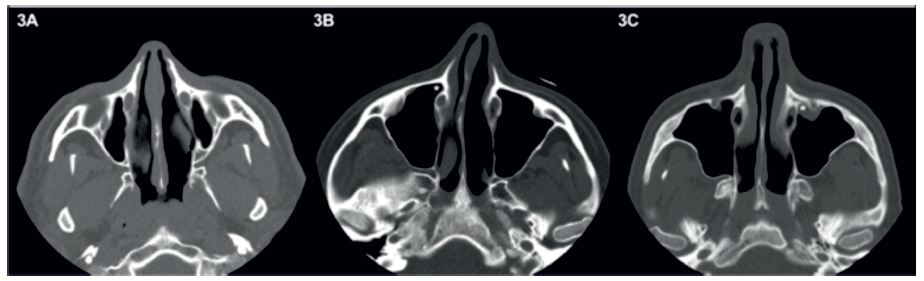
Figura 3 Em (A) o canal nasolacrimal encontra-se adjacente à parede anterior do seio maxilar, não existindo, por isso, recesso pré-lacrimal. Em (B) e em (C) o recesso pré-lacrimal (*) encontra-se presente, tendo uma localização anterior e lateral, respetivamente.
Para medir as larguras do RPL (largRPL) e do CNL (largCNL) foi traçada uma linha paralela à face posterior da parede anterior do seio maxilar e outras duas linhas paralelas a esta, uma tangente à parede anterior e outra à parede posterior do CNL, tendo sido medida a distância entre estas (Figura 4). Tendo em conta a sua largura, o RPL foi depois classificado de acordo com os critérios propostos por Simmen e colegas (14) em tipo I, caso esta fosse inferior a 3 mm, tipo II nos casos em que a largura estivesse compreendida entre 3 e 7 mm e tipo 3 caso esta fosse superior a 7 mm.
Foi também medida a espessura da parede medial do RPL (espRPL) (Figura 4).
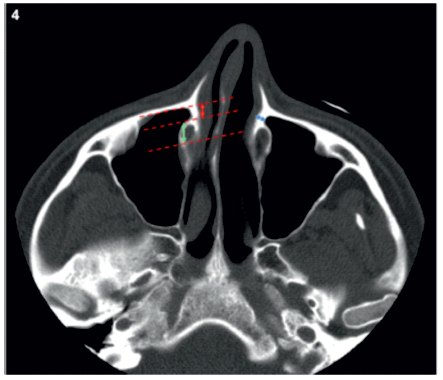
Figura 4 Exemplo da metodologia utilizada para avaliar a largura do recesso pré-lacrimal (seta vermelha) e do canal nasolacrimal (seta verde) e a espessura da parede medial do recesso pré-lacrimal (seta azul).
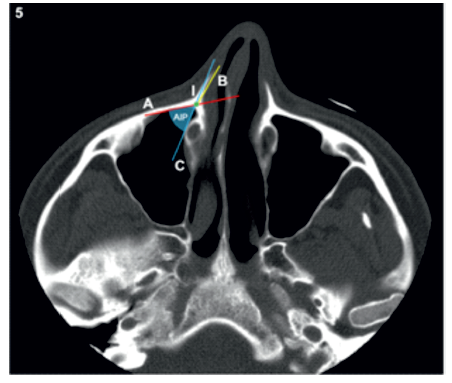
O ângulo da incisura piriforme (AIP) foi medido de acordo com os métodos descritos por Arosio et al.(13). Foi traçada uma linha paralela à face posterior da parede anterior do seio maxilar (linha A) e outra linha paralela à face interna da apófise frontal da maxila (linha B), tendo sido marcado o ponto de interseção entre as duas (ponto I). Foi definida uma terceira linha tangente ao CNL e que passava no ponto I (linha C). A amplitude do AIP foi medida entre as linhas A e C (Figura 5).
A posição do NAAS também foi avaliada. Foi seguido o seu trajeto a partir do canal infraorbitário até à apófise frontal da maxila. Uma vez nesta localização, este foi considerado estar numa posição vulnerável caso se encontrasse posteriormente à linha A e/ou medialmente à linha B (linhas A e B definidas anteriormente) (Figura 6).
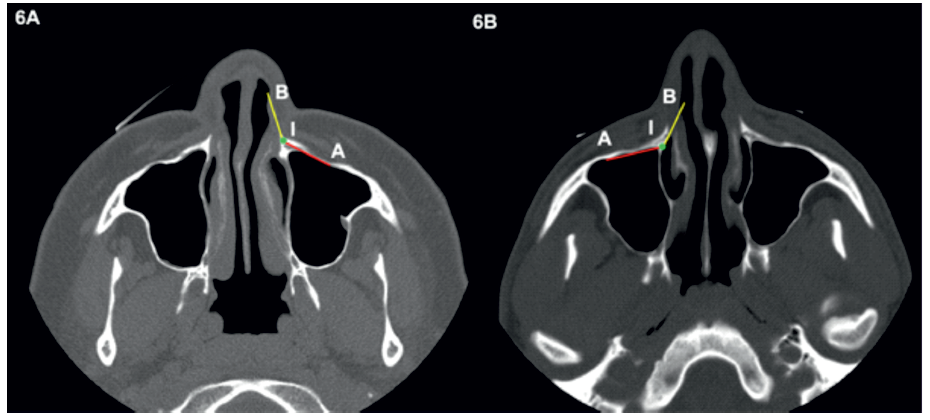
Figura 6 Em (A) o nervo alveolar anterior superior encontra-se posteriormente à linha A, estando numa posição vulnerável. Em (B) o nervo alveolar anterior superior encontra-se anteriormente à linha A e lateralmente à linha B, estado numa posição não vulnerável.
Para todas as variáveis estudadas foram realizadas 3 medições e realizada a média das mesmas.
A análise estatística dos resultados foi realizada com o software SPSS - versão 28 (SPSS inc., Chicago IL., USA). Para comparação de médias foram utilizados o teste t para amostras independentes e o One-Way ANOVA. Para estudar a associação entre variáveis categóricas foi utilizado o teste Qui-Quadrado. O nível de significância considerado foi p=0,05.
Resultados
Neste trabalho foram analisadas TC de seios perinasais de 75 doentes (150 lados). A maioria dos doentes era do sexo feminino (52%). A média de idades dos participantes foi de 38,49 (+/-12,19) anos.
Apenas 4% (6/150) dos SM analisados eram hipoplásicos. O padrão de pneumatização mais frequentemente identificado foi o normal (62,7%), seguido do hiperplásico (33,3%). Quando comparado o grau de pneumatização do SM entre os dois sexos, os seios hiperplásicos revelaram ser mais frequentes no sexo masculino (p=0,001) (Tabela 1).
O RPL estava presente em 125 dos 150 (83,3%) lados analisados. Não se verificaram diferenças significativas na presença do RPL entre sexos. Nenhum dos seios maxilares hipoplásicos estudados apresentava RPL. A presença do RPL nos seios normais e hiperplásicos era semelhante (86,2% e 88,0%, respetivamente) (Tabela 2).
Quando presente, o RPL foi classificado como anterior em 79,2% dos casos, não se tendo verificado diferenças significativas entre os sexos. Pelo contrário, verificou-se uma associação entre a largura do RPL e a localização do RPL (p<0,001). De facto, todos os RPL do tipo III eram anteriores, enquanto apenas 85,1% e 25% dos RPL do tipo II e I, respetivamente, tinham a mesma classificação (Tabela 3).
A largura média do RPL foi de 4,96 (+/-1,69) mm. Não se registaram diferenças significativas entre sexos ou entre graus de pneumatização do SM. Quando aplicada a classificação proposta por Simmen et al. (14), 12,8% dos RPL eram do tipo I, 75,2% do tipo II e 12,0% do tipo III (Tabela 1).
A parede medial do RPL apresentava uma espessura média de 2,94 (+/-1,67) mm. Verificou-se uma associação entre o grau de pneumatização do SM e esta medida. Seios hiperplásicos apresentavam em média uma espRPL inferior à dos seios normais (p=0,009) (Tabela 2). Também a largRPL se mostrou relacionar com a espRPL. De facto, quanto maior a largRPL, menor foi a espRPL registada (p<0,001) (Tabela 3).
A amplitude média do AIP na nossa amostra foi de 43,94 (+/- 12,14) º, não tendo havido diferenças significativas desta medida entre os sexos ou entre os diferentes graus de pneumatização do SM. Verificaram-se diferenças significativas entre a amplitude média do AIP dos RPL do tipo I e do tipo II (p=0,046) (Tabela 3).
O NAAS encontrava-se numa localização vulnerável em 51/125 casos (40,8%). Não houve diferenças na posição do NAAS entre os sexos, entre os graus de pneumatização do seio maxilar ou entre os diferentes tipos de RPL (I, II ou III). Também não se verificou nenhuma associação entre a amplitude do AIP e a localização do NAAS (p=0,746).
Tabela 1 Comparação dos resultados obtidos de acordo com o sexo dos doentes
| Variável | Sexo Feminino (39 participantes) (78 lados) | Sexo Masculino (36 participantes) (72 lados) | Total (75 participantes) (150 lados) | Valor de p |
| Pneumatização do seio maxilar - Hipoplásico - Normal - Hiperplásico | 1 (1,3) 59 (75,6) 18 (23,1) | 5 (6,9) 35 (48,6) 32 (44,4) | 6 (4,0) 94(62,7) 50 (33,3) | 0,001a |
| Presença do RPL - Sim - Não | 67 (85,9) 11 (14,1) | 58 (80,6) 14 (19,4) | 125 (83,3) 25 (16,7) | 0,269a |
| Localização do RPL - Anterior - Lateral | 56 (83,6) 11 (16,4) | 43 (74,1) 15 (26,9) | 99 (79,2) 26 (20,8) | 0,263a |
| Largura do RPL Média (dp) | 4,96 (1,69) | 4,79 (1,70) | 4,90 (1,69) | 0,501b |
| Largura do RPL (tipo) - Tipo I (<3mm) - Tipo II (3-7 mm) - Tipo III (>7 mm) | 9 (13,4) 49 (73,1) 9 (13,4) | 7 (12,1) 45 (77,6) 6 (10,3) | 16 (12,8) 94 (75,2) 15 (12,0) | 0,829a |
| Espessura da parede do RPL Média (dp) | 2,94 (1,67) | 3,38 (2,05) | 3,14 (1,86) | 0,190b |
| AIP Média (dp) | 45,47 (13,6) | 42,14 (9,98) | 43,94 (12,14) | 0,125b |
| Largura CNL Média (dp) | 9,08 (2,82) | 9,88 (2,41) | 9,47 (2,66) | 0,066b |
| Relação com NAS - Sim - Não | 27 (40,3) 40 (69,7) | 24 (41,4) 34 (58,6) | 51(40,8) 74 (59,2) | 0,849a |
AIP - ângulo da incisura piriforme, CNL - canal nasolacrimal, NAAS - nervo alveolar anterior superior, RPR - recesso pré-lacrimal. Nível de significância: p = 0,05. a - Teste Qui-quadrado; b - Teste T para amostras independentes.
Tabela 2 Comparação dos resultados obtidos de acordo como grau de pneumatização do seio maxilar
| Variável | Hipoplásico (6 lados) | Normal (94 lados) | Hiperplásico (50 lados) | Valor de p |
| Presença do RPL - Sim - Não | 0 (0,0) 6 (100,0) | 81 (86,2) 13 (13,8) | 44 (88,0) 6 (12,0) | <0,001a |
| Localização do RPL - Anterior - Lateral | - - | 61 (75,3) 20 (24,7) | 38 (86,4) 6 (13,6) | 0,146a |
| Largura do RPL Média (dp) | - | 4,72 (1,77) | 5,22 (1,50) | 0,057b |
| Largura do RPL (tipo) - Tipo I (<3mm) - Tipo II (3-7 mm) - Tipo III (>7 mm) | - - - | 13 (16,0) 58 (71,6) 10 (12,3) | 3 (5,8) 36 (81,8) 5 (11,4) | 0,314a |
| Espessura da parede do RPL Média (dp) | - | 3,43 (1,83) | 2,54 (1,75) | 0,009b |
| AIP Média (dp) | - | 44,14 (13,35) | 42,14 (9,98) | 0,944b |
| Largura CNL Média (dp) | 8,94 (0,85) | 9,10 (2,51) | 10,22 (2,93) | 0,053b |
| Relação com NAAS - Sim - Não | - - | 33 (40,7) 48 (59,3) | 18 (40,9) 26 (59,1) | 0,849a |
AIP - ângulo da incisura piriforme, CNL - canal nasolacrimal, NAAS - nervo alveolar anterior superior, RPR - recesso pré-lacrimal. Nível de significância: p = 0,05. a - Teste Qui-quadrado; b - Teste T para amostras independentes.
Tabela 3 Comparação dos resultados obtidos de acordo como o tipo de RPL
| Variável | Tipo I (16 lados) | Tipo II (94 lados) | Tipo III (15 lados) | Valor de p |
| Localização do RPL - Anterior - Lateral | 4 (25,0) 12 (75,0) | 80 (85,1) 14 (14,9) | 15 (100.0) 0 (0,0) | <0,001a |
| Espessura da parede do RPL Média (dp) | 5,87 (0,51) | 2,83 (1,50) | 2,00 (0,70) | <0,001b,c |
| APR Média (dp) | 39,0 (15,74) | 44,04 (11,12) | 42,14 (9,98) | 0,046b,c |
| Largura CNL Média (dp) | 8,45 (2,35) | 9,62 (2,68) | 10,04 (3,65) | 0,190b |
| Relação com NAS - Sim - Não | 5 (31,3) 11 (68,8) | 40 (42,6) 54 (57,4) | 6 (40,0) 9 (60,0) | 0,695a |
AIP - ângulo da incisura piriforme, CNL - canal nasolacrimal, NAAS - nervo alveolar anterior superior, RPR - recesso pré-lacrimal. Nível de significância: p = 0,05. a - Teste Qui-quadrado; b - One-way ANOVA; c -Teste T para amostras independentes.
Discussão
A forma piramidal do SM dificulta o acesso endoscópico a algumas das suas paredes e recessos 1,4). Se para o tratamento de algumas patologias, tais como a rinossinusite crónica em que o objetivo primário do tratamento é o restabelecimento da ventilação e do clearance mucociliar, a complexa anatomia do SM pode não interferir no sucesso do mesmo 1, noutras esta pode ser problemática. De entre estas patologias, destacam-se os tumores benignos do seio maxilar, como por exemplo o papiloma invertido, em que uma resseção incompleta do mesmo e do mucoperiósseo em torno da sua área de implantação se associa a um risco elevado de recorrência 5. É, portanto, fundamental garantir uma adequada visualização e acesso às zonas de implantação destes tumores.
Abordagens endoscópicas mais conservadoras, tais como a maxilectomia medial endoscópica do tipo 1 8, não conferem habitualmente uma correta visualização da região anterior da parede antero-lateral e do pavimento do seio maxilar, assim como da sua parede medial. Ainda que o uso de endoscópios angulados possa permitir visualizar estas regiões, tal aumenta a dificuldade cirúrgica; adicionalmente, o acesso a estas regiões implica instrumentos cirúrgicos específicos 1,4,7.
Estas dificuldades têm vindo a ser ultrapassadas utilizando abordagens externas ou abordagens endoscópicas mais extensas. De entre as abordagens externas destaca-se a via de Caldwell, que pode apresentar uma taxa de complicações de até 75%, sendo as mais frequentes resultantes da lesão do nervo infraorbitário e/ou dos seus ramos 9,15.Também uso de abordagens endoscópicas mais extensas (maxilectomias mediais endoscópicas ≥ tipo 2 8) se associa a uma maior incidência de complicações pós-operatórias, nomeadamente de síndrome do nariz vazio, formação abundante de crostas nasais ou epífora 7,8,10.
De forma a ultrapassar as limitações da maxilectomia medial endoscópica do tipo 1 / mega antrostomia / antrostomia tipo 3 de Simmen 8 na visualização e acesso à região ântero-lateral e ao pavimento do SM e a evitar as complicações associadas quer às abordagens externas, Zhou e colegas 11 descreveram uma via alternativa de abordagem endoscópica minimamente invasiva ao SM através do RPL, a AEPL. Esta via permite a visibilidade de uma maxilectomia medial tipo 3 reduzindo a probabilidade de ocorrência das sequelas já descritas. Mais, a sua aplicação não impede, caso necessário intra ou pós-operatóriamente, a conversão numa maxilectomia medial endoscópica clássica de qualquer tipo.
O RPL é o espaço localizado na região ântero-medial do SM limitado anteriormente pela parede anterior do SM, posteriormente pelo CNL, lateralmente pelo nervo infraorbitário e medialmente pela parede medial do SM 6. Para aceder a este recesso, é realizada inicialmente uma incisão na mucosa e no periósseo da parede lateral da fossa nasal. Esta incisão vertical em C deverá iniciar-se ao nível da axila do corneto médio, continuando em direção a um ponto entre a cabeça do corneto inferior e a abertura piriforme, progredindo para uma descarga ao longo do pavimento da fossa nasal. Deverá ser depois dissecado e rebatido medialmente o retalho mucoperiósseo até ao nível do canal nasolacrimal. Posteriormente é feita uma osteotomia na parede lateral da fossa nasal entre a axila do corneto inferior e a abertura piriforme, que poderá ser aumentada de acordo com as necessidades. Se necessário, o revestimento ósseo do canal lacrimal pode ser removido e realizada a transposição medial da via lacrimal. No final do procedimento, o retalho mucoperiósseo com o complexo corneto inferior-via lacrimal é reposicionado sobre a parede lateral da fossa nasal 11. Esta abordagem permite, assim, poupar simultaneamente o corneto inferior e a via lacrimal, evitando complicações associadas à lesão destas estruturas.
Trabalhos previamente publicados parecem indicar que a AEPL é uma via segura e eficaz para o tratamento de tumores benignos do SM, mostrando diminuir significativamente o risco de recorrência de papilomas invertidos quando comparada com a via de Caldwell 12,16. Uma vantagem adicional da utilização da AEPL em relação à via de Caldwell no tratamento de papilomas invertidos implantados na parede anterior do SM é que a primeira permite preservar parte do osso e o periósseo da fossa canina, que podem funcionar como barreira nos casos em que a histologia da peça operatória revele a presença de carcinoma epidermóide, impedindo a progressão do mesmo aos tecidos moles da face 1).
A realização de uma AEPL depende da presença de uma anatomia favorável. De facto, o RPL nem sempre está presente, tal como acontece nos casos em que o CNL se encontra imediatamente adjacente à parede anterior do SM. Trabalhos previamente publicados revelam uma grande variabilidade no que diz respeito à presença do RPL, com prevalências que variam entre os 30,9% 17 e os 85,6% 18. Na nossa amostra, o RPL encontrava-se presente em 125 dos 150 lados analisados (83,3%). Esta variabilidade encontrada na literatura poderá dever-se à existência de diferenças entre as populações estudadas, mas também poderá dever-se ao facto de na maioria dos estudos publicados não ter sido feita uma avaliação do grau de pneumatização do SM. Como os nossos resultados revelaram, a pneumatização do SM parece relacionar-se com a presença do RPL, estando este mais frequentemente presente nos casos em que o SM se encontra mais pneumatizado. Também Soyal e colegas 6 encontraram diferenças significativas na prevalência do RPL entre os seios hipoplásicos e os seios com pneumatização normal ou hiperplásicos (69% vs 99%). Desta forma, uma representação diferente dos vários tipos de pneumatização do SM poderá ter condicionado as diferenças na prevalência do RPL na literatura.
Ainda que o RPL se encontre presente, a AEPL poderá não ser possível sem realizar algum grau de transposição da via lacrimal. A largRPL é um dos outros fatores anatómicos que podem condicionar a realização desta abordagem. Tendo em conta este parâmetro morfométrico do RPL, Simmen et al. 14) propôs classificar este recesso em tipo I (largRPL< 3 mm), tipo II ( 3 mm ≤ largRPL ≤ 7 mm) e tipo III (largRPL > 7 mm). Segundo estes autores, nos RPL do tipo I, a AEPL não só oferece um acesso limitado ao SM, como implica maior remoção de osso e manipulação do CNL, aumentado a dificuldade do procedimento e o risco de complicações. Na nossa amostra, a grande maioria dos RPL estudados (75,2%) eram do tipo 2, sendo a largRPL média de 4,90 (+/-1,69) mm, o que indica que na maioria dos casos a AEPL podia ser realizada. Na literatura são descritas largRPL médias variáveis entre 3,7 e 8,4 mm 6,14,18,19,20,21,22, sendo que os trabalhos publicados parecem indicar que esta medida é maior na população asiática do que na população ocidental 6,22. No nosso trabalho, dado que nenhum dos SM hipoplásicos estudados apresentava RPL, apenas foi possível comparar a largRPL entre os seios normais e hiperplásicos, não tendo sido encontradas diferenças significativas. Pelo contrário, Soyal e colegas (6 encontraram uma associação entre o grau de pneumatização do SM e a largRPL, sendo que SM menos pneumatizados apresentavam largRPL significativamente menores e eram mais frequentemente do tipo I. Estes resultados parecem indicar que os doentes com SM hipoplásicos poderão ser piores candidatos para a realização de AEPL.
Também a espRPL é um parâmetro morfométrico importante a considerar antes de realizar uma AEPL, dado que pode dar uma indicação da dificuldade em alcançar o RPL e orientar para o tipo de instrumentos que devem ser utilizados para abrir a janela óssea pré-lacrimal 6). Na nossa amostra, a
espRPL média foi de 3,14 (+/- 1,86) mm, tendo-se verificado que quanto maior o grau de pneumatização do SM e quanto maior a largRPL, menor era a espRPL. Estes resultados vão de encontro aos de alguns trabalhos previamente publicados que também referem a mesma associação entre estas variáveis 6,7,20). Desta forma, RPL em SM hiperplásicos ou RPL mais largos exigirão menos esforço para penetrar através da sua parede medial dado esta ser mais estreita.
Quanto à localização do RPL, este foi classificado como sendo anterior ao CNL em 79,2% dos casos, enquanto em apenas 20,8% dos lados analisados o RPL se localizava totalmente lateralmente ao CNL. Este padrão é semelhante ao encontrado na literatura (3,6,23. O nosso trabalho descreve pela primeira vez uma relação entre a localização do RPL e a sua largura, sendo mais frequentemente anterior nos RPL mais largos.
Embora a taxa de complicações associadas à AEPL seja mais baixa que a verificada na via de Caldwell ou nas maxilectomias endoscópicas mais extensas, estas podem ocorrer. Entre 15,7 e 52,4% dos doentes que realizam este procedimento referem parestesias persistentes nos territórios de inervação do NAAS 13,24,25,26. Este nervo origina-se a partir dos 2/3 anteriores do nervo infraorbitário, viajando depois no canal sinuoso ao longo da face anterior da maxila em direção à sua apófise frontal e à incisura piriforme, onde se irá ramificar e formar o plexo dentário superior 9. A lesão do NAAS poderá ocorrer durante a realização da osteotomia da parede medial do recesso piriforme, principalmente quando esta é alargada em direção à incisura piriforme, o que tipicamente acontece nos casos em que a largRPL é menor. Apesar disso, os resultados de Arosio e colegas 13 não revelaram nenhuma associação entre a largRPL e a prevalência de parestesias maxilares pós-operatórias, sugerindo que esta medida por si só poderá não ser um bom preditor de ocorrência de lesão do NAAS. Pelo contrário, no seu trabalho, estes autores verificaram que um AIP com uma amplitude menor se associava a uma maior incidência de parestesias persistentes no território do NAAS 13, tendo definido um cut-off de 45º abaixo do qual o risco de lesar este nervo é significativamente maior. Segundo estes autores, AIPs de menor amplitude limitam a visualização e o acesso dos instrumentos ao SM, necessitando de uma maior remoção de osso junto à incisura piriforme. Na nossa amostra, a amplitude média do AIP foi de 43,94 (+/- 12,14) º. Este valor é semelhante ao obtido por Soyal et al. 6 (42,42+/-17,32º), mas é inferior ao reportado por Arosio et al. 13. A amplitude média do AIP dos RPL do tipo I era significativamente menor que a dos RPL do tipo II. Soyal e colegas reportaram que a amplitude do RPL do tipo III era significativamente maior à dos outros tipos de RPL (6. Estes resultados parecem sugerir que quanto maior a largRPL, maior será o AIP, reforçando a utilidade da largRPL, uma medida fácil de determinar, como um bom indicador para a seleção dos doentes e para prever a morbilidade associada à cirurgia. Apesar de tal como foi referido anteriormente, o trabalho de Arosio e colegas não ter demonstrado uma associação entre esta medida e a ocorrência de parestesias maxilares, esse resultado poder-se-á dever ao facto de na sua amostra haver uma sub-representação de doentes com RPL do tipo I 13, dado que doentes com este tipo de RPL foram considerados como maus candidatos para a realização de AEPL, tendo sido excluídos da sua amostra.
No nosso trabalho sugerimos uma nova forma de prever eventuais lesões do NAAS com base na posição que este ocupa na apófise frontal da maxila. Ao traçarmos uma linha paralela à face posterior da parede anterior do SM (linha A) e outra paralela à apófise frontal da maxila (linha B), duas das principais referências utilizadas quando se alarga anteriormente a osteotomia, podemos verificar a relação do NAAS com estas linhas. Quando o NAAS se encontra posteriormente à linha A e/ou medialmente à linha B, este será mais provavelmente incluído na osteotomia realizada, correndo, por isso, maior risco de lesão (Figura 6A). Utilizando estes critérios, o NAAS foi considerado estar numa posição vulnerável em 40,8% dos casos, o que corresponde à taxa de complicações relacionada com a sua lesão descrita na literatura. Este é o primeiro estudo que propõe critérios de vulnerabilidade do NAAS pelo que, apesar dos nossos resultados, estes necessitam de ser validados em estudos futuros.
Este trabalho apresenta a limitação de ser um estudo unicêntrico com uma amostra relativamente pequena de doentes. Outra limitação é o facto de não terem sido incluídos doentes com patologia nasossinusal. Dado serem estes os doentes que mais poderão vir a beneficiar da aplicação da AEPL, deverão ser realizados novos trabalhos para avaliar a morfologia do RPL nestes casos.
Conclusão
O RPL apresenta uma anatomia variável que pode ser condicionada por diferentes fatores, tais como o grau de pneumatização do SM. Ainda assim, o nosso trabalho demonstrou que este se encontra presente e apresenta largura suficiente para a realização de uma AEPL ao SM na maioria dos casos.
Alguns parâmetros morfométricos, nomeadamente a largRPL, o AIP e a localização do NAAS poderão ser utilizados para antecipar e prevenir a lesão deste nervo durante a AEPL. Este estudo propõe uma abordagem inovadora na avaliação da posição do NAAS e da sua potencial vulnerabilidade.
A avaliação pré-operatória com TC é, portanto, mandatória para uma correta seleção dos doentes que poderão ser candidatos à realização deste procedimento.