Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Silva Lusitana
versão impressa ISSN 0870-6352
Silva Lus. vol.20 no.1-2 Lisboa dez. 2012
Analyse des Pontes de la Spongieuse, Lymantria dispar L. (Lepidoptera, Lymantriidae) sur Chêne Liège (Blida-Algérie)
Análise das Posturas de Lymantria dispar L. (Lepidoptera-Lymantriidae) em Sobreiro (Blida-Argélia)
Gypsy Moth, Lymantria dispar L. (Lepidoptera-Lymantriidae) Egg Mass Analysis in Cork Oak (Blida-Algeria)
Dalila Mecellem* et Gahdab Chakali**
*Maître Assistante
**Professeur
Département de Zoologie Agricole et Forestière. École Nationale Supérieure Agronomique. El-Harrach, 16200, Alger (ALGÉRIE)
Résumé
Le dénombrement et la biométrie des pontes de la dernière gradation du bombyx disparate, ont été conduits dans la subéraie de Bouarfa. La comparaison des moyennes a mis en évidence une forte signification entre les pontes quantifiées durant les années 2007 et 2008 avec des valeurs moyennes respectives de 135 et de 29 pontes par arbre. A la seconde année, les mensurations des pontes et la quantification des œufs ont décelé des réductions significatives de la surface de 40% et du nombre moyen des œufs de 65%. L'analyse fréquentielle des surfaces et du nombre d'œufs ont mis en évidence cinq classes pour les deux générations considérées. Les données recueillies confirment le schéma typique d'une gradation de Lymantria dispar.
Mots clés: Bombyx disparate;chêne liège; ponte; Blida; Algérie
Sumário
Efetuou-se a contagem e biometria das posturas de Lymantria dispar L. no sobreiral de Bouarfa. A comparação da média evidenciou uma forte correlação entre as posturas quantificadas durante os anos 2007 e 2008 e os valores médios de 135 e 29 posturas por árvore. No segundo ano, a medição das posturas e a quantificação dos ovos mostraram redução significativa, respetivamente da ordem dos 40% e 65%. A média de frequência da área e do número de ovos evidenciaram cinco classes para as duas gerações consideradas. Os dados colhidos confirmam o esquema típico de uma gradação de Lymantria dispar.
Palavras-chave: Lymantria dispar; sobreiro; postura; Blida; Argélia
Abstract
In the last infestation of Gypsy moth, counting and egg mass biometrics were conducted in Bouarfa cork oak forest. The comparison of means showed a high significance between eggs mass quantified during the years 2007 and 2008 with respective averages of 135 and 29 per tree. At the second year, eggs mass measurements and quantification of eggs laid have found significant reduction surface of 40% and the 65% average number of eggs. Frequency analysis of surfaces and the number of eggs have revealed five classes for the two generations considered. The data confirm the typical pattern of a gradation of Lymantria dispar.
Key words: Gypsy moth; egg mass; Blida; Algeria
Introduction
Le bombyx disparate est le principal défoliateur des chênaies. Originaire d'extrême - orient (Japon, Corée), l'espèce se caractérise par des cycles de gradation de 7 à 8 ans et présente dans les régions méditerranéennes un intérêt économique signifiant vis-à-vis des fagacées en général (HERARD et FRAVAL, 1980). En Algérie, la première observation du bombyx disparate a été signalée à partir de l'année 1923 à l'Est dans la forêt d'Edough, à proximité de la ville d'Annaba (DELASSUS, 1925). Des infestations périodiques au cours du temps se sont succédées dans plusieurs chênaies avec des défoliations d'intensités variables (KHOUS, 1991). Les prospections et les investigations menées depuis l'année 2006 témoignent d'une large répartition à travers diverses yeuseraies et subéraies de l'Atlas blideen, de la Kabylie et de la région de Tamentout. Le cycle biologique de l'insecte est monovoltin. L'espèce passe par une diapause estivo-hivernale dans l'œuf sous forme de larve formée en arrêt de développement. A l'éclosion, les chenilles sont très voraces vis-à-vis des jeunes feuilles de chêne-liège (FRAVAL et El YOUSFI, 1989). Au cours de son développement l'insecte passe par cinq à six stades larvaires. Les chenilles se développent en parfaite synchronisation avec la période végétative (VILLEMANT, 2003). La nymphose s'effectue dès le début de la période estivale, elle dure de 2 à 3 semaines. Le dépôt de l'unique ponte de la femelle se réalise entre juin et juillet, le développement embryonnaire commence juste après la ponte et se poursuit sur 3 semaines. A ce stade, intervient une diapause jusqu'au printemps de l'année suivante, génétiquement déterminée et quasi-obligatoire (NIERHAUS-WUNDERWALD et WERMELINGER, 2001). Le bombyx disparate est une espèce particulièrement dynamique, capable de s'adapter à des conditions variées d'alimentation qui régissent la régulation de leur population. Malgré les nombreuses recherches effectuées sur la biologie et l'écologie de l'espèce, son comportement reste complexe et sous l'égide des variables environnementales. Les populations de L. dispar sont sujettes à des pullulations cycliques et périodiques. Chaque cycle comprend une phase de pro-gradation, s'étendant sur 2 ou 3 ans (LUCIANO et ROVERSI, 2001). Pendant cette phase, la densité du ravageur ne cesse d'augmenter, la zone infestée ne cesse de s'élargir et l'intensité des défoliations prend de l'ampleur. La seconde phase de culmination dure généralement deux ans. A ce stade, le ravageur dépasse la capacité du milieu à assurer le développement complet de chaque individu. Cette phase s'achève par une famine généralisée qui entraîne la mort d’un très grand nombre de la population (VILLEMANT, 2003). Parmi les écophases de Lymantria dispar, les données sur les pontes restent le facteur déterminant de l'état de l'infestation et de l'évolution de la gradation au cours du temps.
Le bombyx disparate a fait l'objet de plusieurs recherches dans le monde depuis le début du siècle. En Algérie, l'ensemble des connaissances accumulées sur Lymantria dispar provient des observations fragmentaires et limitées, l'importance économique considérable des défoliations périodiques particulièrement en chênaies et le manque de données sur ce ravageur nous ont incités dans le choix de sujet. Le but de cette recherche est de caractériser les populations de ponte de Lymantria dispar sur chêne-liège au cours de la dernière gradation.
Matériels et méthodes
Site d'étude
La subéraie de Bouarfa occupe une superficie de l'ordre de 99 hectares et fait partie du massif forestier de l'Atlas Blidéen. Elle s'étend le long d'une ligne de crêtes, orientée NW-SE, dont les points les plus élevés culminent vers 600 mètres d'altitude. Elle présente un relief accidenté avec des pentes variables selon la position. La subéraie est localisée à la longitude de 2°80 00 0 E et à la latitude de 36°43 90 9 N et fait partie de l'étage bioclimatique subhumide à hiver tempéré, caractérisé par des quantités pluviométriques variant de 600 à 900 mm par an. La sécheresse est ressentie en été. La température moyenne annuelle est de l'ordre de 17°C, la moyenne des minima du mois de janvier ne dépasse pas les 6°C.
La formation forestière choisie est constituée principalement par un peuplement de chêne-liège naturel sous forme de jeune futaie assez dense. Le sous-bois est composé principalement de ciste, Cistus crispus et Cistus salvifolius et des espèces de bruyères Erica scoparia et Erica arborea.
Méthodologie adoptée
Dénombrement des pontes
Les comptages des pontes de Lymantria dispar sur chêne-liège, ont été réalisés sur 30 arbres vers la fin de la période estivale pour deux générations consécutives de 2007 et de 2008. Les dénombrements ont été effectués simultanément par deux personnes depuis la base de l'arbre en parcourant du regard les branches charpentières et les rameaux, en explorant le tronc et ses anfractuosités. Chaque arbre est considéré comme unité d'échantillonnage pris selon un choix systématique en ligne. La méthode reste comparable à celle utilisée par FRAVAL et HERARD (1975), qui effectuent un choix de 30 arbres pris au hasard.
Récolte du matériel biologique
L’étude a porté sur deux lots de 30 pontes prélevées séparément et conservées individuellement au courant des années 2007 et 2008. La récolte du matériel biologique a été effectuée à partir de branches accessibles selon un choix systématique conduit sur une dizaine d'arbres. Seules les pontes complètes ont été choisies et prises en considération pour un dénombrement fiable des œufs.
Calcul des surfaces des pontes
Pour commencer, nous avons recherché l'équation modèle de calcul des surfaces des pontes. A partir des lots des pontes récoltées, nous effectuons des mesures des longueurs et des largeurs d'une dizaine de pontes pour un calcul des surfaces théoriques en les assimilant à un rectangle. Les surfaces réelles sont calculées à partir des mêmes échantillons et sont corrélées aux surfaces théoriques. A l'aide de ces deux variables nous recherchons l'équation de régression pour le calcul de l'ensemble des surfaces des pontes mesurées.
Préparation et dénombrement des œufs
Les pontes mesurées sont conservées séparément dans des boites de Pétri. Nous procédons par la suite à l'épilage des œufs en les frottant délicatement à l'aide d'un pinceau fin dans un entonnoir pourvu d'un filtre. La maille du tamis est de l'ordre de 0,8 mm retenant même les œufs fragmentés, permettant uniquement le passage des poils. La technique adoptée est celle proposée par HERARD et FRAVAL (1980). Le dénombrement des œufs a été mené sous une loupe binoculaire.
Méthodes d'analyse
Des analyses de comparaison des moyennes à un facteur ont été effectuées pour tester la différence entre la fertilité des femelles de Lymantria dispar des deux générations. Des analyses fréquentielles sont avérées intéressantes afin de regrouper les pontes en fonction de leur surface et de leur nombre d'œufs, de même des analyses croisées ont été effectuées pour tirer des informations sur la relation entre le nombre d'œufs et la surface des pontes.
Résultats
Quantification des pontes
Les dénombrements des pontes effectués durant les années 2007 et 2008, montrent une régression remarquable des populations de Lymantria dispar (Tableau 1). En 2007, le nombre moyen calculé est de 137 pontes par arbre. En 2008, la population a régressé à 29 pontes en moyenne par arbre.
Tableau 1 - Analyse descriptive des pontes
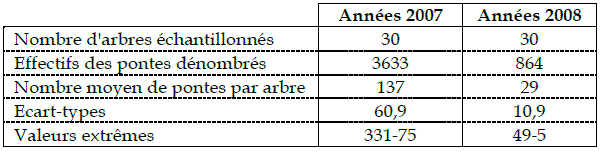
L'examen des données recueillies montre un déséquilibre dans la distribution des pontes entre les arbres au cours des deux années d’étude.
Biométrie des pontes
Les surfaces réelles et théoriques des pontes ont été corrélées de façon très significative.
Équation modèle pour le calcul des surfaces des pontes
La Figure 1 représente l'équation de calcul des surfaces réelles des pontes en provenance du chêne-liège. La probabilité calculée montre une différence de très haute signification.
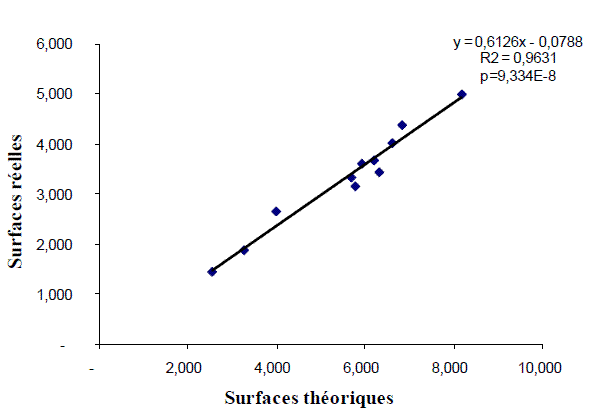
Figure 1 - Relation reliant les surfaces réelles et théoriques des pontes de Lymantria dispar
Analyse descriptive des surfaces des pontes
Sur la base des données recueillies sur les mensurations des pontes (Tableau 2), des analyses fréquentielles ont été conduites pour tirer des informations sur les classes des surfaces des deux populations considérées.
Tableau 2 - Mensuration des pontes de Lymantria dispar
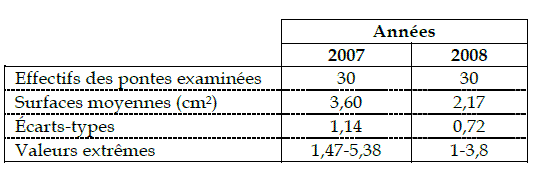
Analyse fréquentielle des surfaces des pontes récoltées
Les surfaces réelles des pontes calculées à l'aide de l'équation modèle varient de 1,47 à 6,45 cm² pour les pontes récoltées en 2007, et se limitent entre 1 à 3,80cm² pour celles récoltées en 2008 dans le même peuplement de chêne liège. A chacune des périodes considérées, l'analyse fréquentielle des surfaces a mis significativement en évidence cinq classes de pontes (Figures 2 et 3).
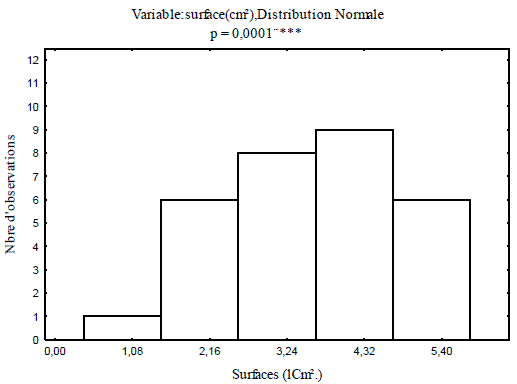
Figure 2 - Fréquences des surfaces des pontes récoltées en 2007
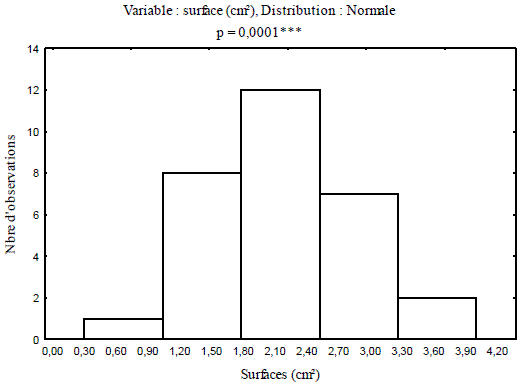
Figure 3 - Fréquences des surfaces des pontes récoltées en 2008
L'analyse des surfaces des pontes récoltées en l'année 2007, a révélé que la classe des pontes comprises entre 0,4 et 1,4 cm², se limite à 3,33% de l'effectif analysé. Le plus grand pourcentage d'observation, soit 30% est noté pour la classe ayant des surfaces comprises entre 3,5 cm² et 4,5 cm². Le taux des observations des surfaces comprises entre 2,4 cm² et 3,5 cm² diminue à 13,33% de la population globale. Les deux classes dont les surfaces sont comprises entre 1,4 cm² et 2,4 cm², et entre 4,5 cm² et 5,6 cm² sont comparables, représentent chacune 20%de l'effectif global.
Les cas observés pour les tailles des pontes inférieures à 1,15 cm² se limitent à 3,33%. Les pontes ayant des surfaces comprises entre 1,05 et 1,8 cm² s'élèvent à 26,66% de l'effectif total. La classe des surfaces comprises entre 1,8 et 2,54 cm² représente 40%, soit la proportion observée la plus représentative. Pour les deux dernières classes des pontes, comprises entre 2,53 et 3,28 cm², les cas observés sont respectivement de 23,33% et de 6,66% de l'effectif total. En comparaison, une réduction nette des surfaces des pontes mesurées en l'année 2008 par rapport à celle de 2007. L'analyse de la variance des surfaces des pontes calculées pour les deux années considérées, met en évidence une différence très hautement significative (Figure 4).
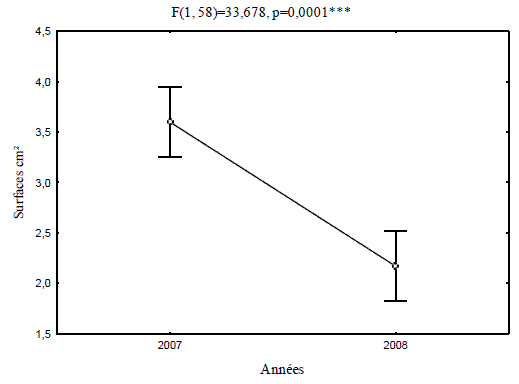
Figure 4 - Comparaison des moyennes des surfaces des pontes
Analyse descriptive du nombre d'œufs
Les résultats de la quantification des œufs pour les deux années considérées sont regroupés dans le Tableau 3.
Tableau 3 - Dénombrement des œufs de Lymantria dispar
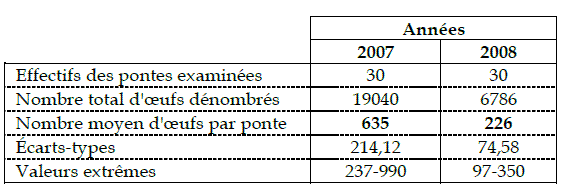
En 2007 une moyenne de 635 œufs par ponte a été décelée. Les pontes examinées en 2008 renferment un nombre moyen de 226 œufs par ponte, soit presque un tiers que précédemment.
Sur la base des comptages effectués nous avons procédé à une comparaison des moyennes par analyse de la variance (Figure 5).
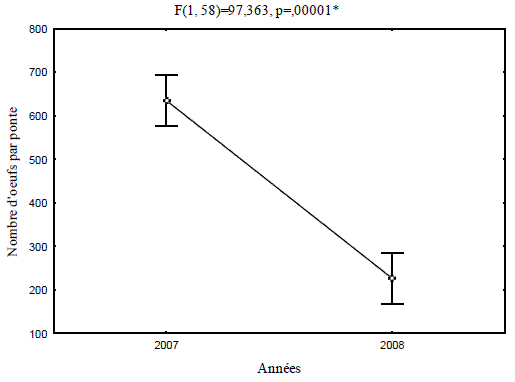
Figure 5 - Nombres moyens d'œufs par ponte
Sur la base des données des dénombrements des œufs des deux générations de Lymantria dispar, des analyses fréquentielles ont été effectuées afin de regrouper les pontes en classes, en relation avec le nombre d'œufs qu'elles comportent.
Analyse fréquentielle des effectifs des œufs dénombrés
Le matériel biologique examiné a révélé cinq catégories de classes de pontes en relation avec le nombre d'œufs. La probabilité calculée est très hautement significative pour les deux générations de pontes examinées (Tableau 4).
Tableau 4 - Répartition du nombre d'œufs par classe chez Lymantria dispar
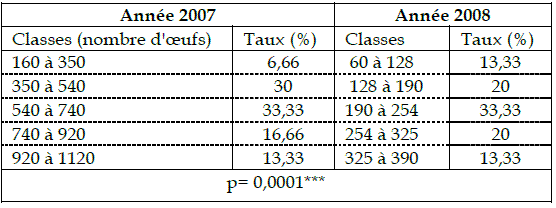
Les catégories de classes du nombre d'œufs de l'année 2007 sont plus représentatives en nombre que celles pour l'année 2008. Malgré la différence du nombre des œufs entre les deux années, les proportions deux à deux des classes restent comparables entre les deux années d'étude.
Relation entre les surfaces des pontes et le nombre des œufs
Les rapports des analyses croisées entre les surfaces des pontes calculées et le nombre d'œufs des deux années sont illustrés dans les Figures 6 et 7.
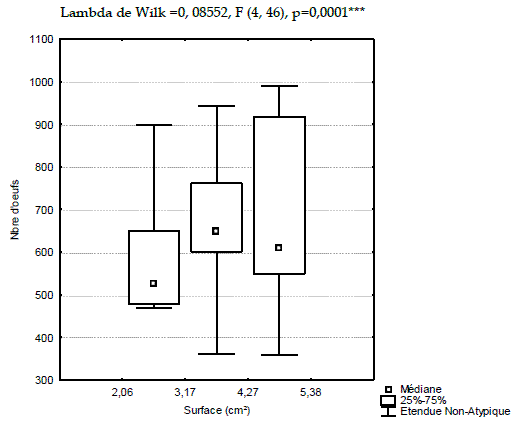
Figure 6 - Distribution du nombre d'œufs en fonction des surfaces des pontes de 2007
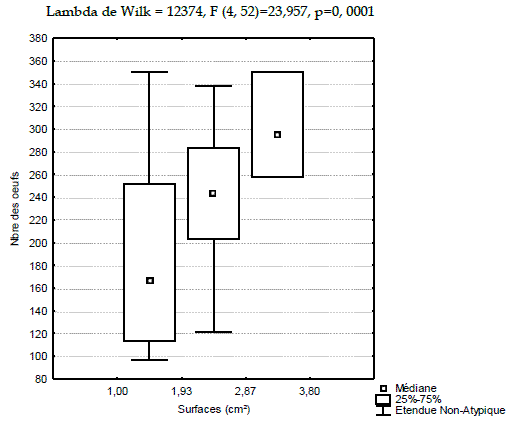
Figure 7 - Distribution du nombre d'œufs en fonction des surfaces des pontes récoltées en 2008
En considérant trois catégories de classes de surfaces des pontes en relation avec le nombre d'œufs, il apparaît qu'à la première catégorie la valeur médiane est de 520 œufs pour des pontes de 2,6 cm². 50% de l'effectif de la classe de 2,6 à 3,17 cm² compte de 480 à 650 œufs avec une grande variabilité allant jusqu'à 900 œufs. L'examen de la classe comprise entre 3,17 et 4,27 cm² met en évidence une valeur médiane de 640 œufs. 50% de l'effectif s'étend entre 600 et 760 œufs avec une variabilité homogène de part de l'étendue. A la troisième catégorie des surfaces supérieures à 4,27 cm², une plus grande variabilité allant de 350 à 990 œufs est notée avec une valeur médiane de l'ordre de 610 œufs.
Une réduction des surfaces et du nombre d'œufs sont notés en l'année 2008. Les valeurs médianes croissent d'une catégorie de surfaces à l'autre. Les étendues des 50% de la population sont plus structurées pour l'année 2007.
Discussion
L'importance économique du bombyx disparate est en relation avec la densité de la population qui varie en fonction de la formation forestière et la phase de la gradation de l'insecte (HERARD, 1984).
L'évaluation de la densité de la population de Lymantria dispar dans la subéraie de Bouarfa a diminué significativement entre les années considérées. En 2007 une moyenne de 137 pontes par arbre a été comptabilisée, valeur plus significative comparativement à 111 obtenue dans la subéraie de la Mamora au Maroc par FRAVAL et al. (1978). En 2008, la population a fortement régressé à 29 pontes en moyenne par arbre. Cette diminution témoigne du schéma typique de la gradation de ravageur qui passe par des phases de progradation, de culmination, de rétrogradation et une phase de latence (LUCIANO et ANDREA, 2005). Dans la subéraie de Bouarfa la gradation a débuté en l'année 2006, où des défoliations partielles ont été notées (Communication personnelle). En 2007 une défoliation totale a caractérisé tout le peuplement de la subéraie prospectée. Les observations régulières conduites en phase de gradation ont mis en évidence une relation entre la densité d'attaque et la disponibilité du feuillage nourricier. Les mêmes observations menées en yeuseraie à Tikjda par KHOUS (1991), mentionnent qu'en phase de gradation de l'insecte, le désynchronisme entre la phénologie de l'insecte et de l'arbre hôte apparaît comme le facteur déterminant dans l'écroulement de la population. Les trois premiers stades larvaires constituent la phase critique dans le développement de l'insecte (FRAVAL, 1989). En 2008, un décalage entre l'éclosion des œufs et le débourrement des arbres a été noté et a influencé la survie de la population et la densité de la génération suivante (Communication personnelle). Une réduction des surfaces moyennes des pontes a été notée entre les années 2007 et 2008. Ces résultats s'expliquent par l'évolution épisodique de la gradation de l'année 2007, représentant la phase de culmination, où les femelles de la population pondent le maximum d'œufs sur une plus grande surface. En phase de rétrogradation, correspondant à l'année 2008, les femelles sont mal nourries ce qui s'est répercuté sur leur pontes qui sont plus limitées en nombre et en surface. La durée des infestations s'étale en général de 3 à 4 ans dans les subéraies littorales, cas de la forêt de Bouarfa, et se limite à 2 ans dans les chênaies de montagne (KHOUS et DEMOLIN, 1997).
Les dénombrements des œufs des pontes de l'année 2007 ont mis en évidence des valeurs très variables, comprises entre 139 et 996 œufs avec une moyenne de 635 œufs par ponte. Ces résultats sont comparables avec ceux obtenus par NIERHAUS-WUNDERWALD et WERMELINGER (2001), qui notent des effectifs variables de 100 à 1000 œufs par ponte.
A ce propos, les auteurs précités notent que le nombre d'œufs varie en fonction de la disponibilité de la nourriture et de la phase de gradation, il est plus élevé avant et au début d'une pullulation que pendant la rétrogradation. VILLEMANT (2003), mentionne que durant la phase de progradation, les pontes sont de grandes tailles dépassant 30 mm et renfermant entre 500 à 800 œufs. En 2008, les œufs dénombrés représentent moins de 50% de la valeur obtenue en 2007, ce qui confirme la phase de rétrogradation du bombyx disparate dans la subéraie prospectée.
Références
DELASSUS, M., 1925. La lutte contre le Liparis dispar dans le massif de l'Edough. Rev. Agric. Afr. Nord 23: 334-336. [ Links ]
FRAVAL, A., El YOUSFI, M., 1989. Dispersion active et passive de Lymantria dispar (L.) (Lép ; Lymantriidae), cas de la subéraie Marocaine atlantique. Z.angew. Entomol. 108. Rabat. Maroc pp. 335-346. [ Links ]
FRAVAL, A., HERARD, F., 1975. Programme de prospection de la faune antagoniste deLymantria dispar (L.) au Maroc U.A.V. Doc. Labo. Zool. I.A.V. Hassan II Maroc, 45 pp. [ Links ]
FRAVAL, A., HERARD, F., JARRY, M., 1978. Méthodes d'échantillonnage des populations de pontes de L. dispar (Lepidoptera: Lymantriidae) en Mamora (Maroc). Ann. Zool. Ecol. Anim. 10(2): 267-279. [ Links ]
FRAVAL, A., 1989. Dynamique des populations. ln FRAVAL, A. Lymantria dispar. Rabat: Actes Editions (Documents scientifiques et techniques) pp. 53-72. [ Links ]
HERARD, F., FRAVAL, A., 1980. La répartition et les ennemis naturels de Lymantria dispar L. (Lép. Lymantriidae) au Maroc. Acta. Ecologica 1(1): 35-48. [ Links ]
HERARD, F., 1984. Étude des relations trophiques entre Lymantria dispar (L.) (Lepidoptera. Lymantriidae) et Quercus suber (L.) (Fagaceae) dans les conditions - simulées en laboratoire - de la forêt de Mamora (Maroc):1, Énoncé général des résultats. Actes Inst. Agro. Vét. (Maroc) 4(1): 147-155. [ Links ]
KHOUS, M.G., 1991. Note sur le contrôle naturel de la spongieuse en Algérie. Séminaire sur le Chêne-liège. Inst. Nat. Rech. Forest. Déprt. Prot. Forêt. Jijel, Mars, 5 pp. [ Links ].
KHOUS, M.G., DEMOLIN, G., 1997. Contribution à la dynamique intracyclique de Lymantria dispar L. en forêt de Tikijda (Parc National). Bull. Soc. Hist.nat. Afr. (72): 65-79. [ Links ]
LUCIANO, P., ROVERSI, P., 2001. Fillofagi delle Quercus in Italia. Ed. Sassari. 161 pp. [ Links ]
LUCIANO, P., ANDREA, L., 2005. La lutte aux lépidoptères défoliateurs des subéraies dans la province de Sassari. Ed. Sassari. pp 57-59. [ Links ]
NIERHAUS-WUNDERWALD, D., WERMLINGER, B., 2001. Le bombyx disparate (Lymantria dispar L.). Inst. Fede. Rech. WSL. Birmensdorf. 34: 8 pp. [ Links ].
VILLEMANT, C., 1993. Les prédateurs-démantèleurs des pontes de Porthetria dispar dans les subéraies marocaines. Thèse. Doc. Université d'Orléans, Tome 1, 281pp. [ Links ]
VILLEMANT, C., 2003. Le Bombyx disparate en Corse. Insectes 3(130): 10 pp. [ Links ].
Remerciements
Nous tenons à remercier M. le Docteur L. Nef de l'université Catholique de Louvain (Belgique), et Mme F. Deriche, enseignante à l'université de Boumerdes (Algérie) pour les suggestions et les corrections apportées au texte. Notre reconnaissance à tous les responsables des forêts qui nous ont facilité le travail de terrain.
Entregue para publicação em Junho de 2010
Aceite para publicação em Maio de 2012













