Serviços Personalizados
Journal
Artigo
Indicadores
Links relacionados
Compartilhar
Revista de Ciências Agrárias
versão impressa ISSN 0871-018X
Rev. de Ciências Agrárias vol.36 no.3 Lisboa jul. 2013
Revisão: microalgas: uma fonte alternativa na obtenção de ácidos gordos essenciais
Review: microalgae: an alternative source to obtain essential fatty acids
Shana Pires Ferreira, Leonor de Souza-Soares e Jorge Alberto Vieira Costa*
* Laboratório de Engenharia Bioquímica (LEB), Programa de Pós-Graduação em Engenharia e Ciência de Alimentos, Escola de Química e Alimentos, Universidade Federal do Rio Grande – FURG. E-mails: shanaferreira@gmail.com, author for correspondence; leonor.souza-soares@gmail.com; jorgealbertovc@terra.com.br
RESUMO
As microalgas são micro-organismos fotossintetizantes de grande importância, uma vez que sintetizam biocompostos de alto valor agregado. Os ácidos gordos de microalgas podem ser produzidos tanto de forma autotrófica quanto heterotrófica e sua síntese ocorre no cloroplasto. O objetivo do presente trabalho é realizar uma breve revisão sobre os ácidos gordos poli-insaturados produzidos por microalgas, enfatizando a influência das condições de cultivo das microalgas, síntese e metabolismo para a produção de ácidos gordos. Esta revisão aborda alguns trabalhos desenvolvidos pelo grupo do LEB e, enfoca os seguintes itens: microalgas, conteúdo lipídico das microalgas, síntese e metabolismo de ácidos gordos, influência das condições de cultivo das microalgas na produção de lipídios e perfil de ácidos gordos.
Palavras-chave – Ácidos gordos essenciais, condições de cultivo, microalgas, teor de lipídios
ABSTRACT
Microalgae are photosynthetic micro-organisms of great importance, since they are capable of synthesizing high value biocompounds. Fatty acids of microalgae can be produced both by autotrophic and heterotrophic pathways, and are synthesized in the chloroplast. The aim of this study is to perform a brief review of the polyunsaturated fatty acids produced by microalgae, emphasizing the influence of culture conditions, synthesis and metabolism for the production of fatty acids. This review discusses some of the work undertaken by the group LEB, and focuses on the following items: microalgae, lipid content of microalgae, fatty acid synthesis and metabolism, influence of culture conditions of microalgae for the production of lipids and fatty acid profile.
Keywords - Culture conditions, essential fatty acids, lipid content, microalgae
Introdução
O estudo de micro-organismos como microalgas, alguns fungos (leveduras, por exemplo) e bactérias, deve-se à essencial importância desses nas diversas cadeias tróficas, para além da possibilidade de aplicação no setor produtivo de diversas áreas como: nutrição, saúde humana e animal, no tratamento de águas residuais, na produção de energia e na obtenção de compostos de interesse das indústrias de alimentos, químicas e farmacêuticas dentre outras (Grobbelaar, 2004; Richmond, 2004).
O crescimento de microalgas é resultado da interação entre fatores biológicos, físicos e químicos. A composição bioquímica da biomassa das microalgas é determinada pela natureza de cada espécie algal, de fatores como a intensidade de luz, temperatura, pH, nutrientes e concentração de CO2 (Miao e Wu, 2004).
Os ácidos gordos reconhecidos pela WHO (World Healthy Organization) como essenciais são o linoléico (C18:2 ω-6), α-linolénico (C18:3, ω-3), γ-linolénico (GLA, 18:3 ω-6) e araquidônico (AA, 20:4 ω-6) (Alonso e Maroto, 2000). O ácido α-linolénico, apesar de ser sintetizado a partir do ácido linoléico, é considerado como essencial por existirem evidências da perda desta capacidade de biossíntese com o envelhecimento. O ácido araquidônico é sintetizado a partir da insaturação do ácido γ-linolénico (Murray et al. 2002).
Os ácidos gordos poli-insaturados (PUFAS) são obtidos de fontes vegetais e são nutrientes essenciais da dieta de tecidos animais, devido a capacidade limitada de insaturação destes tecidos. Estes ácidos gordos essenciais originam os ácidos gordos eicosanóicos (C20), que por sua vez irão dar origem a famílias de compostos conhecidos como eicosanóides (Murray et al. 2002).
Os PUFAS de origem microalgal têm um mercado muito promissor na biotecnologia, em especial na indústria de alimentos funcionais (Bertoldi et al. 2008). Lipídios, especialmente ácidos gordos insaturados, têm sido encapsulado visando diminuir a susceptiblidade à oxidação (Favaro-Trindade et al. 2008).
O objetivo do presente trabalho é realizar uma breve revisão sobre os ácidos gordos poli-insaturados produzidos por microalgas enfatizando a influência das condições de cultivo das microalgas, síntese e metabolismo para a produção de ácidos gordos, bem como seus aspectos nutricionais.
Microalgas
A denominação microalgas inclui organismos com dois tipos de estrutura celular: procariótica e eucariótica. Os procarióticos têm representantes nas divisões Cyanophyta (cianobactérias) e Prochlorophyta. Já os eucarióticos possuem representantes nas Divisões Chlorophyta, Euglenophyta, Rhodophyta, Haptophyta (Prymnesiophyta), Heterokontophyta (Bacillariophyceae, Chrysophyceae, Xantophyceae etc.), Cryptophyta e Dinophyta (Derner et al. 2006).
Microalgas crescem autotroficamente utilizando luz e dióxido de carbono, e também podem ser cultivadas em sistema heterotrófico, usando compostos orgânicos como energia e fonte de carbono, ou ainda em sistema de cultivo mixotrófico. Nesse sistema usam-se, simultaneamente, a fonte luminosa e o substrato orgânico como fonte de energia, além de CO2 e substrato orgânico como fontes de carbono (Chojnacka e Marquez-Rocha, 2004).
Muitas microalgas têm demonstrado facilidade em crescer rapidamente em cultivos heterotróficos. Geralmente, um organismo utilizado para produção heterotrófica deve possuir as seguintes características: (1) habilidade para se dividir e metabolizar na ausência de luz; (2) possibilidade de crescer em meio de baixo custo; (3) facilidade para se adaptar rapidamente em novos ambientes e (4) capacidade para resistirem a stress hidrodinâmico na fermentação (Wen e Chen, 2003). Algumas diatomáceas demonstraram serem capazes de produzir ácido eicosapentaenóico (EPA, C20:5 ω-3) heterotroficamente (Wen, 2001).
As microalgas são cultivadas de forma contínua em curto tempo, requerendo pequenas áreas para seu cultivo, cuidados simples, tais como: reposição mineral, controle de pH, luminosidade, sendo que uma das principais vantagens é que em seu cultivo as mesmas dispensam a utilização de agrotóxicos (Bertoldi et al. 2008). Além disso, as microalgas podem utilizar CO2 como fonte de carbono para se multiplicarem e produzirem compostos de interesse. Assim, auxiliam na diminuição dos níveis de CO2 do ar, os quais são responsáveis pelos efeitos do aquecimento global. A biomassa produzida pode ser utilizada como alimento ou como fonte de biocompostos. Os ácidos gordos, quando extraídos, podem ser utilizados como alimento, fármacos, ou transformados em biocombustíveis (Radmann e Costa, 2008).
As microalgas têm sido estudadas em pesquisas biotecnológicas devido sua importância nutricional, econômica e ecológica (Costa et al. 2006a). Muitas microalgas são utilizadas para produção de alimentos por produzirem diversas substâncias, como vitaminas, sais minerais, pigmentos, lipídios e ácidos gordos (Morais e Costa, 2008).
As principais aplicações dos ácidos de microalgas ocorrem no enriquecimento de rações para peixes, produção de biodiesel e fonte de ácidos gordos essenciais na dieta humana (Morais e Costa, 2008). Mata et al. (2010) fazem uma relação das diferentes espécies de microalgas e seu conteúdo em lipídios (Tabela 1).
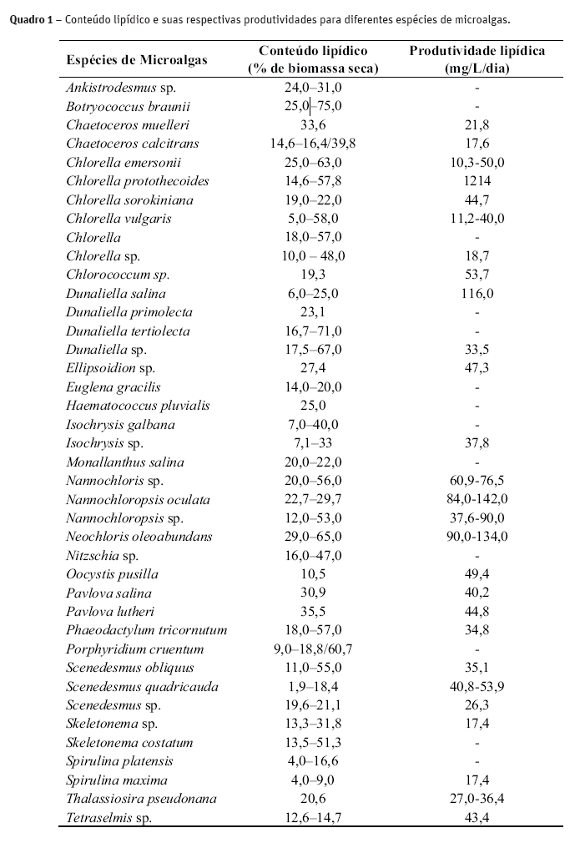
Lipídios de microalgas
Nos sistemas biológicos, os lipídios funcionam como componentes de membrana, produtos de reserva, metabólitos e como fonte de energia, sendo grande parte deles constituída de ácidos gordos. Sendo assim, os lipídios se classificam em: lipídios de armazenamento (lipídios neutros), triacilgliceróis (TAG) e lipídios de membrana (lipídios polares), fosfolipídios, glicolipídios e esteróis (Nelson e Cox, 2002). Uma subcategoria importante dos lipídios polares é constituida pelos glicolipídios (por exemplo, monogalactosil diglicerídeo MGDG), ésteres de ácidos gordos e glicerol, em que um dos grupos hidroxilo do glicerol é combinado com uma molécula de açúcar (neste caso galactose) para formar ligações éster com ácidos gordos (Greenwell et al. 2009).
Os triacilgliceróis podem ser considerados a principal fonte energética da maioria dos organismos (Nelson e Cox, 2011).
Os ácidos gordos são unidades fundamentais da maioria dos lipídios. São ácidos orgânicos de cadeia longa, possuindo de 4 a 24 átomos de carbono; possuindo um grupo carboxila único e uma cauda hidrocarbonada não-polar, que confere à maioria dos lipídios a sua natureza oleosa e gordurosa, insolúvel em água. Os ácidos gordos não ocorrem nas células ou tecidos numa forma não-combinada ou livre, mas sim em formas covalentemente ligadas a diferentes classes de lipídios, a partir dos quais eles podem ser liberados por hidrólise química ou enzimática. Diferentes ácidos gordos têm sido isolados de lipídios de várias espécies. Eles diferem entre si pela extensão da cadeia e sua presença, número e posição de duplas ligações; alguns ácidos gordos possuem também grupos metil ramificados (Nelson e Cox, 2002).
Os glicolípidos que são constituídos de glicerol têm sido encontrados em muitos organismos. No entanto, enquanto que em animais são encontrados em pequenas quantidades, são os constituintes majoritários de outros micro-organismos e o componente lípidico principal das membranas fotossintéticas de algas, incluindo as cianobactérias (algas verde azuladas) e plantas. A sua estrutura é análoga a dos glicerofosfolipídios com uma molécula de açúcar ligada glicosidicamente à posição três do glicerol e ácidos gordos esterificados nas outras duas posições. Os principais glicosilacilgliceróis das membranas fotossintéticas de algas e plantas são (Gurr et al. 2002):
— Monogalactosil-diacilglicerol (MGDG): especialmente abundante em plantas e algas, principalmente nos cloroplastos. Contém elevadas proporções de ácidos gordos poli-insaturados. Para Chlorella vulgaris, o MGDG apresenta principalmente ácido oléico (C18:1) e ácido linoléico (C18:2) quando cultivada no escuro, e 20% de ácido linolénico (C18:3) quando cultivada na luz.
— Digalactosil-diacilglicerol (DGDG): usualmente encontrados juntamente com MGDG nos cloroplastos de plantas superiores e algas. Não são tão abundantes quanto os MGDG, mas apresentam elevadas quantidades de ácidos gordos poli-insaturados, especialmente ácido linolénico (C18:3).
— Sulfoquinovosil-diacilglicerol (SQDG): contém ácidos gordos saturados, principalmente o ácido palmítico (C16:0).
Os lipídios podem ser encontrados em algas, constituindo, principalmente, duas frações: lipídios neutros e lipídios polares. Para o caso da microalga Spirulina platensis, os lipídios polares são compostos de MGDG, DGDG, sulfoquinovosil diacilglicerol e fosfatidilglicerol. A fração neutra consiste, principalmente de pigmentos (Piorreck et al. 1984).
Os ácidos gordos nas microalgas correspondem à maior fração lipídica e, em algumas espécies, os PUFAS representam entre 25 e 60% dos lipídios totais (Richmond, 2004). A estimativa de produção de lipídios por microalgas varia de 15.000 a 30.000 L. km-2 e a extração é simples, podendo serem aplicados os métodos tradicionais usados na indústria química, incluindo a extração por solventes (hexano) (Radmann e Costa, 2008).
Síntese e metabolismo de ácidos gordos
Os ácidos gordos podem ser obtidos na dieta ou produzidos pelo próprio organismo, em um processo chamado de lipogênese. Contudo, existe um grupo de ácidos gordos chamados ácidos gordos essenciais (AGE). Estes AGE não são sintetizados pelo organismo devido à ausência das enzimas dessaturases específicas, responsáveis pela formação das duplas ligações nestes compostos e, por isso, estes devem ser ingeridos através da dieta (Curi et al. 2002).
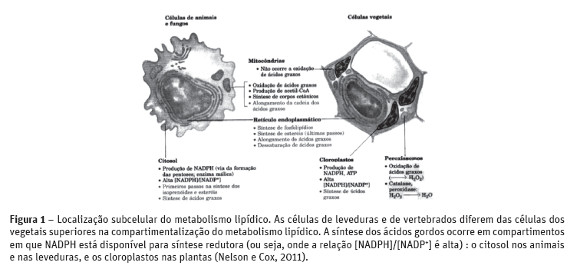
Várias espécies de microalgas vêm sendo cultivadas visando a obtenção de compostos considerados nutracêuticos, como os ácidos gordos poli-insaturados EPA (ácido eicosapentaenóico) e DHA (ácido docosahexaenóico) (Gill e Valivety, 1997). A maior parte das algas, fungos, bactérias, musgos, insetos e alguns invertebrados possuem as dessaturases e elongases requeridas para a síntese de vários ácidos gordos poli-insaturados (Chiou et al. 2001). O peixe, usualmente, obtém o EPA através da acumulação na cadeia alimentar. Muitos esforços têm sido realizados para desenvolver tecnologias adequadas para produção deste ácido gordo de microalgas (Lebeau e Robert, 2003; Molina Grima et al. 2003). Ao contrário, plantas e animais superiores têm deficiências das enzimas necessárias e, raramente, apresentam PUFAS acima de 18 carbonos (Gill e Valivety, 1997). A síntese dos ácidos gordos ocorre no citosol de muitos organismos, mas nos vegetais fotossintéticos e microalgas ela ocorre no estroma do cloroplasto (Figura 1 e 2). Esta localização justifica-se quando o NADPH é produzido nos cloroplastos pelas reações de luz da fotossíntese (Nelson e Cox, 2002).
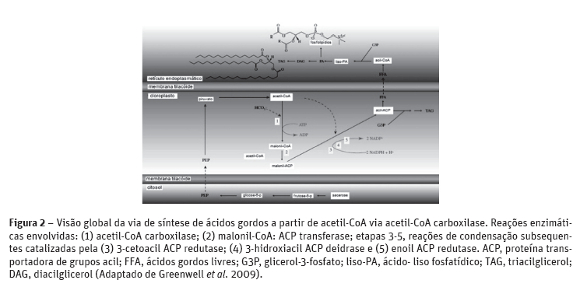
Todos os sistemas biológicos, incluindo os micro-organismos, insetos, plantas superiores e animais, são capazes de fazer a síntese de novo de ácidos gordos, partindo do acetato formando uma cadeia curta de ácidos gordos, com o ácido oléico (C18:1 ω-9) como o maior produto. A biossíntese tem início com a carboxilação de acetil CoA para formar acetato ou piruvato pela ação de enzimas glicolíticas. Então, a acetil CoA é convertida a malonil CoA, sendo esta reação catalisada pela enzima acetil-CoA carboxilase (Figura 2), a qual é utilizada a fim de direcionar a reação de condensação para estender os grupos acil a ácido esteárico (C18:0 ω-9) e uma dessaturase forma o ácido oléico (C18:1 ω-9) (Wen e Chen, 2003). Os vegetais têm outros meios de obter o acetil CoA necessário para a síntese de ácidos gordos. Eles produzem acetil CoA a partir do piruvato, empregando uma isozima estromal da piruvato desidrogenase (Nelson e Cox, 2002).
A composição de ácidos gordos essenciais (AGE) difere muito entre organismos terrestres e aquáticos. Nos tecidos de animais terrestres, prevalecem os ácidos gordos pertencentes à família ω-6, principalmente, ácido linoléico (C18:2) e ácido araquidônico (AA, C20:4). Nos organismos aquáticos, ocorre a predominância dos ácidos gordos da família ω-3, tanto para espécies marinhas como de água doce (Tarley et al. 2004).
Na biossíntese dos ácidos gordos e dos eicosanóides, um intermediário de três átomos de carbono, o malonil-CoA é sintetizado a partir do acetil-CoA sendo esta reação catalisada pela enzima acetil-CoA carboxilase (Figura 2). Os ácidos gordos são sintetizados por uma sequência repetitiva de reações. As longas cadeias carbônicas dos ácidos gordos são montadas em uma sequencia repetitiva de reações com quatro passos (Figura 3). Cada grupo malonil e acetil (ou um acil maior) é ativado por um tioéster que se une ao ácido gordo sintase (complexo multienzimático). O primeiro passo é a condensação de um grupo acil ativado (um grupo acetil é o primeiro grupo acil) com dois átomos de carbono derivados do malonil-CoA, com a eliminação do CO2 do grupo malonil; o resultado líquido final é o aumento de dois átomos de carbono na cadeia do grupo acil. O produto ß-ceto dessa condensação é então reduzido em três passos subseqüentes muito idênticos às reações da ß-oxidação, mas na sequencia inversa. No segundo passo, o grupo ß-ceto é reduzido a um álcool. No terceiro passo, a eliminação de H2O cria uma dupla ligação e no quarto e último passo, a dupla ligação é reduzida para formar o grupo acil-graxo saturado correspondente.
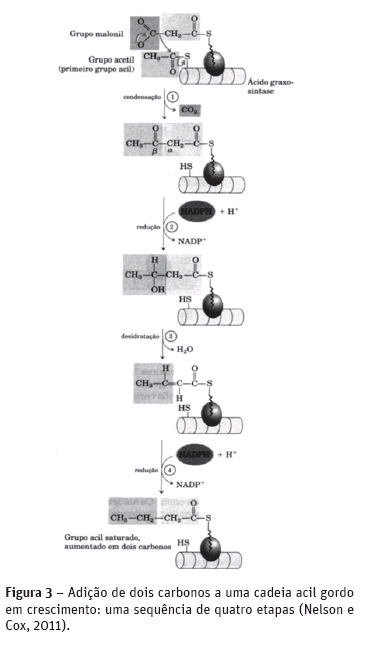
O grupo acil saturado produzido durante este conjunto de reações se transforma no substrato de uma nova condensação com o grupo malonil ativado. Cada uma das passagens através do ciclo aumenta a cadeia do grupo acil graxo de dois átomos de carbono. Quando o comprimento da cadeia atinge 16 carbonos, o produto formado (o palmitato, C16:0) abandona o ciclo. Os átomos de carbono constituindo os grupos metila e carboxila do grupo acetil tornam-se, respectivamente, C-16 e C-15 do palmitato; os átomos de carbono restantes são derivados da acetil-CoA via malonil-CoA (Figura 4).
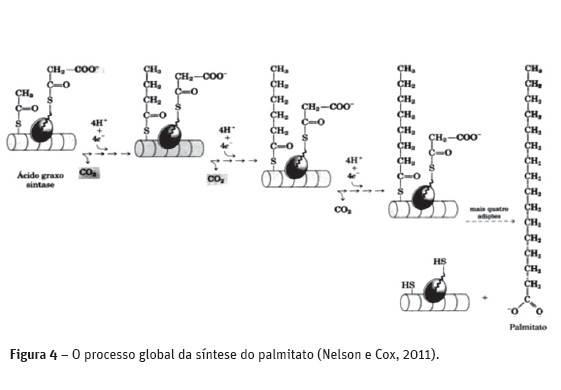
Os ácidos gordos saturados de cadeia longa são sintetizados a partir do palmitato (Figura 5). Este pode ser aumentado, tanto para formar o estearato (C18:0) quanto ácidos gordos saturados ainda menores, por adições posteriores de grupos acetil, por meio da ação dos sistemas de alongamento dos ácidos gordos presentes no retículo endoplasmático liso e na mitocôndria. O sistema de alongamento mais ativo do retículo endoplasmático aumenta a cadeia de 16 carbonos do palmitoil-CoA de dois carbonos, formando estearoil-CoA. Embora diferentes sistemas enzimáticos estejam envolvidos, e a coenzima A, e não a ACP (proteína transportadora de grupos acil), seja o transportador de acil diretamente envolvido na reação, o mecanismo de alongamento é idêntico àquele empregado na síntese do ácido palmítico: a doação de dois carbonos pelo malonil-ACP, seguida, por redução, desidratação e redução ao produto saturado com 18 átomos de carbono, o estearoil-CoA.

O palmitato (C16:0) e estearato (C18:0) servem como precursores dos dois ácidos gordos monoinsaturados, o palmitoleato (C16:1 Δ9) e o oleato (C18:1 Δ9) (Nelson e Cox, 2002). As duplas ligações adicionais introduzidas nos ácidos monoinsaturados estão sempre separadas pelo grupo metileno, exceto nas bactérias. Nos animais superiores as duplas ligações adicionais são todas introduzidas entre a dupla ligação existente e o grupo carboxila; porém, nas plantas superiores, elas podem ser introduzidas entre a dupla ligação existente e o carbono ω (metil terminal) (Murray et al. 2002).
Os ácidos gordos das famílias ω-9, ω-6 e ω-3 são formados a partir dos precursores oleato (ácido oléico, C18:1 Δ9), linolenato (ácido linoléico C18:2, Δ9,12) e α-linolenato (ácido α– linolénico, C18:3 Δ9,12,15), respectivamente, e de uma série de reações de insaturação e alongamento que pode ser verificado com detalhes na Figura 6. O ácido oléico (C18:1 ω-9) é dessaturado por uma dessaturase Δ12 para formar o ácido linoléico (C18:2 ω-6) e uma dessaturase Δ15 para formar o ácido α-linolénico (C18:3 ω-3). Em especial, a biossíntese dos ácidos gordos da família ω-3 tal como o EPA ocorre através de uma série de reações, a qual pode ser dividida em 2 etapas distintas. A primeira é a síntese de novo do ácido oléico (C18:1 ω-9) a partir de acetato. Esta etapa é seguida pela conversão do ácido oléico em ácido linoléico (LA, C18:2 ω-6) e ácido α-linolénico (ALA, C18:3 ω-3) (Wen e Chen, 2003). Este último é dessaturado por uma dessaturase Δ6, formando o ácido estearidonico (ETE, C18:4 ω-3). A seguir ocorre um alongamento da cadeia com adição de 2 átomos de carbono formando o ácido eicosatetraenoico (ETA, C20:4 ω-3). Este, por sua vez, é dessaturado por uma dessaturase Δ5, formando o ácido eicosapentaenóico (EPA, C20:5 ω-3). Após nova reação de alongamento forma-se o ácido gordo docosapentaenoico (DPA, C22:5 ω-3) que é dessaturado por uma dessaturase Δ4, formando o ácido docosaexanoico (DHA, C22:6 ω-3). A biossíntese das três famílias de ácidos gordos é mostrada na Figura 6.
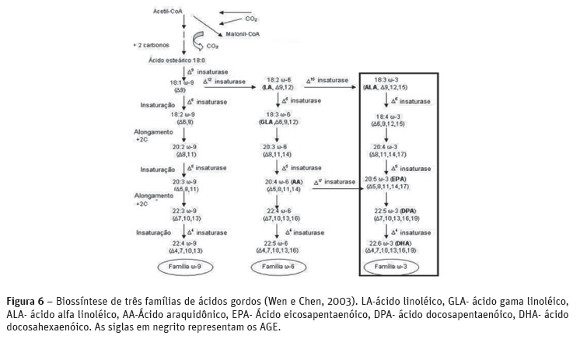
As três fontes de ácidos gordos (ácidos oléico, linoléico e linolênico) competem pela dessaturase Δ6. A afinidade da enzima pelo substrato e o total de substrato disponível determina qual o caminho metabólico é predominante. Geralmente, a primeira insaturação Δ6 é o passo limitante e o ácido linolénico tem alta afinidade pela dessaturase Δ6 seguido por ácido linoléico e oléico (Wen e Chen, 2003).
O alongamento da cadeia carbônica dos ácidos gordos é principalmente dependente na reação de dois sistemas de enzimas incluindo acetil-CoA enzima carboxílica e ácido gordo sintase, na maioria dos organismos. No processo de síntese dos ácidos gordos, acetil-coA é o iniciador. O processo de alongamento da cadeia carbônica necessita da contribuição do malonil-CoA, os substratos em que a enzima atua são acetil-ACP e malonil-ACP. O tioéster de ácido graxo C16-C18 pode ser formado após várias etapas de reação. A formação de ácidos gordos de cadeia carbônica curta é semelhante nas células de plantas superiores, animais, fungos, bactérias e microalgas. Por exemplo, na célula de algas verdes, as rotas de reação do iniciador, tal como o ácido palmitoléico, ácido oléico, ácido linoléico, ácido linolênico na síntese de ácidos gordos são semelhantes às reações que ocorrem nas células de plantas e leveduras. A insaturação da cadeia carbônica de ácidos gordos ocorre a partir do C18 e o alongamento da cadeia carbônica tem lugar a produzir ácidos de cadeia longa, que não são habituais em óleos de plantas. Ácidos gordos de cadeia longa (C20-C22), geralmente estão presentes em microalgas e o teor varia de espécie para espécie. Normalmente, os ácidos gordos de cadeia curta (C14-C18) são maioria nos ácidos gordos de Chlorella sp., mas elevado teor de ácidos gordos de cadeia longa e de hidrocarbonetos existem em algumas espécies específicas de microalgas (Huang et al. 2010).
O EPA é o precursor dos eicosanóides em animais e humanos, os quais têm papel importante na regulação dos processos fisiológicos. Os eicosanóides são substâncias hormonais, que incluem as prostaglandinas, trombonxanas, leucotrienos. O AA e EPA são precursores de compostos eicosanóides. No entanto, os eicosanóides destes ácidos gordos são diferentes estruturalmente e funcionalmente, e são, algumas vezes, antagônicos em seus efeitos. Um balanço de EPA/AA pode prevenir disfunções de eicosanóides e podem ser efetivos em tratar inúmeras doenças e desordens metabólicas (Gill e Valivety, 1997; Alonso e Maroto, 2000).
Segundo Perez-Garcia et al. (2011) todos os micro-organismos usam as mesmas vias metabólicas para respiração. Como esperado, o metabolismo das microalgas é muito semelhante ao metabolismo dos vegetais superiores. No entanto, é impossível especificar substratos específicos que podem ser preferencialmente utilizados por uma espécie particular de microalga.
Durante a respiração, ao contrário da fotossíntese, oxigênio é consumido, com paralela produção de CO2, sendo que a taxa respiratória dos substratos orgânicos está intimamente orientada para o crescimento e divisões celulares. O metabolismo respiratório em microalgas desempenha duas funções principais: serve como fonte exclusiva de energia para manutenção e biossíntese e fornece os blocos construtores de carbono para a biossíntese (Geider e Osborne, 1989). A assimilação oxidativa da glicose começa com a fosforilação da hexose, obtendo-se glicose-6-fosfato (Figura 2), que fica disponível para o armazenamento, síntese celular e respiração. Um equivalente de uma ligação fosfato simples é necessário por mol de glicose assimilada em glicose-6-fosfato. Nesse processo, um adicional de 30 equivalentes de ligações fosfato são gerados por oxidação aeróbia de um mol de glicose (Stewart,1974).
Beneficios dos ácidos gordos ω-3 de origem microalgal
Os ω-3 são ácidos essenciais que participam de diversas funções metabólicas. Estes ácidos representam um importante componente estrutural das membranas celulares humanas, particularmente nas células neurais. Em relação à saúde cardiovascular, o consumo regular de ácidos gordos ω-3 pode ajudar a reduzir o risco de hipertensão, trombose, enfarte do miocárdio e arritmias cardíacas. Isto ocorre porque os ácidos gordos ω-3 aumentam a razão lipoproteínas de alta densidade/lipoproteínas de baixa densidade (HDL/LDL) e diminuem a taxa colesterol total/HDL. Além dos benefícios cardiovasculares, os ácidos gordos ω-3 têm também demonstrado efeito positivo na função cerebral, do sistema nervoso e de doenças crônicas como hipertensão, diabetes, cancro e desordens autoimunes (Silva et al. 2012). Em mulheres grávidas, a ingestão adequada de EPA e DHA é crucial para o desenvolvimento saudável do cérebro do feto. Em lactentes, o ácido araquidônico (ARA), um ácido gordo da família ω-6, e o DHA são também necessários para o crescimento normal e desenvolvimento funcional (Ward e Singh, 2005). Interessantemente, o aumento no consumo de DHA também pode diminuir a gravidade da depressão. Efeitos imuno-modulatórios foram observados quando ácidos gordos ω-3 foram utilizados no tratamento de doenças inflamatórias tais como artrite reumatóide, doença de Crohn, psoríase, lúpus, asma e fibrose cística. Crianças que ingeriam óleo de peixe mais de uma vez por semana tiveram menor probabilidade de sofrer de asma. Aumentar os níveis de DHA e EPA nos pacientes com artrite reumatóide e colite ulcerosa tem sido encontrado como uma forma de reduzir a dor e melhorar suas condições, embora os modos de operação não sejam claros neste ponto (Adarme-Veja et al. 2012). Atualmente, existe uma grande demanda por microalgas nas indústrias nutracêutica e farmacêutica devido a seus efeitos positivos quanto à saúde. Os ácidos gordos poli-insaturados (PUFA) de origem microalgal, tais como ARA e DHA são adicionados como fortificações de fórmulas infantis, uma indústria que vale somente $10 bilhões por ano. Até ao momento, os extratos de microalgas podem ser encontrados em muitos produtos de cuidados faciais e da pele, por exemplo, em creme antienvelhecimento, produtos de cuidados refrescantes ou regenerativos, creme solar, emoliente e anti-irritação em esfoliantes. Dermochlorella é efetivamente extraído de Chlorella vulgaris, que pode estimular a síntese de colágeno na regeneração do tecido da pele e redução de rugas. Protulines é um extrato rico em proteínas de Arthrospira (Spirulina), que ajuda a combater mais cedo o envelhecimento da pele, exercendo um efeito de reforço na prevenção e formação de rugas (Adarme-Veja et al. 2012).
Influência das condições de cultivo das microalgas na produção de lipídios e perfil de ácidos gordos
O conteúdo e a composição dos lipídios e ácidos gordos em microalgas podem ser influenciados por fatores como luz (Fernandez et al. 2000), temperatura (Renaud et al. 2002; Colla et al. 2004), concentração de dióxido de carbono (Araujo e Garcia, 2005), concentração da fonte de nitrogênio (Colla et al., 2004), entre outros nutrientes.
Na presença de luz (cultivo autotrófico)
A maioria dos processos de produção de EPA investigados são baseados em crescimento fotoautotrófico (Sánchez et al. 2002; Molina Grima et al. 2003). No entanto, o crescimento autotrófico pode ser limitado devido à insuficiência de luz (fotolimitação) causada pelo sombreamento das próprias células. Consequentemente, a produtividade e o rendimento do EPA de sistemas fotossintéticos são baixos (Chen, 1996). Para aumentar a produção de EPA por culturas de microalgas, é desejável um processo de crescimento heterotrófico (Wen, 2001).
Um dos principais fatores que influenciam o conteúdo lipídico e de ácidos gordos em microalgas em termos nutricionais é a concentração de CO2. As microalgas utilizam carbono inorgânico para o crescimento, podendo ser utilizadas na mitigação de CO2 mais eficazmente do que vegetais superiores (Brown e Zeiler, 1993). Sendo assim, o estudo dos efeitos da adição de CO2 no crescimento e metabolismo de microalgas é estimulado pela necessidade de redução da emissão deste gás na atmosfera (Muradyan et al. 2004). Diversos pesquisadores (Tabela 2) estudaram a produção de ácidos gordos de origem microalgal a partir de variações dos cultivos autotróficos, tais como a combinação da intensidade luminosa e concentração de CO2 (Carvalho e Malcata, 2005), aumento da concentração de CO2 (Muradyan et al., 2004), aumento da temperatura do cultivo (Colla et al. 2004), uso de nutrientes na forma gasosa derivados de C, N e S (Radmann e Costa, 2008), diferentes concentrações de CO2 (Morais e Costa, 2008) e diferentes temperatura e concentração de NO3 (Costa et al., 2006b).

Na ausência de luz (cultivo heterotrófico)
No cultivo heterotrófico, como fonte orgânica, os açúcares são os substratos mais utilizados, especialmente a glicose (Miao e Wu 2006; Xu et al. 2006; Liang et al. 2009; Heredia-Arroyo et al. 2010; Shen et al. 2010; OGrady e Morgan, 2011), porém outras fontes orgânicas de carbono podem ser utilizadas tais como glicerol (Liang et al. 2009; OGrady e Morgan, 2011) e acetato (Liang et al. 2009; Heredia-Arroyo et al. 2010).
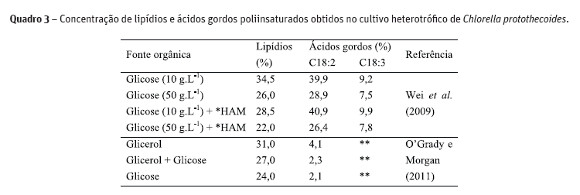
Segundo Martinez et al. (1991) a glicose atuando como substrato orgânico promoveu mudanças fisiológicas nas cepas de Chlorella vulgaris que afetaram a via metabólica de assimilação do carbono, tamanho da célula, densidade volumétrica de material de armazenamento, como grânulos de amido e lipídios. Pesquisadores utilizaram microalga do gênero Chlorella, mais especificamente Chlorella protothecoides em cultivo heterotrófico e avaliaram a produção de lipídios totais e concentração de ácidos gordos (Tabela 3) quando o cultivo foi realizado com diferentes fontes de carbono: mistura de glicose e hidrolisado de amido de mandioca (Wei et al. 2009), glicose (Wei et al. 2009; OGrady e Morgan, 2011) e misturas de glicerol e glicose (OGrady e Morgan, 2011).
Considerações finais
As microalgas constituem uma fonte alternativa potencial na obtenção de ácidos gordos essenciais, sendo estes os precursores de uma grande variedade de metabólitos bioativos, que estão envolvidos em diversas funções fisiológicas no organismo humano. O consumo de ω-3 obtido de microalgas é benéfico para o desenvolvimento neural, além de prevenir problemas coronários, cancro, hipertensão, diabetes, fibrose cística, artrites, asma, esquizofrenia e depressão. As microalgas marinhas são capazes de sintetizar ácidos gordos ω3, eicosapentaenóico (EPA, C20:5) e docosahexaenóico (DHA, C22:6), os quais entram na cadeia alimentar marinha estando disponíveis no óleo de pescado. Estes ácidos gordos são considerados importantes no desenvolvimento do tecido cerebral e na função visual.
Referências bibliográficas
Adarme-Vega, T.C.; Lim, D.K.Y.; Timmins, M.; Vernen, F.; Li, Y. e Schenk, P.M. (2012) Microalgal biofactories: a promising approach towards sustainable omega-3 fatty acid production. Microbial Cell Factories [em linha], vol.11:96. Disponível em: http://www.microbialcellfactories.com/content/11/1/96. [ Links ]
Alonso, D.L. e Maroto, F.G. (2000) Plantas chemical factories for the production of polyunsatured fatty acids. Biotechnology Advances, vol.18, p. 481-497. [ Links ]
Araújo, S.C. e Garcia, V.M.T. (2005) Growth and biochemical composition of the diatom Chaetoceros cf. wighamii brightwell under different temperature, salinity and carbon dioxide levels. Protein, carbohydrates and lipids. Aquaculture, vol.246, p. 405-412. [ Links ]
Bertoldi, F.C.; Santanna, E. e Oliveira, J.L.B. (2008) Revisão: Biotecnologia de microalgas. Boletim do Centro de Pesquisa de Processamento de Alimentos, vol.26, p.9-20. [ Links ]
Brown, L.M. e Zeiler, K.G. (1993) Aquatic biomass and carbon dioxide trapping. Energy Conversion and Management, vol.34, p. 1005-1013. [ Links ]
Carvalho, A.P. e Malcata, F.X. (2005) Optimization of ω-3 fatty acid production by microalgae: crossover effects of CO2 and light intensity under batch and continuous cultivation modes. Marine Biotechnology, vol.7, p. 381-388. [ Links ]
Chen, F. (1996) High cell density culture of microalgae in heterotrophic growth. Trends in Biotechnology, vol.14, p. 421-426. [ Links ]
Chiou, S.Y.; Su, W.W. e Su, Y.C. (2001) Optimizing production of polyunsaturated fatty acids in Marchantia polymorpha cell suspension culture. Journal of Biotechnology, vol.85, p. 247– 257. [ Links ]
Chojnacka, K. e Marquez-Rocha, F.J. (2004) Kinetic and and stoichiometric relationships of the energy and carbon metabolism in the culture of microalgae. Biotechnology, vol.3, n.1, p. 21-34. [ Links ]
Colla, L.M.; Bertolin, T.E. e Costa, J.A.V. (2004) Fatty acids profile of Spirulina platensis grown under different temperatures and nitrogen concentrations. Zeitschrift für Naturforschung, vol.59c, p. 55-59. [ Links ]
Costa, J.A.V.; Morais, M.G.; Dalcanton, F.; Reichert, C.C. e Durante, A.J. (2006a) Simultaneous cultivation of Spirulina platensis and the toxigenic cyanobacteria Microcystis aeruginosa. Zeitschrift für Naturforschung, vol.61c, p. 105-110. [ Links ]
Costa, J.A.V.; Radmann, E.M.; Cerqueira, V.S.; Santos, G.C. e Calheiros, M.N. (2006b) Perfil de ácidos graxos das microalgas Chlorella vulgaris e Chlorella minutissima cultivadas em diferentes condições. Alimentos e Nutrição, vol.17, n.4, p. 429-436. [ Links ]
Curi, R.; Pompéia, C.; Miyasaka, C.K. e Procopio, J. (2002) Entendendo a gordura – os ácidos graxos. São Paulo, Editora Manole, 598p. [ Links ]
Derner, R.B.; Ohse, S.; Villela, M.; Carvalho, S.M. e Fett, R. (2006) Microalgas, produtos e aplicações. Ciência Rural, vol.36, n.6, p. 1959-1967. [ Links ]
Fernandez, F.G.A.; Perez, J.A.S.; Sevilla, J.M.F.; Camacho, F.G. e Grima, E.M. (2000) -Modeling of eicosapentaenoic acid (EPA) production from Phaeodactylum tricornutum cultures in tubular photobioreactors: Effects of dilution rate, tube diameter, and solar irradiance. Biotechnology and Bioengineering, vol.68, p. 173-183. [ Links ]
Geider, R.J. e Osborne, B.A. (1989) Respiration and microalgal growth: a review of the quantitative relationship between dark respiration and growth. New Phytologist, vol.112, p. 327-341. [ Links ]
Gill, I. e Valivety, R. (1997) Polyunsatured fatty acids, part 1: occurrence, biological activities and applications. Trends in Biotechnology, vol.15, p. 401-409. [ Links ]
Gurr, M.I.; Harwood, J.L. e Frayn, K.N. (2002) Lipid Biochemistry: An introdution. 5ª ed. Wiley-Blackwell, 340p. [ Links ]
Greenwell, H.C.; Laurens, L.M.L.; Shields, R.J.; Lovitt, R.W. e Flynn, K.J. (2010) Placing microalgae on the biofuels priority list: a review of the technological challenges. Journal of the Royal Society Interface, vol.7, p.703-726. [ Links ]
Grobbelaar, J.U. (2004) Algal biotechnology: real opportunities for Africa. South African Journal of Botany, vol.70, n.1, p. 140-144. [ Links ]
Heredia-Arroyo, T.; Wei, W. e Hu, B. (2010) Oil accumulation via heterotrophic/mixotrophic Chlorella protothecoides. Applied Biochemistry and Biotechnology, vol.162, p. 1978–1995 [ Links ]
Huang, G.; Chen, F.; Wei, D.; Zhang, X. e Chen, G. (2010) Biodiesel production by microalgal biotechnology. Applied Energy, vol.87, p. 38-46. [ Links ]
Lebeau, T. e Robert, J.M. (2003) Diatom cultivation and biotechnologically relevant products: Part II. Current and putative products. Applied Microbiology and Biotechnology, vol.60, p. 624– 632. [ Links ]
Liang, Y.; Sarkany, N. e Cui, Y. (2009) Biomass and lipid productivities of Chlorella vulgaris under autotrophic, heterotrophic and mixotrophic growth conditions. Biotechnology Letters, vol.31, p. 1043–1049. [ Links ]
Martinez, F.; Ascaso, C. e Orus, M.I. (1991) Morphometric and stereologic analysis of Chlorella vulgaris under heterotrophic growth conditions. Annals of Botany, vol.67, p. 239-245. [ Links ]
Mata, T.M.; Martins, A.A. e Caetano, N.S. (2010) Microalgae for biodiesel production and other applications: A review. Renewable and Sustainable Energy Reviews, vol.14, p. 217–232. [ Links ]
Miao, X. e Wu, Q. (2004) High yield bio-oil production from fast pyrolysis by metabolic controlling of Chlorella protothecoides. Journal of Biotechnology, vol.110, p. 85-93. [ Links ]
Miao, X. e Wu, Q. (2006) Biodiesel production from heterotrophic microalgal oil. Bioresource Technology, vol.97, p. 841–846. [ Links ]
Molina Grima, E.; Belarbi, E.-H.; Acién Fernández, F.G.; Robles Medina, A. e Chisty, Y. (2003) Recovery of microalgal biomass and metabolites: process options and economics. Biotechnology Advances, vol.20, p. 491-515. [ Links ]
Morais, M.G. e Costa, J.A.V. (2008) Perfil de ácidos graxos de microalgas cultivadas com dióxido de carbono. Ciência e Agrotecnologia, vol.32, n.4, p. 1245-1251. [ Links ]
Muradyan, E.A.; Klyachko-Gurvich, G.L.; Tsoglin, L.N.; Sergeyenko, T.V. e Pronina, N.A. (2004) - Changes in lipid metabolism during adaptation of the Dunaliella salina photosynthetic apparatus to high CO2 concentration. Russian Journal of Plant Physiology, vol.51, p. 53-62. [ Links ]
Murray, R.K.; Granner, D.K.; Mayes, P.A. e Rodwell,V.W. (2002) Harper: Bioquímica. 9ª ed. São Paulo: Ed. Atheneu, 860p. [ Links ]
Nelson, D.L. e Cox, M.M. (2002) – Lehninger princípios de bioquímica. 3.ª ed. São Paulo: Sarvier Editora Ltda, 955p. [ Links ]
Nelson, D.L. e Cox, M.M. (2011) Princípios de bioquímica de Lehninger. 5.ª ed. Porto Alegre, Editora Artmed, 1304p. [ Links ]
OGrady, J. e Morgan, J.A. (2011) – Heterotrophic growth and lipid production of Chlorella protothecoides on glycerol. Bioprocess and Biosystems Engineering, vol.34, p. 121–125. [ Links ]
Piorreck, M.; Baasch, K.-H. e Pohl, P. (1984) Biomass production, total protein, chlorophylls, lipids and fatty acids of freshwater green and blue-green algae under different nitrogen regimes. Phytochemistry, vol.23: p. 207-216. [ Links ]
Perez-Garcia, O.; Escalante, F.M.E.; de-Bashan, L.E. e Bashan Y. (2011) Heterotrophic cultures of microalgae: Metabolism and potential products. Water Research, vol.45, p. 11-36. [ Links ]
Radmann, E.M. e Costa, J.A.V. (2008) Conteúdo lipídico e composição de ácidos graxos de microalgas expostas aos gases CO2, SO2 e NO. Química Nova, vol.31, n.7, p. 1609-1612. [ Links ]
Renaud, S.M.; Thinh, L.V.; Lambrinidis, G. e Parry, D.L. (2002) Effect of temperature on growth,chemical composition and fatty acid composition of tropical Australian microalgae grown in batch cultures. Aquaculture, vol.211, p. 195-214. [ Links ]
Richmond, A. (Ed.) (2003) - Handbook of microalgal culture: biotechnology and applied phycology. Oxford: Blackwell Publishing, 566p. [ Links ]
Sánchez Mirón, A.; Cerón Garcia, M.C.; Garcia Camacho, F.; Molina Grima, E. e Chisty, Y. (2002)-Growth and biochemical characterization of microalgal biomass produced in bubble column and airlift photobioreactors: studies in fedbatch culture. Enzyme and Microbial Technology, vol.31, p. 1015–1023. [ Links ]
Shen, Y.; Yuan, W.; Pei, Z. e Mao, E. (2010) Heterotrophic culture of Chlorella protothecoides in various nitrogen sources for lipid production. Applied Biochemistry and Biotechnology, vol.160, p. 1674–1684. [ Links ]
Silva, J.E.S.; Moura, A.M.A e Nogueira, R.A. (2012)-Efeito dos ácidos graxos essenciais sobre lipidemia e vascularização da membrana vitelina de codornas japonesas. Arquivo Brasileiro de Medicina Veterinária e Zootecnia, vol.64, p. 1603-1612. [ Links ]
Stewart, W.D.P. (Ed.) (1974) Algal physiology and biochemistry. Berkeley e Los Angeles, California, Blackwell Scientific Publications Ltd, 989p. [ Links ]
Tarley, C.R.; Visentainer, J.V.; Matsushita, M. e Souza, N.E. (2004) Composição em ácidos graxos de líquidos de cobertura de sardinhas (Sardinella brasiliensis) em conserva. Acta Scientiarum. Technology, vol.26, n.1, p. 7-10. [ Links ]
Ward, O.P. e Singh. A. (2005) Omega-3/6 fatty acids: Alternative sources of production. Process Biochemistry, vol.40, p. 3627–3652. [ Links ]
Wei, A.L.; Zhang, X.W.; Wei, D.; Chen, G.; Wu, Q.Y. e Yang, S.-T. (2009) Effects of cassava starch hydrolysate on cell growth and lipid accumulation of the heterotrophic microalgae Chlorella protothecoides. Journal of Industrial Microbiology and Biotechnology, vol.36, p. 1383–1389. [ Links ]
Wen, Z.Y. (2001) A high yield and productivity strategy for eicosapentaenoic acid production by the diatom Nitzschia laevis in heterotrophic culture. Tese de doutoramento. Hong Kong, University of Hong Kong, 116p. [ Links ]
Wen, Z.Y. e Chen, F. (2003) Heterotrophic production of ecosapentaenoic acid by microalgae. Biotechnology Advances, vol.21, p. 273 – 294. [ Links ]
Xu, H.; Miao, X.L. e Wu, Q.Y. (2006) High quality biodiesel production from a microalga Chlorella protothecoides by heterotrophic growth in fermenters. Journal of Biotechnology, vol.126, p. 499–507. [ Links ]
Recebido/Received: 2012.08.23
Aceitação/Accepted: 2013.04.15














