Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista de Ciências Agrárias
versão impressa ISSN 0871-018X
Rev. de Ciências Agrárias vol.38 no.2 Lisboa jun. 2015
ARTIGO
Cancro do castanheiro na região do Minho. Estrutura populacional e variabilidade genética de populações de Cryphonectria parasitica
Chestnut blight in the Minho region. Population structure and genetic variability of Cryphonectria parasitica
Luísa Moura1,2,*, Gabriela Pereira1, Sofia Costa1,2, Maria Martins1 e Eugénia Gouveia2,3
1 Escola Superior Agrária/Instituto Politécnico de Viana do Castelo, Refóios do Lima, 4990-706 Ponte de Lima, Portugal. * E-mail: luisamoura@esa.ipvc.pt, author for correspondence
2 Centro de Investigação de Montanha (CIMO), Escola Superior Agrária/Instituto Politécnico de Bragança, Campus de Santa Apolónia, 5300-253 Bragança, Portugal
3 Escola Superior Agrária/Instituto Politécnico de Bragança, Campus de Santa Apolónia, 5300-253 Bragança, Portugal.
RESUMO
O cancro do castanheiro (Cryphonectria parasitica) é considerado um dos principais fatores de mortalidade de Castanea sativa. Introduzido em Portugal e com desenvolvimento epidémico conhecido a partir da década de 90, manifestou elevada agressividade e uma dispersão muito rápida, tendo, atualmente, distribuição generalizada nas regiões de produção de castanheiro. Os meios de luta químicos, culturais e físicos não são eficazes no combate do cancro do castanheiro e apenas a luta biológica por Hipovirulência tem mostrado ser eficaz na Europa. A disseminação dos hipovírus está diretamente relacionada com os grupos de compatibilidade vegetativa (VCType), pelo que existe a necessidade de estudar a estrutura populacional de C. parasitica e identificar os VCType presentes em cada souto. Avaliou-se a incidência e severidade do cancro do castanheiro em três soutos da região do Minho, tendo-se obtido isolados de C. parasitica que foram posteriormente caracterizados quanto ao VCtype e avaliada a variabilidade genética das diferentes subpopulações através de box-PCR. Os isolados obtidos nos três soutos pertencem a cinco VCtype diferentes sendo o mais representativo o EU-11 (62% dos isolados), seguindo-se o EU-2 (20%), EU-1 e EU- 66 (5,5%) e EU-12 (7%). Os padrões de bandas obtidos por box-PCR não parecem refletir a virulência, origem geográfica ou VCtype dos isolados.
Palavras-chave: box‑PCR, cancro do castanheiro, Castanea sativa, compatibilidade vegetativa- VCtype, hipovirulência, box‑PCR
ABSTRACT
Cryphonectria parasitica, the causal agent of chestnut blight, was considered one of the main factors of mortality of Castanea sativa. Introduced in Portugal in the 1990s, and with epidemic development, the disease has manifested high aggressiveness and a rapid dispersion. Currently it has a widespread distribution in the chestnut production regions.
Chemical, physical and cultural control means are not effective to control Chestnut Blight and only biological control by hypovirulence has shown to be effective in Europe.
The spread of the hypovirus is directly linked to the vegetative compatibility types (VCType) of the fungal populations, so there is a need to study the population structure of C. parasitica and identify the VCTypes present in each subpopulation. The incidence of Chestnut Blight was assessed in three chestnut groves in the Minho region, and the C. parasitica isolates obtained were further characterized. Each isolate was allocated to a VCType by matching with reference isolates, and the genetic variability of selected isolates was evaluated by BOX-PCR. The isolates obtained were functionally diverse comprising over five VCType, with EU-11 (62%), followed by EU-2 (20%), EU-1 e EU- 66 (5,5%) and EU-12 (7%). Banding patterns obtained by box-PCR fingerprinting did not reflect geographical origin or the VCType of the isolate.
Keywords: BOX-PCR, Castanea sativa, chestnut blight, hypovirulence, VCtypes
Introdução
O castanheiro (Castanea sativa Mill.) é uma espécie de grande importância na região Norte de Portugal produzido num sistema agroflorestal orientado para a produção de castanha. O Cancro do castanheiro (Cryphonectria parasitica (Murrill) Barr) é uma doença de quarentena, introduzida em Portugal em 1989 na região de Trás-os-Montes que teve uma dispersão muito rápida em todas as regiões de produção de castanheiro, sendo atualmente considerada como a principal causa de morte. No Minho, a área de castanheiro teve uma redução drástica quando da introdução da Doença da Tinta nos finais do século XIX (Fernandes, 1966) estando atualmente confinado a plantações de castanheiros híbridos de pequena dimensão e à presença de castanheiros dispersos na região. O Cancro do castanheiro foi progressivamente invadindo as áreas de souto nesta região manifestando de igual forma elevada virulência e agressividade. Não existindo meios de luta eficazes para travar o desenvolvimento e dispersão da doença, e todos os meios de mitigação se tenham revelado de reduzida eficácia no seu controlo e dispersão (Gouveia et al., 2003; Bragança, 2007), a hipovirulência, meio de luta biológico, é a forma mais promissora para travar a doença. A disseminação do hipovírus, vírus dsRNA que transmite o fator de hipovirulência, está diretamente relacionada com os grupos de compatibilidade vegetativa (VCtype) presentes em cada local (Anagnostakis et al., 1986), pelo que para a sua utilização como meio de luta contra a doença exige que se conheça a estrutura populacional de C. parasitica e que se identifiquem os VCtype presentes em cada souto.
Com este trabalho pretende-se avaliar a incidência e severidade do Cancro do castanheiro e analisar a estrutura da população de C. parasitica na região do Minho considerando-se como subpopulações os isolados obtidos em cada um dos três soutos da Região do Minho localizados em Felgueiras, Vila Verde e Ponte de Lima. Constitui ainda objetivo deste trabalho estudar a variabilidade genética de C. parasitica por métodos moleculares (box- PCR) considerando a localização do souto e os isolados do mesmo VCType presentes nas diferentes subpopulações em estudo.
Material e Métodos
Recolha de material vegetal contaminado
Os soutos em estudo localizam-se em Felgueiras, na freguesia de Sendim, em Vila Verde, na Freguesia de Pico de Regalados e em Ponte de Lima, na freguesia de Cepões.
Nos soutos efetuou-se uma amostragem em árvores que apresentavam sintomas do Cancro do castanheiro como a copa afetada com ramos secos, cancros e fendilhamento da casca, rebentação adventícia exuberante, e a presença de picnídios. Nos soutos estudados os procedimentos de campo envolveram uma avaliação geral, num percurso sequencial, para observação do estado sanitário da parcela, procedendo-se a uma análise visual das árvores a fim de detetar os sintomas do Cancro do Castanheiro. Foi recolhido material vegetal na zona de expansão de cancros virulentos (Vir) ou de cancros curados (Hip). As amostras foram retiradas com a ajuda de uma navalha ou com um punch, sendo o material desinfetado com etanol a 96 % entre cada colheita de uma nova amostra. As amostras foram devidamente identificadas e transportados para o laboratório, sendo guardadas no frigorífico até ao isolamento do fungo.
Isolamento das estirpes de C. parasitica
Para o isolamento de C. parasitica utilizou-se o meio de cultura Potato Dextrose Agar (PDA, Difco, 39 g L-1), distribuído em placas de Petri. O manuseamento do material vegetal e os isolamentos foram realizados em condições de assepsia, na câmara de fluxo laminar. Cada secção de madeira foi colocada em etanol a 70% durante dois minutos e flamejada ou lavada em água destilada esterilizada antes de ser transferida para placas de Petri com o meio de cultura. As placas foram incubadas a 25 ºC na ausência de luz durante 7 dias, tendo posteriormente sido expostas à luz do laboratório durante 7 dias para desenvolvimento de esporos (Robin et al., 2000).
Dois isolados de cada amostra foram selecionados e guardados para estudo. Os isolados obtidos de C. parasitica foram seguidamente purificados por repicagem de uma porção de micélio, transferido para novas placas com meio PDA. Os isolamentos puros de C. parasitica foram conservados em tubos de ensaio com PDA inclinado à temperatura de 4 ºC.
Severidade da doença
Avaliou-se a incidência da doença nos soutos e as árvores foram classificadas quanto à severidade da doença provocada por C. parasitica com base na aplicação da escala de severidade de 1 a 5 proposta por Juhásová e Bernadovičová (2001) como indicado no Quadro 1.
Determinação de Grupos de Compatibilidade Vegetativa (VCtype)
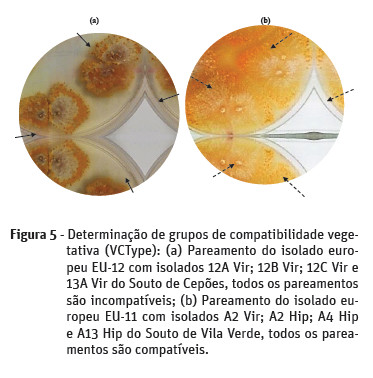
A determinação dos grupos de compatibilidade vegetativa (VCType) dos isolados com caraterísticas virulentas obtidos em laboratório, foi efetuada de acordo com a resposta Barreira versus Fusão proposta por Anagnostakis et al. (1986).
Efetuaram-se pareamentos de todos os isolados com os isolados de referência Europeus (“European Testers”) EU-1, EU-2, EU-11, EU-12 e EU-66. Utilizou-se meio PDA e cada placa foi dividida em cinco partes. Cada uma destas seções foi inoculada com conídeos da estirpe EU-1, e a uma distância de 3 mm em cada seção, inocularam-se conídeos de cinco isolados portugueses dos soutos em estudo. Repetiu-se o mesmo procedimento para as restantes estirpes europeias EU2, EU-11, EU-12 e EU-66.
Caracterização molecular das populações de C. parasitica
Da coleção de C. parasitica obtida, foram selecionados aleatoriamente isolados obtidos em Felgueiras e Vila Verde, pertencentes a grupos de compatibilidade vegetativa diferentes, hipovirulentos ou virulentos (Quadro 2).
Destes isolados, foi extraído DNA das estruturas estromáticas e hifas de cada isolado com o kit Nucleospin (Macherey-Nagel), de acordo com instruções do fabricante. Resumidamente, após um esmagamento inicial no tampão de lise com pistões adaptáveis aos microtubos de 1,5 ml, foi promovida uma lise química e disrupção celular a 70º C com tampão de lise contendo proteinase K. O DNA foi lavado com os tampões de lavagem fornecidos, precipitado com etanol e recuperado na membrana fornecida por centrifugação. Foi obtida uma solução de DNA de cerca de 100 μl de volume.
Para a amplificação de sequências repetidas do DNA com o primer BOX A1R, (Versalovic et al.1994), foi optimizada a mistura de reacção (20 µl) constituída por 10 µl de Sigma ReadyMix RedTaq w/ MgCl2, 1µl primer BOX A1R (10 mM), 3 µl solução de DNA e 6 µl Água MilliQ estéril / PCR grade. A amplificação de DNA realizou-se de acordo com o programa de amplificação constituído por um ciclo de 95 °C (7 minutos), seguido de 35 ciclos (1 minuto a 94 °C, 1 minuto a 53 °C, 4 minutos a 72 ºC), e um ciclo final de 72 °C durante 7 minutos.
Os fragmentos de DNA amplificados foram separados por electroforese horizontal em gel de agarose 2% em TBE 1X, contendo 0,01 % de GelRed (Biotium). Em cada gel, foi incluído 2,5 μl) de marcador de tamanho molecular (1 Kb DNA ladder), previamente misturado com tampão de carregamento. A electroforese decorreu a uma voltagem constante de 100 V durante cerca de 3 horas. Os fragmentos amplificados foram visualizados sob radiação ultra violeta e as imagens gravadas em suporte informático para análise. A análise foi realizada com o programa freeware GelAnalyzer 2010a (GelAnalyzer.com) para proceder à interpretação da mobilidade relativa das bandas, utilizando as bandas obtidas da ladder 1 Kb como referência. A detecção automática das bandas produzidas nas linhas correspondentes às amostras a analisar foi corrigida manualmente, e o seu peso molecular (em pares de bases) foi estimado por comparação com as bandas do espectro da ladder de 250 a 1500 bp. Seguidamente, foi construída uma matriz binária em Excel para Windows para o conjunto das amostras, sendo a presença de bandas com determinado peso molecular (+/- 5 bp) assinalado com ‘1' e a sua ausência com ‘0'. A partir desta matriz foi construído um dendrograma com distâncias euclidianas utilizando o programa Past 3.04 (Hammer et al. 2001), que foi utilizado para averiguar a proximidade genética entre os isolados testados e relacioná-la com as características escolhidas à priori, ou seja, a sua origem, virulência e grupo de compatibilidade vegetativa - VCType.
Resultados
Severidade da doença
Considerando a totalidade das árvores do souto de Felgueiras, conclui-se que apenas 3% das árvores avaliadas não apresentam sintomas do Cancro do Castanheiro, e na maioria dos castanheiros (86%) a doença manifesta-se com severidade de grau 2 ou 3. A percentagem das árvores que estão gravemente afetadas pelo cancro, em que se observou a presença de 3 ou mais cancros e/ou áreas afetadas muito extensas é de 7% e 4% das árvores perderam a sua viabilidade biológica (Figura 1).
Na Figura 2 apresentam-se os resultados obtidos no souto de Vila Verde, onde é possível constatar que apenas 4% das árvores avaliadas estavam sãs, não se verificando a existência de castanheiros sem viabilidade biológica. No entanto, 25% dos castanheiros apresentavam vários cancros e/ou cancros com áreas extensas. Estes últimos pertenciam a uma parcela com castanheiros com mais de 30 anos. As árvores em questão não apresentavam morte de ramos ou rebentação adventícia, mas foi de notar a existência de cancros curados. Estas evidências aplicaram-se a todos os castanheiros avaliados neste souto, independentemente da severidade com que a doença se manifestava. Nos castanheiros mais jovens, em início de produção, a quase totalidade destas árvores apresentava um cancro com área reduzida e cancros curados. Em alguns castanheiros já não se verificavam os sinais e sintomas de cancro, verificando-se apenas a existência de cancros curados nos troncos ou ramos.
Os castanheiros do souto de Cepões (Ponte de Lima) apresentavam um grau de severidade da doença variável entre 2 e 4. Dos 35 castanheiros analisados, 29% não apresentavam sintomas da doença, 26% foram classificados com grau 2; 23% com grau 3 e igual percentagem com grau 4 (Figura 3). A maioria das árvores analisadas apresentavam fendilhamento da casca (88,6%), e a presença de picnídios foi evidente em 22 árvores (63%). Neste souto observou-se igualmente a existência de cancros curados, com uma incidência de 31%.
Caracterização dos isolados de C. parasitica
Sete dias após incubação a 25ºC na ausência de luz, o crescimento de C. parasitica era bem visível. No caso dos isolados obtidos de cancros agressivos observou-se micélio com a coloração laranja e a presença de estruturas estromáticas também de cor laranja e com esporos. Os isolados obtidos de cancros curados apresentavam micélio aéreo branco e ausência de esporos.
Nos três soutos em estudo recolheram-se um total de 132 amostras obtidas de cancros agressivos e de cancros curados conforme o indicado no Quadro 3.
No que diz respeito ao padrão de crescimento do micélio de C. parasitica em meio PDA, verificou-se que apenas os isolados do souto de Cepões apresentaram crescimento irregular do micélio (Figura 4a). Nos soutos de Felgueiras e Vila Verde o padrão de crescimento do micélio dos isolados foi uniforme (Figura 4b, c e d).
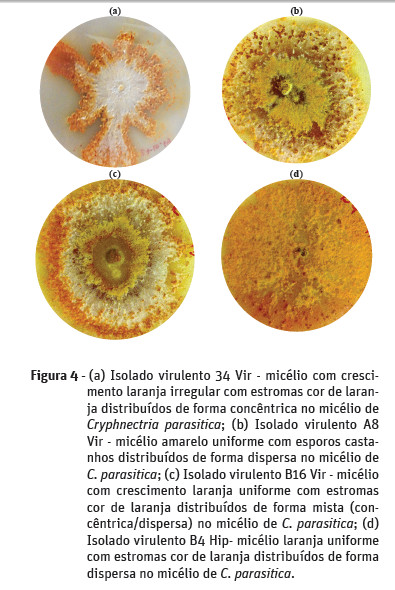
A coloração do micélio predominante nos isolados virulentos dos soutos de Felgueiras e Cepões foi laranja (Figura 4a, c e d), tendo neste último souto uma expressão muito significativa (81%). Nos isolados do souto de Vila Verde observou-se predominância de micélio com coloração amarela (Figura 4b). A cor vermelha alaranjada do micélio dos isolados de C. parasitica foi pouco significativa (1% dos isolados).
A percentagem de esporos com distribuição dispersa no micélio de C. parasitica (Figura 4b) é mais representativa nos soutos de Vila Verde e Cepões (13% e 36%, respetivamente), enquanto no souto de Felgueiras, foi mais representativa a distribuição concêntrica dos esporos no micélio (11%). A distribuição dos esporos no micélio considerada mista, apenas ocorreu nos soutos de Felgueiras e Vila Verde.
Grupos de compatibilidade vegetativa (VCType)
A determinação dos grupos de compatibilidade vegetativa (VCType) dos isolados com caraterísticas virulentas, efetuada de acordo com a resposta Barreira versus Fusão permitiu concluir que no souto de Felgueiras 84,2% dos isolados foram classificados como pertencentes ao VCType EU-11; 13,2% ao VCTypeEU-2 e 2,6% enquadraram-se no VCType EU-1.
O souto de Vila Verde (Figura 5) apresentou uma maior diversidade de VCType. Assim, os isolados deste souto pertencem aos VCType EU-1 (2,2%), EU-2 (30,4%), EU-11 (43,5%), EU-12 (13%), EU-66 (8,7%) existindo ainda o isolado A2 HipA (2,2%) que não apresentou compatibilidade vegetativa com nenhum dos isolados estudados.
O souto de Cepões apresentou os mesmos grupos de compatibilidade, prevalecendo igualmente o EU-11 (60%). Os restantes isolados ficaram incluídos nos VCType EU-1 (8,2%), EU-2 (16,5%), EU-12 (9,4%), EU-66 (5,9%).
Caracterização biológica e molecular das populações de C. parasitica
A análise dos fingerprints genéticos obtidos por rep-PCR utilizando o primer BOX A1R obtidos após electroforese dos fragmentos de DNA amplificados, são os apresentados na Figura 6. Pela sua análise constata-se que não foi possível agrupar os diferentes isolados de acordo com a sua origem geográfica, virulência ou grupo de compatibilidade vegetativa. No entanto, a presença de um produto de PCR de cerca de 370 pb na maioria dos isolados, poderá revelar alguma homogeneidade neste grupo.
Discussão e Conclusão
Estudou-se a população de C. parasitica, em três soutos da Região do Minho, localizados nos concelhos de Felgueiras, Vila Verde e Ponte de Lima. O estudo da incidência e severidade do Cancro do castanheiro mostrou que dos 221 castanheiros analisados, vinte e um não apresentavam sintomas de cancro e quatro não possuíam viabilidade biológica. Estes soutos apresentavam uma elevada incidência de Cancro do Castanheiro, mas também se observou a existência de muitos cancros curados.
A análise morfológica realizada segundo a metodologia de Bissegger et al. (1997) permitiu separar os isolados que apresentavam características virulentas, dos isolados que apresentavam caraterísticas hipovirulentas. Verificou-se que, dos isolados obtidos a partir de amostras de cancros curados, 36 isolados apresentaram colónias com características morfológicas de estirpes virulentas de C. parasitica. Resultados semelhantes foram também obtidos nos estudos realizados por Bryner et al. (2014), que também isolaram estirpes virulentas a partir de amostras de cancros curados.
No souto de Felgueiras 84,2 % dos isolados obtidos pertencem ao VCTypeEU-11, fato pouco comum no resto da Europa e muito comum em Portugal. Os estudos realizados por outros autores (Gouveia et al., 2001; Bragança, 2007) têm tido resultados coincidentes no que diz respeito à prevalência do VCType EU-11. Neste souto, para além da baixa variabilidade de VCType, os isolados hipovirulentos obtidos pertencem ao mesmo VCType (EU-11) que os isolados virulentos da população de C. parasitica, o que terá favorecido a generalização da hipovirulência neste ecossistema, facilitando a recuperação das árvores doentes.
No Souto de Vila Verde existe maior variabilidade de VCType, tendo-se identificado seis grupos de compatibilidade vegetativa EU-1, EU-2, EU-11, EU-12, EU-66 e ainda um isolado não compatível com os EU testers utilizados. O VCType mais representado é o EU-11 (43,5%), seguido do VCType EU-2 com 30,4% dos isolados.
O souto de Cepões é composto por castanheiros de origem nacional e castanheiros importados de França. Verifica-se que existe variabilidade de VCType, ao todo cinco grupos EU-1, EU-2, EU-11, EU-12, EU- 66. O grupo predominante é claramente o EU-11 (60%), seguido do EU-2 (16,5%),). A importação de porta-enxertos e varas para enxertia, franceses, pode ter influenciado a variabilidade de VCType encontrada neste souto, mas a disseminação do Cancro do castanheiro pelo souto parece ter partido dos porta-enxertos nacionais, pois o VCType EU-11 é o VCtype dominante na população Portuguesa de C. parasitica sendo pouco comum no resto da Europa (Bragança, 2007; Bragança et al., 2007; Gouveia et al., 2010). Neste souto não se conseguiu isolar estirpes hipovirulentas, mas verificou-se que existem muitos castanheiros com cancros curados, pelo que se conclui que a hipovirulência também está presente neste souto.
A confirmação da presença de isolados com características de hipovirulência (isolados de micélio branco em Felgueiras e Vila Verde), a presença de elevado número de cancros curados e a presença de cancros ativos e cancros curados na mesma árvore, indica a presença e dispersão da hipovirulência nestas diferentes subpopulações. Continuar o estudo destas subpopulações e dos hipovírus presentes nos isolados brancos obtidos, permitirá compreender os fatores que determinam a sua presença (founder effect) e a sua dispersão. Conhecer a evolução da hipovirulência nestas subpopulações no Minho, contribuirá decisivamente para a aplicação eficiente da hipovirulência como meio de luta biológica contra cancro do castanheiro noutras regiões do país.
Agradecimentos
Este trabalho foi realizado com financiamento do PROJETO PTDC/AGR-PRO/4606/2012 “HiCC - Luta Biológica por Hipovirulência contra o Cancro do castanheiro em Portugal”.
Os autores agradecem ao Engº Augusto Assunção da Direção Regional de Agricultura e Pescas do Norte, ao Engº Ayrton Cerqueira da empresa Delícias do Tojal e à Engª Lúcia Lopes pela colaboração neste trabalho.
Referências bibliográficas
Anagnostakis, S.L.; Hau, B. e Kranz, J. (1986) - Diversity of vegetative compatibility groups of Cryphonectria parasitica in Connecticut (USA) and Europe. Plant Disease, vol. 70, n. 6, p. 536-538. [ Links ]
Bissegger, M.; Rigling, D. e Heiniger, U. (1997) - Population Structure and Disease Development of Cryphonectria parasitica in European Chestnut Forests in the Presence of Natural Hypovirulence. Ecology and Epidemology, vol. 87, n. 1, p. 50–59. [ Links ]
Bragança, H. (2007). Chestnut blight in Portugal: spread and populational structure of Cryphonectria parasitica. Tese Doutoramento, Lisboa, Faculdade de Ciências de Lisboa. 153 p. [ Links ]
Bragança, H.; Simões, S.; Onofre, N.; Tenreiro, R. e Rigling, D. (2007) - Cryphonectria parasitica in Portugal: diversity of vegetative compatibility types, mating types, and occurrence of hypovirulence. Forest Pathology, vol. 37, n. 6, p. 391–402. [ Links ]
Bryner, S.F.; Prospero, S. e Rigling, D. (2014) - Dynamics of Cryphonectria hypovirus infection in chestnut blight cankers. Phytopathology, vol. 104, n. 9, p. 918-925. [ Links ]
Gouveia, E.; Patrícia, C. e Monteiro, M.L. (2001) - Incidence of chestnut blight and diversity of vegetative compatible types of Cryphonectria parasitica in Trás-os-Montes (Portugal). Forest Snow and Landscape Research, vol. 76, n. 3, p. 387-390. [ Links ]
Gouveia, E.; Valentim, C. e Portela, E. (2003) - Cancro do castanheiro: a luta cultural na redução do inóculo e manutenção sustentada dos soutos. Atas do 6º Encontro Nacional de Protecção Integrada. Escola Superior Agrária de Castelo Branco, p. 230-236. [ Links ]
Fernandes C. (1966) - A doença da tinta dos castanheiros. Parasitas do género Phytophthora de Bary. Dissertação para obtenção do grau de Investigador, Direcção Geral dos Serviços Florestais e Aquícolas, Centro de Investigações Florestais, Alcobaça, 95 p. [ Links ]
Hammer, H.D. e Ryan, P.D. (2001) - PAST: Paleonotological statistics software for education and data analysis. Palaeontologia Electronica, vol. 4, n. 1, p. 9. [ Links ]
Juhásová, G. e Bernadovičová, S. (2001) - Cryphonectria parasitica (Murr.) Barr and Phytophthora spp. in chestnut (Castanea sativa Mill.) in Slovakia. Forest Snow and Landscape Research, vol. 76, n. 3, p. 373–377. [ Links ]
Robin, C.; Anziani, C. e Cortesi, P. (2000) - Relationship between biological control, incidence of hypovirulence, and diversity of vegetative compatibility types of Cryphonectria parasitica in France. Phytopathology, vol. 90, n. 7, p. 730-737. [ Links ]
Versalovic, J.; Schneider, M.; de Bruijn, F. e Lupski, J.R. (1994) - Genomic fingerprinting of bactéria using repetitive sequence-based polymerase chain reaction. Methods in Molecular and Celular Biology, vol. 5, n. 1, p. 25-40. [ Links ]
Recebido/Received: 2015.03.16
Aceite/Accepted: 2015.06.01














