Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Ciências Agrárias
versión impresa ISSN 0871-018X
Rev. de Ciências Agrárias vol.40 no.4 Lisboa set. 2017
https://doi.org/10.19084/RCA17029
ARTIGO
Aplicação de extrato etanólico de própolis em doenças da cultura da soja
Application of ethanolic propolis extract in soybean diseases
Cassiano Spaziani Pereira*, Djovane Rempel, Adilson Paulo Sinhorin, Hocelayne Fernandes e Ivan Vilela Fiorini
Instituto de Ciências Agrárias e Ambientais (ICAA), Universidade Federal de Mato Grosso (UFMT) campus Sinop-MT, Brasil
(*E-mail: caspaziani@yahoo.com.br)
RESUMO
A aplicação de fungicidas é a principal forma de manejo das doenças da soja, porém devido ao apelo ambiental e o surgimento de fungos resistentes, existe a necessidade de estudos com produtos alternativos. O objetivo do trabalho foi verificar o efeito do extrato etanólico de própolis (EEP) no manejo de doenças fúngicas, sobre o crescimento, redução de stress hídrico e a produtividade da soja. O delineamento experimental foi em blocos casualizados (DBC), com cinco repetições em esquema fatorial 4 × 2. O primeiro fator foi as doses de EEP: 0, 106, 212, 318 g de própolis bruta ha‑1. O segundo com dois níveis sem e com a aplicação sequencial de fungicidas (duas aplicações de fungicidas trifloxistrobina+protioconazol e uma de mancozeb). A aplicação foliar de EEP reduz a severidade da mancha alvo de forma mais eficiente na dose 212 g ha‑1. O teor de água nas folhas e o crescimento vegetativo aumentam com a aplicação de EEP. A aplicação de manejo de fungicidas aumenta a produtividade de grãos de soja em 12%. A aplicação de EEP aumenta a produtividade da soja em até 23%, atribuindo-se este efeito à redução da severidade da mancha alvo e aumento no teor de água nos tecidos foliares das plantas.
Palavras-chave: Glycine max, Conteúdo de água nas plantas, Crescimento vegetativo, Manejo de fungicidas, Severidade das doenças na cultura da soja.
ABSTRACT
The application of fungicides is the main management of soybean diseases, but due to the environmental appeal and the emergence of resistant fungi, there is a need for studies with alternative products. The objective of this work was to verify the effect of ethanolic propolis extract (EPE) on the management of fungal diseases, on growth, reduction of water stress and soybean yield. The experimental design was a randomized complete block design (DBC), with five replications in a 4 × 2 factorial scheme. The first factor was four EPE doses: 0, 106, 212, 318 g of crude propolis ha‑1 and the second with two levels: without and with the sequential application of fungicides (two applications of fungicides trifloxystrobin + prothioconazole and one of mancozeb). The foliar application of EEP reduced the severity of the target spot with the greatest efficacy at the concentration of 212 g ha‑1. Water content and vegetative growth increase with the application of EEP. The application of fungicide management increases the yield of soybean grains by 12%. The application of EEP increases soybean productivity by up to 23%, due to the reduction of the target spot severity and increase in the water content in the plant tissues.
Keywords: Glycine max, content of water in plants, vegetative growth, management of fungicides, severity of diseases in soybean crop.
INTRODUÇÃO
Na safra 2016/2017, o Brasil produziu 106 milhões de toneladas de grãos de soja, sendo o segundo maior produtor mundial do grão, e a região centro-oeste é responsável por 50% dessa produção (Conab, 2016). Para atingir este patamar de produção a cultura deve ser protegida de inúmeras doenças, principalmente as de origem fúngica com a utilização de fungicidas, sempre que ocorre o aparecimento dos sintomas ou preventivamente (Goulart et al., 2011).
Apesar da necessidade de controle de doenças, deve-se atentar para o uso equilibrado dos defensivos químicos nos cultivos agrícolas, dentre esses defensivos utilizados, ressaltam-se os fungicidas que podem deixar resíduos em alimentos e contaminar os sistemas hídricos do meio ambiente de forma irreversível por meio da lixiviação e contaminando do lençol freático (Bohner et al., 2013).
Dentre as opção ao uso de defensivos químicos, pode-se citar o uso de produtos alternativos, que não causem danos ambientais, sejam estes químicos, biológicos, orgânicos ou naturais (Gouvea et al., 2011). Apesar do risco ambiental da aplicação de fungicidas e dos grandes prejuízos causados pelas doenças na cultura da soja, estudos com caldas fitoprotetoras tem se concentrado apenas em hortaliças e fruteiras (Rodrigues et al., 2006), não havendo trabalhos com o foco em aplicação de produtos alternativos aos fungicidas na cultura da soja. Para outras culturas, algumas opções que se pode citar são: urina de vaca, o leite e o soro, sabão de côco, caldas sulfocálcica e bordalesa e extratos vegetais (Sousa et al., 2012).
Diante do quadro exposto anteriormente é necessário ampliar os estudos sobre novas tecnologias para produção sustentável, com o menor impacto possível ao meio ambiente. Como alternativa, Pereira et al. (2008) estudaram a aplicação de uso de extrato etanólico de própolis (EEP) no controle de doenças na cultura do café, vindo os autores a verificar resultados promissores da aplicação de EEP sobre a ferrugem do cafeeiro Hemileia vastatrix Berk. & Br. e a cercosporiose Cercospora coffeicola Berk. & Cooke, sugerindo os autores a aplicação/estudo dos efeitos do EEP sobre outras doenças em outras culturas.
Diante do exposto, objetivou-se determinar o efeito de doses de EEP, isoladamente e associado com fungicidas a base de estrobilurinas e trizóis, no manejo de doenças fúngicas, sobre o crescimento, redução de stress hídrico e produtividade da soja.
MATERIAL E MÉTODOS
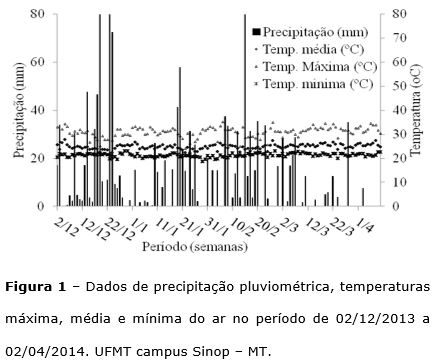
O experimento foi conduzido de dezembro de 2013 a abril de 2014, na área experimental da UFMT, campus Sinop-MT, (11º8648 S, 55º4848 W, altitude 372 m), segundo Köppen-Geiger o clima da região é do tipo Am (tropical com estação seca), caracterizado pela presença de duas estações bem definidas a chuvosa (outubro a abril) e a seca (maio a setembro). Os dados meteorológicos no período da condução do experimento foram coletados junto a Estação Meteorológica da UFMT campus Sinop (Figura 1).
A área do experimento foi cultivada anteriormente com arroz na safra 2011/2012 e soja na safra 2012/2013. O solo foi classificado como Latossolo Vermelho Amareo distrófico. Antes da implantação do experimento, realizou-se a análise do solo na profundidade de 0-0,2 metros. A análise química do solo: pH em H2O (5,4); P (3,69 mg dm‑3); K (37 mg dm‑3); Ca (17 mmolc dm‑3); Mg (7 mmolc dm‑3); V (37,5%) matéria orgânica (27 g kg‑1); S-SO42‑ (10 mg dm‑3); Zn2+ (4,1 mg dm‑3); Mn2+ (8,4 mg dm‑3); Cu2+ (0,7 mg dm‑3) e B (0,4 mg dm‑3). A análise física de solo foi de 436, 147 e 417 mg dm‑3 de areia, silte e argila, respectivamente.
O delineamento experimental foi em blocos casualizados (DBC) com cinco repetições em esquema fatorial 4 × 2. O primeiro fator foram três aplicações, quinzenais de quatro doses de própolis bruta: 0; 106; 212; 318 g de própolis bruta ha‑1. O segundo fator, com dois níveis: a ausência e a presença da aplicação de fungicidas. O manejo de fungicidas foi composto por três aplicações quinzenalmente, partir de R1, de fungicidas a base de triazóis e estrobilurinas (primeira aplicação: fungicida grupos químicos trifloxistrobina+protioconazol, dose 60+70 g de i.a. ha‑1; segunda aplicação: grupos químicos trifloxistrobina+protioconazol, dose 60+70 g de i.a. ha‑1 e terceira aplicação: Mancozeb, 1000 g de i.a. ha‑1, com adição de 0,4 L ha‑1 de adjuvante a óleo vegetal). As parcelas foram constituídas por cinco linhas de 5 m, espaçadas 0,50 m entre si, totalizando 12,5 m². Foi considerada como parcela útil os 7,5 m² centrais das parcelas totais, três fileiras centrais, desconsiderando-se 0,5 m de cada extremidade e duas linhas laterais (bordaduras).
A própolis utilizada no experimento era originaria do litoral paranaense, sendo considerada como pertencente ao grupo 3. As própolis deste grupo apresentam em sua composição concentrações predominantes dos flavonoides, crisina e galangina (Marcucci, 2008). A própolis foi considerada tipo brown de coloração marrom clara e textura moldável e fresca. Na tabela 1, está a análise química da própolis utilizada no trabalho, detectando-se a presença de compostos fenólicos e flavonoides, sendo identificadas substâncias com características antifúngicas, tais como rutina, campferol e a taxifolina, compostos identificados também por outros autores (Becho et al., 2009).
Antes da confecção do EEP, a própolis passou por uma limpeza, retirando-se as impurezas. No preparo do EEP, inicialmente preparou-se uma solução estoque de EEP, para futuras diluições e aplicação dos tratamentos. A solução estoque de EEP foi preparada com álcool a 92% (álcool água‑1) e própolis bruta. A proporção dos componentes foi realizada em massa massa‑1, com 10% própolis bruta ou 100 g de própolis bruta e 90% de álcool hidratado (900 g de álcool), seguindo metodologia proposta (Alencar et al. 2005).
Após a mistura dos componentes do EEP, a solução foi diariamente agitada, em agitador tipo vortex por 30 minutos, em rotação próximo a 2000 rpm, durante 27 dias. A partir do 28º dia a solução ficou em repouso por três dias e retirou-se o sobrenadante vagarosamente com o intuito de separar o excesso de cera, ou borra, do sobrenadante, ou extrato etanólico de própolis (EEP) (Marcucci, 2008).
Com a solução estoque de EEP pronta, a mesma foi diluída em água para confecção das caldas para aplicação dos tratamentos a campo. A diluição seguiu a proporção de kg do EEP kg‑1 de água, obtendo-se quatro caldas (tratamentos com própolis). Antes da aplicação das caldas com EEP também foi adicionado 200 mL ha‑1 de espalhante adesivo siliconado. Foram realizadas três aplicações do EEP quinzenalmente, sendo a primeira na fase vegetativa, estádio (V8) e a última aplicação em (R5). As aplicações do EEP foram realizadas com o auxilio de um pulverizador manual costal, com ponta do tipo cone vazio, aplicando-se volume de calda de 200 L ha‑1. A aplicação do EEP e do fungicida foi realizada separadamente, para evitar possíveis efeitos antagônicos entre os tratamentos.
Antes da realização do experimento ao campo, foram realizadas análises químicas da própolis, com auxílio de um HPLC, quantificando os teores de flavonoides. Determinou-se também os teores de cera. Coletou-se 20 g do EEP e realizou-se uma filtragem em funil de Buchner forrado com papel filtro apropriado. Logo após, o precipitado da filtragem foi lavado com etanol gelado, obtendo um resíduo branco no papel filtro. O resíduo que ficou no papel de filtro foi seco em estufa a 40°C por aproximadamente 24 horas. Por diferença da massa do EEP da massa filtrada e seca, encontrou-se o teor de cera da amostra.
A cultivar utilizada foi a TMG 133 RR, de ciclo, semi-tardio, 120 dias. A semeadura foi realizada no dia 2 de Dezembro de 2014, de forma manual, com 12 sementes m‑1, população de 240 mil plantas ha‑1, com espaçamento entre fileiras de 0,50 m, seguindo as recomendações de Embrapa (2004). Na adubação de base utilizou-se 100 kg ha‑1 de P2O5 e 50 kg ha‑1 de K2O e aos 30 DAE a mesma dose de K2O foi aplicada em cobertura.
O controle de plantas daninhas foi realizada com capinas manuais até 30 dias após a semeadura, período considerado crítico de competição para a cultura da soja. Para o controle de lagartas desfolhadoras, fez-se uma aplicação de inseticida em R1, com inseticida de ação sistêmica, contato e ingestão do grupo Acefato, na dose de 700 g ha‑1.
Avaliou-se a severidade das doenças: ferrugem, mancha alvo e antracnose da soja, em duas épocas a cada 20 dias, a partir de R1. Para estas avaliações foram escolhidas 10 plantas aleatoriamente no meio de cada parcela experimental, as mesmas foram demarcadas e avaliadas atribuindo-se notas a severidade das doenças de acordo com escalas diagramáticas.
A severidade da ferrugem da soja foi determinada utilizando-se de escala proposta por (Cantieri e Godoy, 2003). Para a avaliação da mancha alvo foi utilizada a escala diagramática proposta por Soares et al. (2009), a severidade da mancha alvo foi quantificada atribuindo-se valores em porcentagem. A antracnose foi avaliada em folhas e pecíolos, de acordo com a escala proposta por Costa et al. (2006). Após a atribuição das notas, calculou-se a área abaixo da curva de progresso de lesões das doenças AACPD (Campbell e Maden, 1990).
No pleno florescimento, R2, avaliou-se o teor de água nas folhas da soja, a altura das plantas, o diâmetro de caule, número de folhas por planta, área foliar e a massa seca da parte aérea da soja. Para a obtenção destas características foram retiradas cinco plantas parcela-1 da primeira linha do lado direito da parcela útil. A altura das plantas foi obtida com auxilio de uma trena, medindo-se do solo até o meristema apical das plantas. O diâmetro de caule foi obtido a 5 cm de altura do solo com auxílio de um paquímetro digital. Após as medições à campo, as plantas foram cortadas rente ao solo, acondicionadas em sacolas de papel e levadas para o laboratório de sementes da UFMT campus Sinop. No laboratório as folhas das plantas foram destacadas e contadas, obtendo-se o número de folhas por planta. Logo após obteve-se a área foliar em cm2, com o auxílio de um integrador de área foliar LICOR modelo LI -3010. Por fim as amostras foliares foram recondicionadas em sacos de papel e colocadas em estufa de circulação de ar forçado a 60ºC, até atingirem o peso constante, para obtenção da massa seca da parte aérea, segundo recomendações de Pereira et al. (2014a). Avaliou-se o teor relativo de água das folhas onde foram coletados manualmente, antes do nascer do sol, três trifólios, totalmente expandidos do terço médio das plantas. Os trifólios foram colocados imediatamente em sacos plásticos e condicionados em uma caixa de isopor com gelo, de modo a evitar perda de água pelas folhas no transporte.
No laboratório de sementes da UFMT campus Sinop, com o auxílio de um anel circular de metal, de 1,3 cm de diâmetro, foram retirados dos trifólios, três discos de tecidos foliares, procurando-se evitar nos discos a presença de nervuras ou qualquer tipo de dano às folhas. Os referidos discos tiveram suas massas determinadas em balança de precisão, obtendo-se a massa fresca (mf). Os mesmos discos, depois de pesados foram colocados em béqueres com água destilada por 12 horas até atingir a turgescência, quando determinou-se a massa túrgida (mt) através de pesagem. Por fim os discos passaram por secagem, acondicionados em sacos de papel e colocados em estufa de circulação forçada de ar a 60ºC até atingirem massa constante, obtendo-se a massa seca (ms). Com os dados de mf; mt e ms, obteve-se, através da aplicação da formula, o teor relativo de água do tecido foliar (TRA%):
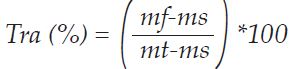
A dessecação da soja ocorreu no final de março de 2014, 120 DAE, utilizando herbicida Diquat (400 g ha‑1). A colheita foi realizada manualmente, quando os grãos estavam por volta de 180 g kg‑1 água de umidade. Após a colheita, determinou-se por contagem o número de vagens por planta e realizou-se a trilha mecânica das plantas em uma trilhadeira estacionária. Os grãos passaram por uma pré-limpeza manual, com auxílio de peneiras e foram acondicionados em sacolas de papel. A umidade dos grãos foi corrigida de para 130 g kg‑1 em estufa de circulação forçada de ar, a 60ºC (Brasil, 2009). A produtividade de grãos foi obtida com auxílio de uma balança digital, em kg de grãos por parcela e transformada para kg ha‑1. Separaram-se amostras dos grãos colhidos e determinou-se a massa de 1000 grãos.
Os dados obtidos, foram submetidos à análise de variância a 5% de probabilidade pelo teste F, para as variáveis qualitativas aplicou-se o teste de Tukey e para as variáveis quantitativas foi utilizada a regressão polinomial, sendo utilizado o programa estatístico SISVAR® (Ferreira, 2011).
RESULTADOS E DISCUSSÃO
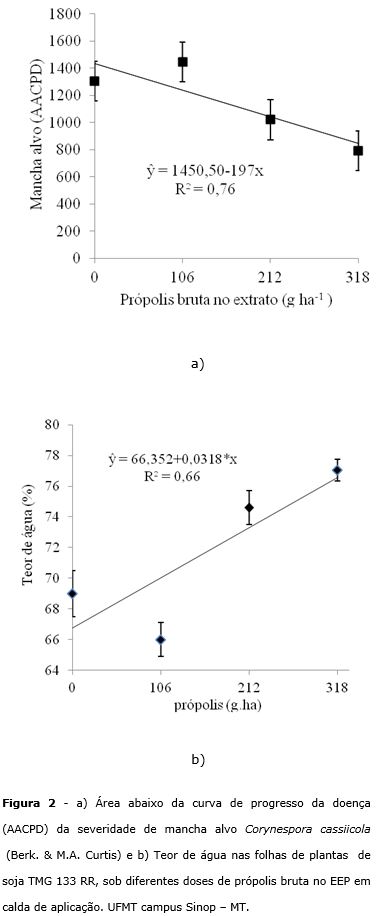
Não houve diferença significativa entre os tratamentos para a AACPD da ferrugem e da antracnose, devendo-se ressaltar que a severidade destas doenças na área do experimento foi insignificante. A doença com maior severidade foi a mancha alvo e os tratamentos reduziram AACPD da mancha alvo (Figura 2a). Verificou-se que a cada 1 g de própolis bruta adicionada ao EEP ocorreu redução de 197 unidades de AACPD da mancha alvo. Pereira et al. (2014b) observaram controle da antracnose do feijoeiro Coletothichum lindemuntianum, com aplicação de EEP, atribuído segundo os autores a presença de cera e substâncias sólidas presentes na composição da própolis, que formam uma camada de protetora de impedimento físico, sobre as folhas, impedindo a entrada do patógeno.
Além da camada de impedimento, a própolis possui compostos fenólicos com propriedades antifúngicas que comprovadamente podem: inibir de germinação de esporos, reduzir o tamanho dos tubos germinativos e inibir o crescimento micelial, efeitos estes dependentes da concentração utilizada (Pereira et al., 2001, 2008; Marini et al., 2012). Com a análise química da própolis utilizada neste trabalho detectou-se a presença de compostos de compostos como a Rutina, um bioflavonóide, na concentração de 514,9 mg kg‑1 da própolis (Quadro 1), sendo rutina, campferol e a taxifolina identificadas na própolis com efeito antifúngico (Becho et al., 2009).
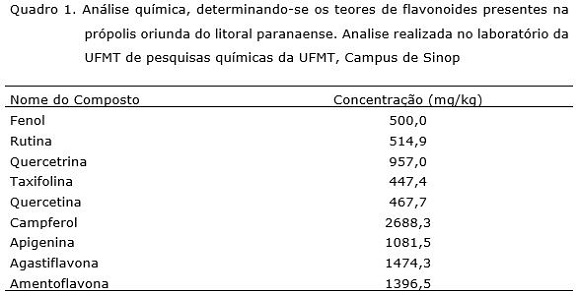
Dentre os compostos antifúngicos detectados na própolis utilizada neste estudo, o campferol atingiu a concentração de 2688,6 mg kg‑1 (Quadro 1), esta substância possui efeito inibitório na germinação de esporos e no crescimento de fungos micorrízicos, dentre eles o Gigaspora gigantea (Baptista et al., 1994). Identificou-se também a presença de taxifolina, que segundo Heemann et al. (2006), apresenta atividade antifúngica reduzindo a germinação de fungos fitopatogênicos, tais como Cladosporium cladosporioides e C. sphaerospermum.
Além dos efeitos citados anteriormente, a própolis pode ter estimulado a ativação de mecanismos de resistência induzida (SAR) que em muitos casos promove efeito químico sobre as estruturas dos patógenos e em outros casos aumenta a inclusive espessura da camada cerosa (Pereira et al., 2008). Efeito que pode ter sido mais pronunciado devido a própolis utilizada neste trabalho, descrita como do grupo 3, uma das mais ricas do Brasil em compostos fenólicos, substâncias com comprovada atividade biológica sobre organismos vivos (Park et al., 2004).
A aplicação de EEP manteve os valores de teores de água nas folhas de plantas sob patamares mais altos que as folhas das plantas testemunha, independentemente da presença ou não a aplicação de fungicida (Figura 2b). A cada 1 g de própolis bruta diluída no EEP ocorreu o aumento de 0,0318% no teor de água das folhas. Este efeito já havia sido verificado por Pereira et al. (2014b) na cultura do feijoeiro e atribuído pelos autores a formação pela aplicação da própolis, de uma camada cerosa de impedimento físico sobre as folhas, que reduz a evaporação das plantas. Segundo Vidal e Fleck (2006) a absorção de água e produtos químicos nas folhas é dificultada pela presença de barreiras que naturalmente estão presentes nos vegetais. A principal é a cutícula que reveste externamente as folhas dos vegetais e tem a função de proteger o tecido foliar da desidratação (Vidal e Flek, 2006). Esta camada de cera natural é constituída por substâncias lipofílicas e cerosas (Lichston e Godoy, 2006), características inerentes a muitas das substâncias presentes na própolis. O EEP utilizado no experimento tinha a presença de 1% de cera e 8,8% de massa seca (consituida de inúmeros compostos) na sua composição. Com a análise química, verificou-se que a própolis do litoral paranaense, é bastante rica em compostos fenólicos e flavonoides (expresso em quercetina), com a presença de 77 g kg‑1 da própolis bruta, compostos com características cerosas.
O número de folhas, altura de plantas e massa seca da parte aérea da cultivar TMG 133 RR, não foram influenciadas pelos tratamentos. A interação manejo de fungicidas com EEP alterou significativamente a área foliar e o diâmetro de caule da cultivar TMG 133 RR. Verificou-se que a aplicação de EEP com a aplicação do manejo de fungicidas atingiu os maiores valores de área foliar (Figura 3a). Com a aplicação de fungicida o maior valor de área foliar ocorreu na dose de 318 g ha‑1 de própolis, com 5200 cm2 e sem a presença do fungicida a área reduziu para aproximadamente 4000 cm2, na dose de 231 g ha‑1 de própolis. Podendo-se atribuir este efeito principalmente a redução na severidade da mancha alvo (Figura 3a), com possível redução de desfolha (fato observado visualmente, mas não determinado), além da manutenção de altos valores de teor de água nas folhas (Figura 3b).
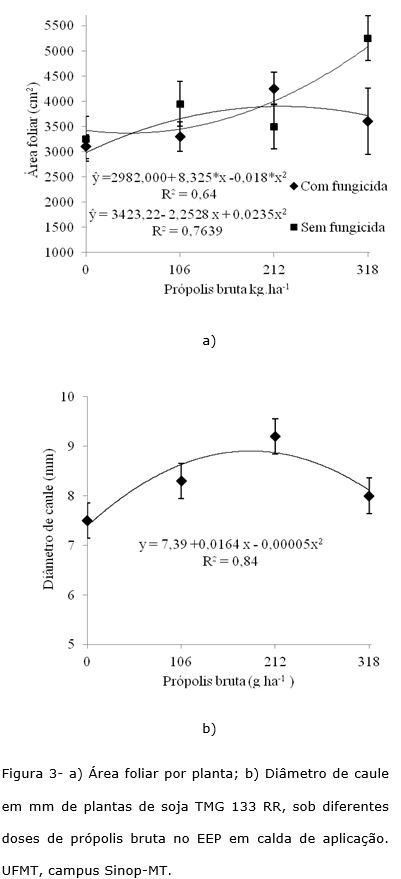
O diâmetro de caule aumentou com as aplicações de EEP, independentemente da ausência ou presença da aplicação do manejo com fungicidas (Figura 3b). A dose de 164 g ha‑1 de própolis apresentou o maior diâmetro de caule de 8,9 mm.
Pereira et al. (2014b) na aplicação do EEP via foliar também verificaram aumento na área foliar de plantas de feijoeiro e também atribuíram este efeito a manutenção dos teores de água nas folhas e ao efeito protetor do EEP à severidade da antracnose do feijoeiro, o que possibilitou, segundo os autores, as plantas aumentar seu crescimento vegetativo, elevando os teores de fotoassimilados responsáveis por aumento na produtividade das culturas (Santana e Silveira, 2008).
Com relação aos componentes de produtividade, a massa de mil grãos não foi influenciada pelos tratamentos, atingindo média de 150 g por mil grãos. O número de vagens foi significativamente influenciado pela interação manejo de fungicidas com EEP. Verificou-se que o número de vagens foi superior nas plantas com o manejo de fungicidas (Figura 4a). As doses de EEP influenciaram o número de vagens por planta, com o maior número de vagens no tratamento da aplicação do manejo de fungicida e na dose de 318 g ha‑1 de própolis bruta no EEP, obteve-se 47 vagens por planta. Sem aplicação de fungicida o maior número de vagens por planta ocorreu na dose de 164 g ha‑1 de própolis com 40 vagens por planta. Pereira et al. (2014) avaliando doses e EEP em feijão tiveram a mesma resposta quanto a massa de grãos, não significativa e aumento no número de vagens.
A produtividade foi influenciada pelas doses de própolis bruta no EEP e pelo manejo de fungicidas de forma isolada, não havendo interação entre os dois fatores. O fator doses de própolis bruta no EEP teve o ponto de máxima produtividade aplicando-se 209 g ha‑1 de própolis, com a produtividade de 3230 kg ha‑1 ou 54 sc ha‑1, aumento de 23%, ou 616 kg ha‑1 em relação a testemunha sem EEP e sem manejo de fungicidas (Figura 4b).
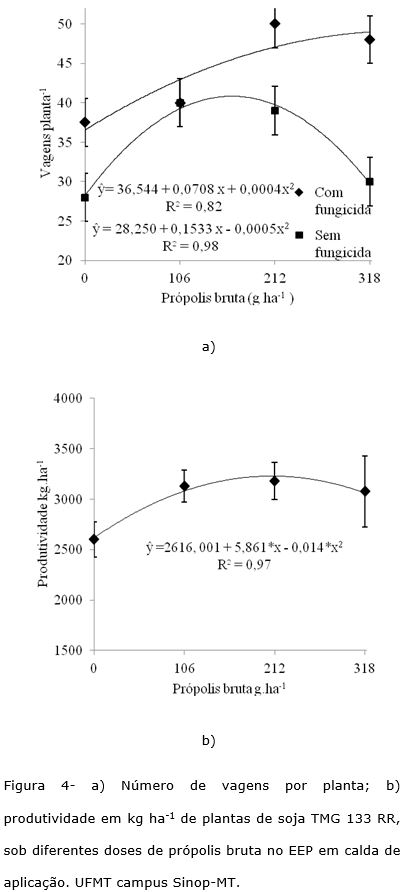
O aumento na produtividade de grãos pode ser atribuído ao controle da mancha alvo e a manutenção dos teores de água foliares, o que propiciou as plantas maiores aumentos no crescimento vegetativo (área foliar e diâmetro de caule) aumentando diretamente os teores de fotoassimilados disponíveis nos tecidos das plantas (Santana e Silveira, 2008) e consequentemente, aumentando a produtividade de grãos da soja.
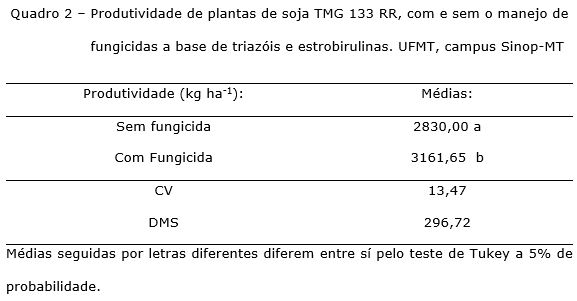
A aplicação do manejo de fungicidas aumentou a produtividade de grãos 12% em relação aos tratamentos sem fungicidas 3161,65 e 2830 kg ha‑1 respectivamente. Provavelmente, devido à manutenção da integridade das folhas com redução da severidade da mancha alvo, o que favoreceu a maior produtividade (Quadro 2).
Conclusões
A aplicação foliar de EEP reduz a severidade da mancha alvo da soja.
A aplicação de EEP mantém os teores de água nas plantas acima dos encontrados em plantas sem aplicação de EEP.
A aplicação de EEP aumenta o crescimento vegetativo das plantas de soja e a aplicação de fungicidas a base de triazóis e estrobilurinas potencializa este efeito.
A aplicação de fungicidas com triazóis e estrobilurinas aumenta a produtividade de grãos de soja em 12%.
A aplicação de EEP aumenta a produtividade da soja em até 23%, devido à redução da severidade de doenças (mancha alvo) e o efeito de manutenção do teor de água nos tecidos das plantas.
Referências bibliográficas
Alencar, S.M.; Aguiar C.L.; Paredes-Guzman J. & Park Y.K. (2005) - Composição química de Baccharis dracunculifolia, fonte botânica das própolis dos estados de São Paulo e Minas Gerais. Ciência Rural, vol. 35, n. 4, p. 909-915. http://dx.doi.org/10.1590/S0103-84782005000400025 [ Links ]
Baptista, M.J. & Siqueira, J.O. (1994) - Efeito de flavonóides na germinação e no crescimento assimbiótico do fungo micorrízico arbuscular Gigaspora gigantea. Revista Brasileira de Fisiologia Vegetal, vol. 6, p. 127-134. [ Links ]
Becho, J.R.M.; Machado, H. & Guerra, M.O. (2009) - Rutina – estrutura, metabolismo e potencial farmacológico. Revista Interdisciplinar de Estudos Experimentais, vol. 1, n. 1, p. 21-25. [ Links ]
Bohner, T.O.L.; Araújo, L.E.B. & Nishijima, T.O. (2013) - Impacto ambiental do uso de agrotóxicos no meio ambiente e na saúde dos trabalhadores rurais. Revista Eletrônica do Curso de Direito, vol. 8, p. 329-341. http://dx.doi.org/10.5902/198136948280 [ Links ]
Brasil (2009) - Regras para análise de sementes. Departamento Nacional de Produção Vegetal. Ministério da Agricultura, Brasília.
Campbell, C.L. & Madden, L.V. (1990) - Introduction to Plant Disease Epidemiology. John Wiley & Sons, New York. [ Links ]
Canteri, M.G. & Godoy, C.V. (2003) - Escala diagramática para avaliação da ferrugem da soja. Summa Phytopathologica, vol. 32, p. 89-94. [ Links ]
CONAB (2016) - Acompanhamento da safra brasileira de grão: nono levantamento junho/2016. Brasília: Companhia Nacional de Abastecimento. [cit. 2016.06.06] < http://www.conab.gov.br/conabweb/download/safra/9levantamentojunho2011.pdf> [ Links ]
Costa, I.F.D.; Balardin, R.S.; Medeiros, L. & Bayer, T.M. (2006) - Resistência de seis cultivares de soja ao Colletotrichum truncatum Schwein em dois estádios fenológicos. Ciência Rural, vol. 36, n. 6, p. 1684-1688. http://dx.doi.org/10.1590/S0103-84782006000600003 [ Links ]
Embrapa Soja (2004) - Tecnologias de Produção de Soja região Central do Brasil. Embrapa Soja. [cit. 2004.11.08] < http://www.cnpso.embrapa.br/producaosoja/instalacao.html> [ Links ]
Ferreira, D.F. (2011) - Sisvar: A computer statistical analysis system.Ciência e Agrotecnologia, vol. 35, n. 6, p. 1039-1042. http://dx.doi.org/10.1590/S1413-70542011000600001 [ Links ]
Goulart, A.C.P.; Furlan, S.H. & Fujino, M.T. (2011) - Controle integrado da ferrugem asiática da soja (Phakopsora pachyrhizi) com o fungicida fluquinconazole aplicado nas sementes em associação com outros fungicidas pulverizados na parte aérea da cultura. Summa Phytopathologica, vol. 37, n. 2, p. 113-118. http://dx.doi.org/10.1590/S0100-54052011000200005 [ Links ]
Gouvêa, A.; Zanotti, J.; Luckmann, M.P.; Mazaro, S.M. & Possenti, J.C. (2011) - Efeito de extratos vegetais em soja sob condições de laboratório e campo. Revista Brasileira de Agroecologia, vol. 6, p. 69-78. [ Links ]
Heemann, W.C.A.; Obdúlio, G.M.; Marilis, D.M.; Sasaki, C.M. & Franco, D.M. (2006) - Estudo fitoquímico da espécie Pterocaulon interruptum DC. (Asteraceae). Brazilian Journal of Pharmaceutical Sciences, vol. 42, n. 4, p. 57-68. http://dx.doi.org/10.1590/S1516-93322006000400014 [ Links ]
Lichston, J.E. & Godoy, S.A.P. (2006) - Morfologia e teor de cera de folhas de café após aplicação de fungicida. Pesquisa Agropecuária Brasileira, vol. 41, n. 6, p. 919-926. http://dx.doi.org/10.1590/S0100-204X2006000600004 [ Links ]
Marcucci, M.C. (2008) - Própolis tipificada: um novo caminho para a elaboração de medicamentos de origem natural, contendo este produto apícola. Revista Fitos, vol. 1, n. 3, p. 36-45. [ Links ]
Marini, D.; Mensch, R.; Freiberger, M.B.; Dartora, J.; Franzener, G.; Garcia, R.C. & Stangarlin, J.R. (2012) - Efeito antifúngico de extratos alcoólicos de própolis sobre patógenos da videira. Arquivos do Instituto Biológico, vol. 79, n. 2, p. 305-308. http://dx.doi.org/10.1590/S1808-16572012000200023 [ Links ]
Park, Y.K.; Paredes-Guzman, J.F.; Aguiar, C.L.; Alencar, S.M. & Fujiwara, F.Y. (2004) - Chemical constituents in Baccharis dracunculifolia as the main botanical origin of southeastern Brazilian Propolis. Journal of Agricultural and Food Chemistry, vol. 52, n. 5, p. 1100-1103. http://dx.doi.org/10.1021/jf021060m [ Links ]
Pereira CS, Araújo AG, Guimarães RJ, Paiva LC (2001) Uso da própolis como inibidor da germinação de esporos de Hemileia vastatrix. Mensagem doce, 3:45-49. [ Links ]
Pereira, C.S.; Guimarães, R.J.; Pozza, E.A. & Silva, A.A. (2008) - Controle da cercosporiose e da ferrugem do cafeeiro com extrato etanólico de própolis. Revista Ceres, vol. 55, n. 5, p. 369-376. [ Links ]
Pereira, C.S.; Farias, F.L. & Godoy, C.A. (2014a) - Aplicação de extrato etanólico de própolis (EEP) na nutrição e desenvolvimento de mudas de cafeeiro. Coffee Science, vol. 9, n. 1, p. 14-23. [ Links ]
Pereira, C.S.; Maia, L.F.P. & Paula, F.S. (2014b) - Aplicação de extrato etanólico de própolis no crescimento e produtividade do feijoeiro comum. Revista Ceres, vol. 61, n. 1, p. 98-104. http://dx.doi.org/10.1590/S0034-737X2014000100013 [ Links ]
Rodrigues, G.B.; Nakada, P.G.; Silva, D.J.H.; Dantas, G.G. & Santos, R.R.H. (2006) - Desempenho de cultivares de cebola nos sistemas orgânico e convencional em Minas Gerais. Horticultura Brasileira, vol. 24, n. 2, p. 206-209. http://dx.doi.org/10.1590/S0102-05362006000200017 [ Links ]
Santana, E.V.P. & Silveira, P.M. (2008) - Crescimento do feijoeiro (Phaseolus vulgaris L.) influenciado por doses de nitrogênio em cobertura. Pesquisa Agropecuária Tropical, vol. 38, n. 2, p. 134-140. [ Links ]
Soares, R.M.; Godoy, C.V. & Oliveira, M.C.N. (2009) - Escala diagramática para avaliação da severidade da mancha alvo da soja. Tropical Plant Pathology, vol. 34, n. 5, p. 333-338. http://dx.doi.org/10.1590/S1982-56762009000500007 [ Links ]
Sousa MF de, Silva LV, Brito MD de & Furtado DC de M (2012) Tipos de controle alternativo de pragas e doenças nos cultivos orgânicos no estado de Alagoas, Brasil. Revista Brasileira de Agroecologia. 7:132-138. [ Links ]
Vidal RA, Fleck NG (2006) Absorção e translocação de defensivos agrícolas. In: BORGES, L. D. Tecnologia de aplicação de defensivos agrícolas. Passo Fundo: Plantio Direto Eventos. p.57-70. [ Links ]
Recebido/received: 2017.02.14
Recebidio em versão revista/received in revised form: 2017.05.24
Aceite/accepted: 2017.05.26














