INTRODUCCIÓN
Los microorganismos presentes en el suelo participan en la descomposición de sustancias del suelo y en los ciclos de los nutrientes (Aislabie et al., 2013). A la hora de caracterizar las comunidades de microorganismos presentes en el suelo pueden emplearse técnicas como el análisis de los ácidos grasos fosfolípidos (PLFA), elementos presentes en las membranas celulares de casi todos los organismos del suelo, que se sintetizan en mayor medida durante etapas de crecimiento (Zelles, 1997; Zhang et al., 2019). A diferencia de lo que ocurre con los ácidos grasos neutros (NLFAs), estos no están asociados al almacenamiento, por lo que no se suelen acumular en la materia orgánica edáfica (Bååth, 2003). Los PLFAs son, por lo tanto, buenos indicadores de la biomasa bacteriana presente en el suelo, pero además ofrecen información sobre la composición de esta biomasa. En la tabla 1 se pueden observar los ácidos grasos asociados con algunos importantes grupos de microorganismos (Joergensen, 2022).
Tabla 1 PLFAs presentes en los diferentes grupos microbianos (adaptado de Nichols et al., 1986; Zelles, 1997; Joergensen, 2022)
| PLFAs Microbianos Inespecíficos | 14:0, 15:0, 16:01, 17:0, 18:0, 20:0, 20:4ω6,9,12,15 | |||
| PLFAs Bacterianos | G+ | Firmicutes | i14:0, i15:02, i16:02, i17:0, i18, a15:0, a16:0, a17:0, a18:0, a19:0 | |
| Actinobacterias | 10Me16:0, 10Me17:0, 10Me18:0 | |||
| G- | cy17:0, cy19:0, 16:1ω7, 16:1ω9, 17:1ω8, 18:1ω7 | |||
| PLFAs Fúngicos | PLFAs Fúngicos Inespecíficos | 18:3ω6,9,121 | ||
| AMF | 16:1ω5c2 | |||
| Zigomicetes | 18:1ω9c3 | |||
| Ascomicetes y Basidiomicetes | 18:2ω6c1 | |||
1 Presentes también en plantas.
2 Presentes también en G-.
3 Presente también en plantas y G-.
La estructura, distribución y composición de las comunidades microbianas presentes en el suelo van a estar condicionada por características como son el pH, y la temperatura, pero también por factores relacionados con el tipo de manejo que se hace sobre ese suelo (Deslippe et al., 2005).
El objetivo de este trabajo es estudiar las diferencias entre las comunidades microbianas, caracterizadas mediante análisis de PLFAs, de suelos agrícolas de la zona pedoclimática lusitana, en los que se cultiva trigo empleando dos tipos de manejo diferentes: convencional y orgánico.
MATERIAL Y MÉTODOS
Para la realización de este trabajo se tomaron muestras de diferentes campos dedicados al cultivo de trigo: 10 parcelas bajo un manejo convencional (en cinco zonas diferentes), y 13 bajo manejo orgánico (obtenidas en 6 localizaciones). Todas las parcelas se encontraban en la zona pedoclimática lusitana. En cada una de las parcelas se tomaron dos réplicas compuestas por cinco puntos de muestreo aleatorios.
A este suelo se le realizó una caracterización fisicoquímica, y se determinó: densidad aparente, textura, cantidad de materia orgánica, nitrógeno total, estabilidad de agregados, y cationes básicos, entre otras propiedades. Además, se analizaron los PLFAs mediante el método propuesto por Frostegard & Baath (1996), y se complementó la obtención de grupos de microorganismos usando el trabajo de Joergensen (2022).
RESULTADOS Y DISCUSIÓN
En la Figura 1 presentamos un resumen de los resultados obtenidos para el análisis de los PLFAs. Se observa que existe una cantidad significativamente mayor de biomasa microbiana en los suelos dedicados a agricultura orgánica. Esto se mantiene también para las bacterias: tanto Gram negativas como positivas (firmicutes y actinobacterias). En los suelos de manejo orgánico también existe una cantidad mayor de PLFAs microbianos inespecíficos. No obstante, si estudiamos las comunidades de hongos estas diferencias no están tan claras: si consideramos la cantidad total de PLFAs totales asociados a hongos podemos ver que no hay diferencias significativas considerando el tipo de manejo, y tampoco se observan diferencias significativas para el caso específico de los zigomicetos. Sin embargo, la tendencia que se observa para las bacterias es la misma que presentan las poblaciones de hongos micorrízicos arbusculares: la cantidad de estos es significativamente mayor en suelos agrícolas bajo un manejo orgánico. Por otro lado, los ascomicetos y basidiomicetos aparecen en mayor cantidad en los suelos de agricultura convencional. Con estos resultados, observamos también que la proporción de hongos/bacterias es significativamente menor en el caso de los cultivos de agricultura orgánica: 0.34 ± 0.01 en convecional, frente a 0.22 ± 0.02 en orgánico.
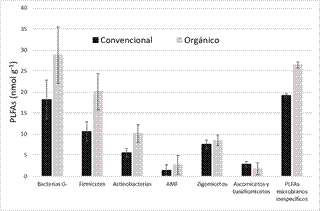
Figura 1 Cantidad de PLFAs (en nmol g-1) en los dos tipos de manejo considerados: convencional (negro) y orgánico (gris). Las barras representan el error estándar.
Los resultados obtenidos tanto para la biomasa total como para la cantidad de PLFAs bacterianos concuerdan con los observados por Stagnari et al. (2014) en un clima mediterráneo. En este trabajo, al igual que en nuestro estudio, los suelos bajo un manejo orgánico presentan una mayor cantidad de materia orgánica y nitrógeno total, lo que favorece el desarrollo de las comunidades bacterianas, y se traduce en una mayor cantidad de PLFAs totales (Kandeler et al., 1999). En nuestro caso, la materia orgánica total está correlacionada tanto con los PLFAs totales (R = 0.72), como con los procedentes de los diferentes grupos de bacterias: Gram negativo (R = 0.79), firmicutes (R = 0.70) y actinobacterias (R = 0.67).
Únicamente la cantidad de PLFAs relacionados con ascomicetos y basidiomicetos aparecen en una cantidad significativamente mayor en el manejo convencional. En un trabajo anterior (Kong et al., 2011) se ha observado que la cantidad de PLFAs asociados con hongos es mayor en los micro-agregados del suelo (entre 53 y 250 µm). En nuestro trabajo hemos encontrado dos correlaciones significativas que incluyen la proporción de macro-agregados (> 2000 µm): la primera con la cantidad de PLFAs de ascomicetos y basidiomicetos (R = 0.63), y la segunda con la relación PLFAs de hongos/bacterias (R = 0.70). Esto sugiere que el interior de los agregados es un hábitat mejor para la actividad fúngica. Y es importante mencionar que la proporción de este tipo de agregados es mucho mayor (del orden de 20 veces mayor) en los suelos convencionales.
Por lo tanto, es importante considerar que la relación de los PLFAs de hongos/ bacterias es menor en los suelos bajo manejo orgánico, lo que puede deberse a una mayor cantidad de nitrógeno que en los suelos convencionales. Esta proporción (hongos/bacterias) suele estar inversamente relacionada con la cantidad de nitrógeno del suelo (Kong et al., 2011), algo que se cumple para nuestro trabajo (R = - 0.56).
CONCLUSIONES
Al estudiar, mediante análisis de PLFAs, las comunidades microbianas de suelos de la región pedoclimática lusitana bajo manejo convencional y orgánico, podemos concluir que: i) por un lado, los suelos bajo manejo orgánico presentan una cantidad significativamente mayor de PLFAs microbianos totales y relacionados con grupos de bacterias (gram positivo y negativo) y hongos arbusculares micorrízicos, y estos están directamente correlacionados con la materia orgánica y el nitrógeno total; ii) los suelos convencionales presentan una cantidad significativamente mayor de PLFAs de hongos ascomicetos y basidiomicetos, correlacionados con la proporción de agregados mayores de 2 cm; y iii) la proporción PLFAs de hongos/bacterias es significativamente menor en los suelos orgánicos, y está directamente correlacionada con la proporción de agregados mayores de 2 cm, e inversamente correlacionada con la cantidad de nitrógeno total.