Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Portuguesa de Imunoalergologia
versão impressa ISSN 0871-9721
Rev Port Imunoalergologia vol.23 no.1 Lisboa mar. 2015
ARTIGO ORIGINAL
Eficácia e tolerância de Imunoterapia sublingual com Pru p 3 em doentes com alergia grave ao pêssego – evolução clínica e imunológica ao longo de 12 meses
Efficacy and tolerance of sublingual immunotherapy with Pru p 3 in patients with peach severe allergy – clinical and immunological follow-up during 12 months
Ana Célia Costa1, Alcinda Melo2, Fátima Duarte1, Manuel Pereira -Barbosa1, M. Conceição Pereira Santos2
1 Serviço de Imunoalergologia, Hospital de Santa Maria, CHLN, Lisboa
2 Unidade de Imunologia Clínica, Instituto de Medicina Molecular, Faculdade de Medicina da Universidade de Lisboa, Lisboa.Prémio SPAIC -MSD 2013 – Comunicação Oral (2.º prémio)
RESUMO
Introdução: A alergia ao pêssego é prevalente, persistente e potencialmente grave, sendo as proteínas de transferência lipídica (LTPs) – Pru p 3 e as profilinas – Pru p 4, os principais alergénios envolvidos.A presença oculta de Pru p 3 em produtos alimentares pode desencadear reacções acidentais graves, incluindo anafilaxia e os doentes podem reagir a outros alimentos que contêm LTPs (síndrome LTP). Este tipo de alergia pode ser considerado um alvo importante para imunoterapia (IT) a alergénios. Objectivo: Demonstrar a eficácia e segurança da IT sublingual (SLIT) com Pru p 3 (SLIT-Pru p 3) em doentes com reacções sistémicas (RS) associadas à ingestão de pêssego, através da avaliação de parâmetros clínicos e imunológicos, ao longo de 12 meses. Material e métodos: Oito doentes (7F,1M; média de idades -25,6;19-41 anos) com história de alergia ao pêssego, confirmada por Prova de Provocação Oral (excepto se anafilaxia e evidência de sensibilização) submetidos a SLIT -Pru p 3 (Alk -Abelló) durante 1 ano. Todos os doentes tiveram RS (75% anafilaxia) associadas à ingestão de pêssego (62,5% referiam sintomas com outros alimentos com LTP). Realizaram testes cutâneos por picada (TCP) com bateria de aeroalergénios, extrato de pêssego pele e polpa, outros alimentos de acordo com os sintomas, Pru p 3 e Pho d 2 (para excluir sensibilização a profilina). A SLIT-Pru p 3 tem uma fase de indução (4 dias em Hospital de Dia de Imunoalergologia), seguida da fase de manutenção em ambulatório (3anos). Foram realizados TCP e quantificadas IgE e IgG4 específicas (sIgE e sIgG4) para pêssego e Pru p 3 antes (T0), 1 (T1), 6 (T6) e 12 meses (T12) após início de SLIT. Realizou-se Teste de Activação de Basófilos (TAB), com extracto de Pru p 3 em 3 concentrações (0,05, 0,5 e 5ug/mL). Resultados: Diminuição significativa do diâmetro médio da pápula, de T0 -T12, no TCP com pêssego pele e polpa (p=0,0039) e Pru p 3 (p=0,0078). Quantificação de sIgE para pêssego e Pru p 3: diminuição significativa de T0 -T12 (p=0,0122 e p<0,001 respectivamente); sIgG4: aumento significativo de T0 -T12 (p<0,001) para os mesmos alergénios; TAB: diminuição significativa entre os diferentes tempos e nas 3 concentrações. Durante os 12 meses de SLIT, verificaram-se apenas reacções locais (prurido) durante a fase de indução em 50% dos doentes, de resolução espontânea. Conclusões: Nesta avaliação inicial, a SLIT -Pru p 3 parece ser uma opção terapêutica promissora e segura para os doentes com alergia grave ao pêssego.
Palavras-chave: alergia ao pêssego, imunoterapia sublingual, Pru p 3, síndrome de LTP
ABSTRACT
Background: Peach allergy is prevalent, persistent and potentially severe, involving LTPs (Pru p 3) and profilins (Pru p 4) as main allergens. The hidden presence of LTPs in foodstuffs can trigger severe reactions, including anaphylaxis, being considered an important target for immunotherapy (IT). Aims: Evaluation of clinical and immunological parameters, during 12 months, to demonstrate the efficacy and safety of SLIT with Pru p 3 (SLIT -Pru p 3) in patients with systemic reactions (SR) associated with peach ingestion. Material and Methods: 8 patients (7F,1M; mean age-25.6; 19 -41 years) with a history of peach allergy, confirmed by Oral Food Challenge (unless evidence of anaphylaxis and peach sensitization) undergoing SLIT-Pru p 3 during 1 year, were evaluated. 100% of patients had SR (75% anaphylaxis) associated with peach ingestion (62.5% reported symptoms with other foods containing LTPs). All patients underwent skin prick tests (SPT) to aeroallergens), to peach extract (peel and pulp), to other foods according to symptoms, and to Pru p 3 and Pho d 2 (to excluded profilin sensitization). SLIT-Pru p 3 had an induction phase (4 days in Immunoallergology Department), followed by outpatient maintenance phase (3 years). In all patients were performed SPT and quantified specific IgE and IgG4 (sIgE, sIgG4) to peach and Pru p 3 before (T0), 1 (T1), 6 (T6) and 12 months (T12) after SLIT initiation. Basophil Activation Test (BAT) was performed with Pru p 3 extract in three concentrations 0.05, 0.5, 5ug/ml at the same time points. Results: There was a significant decrease of the mean wheal diameter of SPT in T0-T12, with peel and pulp peach (p=0.0039) and Pru p 3 (p=0.0078). Quantification of sIgE to peach and Pru p 3: significant decrease of T0-T12 (p=0.0122 and p<0.001, respectively); sIgG4: significant increase of T0-T12 (p<0.001) for the same allergens; BAT: significant decrease between all time points and concentrations. Local reactions (itching) occurred only during the induction phase in 50% of patients with spontaneous resolution. No other reactions occurred along 12 months. Conclusions: These data sugest that SLIT with Pru p 3 seems to be a promising and safe therapy for patients with severe peach allergy.
Keywords: peach allergy, sublingual immunotherapy, Pru p 3, LTP syndrome
INTRODUÇÃO
A alergia a alimentos de origem vegetal é o tipo de alergia alimentar mais comum em adolescentes e adultos1,2. Na região do Mediterrâneo, os frutos frescos (rosáceas e kiwi) e os frutos secos (avelã) são os alimentos mais frequentemente envolvidos em reações alérgicas alimentares, sendo a sua gravidade variável, mas potencialmente fatal1,2. A alergia a estes frutos é causada sobretudo por sensibilização a panalergénios como as proteínas transportadoras de lipídos (LTPs) ou as profi linas, podendo os doentes apresentar monosensibilização ou co-sensibilização a estes alergénios2-5. As LTPs são panalergénos, ubiquitárias em diversas espécies vegetais, clinicamente relevantes na alergia a frutos e vegetais, tendo também sido descritas em pólenes2-4. As LTPs partilham características estruturais, o que aumenta signifi cativamente a probabilidade de reatividade cruzada clinicamente relevante. Por outro lado, as suas características bioquímicas diminuem a possível degradação térmica ou digestiva, aumentando assim a probabilidade de absorção sistémica e reacções alérgicas graves2-5.
Deste modo, a alergia alimentar múltipla a frutos e/ou vegetais pode ser causada por sensibilização a um mesmo panalergénio como a LTP, sendo designada por síndrome de LTP2. Dos frutos da família das rosáceas, o pêssego é responsável pela maioria das reacções alérgicas, sendo a causa mais comum de alergia alimentar a frutos em Portugal, Espanha e Itália, principalmente devido à sensibilização primária a LTP do pêssego (Pru p 3)3-5.
A alergia ao pêssego é uma alergia alimentar predominante, persistente ao longo da vida e potencialmente grave, em que a evicção nem sempre é fácil, uma vez que a LTP (Pru< p 3) está presente numa grande variedade de alimentos processados, podendo levar à ocorrência de reações acidentais graves. A maioria destes doentes, para além do pêssego, são também alérgicos a outros frutos frescos, secos e/ou vegetais.
Dada a sua gravidade, persistência e dificuldade na manutenção da dieta de exclusão, com impacto económico, familiar e social, este tipo de alergia tem sido considerada um alvo importante para imunoterapia (IT) a alergénios6-8.
Os autores pretendem demonstrar a eficácia e segurança da imunoterapia sublingual (SLIT) com pêssego (Pru p 3) em doentes com reações sistémicas associadas à ingestão de pêssego, através da avaliação de parâmetros clínicos e imunológicos ao longo de 12 meses.
MATERIAL E MÉTODOS
População
Foram incluídos 8 doentes (7 do sexo feminino e 1 do sexo masculino, com uma média de idades de 25,6 anos; idades compreendidas entre 19 e 41 anos) com história de dois ou mais episódios sugestivos e reprodutíveis de reações adversas imediatas após a ingestão de pêssego.
Avaliação clínica e laboratorial
A avaliação clínica incluiu um questionário padronizado (idade, sexo, tipo de reação com pêssego; alergia a outros alimentos ou látex; antecedentes pessoais e familiares) e uma história clínica completa para caracterização das reações relatadas, induzidas por pêssego (síndrome de alergia oral, urticária generalizada e/ou angioedema, queixas respiratórias e gastrointestinais e anafilaxia).
Todos os doentes foram submetidos a testes cutâneos por picada (TCP) com extrato comercial (Bial -Aristegui®, Bilbao, Espanha) de polpa e pele de pêssego, polpa e pele de maçã, pera, ameixa, cereja, alperce, damasco, morango, amêndoa, kiwi, banana, abacate, manga, laranja, amendoim, avelã, nozes, castanha, pinhão, aipo, melão, ervilha, cenoura, ananás, tomate, soja, látex, ácaros do pó doméstico (Dermatophagoides pteronyssinus, Dermatophagoides farinae, Euroglyphus maynei, Blomia tropicalis), ácaros de armazenamento (Lepidoglyphus destructor), Alternaria alternata, Aspergillus fumigatus e mistura de pólenes de gramíneas, Phleum pratense, Parietaria judaica, Artemisia vulgaris, Olea europea, Plantago lanceolata, Betula verrucosa, Platanus acerifolia e Chenopodium album, LTP de pêssego (Pru p 3) e profilina e palmeira (Pho d 2). Foram, também, realizados TCP com extrato (Alk -Abelló, Madrid, Espanha) de pêssego (pele e polpa) e de vacina SLIT -Pru p 3 na concentração de 50 μg/ml antes do início (T0) e ao fim de 1 mês (T1), 6 meses (T6) e 12 meses (T12) de vacina.
Todos os 8 doentes foram submetidos a prova de provocação oral em dupla-ocultação, contra-placebo (PPODOCP) com polpa de pêssego, antes do início do estudo (T0), excepto se história de anafilaxia, e após 12 meses de SLIT-Pru p 3 (T12), no Hospital de Dia de Imunoalergologia, fora da estação polínica e de acordo com as recomendações da EAACI9.
Foi colhida uma amostra de sangue periférico a todos os doentes, em T0, T1, T6 e T12, para doseamento sérico de anticorpos IgE e IgG4 específicos para pêssego e Pru p 3 e teste de ativação dos basófilos (TAB).
Na avaliação inicial destes doentes foram determinadas as concentrações séricas dos anticorpos específicos IgE para pêssego, rPru p1, rPru p3, rPru p4, e níveis séricos de IgE e IgG4 específicos para pêssego e Pru p 3 em T0, T1, T6 e T12 por ImmunoCAP 100 (Thermofisher, Uppsala, Suécia) de acordo com as instruções do fabricante. O teste foi considerado positivo para valores superiores a 0,10 kUA/L. Em todos os doentes realizou -se teste da ativação de basófilos com avaliação da expressão de CD63, quantificada por citometria de fluxo – Flow2 CAST® (Bühlmann, Suíça), de acordo com as instruções do fabricante. 50μl de sangue total heparinizado foi incubado com IL-3 e extrato estandardizado de alergénio – Pru p 3 do pêssego em 3 concentrações: 0,05, 0,5 e 5μg/ml, em T0, T1, T6 e T12. A aquisição foi realizada num citómetro FACSCalibur (BD -Biosciences, São José, EUA), nas duas horas após finalização do procedimento técnico, sendo os resultados considerados positivos com uma percentagem de activação superior a 5% e índice de estimulação igual ou superior a dois.
Protocolo da Imunoterapia (SLIT – Pru p 3)
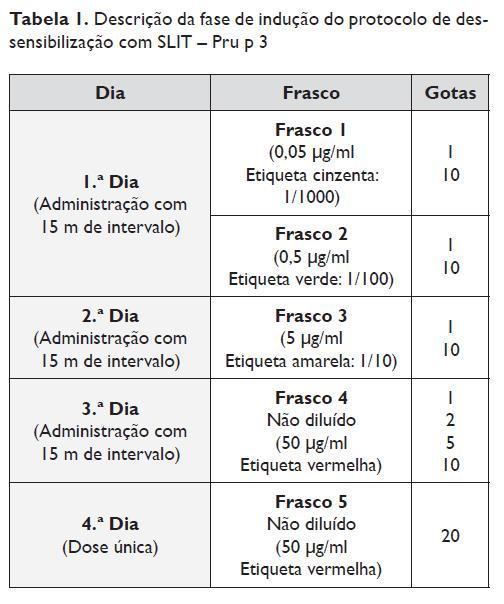
A vacina foi administrada por via sublingual (via sublingual 2 minutos – cospir) e inclui 4 concentrações 0,05, 0,5, 5 e 50 μg/ ml de Pru p 3 (Bioportugal®, ALK -Abelló, S.A Madrid, Espanha). A reconstituição do extracto da SLIT com Pru p 3 foi realizada em concentrações sucessivas a partir de uma concentração inicial de 50μg/ml, de acordo com as instruções do fabricante.
O protocolo de dessensibilização da imunoterapia sublingual com extrato de pêssego (Pru p 3) é constituído por:
– Fase de indução ou fase rápida, durante 4 dias, em Hospital de Dia de Imunoalergologia, com doses crescentes (Tabela 1);
– Fase manutenção, a partir do 5.º dia durante 3 anos, em ambulatório, 5 gotas/dia do frasco 4 (10 μg/dia, 7x/semana).
Foram entregues aos doentes diários clínicos, para registo de qualquer evento adverso. Durante a fase de manutenção, os doentes foram observados mensalmente no Serviço de Imunoalergologia, onde devolviam os diários clínicos e os frascos vazios da SLIT, para monotorização da segurança e adesão à imunoterapia.
Análise estatística
Foi utilizado o software GraphPad Prism versão 5.00 (Graphpad Software Inc., SanDiego, EUA). Na comparação entre dois grupos foi usado o teste t de Student e considerados como significativos valores de p<0,05.
O estudo foi realizado com a aprovação da Comissão de Ética hospitalar e o consentimento informado dos doentes.
RESULTADOS
População de estudo
Aquando da análise descrita, oito doentes, tinham completado pelo menos 12 meses de imunoterapia com SLIT-Pru p 3. Seis (62,5%) doentes apresentavam sintomas com outros alimentos relacionados com síndrome de LTP, nomeadamente frutos secos, sementes e kiwi. Ausência de história de alergia a alimentos de outros grupos.
TCP para extrato de pêssego pele e polpa e de Pru p 3 (Figura 1)
Na população estudada, o diâmetro médio da pápula no TCP diminuiu significativamente (p=0,0039) de uma média de 8±2 mm (VM±DP) com pele e 5±1 mm com polpa de pêssego em T0, para 4±2 mm e 0,6±1mm, respetivamente ao fim de 12 meses de SLIT -Pru p 3. Nos TCP com Pru p 3 observou-se, igualmente, uma diminuição significativa (p=0,0078) do diâmetro médio das pápulas duma média de 11±5 mm em T0 para 7± 2 mm em T12.
Quantificação de IgE e IgG4 específica para extrato de pêssego e Pru p 3 (Figura 2 e Figura 3)
Na população estudada, ao fim de 12 meses de SLIT-Pru p 3, verificou -se uma diminuição significativa de IgE específica para pêssego (p=0,0122) e Pru p 3 (p<0,001), e um aumento significativo de IgG4 específica para pêssego (p<0,001) e Pru p 3 (p<0.001) quando comparadas com o valor basal.
Teste de activação dos basófilos (Figura 4)
Ao longo dos 12 meses de imunoterapia com SLIT–Pru p 3, observou -se uma diminuição significativa da expressão de CD63 em basófilos activados, nas 3 concentrações de Pru p 3 (0,05, 0,5 e 5 μg/ml) e entre os diferentes tempos. Esta diminuição foi significativa desde o primeiro mês de imunoterapia, com maior impacto na concentração de 5 μg/ml de Pru p 3 (p<0,001).
Segurança
Durante os 12 meses de SLIT-Pru p 3, todos os doentes mostraram uma boa adesão à terapêutica, cumprindo integralmente o protocolo definido. Em 50% dos doentes e durante a fase de indução, não ocorreram reações sistémicas, tendo -se registado apenas reacções locais ligeiras (prurido orofaríngeo), de resolução espontânea, sem necessidade de medicação.DISCUSSÃO
Nos últimos anos, a alergia aos frutos frescos tem sido alvo de investigação crescente dada a sua elevada prevalência, potencial gravidade e persistência1. A presença oculta de Pru p 3 em produtos alimentares manufacturados pode desencadear reacções acidentais graves, incluindo anafilaxia2-5. Neste contexto, a alergia ao pêssego tem sido considerada como um alvo na procura de um tratamento eficaz6-8.
Este é o primeiro estudo de investigação clínica sobre imunoterapia para alergia ao pêssego, numa população de 8 doentes adultos, publicado em Portugal. Neste estudo, os autores pretenderam avaliar se a dose e o esquema utilizados na imunoterapia com Pru p 3 administrada por via sublingual teria eficácia, sem comprometer a segurança do tratamento. Foi estudada uma população de doentes portugueses com reações sistémicas, incluindo anafilaxia em 62,5% dos casos, de alergia ao pêssego. Verificou-se uma diminuição significativa da reatividade cutânea com os 3 extratos – pele e polpa de pêssego e Pru p 3; aumento significativo de IgG4; diminuição do limiar de ativação dos basófilos circulantes, traduzido pela diminuição significativa da expressão de CD63. Paralelamente, observaram–se apenas reações locais ligeiras de prurido orofaríngeo, em 50% dos doentes e exclusivamente na fase de indução.
A Imunoterapia a alergénios ou vacina anti-alérgica é o único tratamento capaz de atuar sobre a causa e não apenas sobre os sintomas da alergia, modelando a resposta imunitária com capacidade de alterar a história natural da doença alérgica10,11. Está já bem demonstrado que suprime a inflamação alérgica mediada por células Th2 com aumento da produção de IgG específica do antigénio, provavelmente por indução de células T reguladoras, desvio imune,Th2 para Th1, e / ou apoptose de células efetoras de memória Th210,11.
Para além dos mecanismos celulares referidos, a eficácia da SLIT resulta, primordialmente, da interação do alérgeno com as células de Langerhans na mucosa oral, cruciais na indução de tolerância aos antígenos, levando à diminuição da resposta alérgica12-13.
Os benefícios a longo prazo da SLIT, em doses ótimas, estão já bem demonstrados. Mesmo após descontinuação, durante 1 e 2 anos, foi evidente a indução de remissão da doença, incluindo modificação do seu perfil, aspetos consistentes com a indução de tolerância específica ao alergénio12,13.
Além disso, os dados obtidos a partir de biópsias indicam claramente que a fisiopatologia da mucosa bucal desempenha um papel fundamental na indução de tolerância ao alérgeno administrado por via sublingual, em indivíduos, tratados com SLIT em altas doses 12,13.
Os primeiros relatos publicados de SLIT para alergia alimentar surgiram há mais de uma década atrás, em 2003, quando um caso de sucesso de SLIT para alergia a kiwi foi descrito numa doente com uma história de múltiplas reações anafiláticas, mantendo-se a eficácia da dessensibilização mesmo após suspensão da SLIT14,15. Seguiram-se diversos protocolos sublinguais ou orais-sublinguais não estandardizados na alergia ao leite, ovo e amendoim e um estudo duplo-cego controlado com placebo de SLIT com avelã16 -19.
Aquando da apresentação deste estudo, existiam na literatura apenas 3 artigos publicados (duas séries do mesmo grupo de trabalho espanhol e 1 caso clínico português) sobre a SLIT com extrato de pêssego, usando Pru p 3 nativo. Nestes estudos, de curta duração (máximo de 6 meses nas duas séries de doentes) ou limitado a um doente (no caso português com 12 meses de avaliação), os autores demonstraram eficácia clínica de acordo com a avaliação de parâmetros imunológicos, referindo aumento da tolerância à ingestão de pêssego6-8.
Em Portugal, existe apenas um caso reportado, em 2010, por Pereira C et al6 que descreve um caso clinico de uma doente de 40 anos que, desde os 36 anos, tinha reações sistémicas com múltiplos frutos/vegetais, nomeadamente frutos frescos da família das rosáceas, frutos secos, legumes, cereais e especiarias. Foi submetida a uma SLIT (BialAristegui®) com extrato nativo de Pru p 3 (40μg/ml), cujo protocolo incluía uma fase rápida ao longo de 1 dia, iniciada por 1 gota até 5 gotas e uma fase de manutenção que consistia em 5 gotas/dia, 5 dias/semana (dose cumulativa 200μg de Pru p 3 por mês). Os resultados descritos referem-se a um período de 12 meses, sendo que 4 meses após o inicio do tratamento foi observada uma diminuição da reactividade cutânea, sem alterações relevantes nos valores séricos de IgE, IgG, IgG1 and IgG4 específicas para Pru p 3, e PPODOCP com pêssego mascarado negativa. Nesta fase a doente já não tinha grandes restrições alimentares, com exceção de nozes e pimenta.
Em 2009 e 2010, foram publicados, dois estudos, randomizados, duplo -cego, controlados por placebo com SLIT de pêssego (Pru p 3) realizados conjuntamente em dois Centros de Alergologia em Espanha7,8. Avaliaram os pârametros de segurança e eficácia clínica, através de realização de PPO em dupla-ocultação controlada por placebo, TCP, e doseamento de IgE e IgG4. Em comparação com o grupo placebo, os doentes alérgicos ao pêssego submetidos a tratamento activo com SLIT-Pru p 3 durante 6 meses, toleraram uma quantidade de pêssego tripla da inicial, apenas com reções locais. Paralelamente, os autores verificaram uma diminuição da reactividade cutânea para pêssego e aumento significativo de sIgG4 mas sem alterações significativas da sIgE, incluindo para outros alergénos purificados (rMal d 1, rMal d 4 e nArt v 3) e sem aparecimento de novas sensibilizações.
O nosso estudo reporta um período superior ao descrito, 12 meses, em que foi possível documentar em paralelo, uma elevada segurança da vacina, e alterações imunológicas sustentadas que podem, eventualmente, antever uma eficácia a longo -prazo, mesmo após a descontinuação da imunoterapia. Ao fim de 12 meses de imunoterapia, observámos alterações imunológicas idênticas às descritas na literatura, nomeadamente diminuição significativa da reatividade cutânea, aumento significativo dos anticorpos específicos protectores da resposta alérgica – IgG4 e diminuição significativa da resposta IgE específica, não só para Pru p 3 mas também para pêssego.
Na literatura até 2013, não existiam publicações referentes à avaliação de activação de basófilos na SLIT com pêssego. No nosso estudo, observámos uma diminuição significativa da percentagem de basófilos ativados, quantificada pela expressão de CD63 após estimulação com Pru p 3 nas 3 concentrações utilizadas, logo a partir do primeiro mês de tratamento, sugerindo uma elevada sensibilidade deste método na avaliação da eficácia da SLIT com Pru p 3.
Por outro lado, observámos apenas reacções locais ligeiras de resolução espontânea em 50% dos doentes, percentagem inferior à dos estudos publicados (98,8%), não ocorrendo nenhuma reação sistémica, incluindo nos doentes com história de anafilaxia.
CONCLUSÕES
Nesta avaliação inicial, a SLIT com Pru p 3 parece ser uma opção terapêutica promissora, segura, capaz de modificar a reatividade clínica, tendo sido bem tolerada em doentes com alergia grave ao pêssego.
REFERÊNCIAS
1. NIAID -Sponsored Expert Panel. Boyce JA, Assaad A, Burks AW, Jones SM, Sampson HA, Wood RA et al. Guidelines for the Diagnosis and Management of Food Allergy in the United States: Report of the NIAID -Sponsored Expert Panel. J Allergy Clin Immunol 2010;126:S1 -S58 [ Links ]
2. Pascal M, Munõz -Cano R, Reina Z, Palacín A, Vilella R, Picado C, et al. Lipid transfer protein syndrome: clinical pattern, cofactor effect and profile of molecular sensitization to plant -foods and pollens. Clin Exp Allergy 2012; 42: 1529–39. [ Links ]
3. Rossi RE, Monasteroo G, Canonica GW, Passalacqua G. Systemic reactions to peach are associated with high levels of specific IgE to Pru p 3. Allergy 2009; 64: 1795–8. [ Links ]
4. Fernãndez -Rivas M, González -Mancebo E, Rodríguez -Pérez R, Benito C, Sánchez -Monge R, Salcedo G, et al. Clinically relevant peach allergy is related to peach lipid transfer protein, Pru p 3, in the Spanish population. J Allergy Clin Immunol 2003; 112: 789–95. [ Links ]
5. Rodrigues -Alves R, Lopes A, Pereira -Santos MC, Lopes -Silva S, Spínola -Santos A, Costa C, et al. Clinical, anamnestic and serological features of peach allergy in Portugal. Int Arch Allergy Immunol 2009; 149: 65–73. [ Links ]
6. Pereira C, Bartolomé B, Asturias JA, Ibarrola I, Tavares B, Loureiro G, et al. Specific sublingual immunotherapy with peach LTP (Pru p 3). One year treatment: a case report. Cases Journal 2009; 2: 6553. [ Links ]
7. Fernandez -Rivas M, Fernandez SG, Nadal JA, Díaz de Durana MD, García BE, González -Mancebo E, et al. Randomized double-blind, placebo-controlled trial of sublingual immunotherapy with a Pru p 3 quantified peach extract. Allergy 2009; 64: 876–83. [ Links ]
8. García BE, González -Mancebo E, Barber D, Martín S, Tabar AI, Díaz de Durana AM, et al. Sublingual Immunotherapy in Peach Allergy: Monitoring Molecular Sensitizations and Reactivity to Apple Fruit and Platanus Pollen. J Investig Allergol Clin Immunol 2010; 20(6): 514 -20. [ Links ]
9. Bindslev -Jensen C, Ballmer -Weber BK, Bengtsson U, Blanco C, Ebner C, Hourihane J, et al. Standardization of food challenges to foods – position paper from reactions to foods - position paper from European Academy of Allergology and clinical Immunology. Allergy 2004; 59: 690 -7. [ Links ]
10. Alvarez -Cuesta E, Bousquet J, Canonica GW, Durham SR, Malling HJ, Valovirta E. EAACI, Immunotherapy Task Force. Standards for practical allergen -specific immunotherapy. Allergy 2006; 61(Suppl 82):1 -20. [ Links ]
11. Burks AW, Calderon MA, Casale T, Cox L, Demoly P, Jutel M, et al. Update on allergy immunotherapy: American Academy of Allergy, Asthma & Immunology/European Academy of Allergy and Clinical Immunology/PRACTALL consensus report. J Allergy Clin Immunol 2013; 131(5):1288 -96.
12. Canonica GW, Cox L, Pawankar R, Baena -Cagnani CE, Blaiss M, Bonini S, et al. Sublingual immunotherapy: World Allergy Organization position paper 2013 update. World Allergy Organization Journal 2014; 7:6. [ Links ]
13. Dávila I, Navarro A, Domínguez -Ortega J, Alonso A, Antolín-Amérigo D, Diéguez MC,et al.QUASAR Group (QUality in the Administration of SLIT in Allergic Rhinitis). SLIT: indications, follow -up, and management. J Investig Allergol Clin Immunol 2014; 24 (Suppl. 1): 1 -35. [ Links ]
14. Mempel M, Rakoski J, Ring J, Ollert M. Severe anaphylaxis to kiwi fruit: Immunologic changes related to successful sublingual allergen immunotherapy. J Allergy Clin Immunol 2003; 111(6): 1406-9. [ Links ]
15. Kerzl R, Simonowa A, Ring J, Ollert M, Mempel M. Life–threatening anaphylaxis to kiwi fruit: protective sublingual allergen immunotherapy effect persists even after discontinuation. J Allergy Clin Immunol 2007; 119: 507 -8. [ Links ]
16. Keet CA, Frischmeyer -Guerrerio PA, Thyagarajan A, Schroeder JT, Hamilton RG, Boden S, et al. The safety and efficacy of sublingual and oral immunotherapy for milk allergy. J Allergy Clin Immunol 2012; 129:448 -55. [ Links ]
17. Kim EH, Bird JA, Kulis M, Laubach S, Pons L, Shreffler W, et al. Sublingual immunotherapy for peanut allergy: clinical and immunologic evidence of desensitization. J Allergy Clin Immunol 2011; 127:640 -6. [ Links ]
18. Enrique E, Pineda F, Malek T, Bartra J, Basagana M, Tella R, et al. Sublingual immunotherapy for hazelnut food allergy: a randomized, double -blind, placebo controlled study with a standardized hazelnut extract. J Allergy Clin Immunol 2005; 116: 1073 -9. [ Links ]
19. Moran TP, Vickery BP, Burks AW. Oral and sublingual immunotherapy for food allergy: current progress and future directions. Curr Opin Immunol 2013; 25(6): 781–87. [ Links ]
Ana Célia Costa
Serviço de Imunoalergologia
Centro hospitalar Lisboa Norte
Hospital de Santa Maria
Av. Professor Egas Moniz 1649-035 Lisboa
E-mail: anaceliacosta@sapo.pt
Declaração de conflitos de interesse: Nenhum.
AGRADECIMENTOS
Agradecemos à Bioportugal® e à Thermo Fisher Scientific® a ajuda financeira para a concretização deste trabalho.
Data de recepção / Received in: 17/10/2014
Data de aceitação / Accepted for publication in: 12/02/2015
Prémio SPAIC -MSD 2013 – Comunicação Oral (2.º prémio)














