Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Portuguesa de Imunoalergologia
versão impressa ISSN 0871-9721
Rev Port Imunoalergologia vol.24 no.2 Lisboa jun. 2016
ARTIGO DE ATUALIZAÇÃO
Hipersensibilidade a fármacos – Os estudos in vivo
Drug Hypersensitivity – In vivo diagnosis
Susana Cadinha
Serviço de Imunoalergologia do Centro Hospitalar de Vila Nova de Gaia/Espinho
RESUMO
As reações de hipersensibilidade a fármacos representam cerca de um terço de todas as reações adversas e estima‑se que afetem mais de 7 % da população geral, pelo que representam um importante problema de saúde pública. As reações alérgicas são reações de hipersensibilidade em que se demonstra um mecanismo imunológico subjacente. O diagnóstico definitivo de hipersensibilidade a fármacos não deve basear‑se apenas numa história clínica sugestiva, sob pena de limitar as opções terapêuticas e potenciar a utilização de fármacos mais caros e menos eficazes. Esta revisão descreve os diferentes procedimentos de estudo in vivo disponíveis, como a biópsia cutânea, os testes cutâneos e a prova de provocação, e avalia o contributo de cada um para estabelecer um diagnóstico definitivo de hipersensibilidade a fármacos.
Palavras‑chave: Alergia a fármacos, hipersensibilidade a fármacos, biópsia cutânea, testes cutâneos, prova de provocação.
ABSTRACT
Hypersensitivity reactions represent about one third of all adverse drug reactions and affect more than 7 % of the general population and therefore represent an important public health problem. Drug allergies are drug hypersensitivity reactions for which a definite immunological mechanism is demonstrated. Misclassification based on the drug hypersensitivity reaction history alone may limit therapeutic options and can lead to the use of more‑expensive and potentially less‑effective drugs.
This review summarizes the available in vivo diagnostic procedures, such as skin biopsy, skin tests and drug provocation test, and evaluates its importance in order to establish a solid drug hypersensitivity diagnosis.
Key-words: drug allergy, drug hypersensitivity, drug provocation, test skin biopsy, skin tests.
INTRODUÇÃO
As reações de hipersensibilidade a fármacos representam cerca de um terço de todas as reacções adversas1. Estima‑se que afetem 10‑20% dos doentes hospitalizados e mais de 7 % da população geral, pelo que representam um importante problema de saúde pública1,2. As reações de hipersensibilidade a fármacos são reações adversas de tipo B, definidas como imprevisíveis e não dependentes da dose2, e cursam com sintomas/sinais objetivamente reprodutíveis desencadeados pela exposição a um estímulo definido numa dose tolerada por indivíduos normais3.
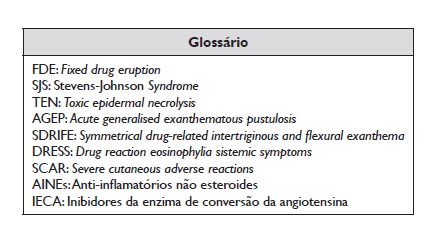
As reações alérgicas são reações de hipersensibilidade em que se demonstra um mecanismo imunológico subjacente, mais frequentemente mediado por IgE ou por células T2. Classificam‑se em imediatas quando ocorrem na primeira hora (1‑6 horas) após a administração do fármaco (urticária, angioedema, rinite, conjuntivite, asma, manifestações gastrointestinais, anafilaxia) e não imediatas quando ocorrem mais de uma hora após a administração do mesmo (exantemas maculopapular/morbiliforme, urticária/angioedema retardados, FDE, vasculite, SJS‑TEN, AGEP, DRESS, SDRIFE, manifestações específicas de órgão)2,4.
Na maioria dos casos, o diagnóstico de alergia a fármacos é baseado numa história clínica detalhada e na demonstração de sensibilização a um alergénio relevante e concordante com a história5.
A história clínica deve incluir a sintomatologia (se compatível com reação de hipersensibilidade a fármacos), a cronologia das queixas (exposição prévia, relação temporal com a administração do fármaco), a medicação concomitante (na altura da reação e outros fármacos da mesma classe administrados posteriormente) e a história patológica do doente (suspeita prévia de alergia a fármacos ou outros alergénios, urticária crónica ou rinossinusite que podem ser agravadas pela administração de AINEs, outras comorbilidades)2. Os dados devem ser colhidos num formato uniformizado, tendo para isso sido desenvolvido um questionário pelos membros da EAACI/ENDA, que actualmente se encontra disponível em diversas línguas6. As manifestações cutâneas são a forma mais comum de apresentação, em particular os exantemas maculopapulares, a urticária e o angioedema. As manifestações cutâneas com início mais tardio e as situações em que há envolvimento sistémico são as formas mais graves de apresentação, com uma taxa de morbilidade e mortalidade mais elevada2,4.
O diagnóstico definitivo não deve basear‑se apenas numa história clínica sugestiva, sob pena de limitar as opções terapêuticas e potenciar a utilização de fármacos mais caros e menos eficazes, devendo incluir a realização de testes cutâneos e prova de provocação, sempre que possível2.
A biópsia cutânea pode ser útil ao sugerir uma reação cutânea induzida por fármacos. Os achados histológicos sugestivos de exantema induzido por fármacos, como dermatite da interface com vacuolização dos queratócitos, espongiose focal e infiltrado perivascular linfocítico com um número variável de eosinófilos, não são específicos desta entidade nosológica, podendo ser observados noutras patologias cutâneas4.
Num estudo recente, os resultados da biópsia cutânea foram comparados com os dos testes cutâneos e da prova de provocação com o fármaco suspeito, permitindo estimar uma sensibilidade de 62,9 %, especificidade de 41,1 %, valor preditivo positivo (VPP) de 40.7 e valor preditivo negativo (VPN) de 69,7 % para este método de diagnóstico in vivo. Em função destes resultados, os autores concluem que uma história clínica compatível com exantema induzido por fármacos em associação com achados histológicos sugestivos na biópsia cutânea não são suficientes para estabelecer o diagnóstico de hipersensibilidade a fármacos não mediada por IgE7.
O estudo in vivo deve ser realizado preferencialmente mais de quatro semanas após a reação, após confirmar a interrupção de fármacos que interferem com o resultado (anti‑histaminicos, corticosteróides, antidepressivos tricíclicos), que podem interferir com o tratamento de uma eventual reação (beta‑bloqueadores) ou que podem potenciar uma reação (IECAs). Deve também ser confirmada a ausência de intercorrências infecciosas, febre ou reações inflamatórias na altura do estudo e o doente deve proceder à leitura e assinatura do consentimento informado antes de iniciar o procedimento8,9.
TESTES CUTÂNEOS
Os testes cutâneos são o método de diagnóstico mais frequentemente utilizado para confirmar sensibilização, embora o seu valor diagnóstico não tenha sido totalmente avaliado para todos os fármacos10.
Os testes cutâneos por picada (TCP) e os testes intradérmicos (ID) são utilizados na investigação de reacções de hipersensibilidade imediata2,8,10. Os TCP são de fácil execução, seguros e de baixo custo, com moderada sensibilidade e elevada especificidade2,8,10. Os ID, mais dolorosos e com maior risco de reação irritativa e reacção sistémica, são mais sensíveis, embora a sua sensibilidade e valor preditivo variem em função do fármaco suspeito e do tipo de reação2,8,10. A sensibilidade e o valor preditivo dos testes cutâneos parecem ser moderados a elevados no diagnóstico de reações de hipersensibilidade imediata a antibióticos beta‑lactamicos, fármacos utilizados no período perioperatório, sais de platina e meios de contraste iodados, mas baixos para muitos outros fármacos2,8,10. As soluções estéreis, em particular as de administração endovenosa, devem ser utilizadas na execução dos TCP e dos ID10. Quando o fármaco suspeito não se encontra disponível sob a forma de solução estéril pode ser preparada uma suspensão pela diluição do comprimido/cápsula em solução salina na máxima concentração disponível, podendo esta ser utilizada exclusivamente nos TCP10. Só existem formulações estandardizadas para a realização de TCP e ID com os determinantes major (PPL) e minor (MDM) da penicilina e amoxicilina, embora estejam recomendadas concentrações não irritativas para diversos outros fármacos8,10,11.
Nas reações de hipersensibilidade não imediata está recomendada a leitura tardia dos ID e a realização de testes epicutâneos (TE)8,10. Os TE são mais seguros do que os ID e devem ser efetuados com as diversas formulações disponíveis, utilizando como veículos uma solução salina ou vaselina (5‑30%)8,12. São menos sensíveis do que os testes intradérmicos e a sua sensibilidade varia em função dos fármacos suspeitos e do veículo utilizado12.
Para a maioria dos fármacos não existem concentrações nem veículos estandardizados e validados2. Os TE parecem ser úteis quando os fármacos suspeitos são os meiosde contraste iodados ou anticonvulsivantes, existindo um número limitado de fármacos comercialmente disponíveis para a sua realização13.
PROVAS DE PROVOCAÇÃO
A prova de provocação (PP) consiste na administração controlada do fármaco suspeito e é considerada o Gold standard para estabelecer o diagnóstico de hipersensibilidade a fármacos9.
É o procedimento de diagnóstico in vivo que apresenta maior sensibilidade e o seu valor preditivo depende do fármaco suspeito e do tipo de reação2, sendo que o VPN estimado no caso de suspeita de hipersensibilidade aos beta‑lactamicos é de 94 %14 e para os AINEs superior a 96 %15. Apesar das suas vantagens relativamente aos outros procedimentos de diagnóstico disponíveis tem diversas limitações. Trata‑se de um procedimento de risco, pelo que deve ser sempre realizado por pessoal treinado e em meio hospitalar; a interpretação dos resultados é difícil, dado que muitas vezes as queixas são subjetivas e não objetiváveis; não esclarece o mecanismo subjacente, pelo que não permite a destrinça entre reações alérgicas e não alérgicas; podem ocorrer resultados falsos negativos, pela ausência de cofactores ou ocorrência de dessensibilização durante o procedimento, e falsos positivos, pelo agravamento de um quadro clínico pré‑existente2,9.
Está indicada sempre que se pretende excluir hipersensibilidade em doentes com história não sugestiva, facultar uma alternativa segura em doentes alérgicos, excluir reatividade cruzada entre fármacos relacionados em doentes com hipersensibilidade comprovada e estabelecer o diagnóstico em casos de história sugestiva, mas testes negativos9.
Não está recomendada quando a história clínica claramente suporta o diagnóstico (duas ou mais reacções prévias reprodutíveis), durante a gravidez, na presença de comorbilidades que aumentem o risco do procedimento, quando as reações são graves e podem comprometer a vida (recomendada PP com fármaco alternativo) ou quando os fármacos são prescindíveis ou pouco utilizados2,5,9.
A administração do fármaco suspeito deve ser idealmente efetuada pela mesma via que foi utilizada na altura da reação, embora a via oral seja a preferida, dado que a absorção é mais lenta e o tratamento de possíveis reacções pode ser iniciado precocemente2,5,9. A administração também pode ser efetuada por via parentérica (subcutânea, intramuscular, endovenosa) ou por outras vias (nasal, brônquica, conjuntival, cutânea)9.
A PP deve ser controlada por placebo e efectuada em ocultação simples, embora possa ser realizada em dupla ocultação nos casos em que os aspectos psicológicos podem interferir com o seu resultado9. Os protocolos de provocação variam consideravelmente, no entanto é recomendado que se inicie com uma dose baixa e se aumente gradualmente até atingir a dose diária pretendida.
Genericamente, nas reações imediatas a dose inicial deve ser 1/10 000‑1/10 da dose terapêutica e o intervalo de tempo entre as doses administradas de 30 minutos a 1 hora; nas reações não imediatas a dose inicial não deve exceder 1/100 da dose terapêutica e a PP pode ser concluída em horas, dias ou semanas9. No que respeita aos antibióticos beta‑lactamicos16‑18, AINEs19‑22 e meios de contraste iodados23‑27 já foram publicados diversos protocolos de provocação.
A PP deve ser interrompida quando reproduz a reacção original, sendo considerada positiva, ou quando se atinge a dose terapêutica pretendida sem evidência de reação, sendo considerada negativa2,5,9.
A administração continuada do fármaco suspeito não faz parte das atuais recomendações e não é consensual, embora pareça aumentar a sensibilidade e os valores preditivos do estudo diagnóstico no caso de reações não imediatas28,29. Um estudo recente demonstrou que cerca de 20 % dos doentes com reações não imediatas aos antibióticos beta‑lactamicos apenas são identificados pela inclusão da administração oral continuada na sua investigação30.
PARTICULARIDADES NA INFÂNCIA
No que respeita à investigação diagnóstica em crianças, os testes cutâneos são considerados seguros, mas dolorosos e menos tolerados, em particular os ID. Enquanto o valor diagnóstico dos TCP e dos ID no diagnóstico de reações de hipersensibilidade imediata é relativamente elevado, a leitura tardia dos ID e os TE têm baixa sensibilidade no diagnóstico de reações de hipersensibilidade não imediata. A PP tem um bom VPN e é particularmente importante nas crianças, dado que a maioria dos fármacos suspeitos (antibióticos beta‑lactamicos e AINEs, nomeadamente o ibuprofeno e o paracetamol) são necessários em futuros tratamentos e o diagnóstico não pode ser excluído de outra forma. Deste modo, foi proposto recentemente um algoritmo de abordagem diagnóstica neste grupo etário que avança directamente para a realização de PP com o fármaco suspeito, em caso de exantemas ligeiros não imediatos. No caso de reacções imediatas ou de reações não imediatas graves, os testes cutâneos devem ser realizados antes da PP com o fármaco suspeito, exceto nos casos em que esta se encontra contraindicada (SCAR)31.
CONCLUSÃO
Deste modo, conclui‑se que uma história clínica detalhada é insuficiente para um diagnóstico definitivo de hipersensibilidade a fármacos, devendo ser acompanhada pela realização de todos os procedimentos de estudo in vivo disponíveis, como a biópsia cutânea, os testes cutâneos e a prova de provocação com o fármaco suspeito, permanecendo a última o gold standard para a confirmação do diagnóstico.
REFERÊNCIAS
1. Gomes ER, Demoly P. Epidemiology of hypersensitivity drug reactions. Curr Opin Allergy Clin Immunol 2005;5(4):309‑16. [ Links ]
2. Demoly P, Adkinson NF, Brockow K, Castells M, Chiriac AM, Greenberger PA, et al. International consensus on drug allergy. Allergy 2014;69:420‑37. [ Links ]
3. Johansson SGO, Hourihane JOB, Bousquet J, Bruijnzeel‑Koomen C, Dreborg S, Haahtela T, et al. A revised nomenclature for allergy: an EAACI position statement from the EAACI nomenclature task force. Allergy 2001;56:813‑24. [ Links ]
4. Joint Task Force on Practice Parameters; American Academy of Allergy AaIACoA, Asthma and Immunology; Joint Council of Allergy, Asthma and Immunology. Drug allergy: An updated practice parameter. Ann Allergy Asthma Immunol 2010;105:259‑73. [ Links ]
5. Agache I, Bilò M, Braunstahl G‑J, Delgado L, Demoly P, Eigenmann P, et al. In vivo diagnosis of allergic diseases–allergen provocation tests. Allergy 2015;70:355‑65. [ Links ]
6. Demoly P, Kropf R, Pichler WJ, Bircher A. Drug hypersensitivity: questionnaire. Allergy 1999;54:999‑1003. [ Links ]
7. Seitz CS, Rose C, Kerstan A, Trautmann A. Drug‑induced exanthems: Correlation of allergy testing with histologic diagnosis. J Am Acad Dermatol 2013;69:721‑28. [ Links ]
8. Brockow K, Romano A, Blanca M, Ring J, Pichler W, Demoly P. General considerations for skin test procedures in the diagnosis of drug hypersensitivity. Allergy 2002;57:45‑51. [ Links ]
9. Aberer W, Bircher A, Romano A, Blanca M, Campi P, Fernandez J, et al. Drug provocation testing in the diagnosis of drug hypersensitivity reactions: general considerations. Allergy 2003; 58:854‑63. [ Links ]
10. Brockow K, Garvey LH, Aberer W, Atanaskovic‑Markovic M, Barbaud A, Bilo MB, et al. Skin test concentrations for systemically administered drugs – an ENDA/EAACI Drug Allergy Interest Group position paper. Allergy 2013;68:702‑12. [ Links ]
11. Blanca M, Romano A, Torres MJ, Férnandez J, Mayorga C, Rodriguez J, et al. Update on the evaluation of hypersensitivity reactions to betalactams. Allergy 2009;64:183‑93. [ Links ]
12. Romano A, Viola M, Gaeta F, Rumi G, Maggioletti M. Patch testing in non‑immediate drug eruptions. Allergy Asthma Clin Immunol 2008;4:66‑74. [ Links ]
13. Ohtoshi S, Kitami Y, Sueki H, Nakada T. Utility of patch testing for patients with drug eruption. Clinical and Experimental Dermatology 2014;39:279‑83. [ Links ]
14. Demoly P, Romano A, Botelho C, Bousquet‑Rouanet L, Gaeta F, Silva R, et al. Determining the negative predictive value of provocation tests with beta‑lactams. Allergy 2010;65:327‑32. [ Links ]
15. Defrance C, Bousquet P‑J, Demoly P. Evaluating the negative predictive value of provocation tests with nonsteroidal anti‑inflammatory drugs. Allergy 2011;66:1410‑14. [ Links ]
16. Torres MJ, Blanca M, Fernandez J, Romano A, de Weck A, Aberer W, et al. Diagnosis of immediate allergic reactions to beta‑lactam antibiotics. Allergy 2003;58:961‑72. [ Links ]
17. Lopez S, Blanca‑Lopez N, Cornejo‑Garcia JA, Canto G, Torres MJ, Mayorga C, et al. Nonimmediate reactions to betalactams. Curr Opin Allergy Clin Immunol 2007;7:310‑16. [ Links ]
18. Mirakian R, Leech SC, Krishna MT, Richter AG, Huber PAJ, Farooque S, et al. Management of allergy to penicillins and other beta‑lactams. Clin Exp Allergy 2015;45:300‑27. [ Links ]
19. Niżankowska‑Mogilnicka E , Bochenek G, Mastalerz L, Świerczyńska M, Picado C, Scadding G, et al. EAACI/GA2LEN guideline: aspirin provocation tests for diagnosis of aspirin hypersensitivity. Allergy 2007;62:1111‑18. [ Links ]
20. Kowalski ML, Makowska JS, Blanca M, Bavbek S, Bochenek G, Bousquet J, et al. Hypersensitivity to nonsteroidal anti‑inflammatory drugs (NSAIDs) – classification, diagnosis and management: review of the EAACI/ENDA and GA2LEN/HANNA. Allergy 2011;66:818‑29. [ Links ]
21. Kowalski ML, Asero R, Bavbek S, Blanca M, Blanca‑Lopez N, Bochenek G, et al. Classification and practical approach to the diagnosis and management of hypersensitivity to nonsteroidal anti‑inflammatory drugs. Allergy 2013;68:1219‑32. [ Links ]
22. Ortega N, Doña I, Moreno E, Audicana MT, Barasona MJ, Berges‑Gimeno MP, et al. Practical guidelines for diagnosing hypersensitivity reactions to nonsteroidal anti‑inflamatory drugs. J Investig Allergol Clin Immunol 2014;24:308‑23. [ Links ]
23. Brockow K, Christiansen C, Kanny G, Clément O, Barbaud A, Bircher A, et al. Management of hypersensitivity reactions to iodinated contrast media. Allergy 2005;60:150‑58. [ Links ]
24. Prieto‑Garcia A, Tomás M, Pineda R, Tornero P, Herrero T, Fuentes V, et al. Skin test‑positive immediate hypersensitivity reaction to iodinated contrast media: The role of controlled challenge testing. J Investig Allergol Clin Immunol 2013; 23(3):183‑89. [ Links ]
25. Salas M, Gomez F, Fernandez TD, Doña I, Aranda A, Ariza A, et al. Diagnosis of immediate hypersensitivity reactions to radiocontrast media. Allergy 2013;68:1203‑6. [ Links ]
26. Torres MJ, Gomez F, Doña I, Rosado A, Mayorga C, Garcia I, et al. Diagnostic evaluation of patients with nonimmediate cutaneous hypersensitivity reactions to iodinated contrast media. Allergy 2012;67:929‑35. [ Links ]
27. Gómez E, Ariza A, Blanca‑Lopez N, Torres MJ. Nonimmediate hypersensitivity reactions to iodinated contrast media. Curr Opin Allergy Clin Immunol 2013;13:345‑53. [ Links ]
28. Borch JE, Bindslev‑Jensen. Full‑Course Drug Challenge Test in the diagnosis of delayed allergic reactions to penicillin. Int Arch Allergy Immunol 2011;155:271‑74.
29. Rodriguez‑Alvarez M, Santos‑Magadan S, Rodriguez‑Jimenez, Reig‑Rincon De Arellano I, Vazquez‑Cortes S, Martinez‑Cocera C. Reproducibility of delayed‑type reactions to betalactams. Allergologia et Immunopathologia 2008;36:201‑4.
30. Hjortlund J, Mortz CG, Skov PS, Eller E, Poulsen JMH, Borch JE, et al. One‑week oral challenge with penicillin in diagnosis of penicillin allergy. Acta Derm Venereol 2012;92:307‑12. [ Links ]
31. Gomes ER, Brockow K, Kuyucu S, Saretta F, Mori F, Blanca‑Lopez N, et al. Drug hypersensitivity in children: report from the pediatric task force of the EAACI Drug Allergy Interest Group. Allergy 2016;71:149‑61. [ Links ]
Susana Cadinha
Serviço de Imunoalergologia
Centro Hospitalar de Vila Nova de Gaia/Espinho
R. Dr. Francisco Sá Carneiro,
4400‑129 Vila Nova de Gaia
Financiamento: Sem financiamento a declarar














