Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Portuguesa de Imunoalergologia
versão impressa ISSN 0871-9721
Rev Port Imunoalergologia vol.26 no.4 Lisboa dez. 2018
ARTIGO ORIGINAL
Perfis de sensibilização às cefalosporinas na prática clínica
Profiles of sensitization to cephalosporins in clinical practice
Sofia Farinha, Bárbara Kong Cardoso, Elza Tomaz, Filipe Inácio
Serviço de Imunoalergologia, Centro Hospitalar de Setúbal, EPE – Hospital de S. Bernardo
RESUMO
Fundamentos: A prevalência estimada de hipersensibilidade às cefalosporinas é de 1% a 3% na população geral. A investigação alergológica desta situação implica uma abordagem que tenha em conta as semelhanças estruturais entre os compostos betalactâmicos, no sentido de identificar eventual reatividade cruzada. Objetivos: Caracterizar os quadros de reação alérgica imediata aos antibióticos do grupo das cefalosporinas em termos clínicos e em termos de padrões de sensibilização cruzada, que surgem na prática clínica. Métodos: Foram analisados os processos de 12 doentes em que se verificou uma reação alérgica imediata a uma cefalosporina. Registaram-se as manifestações clínicas e os resultados do estudo alergológico e foram identificados padrões de sensibilização, nomeadamente de provável sensibilização cruzada presentes neste grupo de doentes. Resultados: Em 9 dos 12 doentes a manifestação alérgica verificada foi uma reação anafilática. Maioritariamente os padrões de sensibilização cruzada encontrados sugeriram uma associação com o anel betalactâmico. Em 2 casos verificou-se uma sensibilização cruzada relacionada com as cadeias R2 e apenas num caso estaria envolvida a cadeia lateral R1, classicamente responsabilizada pelas reações cruzadas que envolvem cefalosporinas. Conclusões: Na alergia imediata às cefalosporinas as reações potencialmente graves parecem ser frequentes. No estudo alergológico, para além das cadeias laterais R1, deverão ser considerados o anel betalactâmico e as cadeias laterais R2 enquanto estruturas eventualmente implicadas em reações cruzadas.
Palavras-chave: Cefalosporinas reação cruzada, cadeias laterais, antibióticos betalactâmicos, reação alérgica imediata.
ABSTRACT
Background: The estimated prevalence of hypersensitivity to cephalosporins is about 1% to 3% of general population. The allergological workup for this situation requires a proper methodology, considering the structural similarities between beta-lactam compounds, which may imply different patterns of cross-sensitization. Aims: To characterize the allergic immediate reactions to cephalosporins observed in the clinical practice concerning the clinical presentation as well as the patterns of cross-sensitization. Methods: The clinical files of 12 patients with immediate allergic reaction to a cephalosporin were searched and data regarding the clinic manifestation and allergological workup findings were recorded and analysed. Patterns of sensitization to cephalosporins and cross-sensitization were identified. Results: Nine out of twelve patients presented an anaphylactic reaction to a cephalosporin. Most of the cross-sensitization patterns observed in this group of patients seemed to be related to the betalactamic ring and in 2 cases to R2 lateral chains. Only in one patient the R1 lateral chain was involved, in spite of this one being generally seen as the main responsible for cephalosporin cross-reactions. Conclusions: In cephalosporin immediate allergy severe reactions seem to be frequent. Besides R1 lateral chains, the allergy workup must consider the betalactamic ring and theR2 lateral chains as potentially involved in cross-reactions.
Key-words: Cephalosporin, cross-sensitization, lateral chain, beta-lactams antibiotic, immediate reactions.
INTRODUÇÃO
As cefalosporinas são um grupo de antibióticos betalactâmicos derivados do fungo Cephalosporiumacremonium1. Assemelham‑se Quimicamente às penicilinas, apresentando o ácido 7‑aminocefalosporânico (7‑ACA) como núcleo central, constituído por dois anéis, um anel betalactâmico e um anel de di‑hidrotiazina (Figura 1)2. Todas as cefalosporinas em uso clínico são derivados semissintéticos do 7‑ACA, obtido inicialmente de um antibiótico natural, a cefalosporina C, oriunda do referido fungo.
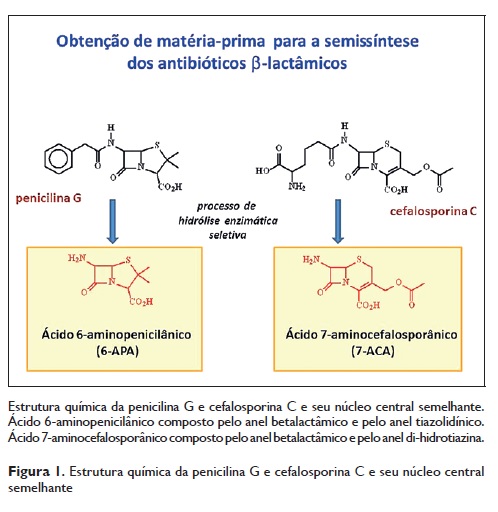
Este grupo de antibióticos é utilizado em contexto de clínica de ambulatório e hospitalar em situações de infecções bacterianas variadas, que incluem septicemia, pneumonia, infeção das vias biliares, infeções do trato urinário ou sinusite bacteriana. Algumas cefalosporinas são também correntemente utilizadas em vários protocolos cirúrgicos3.
Este seu uso alargado é devido ao seu amplo espetro, baixa toxicidade, facilidade de administração e perfil farmacocinético favorável.
As cefalosporinas são classificadas em antibióticos de primeira, segunda, terceira e quarta gerações; mais recentemente surgiram as cefalosporinas de quinta geração, no qual estão englobados o ceftobiprole e a ceftarolina. As cefalosporinas de primeira geração foram produzidas quimicamente ou enzimaticamente, modificando a cadeia lateral R1 da cefalosporina básica. As gerações subsequentes das cefalosporinas sofreram modificação nas cadeiras laterais R1 e R24. Às várias gerações correspondem, em geral, espetros diferentes, com a primeira geração a atuar essencialmente em bactérias gram‑positivas, alargando as gerações seguintes a sua atividade às gram‑negativas.
Estas alterações no espetro são obtidas através da adição de radicais às cadeias laterais da estrutura química básica, permitindo modificar diversas propriedades da molécula-base.
Este grupo de antibióticos pode ser causa de reacções de hipersensibilidade imediata (urticária, angioedema, anafilaxia) ou reações de hipersensibilidade não imediata (exantema maculopapular, urticária e/ou angioedema, síndrome de Stevens‑Johnson, necrólise epidérmica tóxica (TEN) ou síndrome de DRESS). A prevalência estimada de hipersensibilidade às cefalosporinas é de 1% a 3% na população geral5,6.
As reações alérgicas podem ocorrer a uma cefalosporina específica, a um grupo de cefalosporinas, ou como reação cruzada com outros antibióticos betalactâmicos7.
As cadeias laterais são consideradas a fonte mais comum de reatividade cruzada entre as cefalosporinas ou entre estas e as penicilinas. As cadeias laterais do grupo R1 são idênticas na amoxicilina, cefadroxil, cefprozil e cefatrizina.
A ampicilina compartilha cadeias laterais com acefalexina, o cefaclor, acefradina, acefaloglicina e o loracarbef. A penicilina benzatínica tem cadeias laterais semelhantes às da cefalotina e cefalodrina (Quadros 1 e 2)2,8. Durante a degradação da cefalosporina, a rutura do anel di‑hidrotiazina conduz à excisão do grupo R2, ficando o grupo R1 intacto, parecendo este último ser o mais importante para a reatividade cruzada das cefalosporinas7,9,10. No entanto, existem descrições na literatura sobre o papel das cadeias laterais R2 na reatividade cruzada entre cefalosporinas2,9,11.
Importa salientar que aproximadamente 40% das reacções de anafilaxia perioperatória relacionadas com fármacos são atribuídas à antibioterapia com cefalosporinas, sendo estas responsáveis por 30% das reações graves a betalactâmicos12,13. A Figura 2 mostra a estrutura química das penicilinas e algumas cefalosporinas, ilustrando também a diversidade das suas cadeias laterais R1 e R2.
Maioritariamente a alergia às cefalosporinas é abordada no contexto da investigação da alergia à penicilina/aminopenicilinas. Partir de uma reação alérgica a uma cefalosporina implica uma abordagem diferenciada que tenha em conta a variabilidade estrutural destes antibióticos, mas também as semelhanças entre eles, particularmente no processo de identificação de um antibiótico betalactâmico que seja tolerado.
OBJETIVO
O presente estudo tem como objetivo caracterizar os quadros de reação alérgica imediata aos antibióticos do grupo das cefalosporinas em termos clínicos e em termos de padrões de sensibilização cruzada que surgem na prática clínica. Esperamos que possa ser um contributo para a adoção de uma metodologia de estudo alergológico adequada, que possa oferecer ao doente alérgico a cefalosporinas um diagnóstico preciso e uma alternativa segura dentro do grupo dos betalactâmicos, sempre que possível.
MATERIAL E MÉTODOS
População
Foram analisados os processos clínicos de 12 doentes estudados em consulta de Imunoalergologia no período entre 2013 e 2016 com reação alérgica a um antibiótico do grupo das cefalosporinas.
Testes cutâneos
Os testes cutâneos (TC) e as provas de provocação com fármacos foram realizados de acordo com o manual de boas práticas em Imunoalergologia14. Nos TC foram utilizadas concentrações comprovadamente não irritativas15: penicilina 10 000 U/mL, aminopenicilinas 20 mg/mL e cefalosporinas 2mg/mL, exceto no caso da cefatrizina, em que foi realizado teste prick com o pó da cápsula. Os testes cutâneos em prick foram considerados positivos se a correspondente pápula atingia um diâmetro médio superior em 3 mm ao do controlo negativo e tinha eritema circundante 20 minutos após a execução. Para os testes intradérmicos, realizados só quando existia formulação parenteral do fármaco, o critério de positividade consistiu no aumento em 3 mm do diâmetro médio da pápula de inoculação, com eritema circundante 20 minutos após a execução.
Todos os doentes incluídos realizaram o estudo para alergia a aminopenicilinas, iniciando‑se sempre pelos testes cutâneos aos determinantes major e minor (PPL e MDM) da penicilina, seguido dos testes com benzilpenicilina, ampicilina e amoxicilina. Realizaram ainda testes à cefalosporina suspeita e, eventualmente, a outras cefalosporinas.
Provas de provocação
As provas de provocação foram realizadas em períodos de doença estabilizada utilizando um protocolo aberto, e só consideradas positivas se levaram ao desencadear de sinais e sintomas objetiváveis, reproduzindo a clínica anterior.
Foi administrado o fármaco a testar, iniciando com uma dose entre 1/10 000 e 1/10 da dose terapêutica, prosseguindo‑se com doses entre duplas e triplas da dose anterior, com intervalos ajustados ao tempo previsto de reação, mas nunca inferiores a 20 minutos. A prova era interrompida no caso de se verificar uma reação, ou quando a dose cumulativa atingia o valor da dose média de toma do fármaco em questão para o doente. Os doentes, em geral, foram instruídos para não tomar anti‑histaminicos ou antidepressivos nos 5 dias, nem corticosteroides nos 7 dias anteriores à prova. Nenhum doente sujeito a prova de provocação fazia corticoterapia prolongada ou fármacos betabloqueantes. Para todas as provas foi obtido o consentimento informado do doente ou do seu representante.
RESULTADOS
Os dados demográficos, a reação alérgica verificada e o antibiótico associado são apresentados no Quadro 3.
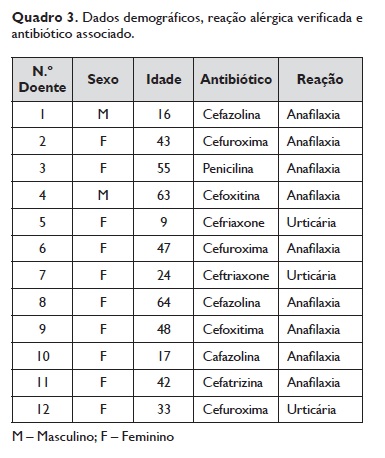
Os resultados do estudo alergológico realizado para cada doente estão resumidos no Quadro 4. No grupo estudado, 10 doentes eram do sexo feminino e 2 do sexo masculino e tinham idades entre os 9 e os 63 anos – média de 38,4± 18,6 anos. A reação apresentada foi em nove doentes (75% deste grupo) uma anafilaxia, associada à cefuroxima em 4 casos, à cefazolina em 3, à cefoxitina em 2, ao ceftriaxone em 2 e à cefatrizina em 1. Os restantes 3 tiveram uma urticária como reação.
Os doentes 2 e 3 (reação com cefuroxima) apresentaram TC negativos com prova de provocação oral (PPO) positiva para a cefuroxima. Um deles apresentou PPO positiva para a amoxicilina e o outro TC com benzilpenicilina positivo. Os doentes 6 e 12 (reação com cefuroxima) tiveram TC com cefuroxima positivos, tendo um deles TC positivos num caso com MDM e no outro com benzilpenicilina e com amoxicilina.
Três doentes tiveram história de anafilaxia à cefazolina (doente 1, 8 e 10), com positividade no teste ID realizado com este antibiótico. Os doentes 1 e 8 não apresentaram positividade a nenhum dos outros antibióticos testados (aminopenicilinas, cefuroxima e ceftriaxone no doente 1). O doente 10 apresentou positividade no TC ao MDM e teste ID à cefuroxima.
Os doentes 4 e 9 apresentavam história de reação anafiláctica com a cefoxitina, com o respetivo TC positivo. No caso do doente 4, o teste prick, para além da pápula local, desencadeou uma reação sistémica ao antibiótico suspeito e os TC à cefuroxima e ceftriaxone foram positivos. O doente 9 apresentou o restante estudo alergológico negativo.
Os doentes 5 e 7 tiveram uma reação cutânea de urticária associada à administração de ceftriaxone. O estudo alergológico foi positivo ao fármaco suspeito, com negatividade nos restantes antibióticos testados.
No único doente em que houve história de reacção anafilática à cefatrizina a alergia foi comprovada pelo teste prick positivo a este antibiótico. Neste caso, o teste intradérmico com amoxicilina foi positivo e os TC e a PPO com cefuroxima foram negativos.
DISCUSSÃO
Um primeiro facto a comentar é o pequeno número de doentes com reação alérgica imediata às cefalosporinas que estudámos durante estes 4 anos, que poderá traduzir uma baixa prevalência de alergia às cefalosporinas, possivelmente pela queda do seu consumo relativo nas últimas duas décadas16. Este decréscimo de utilização, que se verificou de uma forma geral no espaço europeu17, esteve associado a campanhas das autoridades de saúde com o objetivo de racionalizar o uso de antibióticos e assim diminuir o fenómeno das resistências bacterianas. Em Portugal, a percentagem relativa do consumo de cefalosporinas no ambulatório diminuiu em 43,5% entre 2000 e 200916. No entanto, é de notar, no grupo estudado, a elevada frequência de reações anafiláticas como expressão de alergia. Também as cefalosporinas que nos aparecem como causa de reacção estarão associadas a padrões de consumo: no ambulatório um predomínio das cefalosporinas de 2.ª geração; a nível hospitalar a cefazolina e a cefoxitina, utilizadas largamente nos protocolos cirúrgicos, e o ceftriaxone, essencialmente em infeções graves. Aliás, os padrões de consumo também poderão estar na causa dos padrões de sensibilização cruzada encontrados serem maioritariamente referidos na literatura como pouco frequentes ou raros.
No que diz respeito a sensibilizações cruzadas, só 1 dos 12 doentes apresentou um padrão compatível com cruzamento associado à cadeia lateral em posição R1, apontado classicamente como o mecanismo mais frequente de sensibilização cruzada entre cefalosporinas18. Acontece que este padrão seria o verificado habitualmente entre as penicilinas e as cefalosporinas de primeira geração, cujo consumo tem vindo a descer significativamente. Poder‑se‑a admitir que a alteração no consumo de cefalosporinas, eventualmente associada à prática de evitar a medicação com cefalosporinas de 1.ª geração nos doentes alérgicos à penicilina/aminopenicilinas, esteja na origem do aumento de frequência relativa de outros padrões de sensibilização cruzada. Em 2015, Baldo e Pham sublinharam já a importância de outras estruturas moleculares nas reações cruzadas, nomeadamente das cadeias em posição R219. Nos 12 doentes apresentados, cinco evidenciaram um padrão de sensibilização à penicilina/amoxicilina e cefuroxima, com um a reagir também à cefazolina e outro ao ceftriaxone.
Assumindo o padrão como expressão de reatividade cruzada, esta será devida à sensibilização ao anel betalactâmico ou aos seus metabolitos, dado que estes antibióticos não têm na sua estrutura cadeias laterais idênticas ou similares.
Em 2 doentes verificou‑se sensibilização à cefazolina, sem sensibilização às penicilinas ou a outras cefalosporinas testadas. Provavelmente tratar‑se‑a de sensibilização isolada à cefazolina, descrita como provavelmente associada a uma cadeia lateral específica deste antibiótico20. Também em 2 doentes existia um padrão de sensibilização cefoxitina‑cefuroxima, com tolerância à penicilina e aminopenicilinas, que atribuímos a uma reação cruzada pela similaridade das cadeias laterais em posição R2. Em outros 2 doentes verificámos sensibilização ao ceftriaxone, com tolerância à penicilina/aminopenicilinas. Nos resultados há ainda a realçar 3 doentes com testes cutâneos negativos para cefalosporinas e provas de provocação positivas (2) com cefuroxima e 1 com ceftriaxone, o que talvez seja devido à concentração do fármaco usada nos testes. Na realidade há trabalhos recentes que demonstraram que concentrações até 33 mg/mL de cefazolina e 20mg/mL de ceftriaxone não induzirão reações irritativas, podendo melhorar a sensibilidade dos testes15,18. Num dos casos estudados verificou‑se também uma prova de provocação positiva com amoxicilina, com testes cutâneos negativos (PPL, MDM, amoxicilina e ampicilina). De qualquer forma, estes resultados falsos negativos nos TC são a prova clara de que a indicação de antibióticos betalactâmicos como alternativa, em caso de alergia, terá que ser feita com base em provas de provocação, ao contrário do preconizado em alguns artigos que essa indicação seja baseada apenas na não semelhança das cadeias laterais.
O presente estudo tem as limitações inerentes a um trabalho de revisão e aos limites éticos a considerar na abordagem de reações alérgica graves, que são a falta de estudo por testes cutâneos alargado a outros antibióticos em alguns doentes e a não realização de algumas provas de provocação, confirmando ou não a tradução clínica de algumas sensibilizações. Estas limitações são, contudo, habituais nos estudos publicados sobre o tema.
Não deixa, no entanto, de refletir a realidade dos problemas que se põem ao alergologista no estudo da alergia às cefalosporinas: identificação do fármaco responsável pela reação, identificação de potenciais reacções cruzadas, identificação de antibiótico betalactâmico seguro a utilizar em alternativa.
CONCLUSÕES
Embora provavelmente pouco frequentes, as reacções alérgicas imediatas a cefalosporinas são um problema da clínica alergológica, pela sua potencial gravidade e, por outro lado, porque implicam encontrar, sempre que possível, um antibiótico betalactâmico seguro para o doente.
No estudo da alergia às cefalosporinas, para além das cadeias laterais R1, deverão ser considerados o anel betalactâmico e as cadeias laterais R2 como estruturas que podem estar implicadas em reações cruzadas.
O antibiótico a indicar como alternativa deverá sempre ser testado com prova de provocação.
REFERÊNCIAS
1. Lemke TL, Roche VF, Williams DA. Foyes principles of medicinal chemistry. Philadelphia: Lippincott Williams & Wilkins. 2008. 1028-82. ISBN 978‑0‑7817‑6879‑5. [ Links ]
2. Kim MH, Lee JM. Diagnosis and management of immediate hypersensitivity reactions to cephalosporins. Allergy Asthma Immunol Res 2014;6(6):485‑95. [ Links ]
3. Geroulanos S, Marathias K, Kriaras J. Cephalosporins in surgical prophylaxis. BJ Chemother 2001;13 Spec No 1(1):23‑6. [ Links ]
4. Michael E, Pichichero MD, Zagursky R. Penicillin and cephalosporin allergy. Ann Allergy Asthma Immunol 2014; 112(5): 404‑12. [ Links ]
5. Saxon A, Beall GN, Rohr AS, Adelman DC. Immediate hypersensitivity reactions to beta‑lactam antibiotics. Ann Intern Med 1987; 107:204-15. [ Links ]
6. Macy E, Poon KY. Self‑reported antibiotic allergy incidence and prevalence: age and sex effects. Am J Med 2009;122:778.e1-778.e7. [ Links ]
7. Romano A, Torres MJ, Namour F, Mayorga C, Artesani MC, Venuti A, et al. Immediate hypersensitivity to cephalosporins. Allergy 2002;57Suppl 72:52‑7. [ Links ]
8. Ledford DK. Cephalosporin side chain cross‑reactivity. J Allergy Clin Immunol Pract 2015;3(6):1006‑7. [ Links ]
9. Sánchez‑Sancho F, Perez‑Inestrosa E, Suau R, Montañez MI, Mayorga C, Torres MJ, et al. Synthesis, characterization and immuno‑ chemical evaluation of cephalosporin antigenic determinants. J Mol Recognit 2003;16:148‑56. [ Links ]
10. Perez‑Inestrosa E, Suau R, Montañez MI, Rodriguez R, Mayorga C, Torres MJ, et al. Cephalosporin chemical reactivity and its immunological implications. Curr Opin Allergy Clin Immunol 2005;5: 323‑30. [ Links ]
11. Pham NH, Baldo BA. Beta‑Lactam drug allergens: fine structural recognition patterns of cephalosporin‑reactive IgE antibodies. J Mol Recognit 1996;9:287‑96. [ Links ]
12. Almeida JP, Soares, J, Lopes A, Barbosa MP. Hipersensibilidade selectiva a cefazolina – Revisão de casos. Rev Port Imunoalergologia 2014;22(1). [ Links ]
13. Renaudin JM, Beaudouin E, Ponvert C, Demoly P, Moneret‑Vautrin DA. Severe drug‑induced anaphylaxis: analysis of 333 cases recorded by the Allergy Vigilance Network from 2002 to 2010. Allergy 68:929‑37. [ Links ]
14. Colégio Imunoalergologia – Ordem dos Médicos. Manual de Boas Práticas – Procedimentos diagnóstico / tratamento em Imunoalergologia. Site da Ordem dos Médicos. 2011. [ Links ]
15. Brockow K, Garvey LH, Aberer W, Atanaskovic‑Markovic M, et al. Skin test concentrations for systemically administered drugs – an ENDA/EAACI Drug Allergy Interest Group position paper. Allergy 2013;68:702-12. [ Links ]
16. Ramalhinho I, et al. Consumo de antibióticos em ambulatório – Portugal 2000‑2009, Acta Med Port 2012;25(1):20‑8. [ Links ]
17. Coenen S, Ferech M, Dvorakova K, Hendrickx E, Suetens C, Goossens H, on behalf of the ESAC Project Group. European Surveillance of Antimicrobial Consumption (ESAC): Outpatient cephalosporin use in Europe. Journal of Antimicrobial Chemotherapy 2006;58:413-7. [ Links ]
18. Romano A. Cephalosporin allergy: Clinical manifestations and diagnosis. UptoDate. 2017.Disponível em: http://www.uptodate.com/online. Acesso em: 31/07/2017. [ Links ]
19. Baldo BA, Pham NH. Allergenic significance of cephalosporin side chains. J Allergy Clin Immunol 2015;138(5):1426‑8. [ Links ]
20. Weber EA. Cefazolin specific side chain hypersensitivity. J Allergy Clin Immunol 1996; 98(4): 849‑50. [ Links ]
Sofia Farinha
Email: sofiamf_@hotmail.com
Financiamento: Nenhum
Declaração de conflito de interesses: Nenhum
Prémio SPAIC DIATER 2017
Data de receção / Received in: 18/11/2017
Data de aceitação / Accepted for publication in: 16/12/2017














