INTRODUÇÃO
A doença alérgica é cada vez mais prevalente em todo o mundo. O objetivo primário do seu tratamento é restaurar a função do(s) órgão(s) e sistema(s) afetados, de forma a melhorar o controlo da doença e a qualidade de vida do doente1,2. A evicção dos alergénios envolvidos pode auxiliar no controlo dos sintomas, mas é a farmacoterapia que atua diretamente no alívio e prevenção dos sintomas desde a fase mais precoce em que há libertação de histamina, até fases tardias em que há infiltração celular e perpetuação da resposta inflamatória. São vários os grupos terapêuticos disponíveis, bem como a via e posologias de administração3,4,5.
Porém, a imunoterapia com alergénios é a única opção terapêutica que modifica o mecanismo imunológico subjacente à doença alérgica, procurando induzir dessensibilização e um estado de tolerância para os alergénios envolvidos6,7. Está normalmente indicada na rinoconjuntivite alérgica moderada a grave apesar da farmacoterapia otimizada, a partir dos 5 anos de idade, reduzindo o risco de progressão para asma, e na asma alérgica sobretudo se associada a rinoconjuntivite, devendo ser utilizados extratos alergénicos padronizados. São várias as vantagens relativamente a outras formas de tratamento: melhoria dos scores de sintomas; redução da medicação necessária para o controlo da doença; manutenção de um efeito clínico duradouro após a descontinuação, bem como um papel protetor na progressão da doença e no aparecimento de novas sensibilizações2,3,8-11.
Vivemos atualmente a maior pandemia de que há memória no último século; desde o final do ano 2019, na China, onde apareceram os primeiros casos, foi identificado um novo coronavírus - Severe acute respiratory syndrome - Coronavirus 2 (SARS-CoV-2). É extremamente infecioso e o espetro de doença pode variar desde um indivíduo totalmente assintomático até à sua morte, sendo o pulmão o órgão mais afetado, podendo causar a síndrome respiratória aguda grave12. Até final de fevereiro de 2021, eram já mais de 112 milhões os casos em todo o mundo, com uma contagem global de mortes diretamente associadas que está perto de atingir os três milhões, ainda em ritmo ascendente. Por este motivo foi decretado, a 18 de março de 2020, o estado de emergência (EE) em Portugal, pela primeira vez no contexto desta pandemia, com medidas de contacto muito limitadas, desde o encerramento de estabelecimentos não essenciais (restaurantes, centro comerciais), limitação no número de pessoas em ajuntamentos, sobretudo não sendo do mesmo agregado familiar, limitação do número de pessoas em estabelecimentos essenciais, como supermercados, de acordo com a área dos mesmos, ensino à distância com recurso aos meios digitais, proibição de circulação entre concelhos, com exceção de trabalho ou motivos de saúde, entre outros.
O nosso hospital foi, desde a chegada desta pandemia a Portugal, dedicado ao tratamento da doença causada pelo novo coronavírus (COVID-19), um dos motivos pelos quais foi suspensa toda a atividade não urgente.
Não sendo a imunoterapia com aeroalergénios uma terapêutica life-saving e pesando os riscos inerentes à deslocação dos doentes ao hospital em plena curva ascendente da COVID-19 em Portugal, desde a utilização de transportes públicos ao tempo de espera em salas fechadas e sobrelotadas, também a administração da imunoterapia subcutânea com aerolergénios (ITSCA) foi suspensa a 18 de março, com o objetivo de manter os doentes em segurança (de acordo com as diretrizes do Centro Hospitalar e do Colégio da Especialidade de Imunoalergologia13). Porém, pelo facto de se saber que a doença alérgica mal controlada é fator de risco para infeção respiratória e tendo sido iniciado o período de desconfinamento, a 3 de maio foi retomada a administração da ITSCA com todas as medidas de segurança necessárias12,14.
O objetivo deste trabalho foi avaliar e quantificar, nos doentes sob programa de ITSCA e que a interromperam durante o período de EE na pandemia de COVID-19, o atraso na sua administração, caracterizar os ajustes de dose e verificar a segurança da dose administrada. Adicionalmente procurou-se determinar se neste período ocorreu agravamento dos sintomas e/ou uso de medicação de resgate.
MATERIAL E MÉTODOS
População
Estudo observacional retrospetivo em que foram selecionados os doentes aos quais foi suspensa a ITSCA durante o período de EE em Portugal (entre 18 de março e 2 de maio de 2020) e que retomaram a sua administração pela equipa de enfermagem sob supervisão de Imunoalergologista na Unidade Funcional de Imunoterapia com Alergénios (UFIA).
Os dados referem-se ao período de retoma entre 1 de maio e 30 de junho de 2020 e foram recolhidos através dos registos no processo clínico dos doentes, incluindo os registos de enfermagem.
Avaliação pré e pós administração de ITSCA
À entrada no espaço do centro de ambulatório todos os doentes, incluindo os doentes em programa de ITSCA, foram submetidos a uma triagem que consiste na medição da temperatura com um termómetro digital de infravermelhos e questionados acerca de sinais e sintomas (tosse, febre, dispneia, cefaleias, mialgias, diarreia, anosmia, ageusia) e/ou contato com pessoas suspeitas ou confirmadas com COVID-19.
Com o apoio da equipa de enfermagem da UFIA foi realizado um inquérito verbal registado no processo clínico informático, após consentimento verbal dos doentes, dirigido à avaliação da doença alérgica, tanto durante o período de suspensão da ITSCA, como após a sua retoma: agravamento da doença alérgica de base e quais os sintomas, necessidade de recorrer a terapêutica de resgate e qual a terapêutica, necessidade de recorrer a cuidados de saúde.
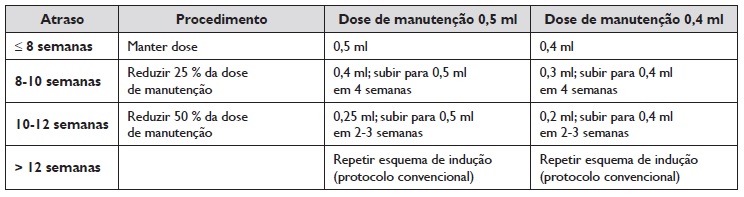
O Quadro 1 explicita os procedimentos de ajuste de dose da ITSCA em função do número de semanas em atraso, adaptado da Academia Americana de Alergia, Asma e Imunologia (AAAAI)15,16. Estes procedimentos foram efetuados pela equipa de enfermagem e, em caso de necessidade, foi solicitado o apoio do Imunoalergologista presente na UFIA para a tomada de decisão. Após
a administração da ITSCA há um período de vigilância clínica de 30 minutos.
O agendamento e atendimento de todos os doentes foi efetuado de acordo com as normas da Academia Europeia de Alergia e Imunologia Clínica (EAACI) na prevenção de COVID-1917.
Critérios de inclusão e exclusão
Foram incluídos todos os doentes que estão a realizar ITSCA na UFIA; foram excluídos os doentes que não suspenderam a ITSCA durante este período e os doentes que, à data da implementação do EE, ainda não tinham atingido a dose de manutenção.
RESULTADOS
Foram avaliados 210 doentes, dos quais 15 foram excluídos (6 ainda não tinham atingido a dose de manutenção previamente à suspensão da ITSCA e 9 mantiveram a administração da ITSCA neste período fora da UFIA).
Assim, analisámos um total de 195 doentes: 110 mulheres (56,4%), 13 crianças com idade inferior a 12 anos (6,7%) e 22 adolescentes (11,3%). Uma doente adulta teve infeção pelo SARS-CoV-2, com sintomas ligeiros e sem necessidade de internamento.
A média de idades de início da ITSCA foi de 29,1±14,2 anos (mínimo de 7 e máximo de 70 anos), estando os doentes a realizar ITSCA em média há 1,8±1,1 anos, e 20 doentes (10,3%) já tinham realizado outro esquema vacinal previamente, maioritariamente sublingual.
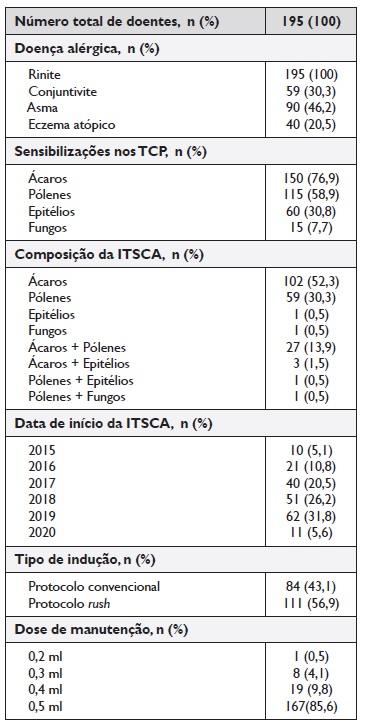
O Quadro 2 revela a caracterização da população estudada quanto à sua doença alérgica, sensibilização, composição e data de início da ITSCA, assim como o seu protocolo de iniciação.
ITSCA - imunoterapia subcutânea com aeroalergénios
TCP - testes cutâneos em picada
A média de atraso na administração da ITSCA pela interrupção devido ao EE durante a pandemia de COVID- 19 foi de 11,3±2,6 semanas (mínimo de 7 e máximo de 21 semanas).
Verificou-se que 188 doentes (96,4%) diminuíram a dose da ITSCA, dos quais 37 doentes (19,7%) diminuíram em menos de 50% e 151 (80,3%) diminuíram em mais de 50% a dose; os restantes 7 doentes (3,6%) mantiveram a dose devido ao intervalo da pausa ter sido inferior a 8 semanas, estando todos a realizar ITSCA a ácaros (Quadro 3).
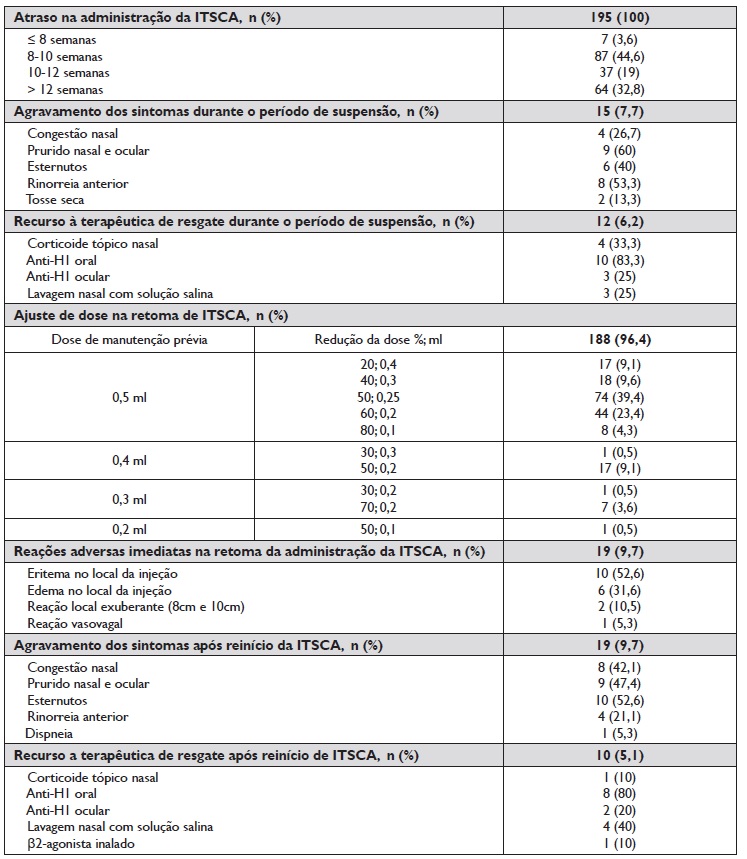
Quadro 3 Caracterização da pausa da ITSCA, da clínica e terapêutica da doença alérgica, ajuste de doses e reações adversas no reinício da ITSCA
ITSCA - imunoterapia subcutânea com aeroalergénios. Anti-H1 - anti-histamínico H1. β2 - beta 2.
Verificámos que a maioria (103 doentes - 54,8%) retomou a dose de manutenção na 2.ª administração (às 4 semanas), 33 doentes (17,6%) retomaram a dose de manutenção na 3.ª administração (às 8 semanas), 16 (8,5%) falharam a toma seguinte e 36 (19,1%) ainda não tinham retomado a dose de manutenção à data da análise dos dados. Dos 64 doentes com atraso superior a 12 semanas, apenas 4 (6,3%) realizaram novo protocolo de indução.
A Figura 1 detalha a frequência de doentes que reduziram a dose de acordo com o intervalo de tempo da pausa. Verifica-se que no período de pausa entre 8 a 10 semanas, correspondente no geral a uma redução de 25% da dose de manutenção de acordo com o nosso protocolo, na maioria dos doentes a dose foi reduzida em 50% ou mais; no período de pausa entre 10 a 12 semanas, correspondente a uma redução de 50% da dose de manutenção de acordo com o nosso protocolo, tal foi cumprido na maioria dos doentes; e no período de pausa superior a 12 semanas, correspondente a um novo esquema de iniciação de acordo com o nosso protocolo, tal não se verificou, no entanto com uma redução em 60% ou mais da dose na maioria dos doentes.
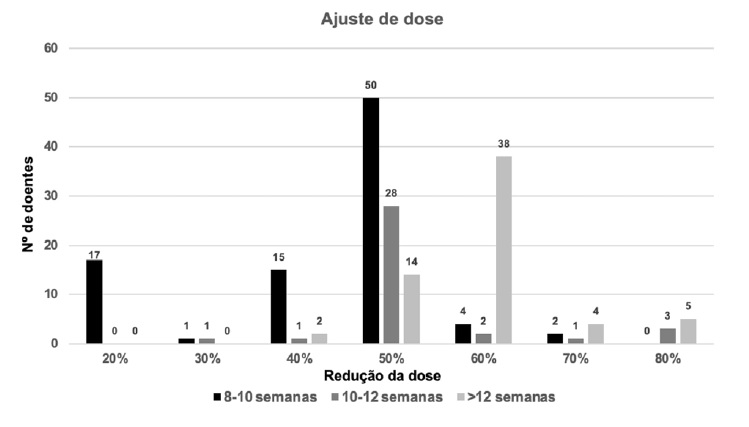
Figura 1 Distribuição da frequência de ajuste de dose de acordo com os dias de atraso na administração da imunoterapia subcutânea com aeroalergénios
Verificaram-se 18 reações adversas locais imediatas, das quais 5 efetuaram tratamento com corticoide tópico, 3 com anti-histamínico oral e 5 com aplicação local de gelo (Quadro 3). Não ocorreram reações anafiláticas. Uma doente teve reação vasovagal; no entanto, esta doente já tinha registo de várias reações semelhantes em administrações prévias.
Dos 15 doentes que agravaram os sintomas alérgicos durante o período de suspensão da ITSCA (Quadro 3), 8 (53,3%) estavam previamente controlados sem terapêutica diária e dos 12 que recorreram a terapêutica de resgaste, 6 (50%) estavam previamente controlados sem terapêutica diária.
Dos 19 doentes que agravaram os sintomas depois da primeira administração da ITSCA após o período de suspensão (Quadro 3), 4 já tinham agravado anteriormente durante o período de suspensão, 12 (63,2%) estavam previamente controlados sem terapêutica diária e dos 10 doentes que recorreram a terapêutica de resgaste 6 (60%) estavam previamente controlados sem terapêutica diária. Seis (31,5%) dos 19 doentes também terão agravado os sintomas no período homólogo do ano anterior e, destes, 4 (21%) tinham sensibilização polínica (3 estavam a realizar ITSCA com extrato polínico e 1 com extrato não polínico).
DISCUSSÃO
Neste estudo, a totalidade dos doentes apresentava a rinite como a sua principal doença alérgica, tendo como comorbilidades mais frequentes a conjuntivite e a asma alérgicas. A rinite é a doença alérgica mais comum em todo o mundo, estimando-se atualmente uma prevalência global entre 10 a 40%, variando consoante a localização geográfica2,18. A maioria dos nossos doentes está sensibilizada a ácaros e pólenes, sendo estas as principais composições das suas ITSCA, estando alguns a realizar misturas.
Estes resultados estão de acordo com outros estudos, onde também a principal composição da imunoterapia são os ácaros, os alergénios mais ubiquitários, seguidos dos pólenes e misturas de ambos. Os epitélios e fungos acabam por não ter tanta expressão na composição da imunoterapia4,5,18,19.
Estamos a viver a maior crise mundial de saúde pública dos últimos 100 anos. Por este motivo e pelo facto de ainda muito se desconhecer sobre o novo coronavírus, é imperativo mantermos a segurança dos nossos doentes.
Com este propósito, as diferentes academias de alergologia de todo o mundo procuraram estabelecer guidelines orientadoras da melhor prática na administração da ITSCA15,20. Também neste hospital foram avaliados os riscos e benefícios de manter a sua administração e, baseados nas recomendações do Colégio da Especialidade de Imunoalergologia13, do Centro de Controlo e Prevenção de Doenças21, da EAACI17, da AAAAI15 e da Organização Mundial de Alergia20, foram elaborados protocolos de triagem (temperatura, sinais e sintomas de COVID-19), circulação de doentes (circuitos de um só sentido, utilização de máscara cirúrgica e desinfeção frequente das mãos) e isolamento dos suspeitos de COVID-19, bem como listagens dos equipamentos de proteção para os profissionais de saúde, desinfeção das superfícies entre doentes e utilização de gabinetes ventilados, com o principal objetivo de podermos retomar a administração da ITSCA e manter o controlo da doença alérgica dos doentes em segurança22.
Uma dificuldade transversal a todos os prestadores de cuidados de saúde é garantir que os doentes cumprem a medicação de forma a manterem as suas patologias o mais controladas possível. Também tal acontece no cumprimento da administração da ITSCA, pois, além de implicar um custo económico que para muitos é uma dificuldade, requer também investimento de tempo, pois obriga a deslocação periódica às instituições hospitalares e tempo de espera após a sua administração. Estes são motivos pelos quais frequentemente os doentes atrasam/abandonam a administração da ITSCA.23 O receio dos doentes em se deslocarem aos hospitais dada a atual situação pandémica poderá ser um fator adicional de não adesão; daí que seja ainda mais importante ter os circuitos bem planeados, para que se possam sentir seguros.
A eficácia da ITSCA depende de uma administração regular das doses de manutenção recomendadas; o espaçamento prolongado entre administrações pode resultar numa diminuição da eficácia terapêutica16. A maioria dos fabricantes preconiza intervalos de 4 semanas, sendo este o esquema globalmente mais praticado; no entanto, guidelines americanas19 apontam para esquemas de manutenção a cada 2 semanas e um estudo dinamarquês23 relata que os doentes deste país recebem doses de manutenção a cada 6 semanas. Mas no geral a maioria dos estudos refere que a segurança se mantém até às 8 semanas de atraso relativamente à última toma, conseguindo manter-se a eficácia clínica da ITSCA16,19. No presente estudo o intervalo da pausa (mínimo 7 e máximo 21 semanas) foi superior à duração do EE (6 semanas).
Atualmente, a informação disponível sobre esquemas de ajustes de dose é escassa, porém importante, pois são vários os fatores que podem justificar um ajuste de dose, desde infeções, agravamento de sintomas, reações adversas à ITSCA ou outras causas que motivem pausa prolongada. Em 2012 a AAAAI realizou um questionário online aos seus profissionais: todos relataram os ajustes de dose com base na data da última administração; a maioria reduziu a dose voltando atrás um ou mais degraus no esquema previsto de doses, tendo outros reduzido em percentagem ou em volume24.
Especificamente nesta fase que atravessamos, as referências são muito gerais e semelhantes ao que foi desenhado para a nossa UFIA: se o doente apresentar sinais e/ou sintomas e/ou infeção comprovada por SARS-CoV-2 não deve realizar ITSCA até estar assintomático ou curado; se estiver assintomático ou já curado, pode e deve retomar a administração da ITSCA, nunca deixando de
ter especial consideração (eventual redução de dose ou aumento do período de vigilância após a administração da ITSCA) pelos grupos de risco, como doentes com asma não controlada, com reações locais exuberantes ou sistémicas prévias na administração da ITSCA, pediátricos, administração da ITSCA em época polínica16,17.
A maioria dos centros implementaram um período de suspensão da ITSCA no início da pandemia de COVID-19 enquanto organizavam os circuitos, pessoal hospitalar e equipamentos de proteção, tendo esta sido retomada assim que possível, porém com consequentes atrasos na sua administração. No presente estudo, a maioria dos doentes teve um período de pausa superior a 8 semanas, com maior número com um intervalo entre as 8 e 10 semanas, o que, de acordo com o esquema de ajuste de dose preconizado na UFIA, corresponderia a uma diminuição em 25% da dose. No entanto, reduções de dose abaixo de 50% apenas foram feitas em cerca de 20% dos doentes, sendo que em cerca de 30% as reduções foram iguais ou superiores 60% da dose de manutenção prévia.
Tal pode ser justificado pelo facto de o estudo ter decorrido em época polínica, mas também por prudência dos profissionais de saúde face à incerteza da atualidade que se vivia e continua a viver, motivando reduções de dose personalizadas.
De igual forma, dos doentes com atraso superior a 12 semanas e, por isso, com indicação para novo esquema de iniciação, apenas 6% o realizaram. Foi decidido na nossa UFIA, e de acordo com as diretrizes do centro hospitalar e do Colégio da Especialidade de Imunoalergologia, realizar as novas iniciações sob esquema convencional, de forma a evitar reações adversas (pela repartição das doses em diferentes semanas), mas também para evitar estadias prolongadas dos doentes na instituição com os riscos que tal pudesse acarretar. Por outro lado, a realização de esquemas de iniciação convencionais pode diminuir a compliance dos doentes, uma vez que serão necessárias mais deslocações ao hospital até retomar a dose de manutenção13. Embora os restantes doentes não tenham realizado novo esquema de iniciação e seja esse o procedimento preconizado, a grande maioria acabou por reduzir a dose em 60% ou mais, sem reações adversas, sendo esta também uma possibilidade já descrita por algumas sociedades (AAAAI) em alguns estudos, de forma a retomar a dose de manutenção prévia mais rapidamente16,17,25.
As reações adversas ocorridas foram ligeiras, sobretudo eritema e edema no local da injeção, que são reações típicas deste tipo de terapêutica; não houve registo de reações sistémicas, indo de encontro ao descrito na literatura25,26.
Adicionalmente evidencia-se que apenas aproximadamente 15% dos doentes reportou algum agravamento dos seus sintomas e/ou recorreu a terapêutica de resgate.
Cerca de 1/5 dos doentes que agravaram tinha sensibilização polínica, referindo também agravamento dos sintomas no mesmo período do ano anterior. Destes, cerca de 60% estavam previamente sem qualquer terapêutica diária de manutenção. Esta informação está em linha com muitos dos estudos publicados que referem melhoria dos sintomas alérgicos com redução da necessidade de terapêutica de manutenção1,7,25.
O facto do agravamento de sintomas e terapêutica de resgate utilizada (durante a suspensão da ITSCA e após o seu reinício) terem sido avaliados apenas por questionário verbal não estruturado e por diferentes profissionais de saúde, é uma limitação deste estudo. Outras limitações deste estudo são o facto de não terem sido utilizados scores de sintomas para a rinite e/ou asma, não ter sido realizada uma avaliação comparativa de reações locais ou sistémicas no período anterior à suspensão da ITSCA, e o facto dos períodos de pausa terem sido muito variáveis na população estudada.
Em caso de novo EE voltar a imperar com nova suspensão da administração da ITSCA, é importante reconhecer as falhas e adaptar à realidade, reorganizar procedimentos e circuitos, uniformizar a avaliação do agravamento de sintomas e da necessidade de redução de doses de acordo com o protocolo preestabelecido, de forma a que, mesmo em contexto pandémico, os doentes consigam manter a sua patologia alérgica controlada e, assim, evitar recorrer aos cuidados de saúde, como até então se conseguiu.
CONCLUSÕES
Com todas as limitações impostas para o controlo da pandemia, bem como o desvio de recursos humanos para a avaliação de doentes COVID, o acompanhamento dos doentes crónicos foi grandemente afetado, podendo pôr em causa o controlo das suas patologias, nomeadamente a doença alérgica.
A grande maioria dos doentes teve um intervalo de suspensão superior ao período do EE, mas apenas 15% reportou agravamento dos seus sintomas alérgicos e recorreu a terapêutica de resgate. O facto de se terem registado apenas um pequeno número de reações locais imediatas demonstra a segurança do protocolo utilizado no reajuste de dose na retoma da ITSCA. Verificou-se ainda que a maioria dos doentes que agravou os sintomas alérgicos estavam previamente controlados sem terapêutica diária, expressando a boa eficácia clínica da ITSCA, que se manteve apesar da interrupção.
A retoma da ITSCA durante a época polínica e a maior prudência dos profissionais de saúde na decisão da dose a administrar após a interrupção face a uma situação até então pouco conhecida, levou a reduções de dose superiores ao esperado, de acordo com o nosso protocolo.
No presente estudo, o atraso na administração da ITSCA não demonstrou impacto significativo na eficácia e segurança da imunoterapia dos doentes, mas tal pode não se verificar noutros centros. Pela incerteza do que se poderá vir a repetir no futuro, é importante uniformizar e estandardizar protocolos de atuação, não só a nível nacional, mas também mundial.
Mais estudos serão necessários para comparar os eventos ocorridos nesta época específica com outros em períodos homólogos.