A CONDIÇÃO CUTÂNEA E A SUA EXPRESSÃO NA ALERGIA CANINA, FELINA E EQUINA
A principal motivação para consulta de cães e gatos alérgicos relaciona-se com o prurido. A pele apresenta-se eritematosa e pode mesmo desenvolver várias complicações, como alopecia e infeções secundárias. Manifestações digestivas e cutâneas de reação adversa a alimentos1-7, dermatite alérgica às pulgas7-10, rinite, conjuntivite, otite10 e asma, especialmente em gatos, assim como agravamento invernal da dermatite em indivíduos sensibilizados a fungos ou a ácaros11-14 ou alergia primaveril a pólenes são também condições bem conhecidas nos nossos animais8.
A dermatite alérgica em cães e gatos pode configurar, fundamentalmente, i) dermatite atópica; ii) alergia alimentar; iii) dermatite alérgica às pulgas; iv) dermatite a Malassezia pachidermatis ou v) dermatite de contacto15. A dermatite atópica, quer humana (DAh) quer canina (DAc), pode também apresentar várias semelhanças5,7,16,17.
O tipo de lesões cutâneas mais frequentemente observadas, as áreas predominantemente atingidas e os critérios de diagnóstico vêm sendo extensamente debatidos, desde a década de 19806,18,19-23,24. Globalmente, a dermatite alérgica consiste numa inflamação crónica da pele, de base genética, frequentemente hereditária, englobando alterações das funções da barreira cutânea e infeções secundárias por Staphylococcus e Malassezia na pele e nos ouvidos e hipersensibilidade a alergénios ambientais, alimentares, de Staphylococcus e/ou de Malassezia7.
No que respeita à DAc, esta engloba um conjunto de manifestações cutâneas, consequentes ao contacto com
as espécies alergénicas a que os indivíduos se encontram sensibilizados, na sequência de uma acrescida predisposição de base genética25, sendo que as áreas do corpo mais afetadas são os membros, o abdómen, as axilas, os ouvidos, a região perilabial e a zona perianal5,10. A prevalência das áreas afetadas varia entre as raças mais suscetíveis26.
Na vertente atópica, a dermatite considera-se, assim, uma condição com predisposição genética, com características clínicas definidas, associadas a resposta IgE, mais frequentemente dirigida contra alergénios ambientais5-7,25,27. No seu enquadramento, a DAc não é vista como uma entidade única, mas como uma síndrome clínica25. Podem também considerar-se casos sintomatologicamente análogos, em que não é possível demonstrar a implicação da IgE, quer por testes intradérmicos, quer por serologia, recebendo a designação de dermatite do tipo atópico7,20,28. Não está perfeitamente esclarecido se o tratamento antipruriginoso em animais atópicos apresentará efeitos equivalentes em animais com dermatite do tipo atópico, em virtude da diferença de mecanismos potencialmente associados ao desencadeamento de manifestações clínicas.
Para além da componente genética, a DAc é igualmente reflexo do contexto ambiental que envolve o animal.
Assim, perante dois animais com semelhante predisposição genética para aquela condição, se, no ambiente de um deles estiverem presentes os alergénios sensibilizantes e no do outro não, o primeiro sensibilizar-se-á, podendo desenvolver dermatite atópica. De igual modo, perante uma pressão alergénica ambiental superior, mais cedo poderá ocorrer sensibilização com desencadeamento de manifestações clínicas de DAc(7.
De acordo com Nutall et al.7), observou-se que cães da raça Labrador apresentavam uma probabilidade de cerca de 50% de desenvolver dermatite atópica. Verificou-se ainda que, se ambos os progenitores apresentassem dermatite atópica, a probabilidade seria elevada, sendo moderada se só um dos progenitores apresentasse e baixa se ambos os progenitores fossem livres de dermatite atópica.
Ainda se debate se se pode considerar a existência de dermatite atópica em gatos. Com efeito, em gatos ocorre dermatite alérgica desencadeada por alergénios ambientais, mediada por IgE, porém sem clara diferenciação clínica relativamente a dermatite por outras causas.
Sobre as alterações da barreira cutânea em gatos com sintomatologia de enquadramento atópico sabe-se relativamente pouco, tendo-se, conceptualmente, dividido a dermatite alérgica felina em três subgrupos: i) induzido pela picada de pulga; ii) induzido pela alimentação e iii) induzido por agentes ambientais25.
Os cavalos podem, igualmente, apresentar manifestações atópicas, mediadas por IgE, podendo desenvolver sinais cutâneos ou respiratórios. Nos equinos a dermatite alérgica encontra-se frequentemente associada à picada de insetos, especialmente culicoides. Tal como nos cães e nos humanos, também nos equinos se observou uma acrescida prevalência de alterações ultraestruturais cutâneas, ao nível da estrutura lamelar lipídica, epidérmica, com desorganização do estrato córneo, associada a alteração da barreira cutânea. No caso canino, as alterações da barreira cutânea, frequentemente associadas a dermatite atópica, apresentam elevada similaridade com o que ocorre na espécie humana25.
A BARREIRA CUTÂNEA E OS FATORES IMPLICADOS
A constituição lipídica e proteica
Para o desenvolvimento da DAc, defeitos na constituição lipídica e proteica da pele, agravados pela inflamação, poderão contribuir para a diminuição da função de barreira, favorecendo a penetração dos alergénios em profundidade, com estimulação da resposta imunitária, o que configura a hipótese outside/inside, do paradigma etiopatogénico outside/inside - inside/outsider6,28,29.
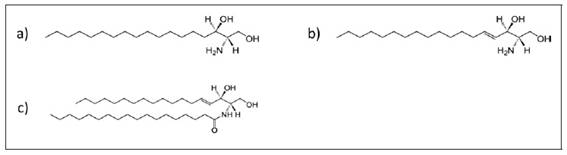
Na epiderme, o estrato granuloso produz corpos lamelares, contendo lípidos estruturais, como ceramidas, ácidos gordos e colesterol6, e enzimas responsáveis pela diferenciação das células epiteliais. Fisiologicamente, os corpos lamelares são direcionados para o espaço extracelular e formam “pilhas” organizadas, as lamelas. Num modelo da estrutura da epiderme canina, em que as células epiteliais sejam vistas como tijolos e os lípidos e proteínas intercelulares como cimento, aquelas lamelas parecem contribuir, de forma crucial, para o efeito de barreira cutânea, fundamental para prevenir a perda de água e o acesso dos alergénios às camadas mais profundas da pele29, onde poderão contactar com as células apresentadoras de antigénios e desencadear os mecanismos imunomediados de sensibilização30 e de alergia31. A excessiva perda de água cutânea pode estar, também, relacionada com o estado de maior penetrabilidade da barreira cutânea aos alergénios, pois sabe-se que cães atópicos apresentam maior perda de água cutânea por evaporação, do que os não atópicos, conduzindo a estados de desidratação e irritação da pele, associados a défice da função da respetiva barreira6,32,33. Com efeito, a medição da perda transepidérmica de água pode mesmo ser utilizada para estimar a função da barreira cutânea6,34,35. Adicionalmente observou-se que cães com dermatite atópica apresentam défice cutâneo de ceramidas, um tipo de lípidos constituinte importante das lamelas, as quais se apresentam, nesses casos, deficitárias e com um arranjo claramente desorganizado6,33,36. Fundamentalmente as ceramidas derivam da esfingosina, um esfingolípido que tem como base o aminoálcool esfinganina.
Esta é oxidada a esfingosina, o composto base dos esfingolípidos, que, para além de um álcool insaturado, é uma base de cadeia longa com dez átomos de carbono e uma função amina. A esfingosina, ao estabelecer, através da sua função amina, uma ligação amida com um ácido gordo, transforma-se numa ceramida, o principal esfingolipido6,27,37 (Figura 1). No estrato córneo da pele os esfingolípidos contribuem, então, para o efeito cutâneo de barreira, regulando a perda transepidérmica de água27.
Diferentes estudos demonstraram a diminuição das ceramidas em pele saudável e lesionada em cães atópicos, associada a i) aumento de perda transepidérmica de água, com diminuição do efeito de barreira da pele; ii) alteração na expressão da filagrina; e iii) aumento da expressão de enzimas envolvidas no metabolismo da filagrina e o aumento da perda transepidérmica de água parece ser mais evidente em indivíduos atópicos, contribuindo para um défice superior da barreira cutânea7,25,27.
De uma forma geral aceita-se que o défice da barreira cutânea, observado sobretudo em animais atópicos, conduz a secura da pele, redução da tolerância ao prurido, aumento de perda transepidérmica de água, com redução da hidratação cutânea e elevação do pH25. Em cães atópicos, ou seja, com predisposição para se sensibilizarem e desenvolverem alergia, a distribuição das lesões de dermatite atópica poderá estar relacionada com o defeito primário da barreira cutânea, mais evidente nesses locais, e não apenas com o maior contacto com os alergénios, nesses pontos. A pele clinicamente sã de cães atópicos também revela alterações na secreção do corpo lamelar e na camada celular lamelar, quando comparada com a de cães não atópicos, e o estabelecimento e agravamento de lesões acentuam aquelas alterações, nomeadamente por aumento dos espaços intercelulares, libertação e destacamento de corpos lamelares e desorganização das lamelas lipídicas29.
Num estudo desenvolvido por Hightower et al.32 observou-se que Beagles atópicos, sensibilizados a ácaros do pó doméstico, apresentavam alteração da função de barreira cutânea nas “áreas atópicas”, que essas alterações eram mais evidentes em indivíduos jovens e que eram agravadas pela exposição aos alergénios. Nos indivíduos jovens essa exposição resultou numa perda transepidérmica de água acrescida nas “áreas atópicas”, à semelhança do observado em estudos realizados em humanos, onde a perda transepidérmica de água se revelou aumentada em casos de dermatite atópica e correlacionada com o nível da resposta clínica. A idade parece estar, também, relacionada com a perda transepidérmica de água, com cães mais jovens a apresentarem níveis superiores, como sucede em humanos, onde as crianças apresentam igualmente níveis mais elevados, suportando a hipótese de que a sensibilização de indivíduos predispostos deverá iniciar-se logo na fase juvenil32.
Noutro estudo, levado a cabo por Lau-Gillard et al.34 verificou-se que a perda transepidérmica de água era significativamente maior em cães atópicos, quer em zonas lesionadas, quer não lesionadas, comparativamente a animais saudáveis não atópicos. Quanto ao teor de colesterol e de ácidos gordos livres, não se observaram variações significativas entre atópicos e não atópicos. Relativamente ao teor de ceramidas no extrato córneo da pele dos atópicos em áreas lesionadas ou não, este foi significativamente menor do que nos não atópicos. Nos animais atópicos observou-se uma correlação negativa entre a perda transepidérmica de água e o teor de ceramidas, quer nas áreas lesionadas, quer não, sugerindo que, como na espécie humana, uma diminuição do conteúdo em ceramidas acelera a perda transepidérmica de água. Dessa forma, na DAc, como observado na DAh, a diminuição do teor de ceramidas intercelulares pode estar relacionada com o défice da função de barreira cutânea38-40.
Com efeito, em 2017 Marsella & Benedetto25 demonstraram que a aplicação tópica de suplementos contendo ceramidas contribui para o restauro da composição lipídica do estrato córneo, com a consequente melhoria dos sinais clínicos em cães atópicos, o que viria também a ser avançado por Nuttall et al. em 2019(7).
Noutro estudo levado a cabo por Santoro et al.41 demonstrou-se que a diminuição da expressão de filagrina, mesmo em animais saudáveis, expostos a ácaros do pó doméstico, aumentava a probabilidade de diminuição do efeito de barreira cutâneo. Também no estudo levado a cabo por Pin et al.42 com biópsias cutâneas obtidas da região dorsal e almofadas plantares em cães saudáveis das raças Beagle, Golden Retriever e Labrador, avaliadas por imunoistoquímica e por immunoblotting, após extração proteica, verificou-se que, ao nível da pele do dorso, quando comparada com a humana, a filagrina distribuía-se pelo citoplasma granular do estrato granuloso e pelo estrato córneo profundo a nível inter e intrafolicular, na epiderme. Resultado semelhante foi observado ao nível das almofadas plantares, onde a camada granular é mais espessa, sendo mais facilmente identificável.
Neste estudo selecionaram ainda quatro anticorpos monoclonais específicos para filagrina de cão e um para corneodesmosina, facilitando a caracterização dessas moléculas com relevância na constituição da barreira cutânea. Observou-se também que, em cultura celular, ao adicionarem-se citocinas pró-inflamatórias do tipo Th2, ocorria um grande decréscimo da imunomarcação para filagrina. Verificou-se igualmente que, quer a sequência quer a estrutura da filagrina podem variar significativamente entre raças e mesmo entre indivíduos.
Neste estudo, a colocação de um patch epicutâneo com ácaros do pó doméstico em Beagle atópico mostrou-se associada à redução da expressão de filagrina, revelando que a ação alergénica direta pode interferir com a respetiva expressão e, consequentemente, com a saúde da barreira cutânea. Comparativamente ao humano observou-se que a distribuição das proteínas cutâneas é essencialmente similar à do cão10,42, sugerindo que ambas as espécies possam servir mutuamente de modelo da barreira cutânea.
A resposta imunitária
A diminuição do efeito de barreira cutânea, assim como a inflamação e a alergia, encontram-se intimamente relacionadas. As alterações cutâneas de caráter inflamatório, associadas à predominância de citocinas do tipo Th2, contribuem para a diminuição da função de barreira cutânea, promovendo a sensibilização ao permitir uma maior penetração dos alergénios em profundidade na pele6,7,25, observando-se ainda um comprometimento da expressão de filagrina por ação de citocinas do tipo Th2, como IL-4, IL-13 e IL-22, especialmente prevalentes em lesões agudas da pele de cães atópicos7.
Experimentalmente, verificou-se também que animais com défice do estrato córneo se sensibilizavam mais rapidamente perante um alergénio e apresentavam maior produção de IgE do que animais com o estrato córneo preservado. Face a um défice do estrato córneo, a exposição alergénica vai levar a uma maior migração das células de Langerhans, com subsequente apresentação antigénica, predominando uma resposta Th2, o que demonstra a importância da barreira cutânea na proteção relativamente à sensibilização alergénica7,25.
Existe também evidência de uma maior produção cutânea de linfopoietina estromal tímica (LpET) em cães atópicos em resposta a microrganismos, o que resulta numa promoção da resposta Th2 e modulação da resposta de células dendríticas, aquando da exposição alergénica. O aumento da expressão de LpET poderá ser devido a estimulação por Staphylococcus, via recetores toll-like7,25.
Num estudo sobre a imunomodulação da secreção de citocinas na pele por extratos de ácaros do pó doméstico, Arlian & Morgan43 observaram que moléculas daquelas espécies alergénicas eram capazes de induzir o aumento de múltiplas citocinas pró-inflamatórias e de quimiocinas dos queratinócitos epidérmicos e dos fibroblastos dérmicos. Observaram ainda uma associação negativa entre medidas de evicção relativamente aos ácaros e a indução de inflamação, sugerindo-se em termos profiláticos uma intensiva aspiração de peças de mobiliário estofado e de carpetes, e a lavagem de roupas e camas para remover ácaros e seus produtos alergénicos. Para além da observação de uma maior penetração em profundidade na epiderme e na derme de moléculas alergénicas de ácaros, associada a defeitos na barreira cutânea, observou-se também que diferentes alergénios de ácaros não apresentavam o mesmo comportamento na pele.
Assim, os alergénios do grupo 1, proteases da cisteína, e os dos grupos 3, 6 e 9, proteases da serina, juntamente com produtos com marcada ação detergente e substâncias abrasivas, tendem a provocar danos na barreira cutânea, favorecendo a penetração dos alergénios na epiderme profunda e na derme, onde poderão originar sensibilização e subsequente alergia. Relativamente ao ácaro Dermatophagoides farinae, o alergénio recombinante Der f 1, uma protease da cisteína, tem demonstrado reduzir a barreira cutânea. Por outro lado, outros alergénios de Dermatophagpoides pteronyssinus, como as peptidases da serina, foram associados a défice da respiração celular, uma vez que conduzem a uma obstrução das junções epiteliais. Extratos de D. farinae e de D. pteronyssinus, embora contendo proteases da serina, provocam predominantemente alteração ao nível do crescimento das células epiteliais e uma diminuição da adesão entre elas43.
Estas alterações facilitam a penetração de moléculas em profundidade, podendo promover a inflamação e a resposta imunitária, sobretudo a nível da derme, mediadas por citocinas, as quais vão estimular queratinócitos, fibroblastos e células do endotélio microvascular, células de Langerhans, linfócitos, monócitos/macrófagos, neutrófilos e eosinófilos. A estimulação de queratinócitos e fibroblastos levará à secreção de múltiplas citocinas promotoras da inflamação cutânea. Observou-se também que várias das moléculas libertadas pelos ácaros do pó doméstico estimulavam, elas próprias, a secreção de citocinas. Também os extratos de ácaros do pó doméstico como D. farinae e D. pteronyssinus revelaram capacidade de estimulação de culturas de queratinócitos, induzindo a secreção de citocinas, associada ao extravasamento de leucócitos durante a inflamação. Além disso, induzem a secreção de citocinas como IL-6 e IL-8, de MCP-1 e CCL2, e de fator de estimulação de colónias de macrófagos (M-CSF) em culturas de fibroblastos. A resposta de queratinócitos e fibroblastos é igualmente importante na progressão da inflamação e da resposta imunitária, e na manifestação da dermatite atópica43.
Segundo Einhorn et al.44, o simples facto de um animal se encontrar exposto aos ácaros do pó doméstico poderá contribuir também para uma alteração da barreira cutânea. Para além disso, verificaram que a inflamação cutânea e a ação de produtos com efeito detergente promovem um défice da barreira cutânea, conduzindo a uma maior permeabilidade aos alergénios de ácaros do pó doméstico, o que, por sua vez, conduz a uma maior diminuição do efeito de barreira, como consequência da ação enzimática local, favorecendo a sensibilização.
Para além de se verificar que a implementação de medidas de evicção para ácaros do pó doméstico, com a consequente redução do contacto a nível cutâneo, reduzia a gravidade da dermatite atópica em indivíduos sensibilizados, observou-se ainda que diferentes espécies de ácaros induziam diferentes respostas cutâneas. Em termos de concentração de endotoxinas verificou-se a seguinte hierarquia: Euroglyphus maynei > D. farinae > D. pteronyssinus, enquanto em termos da resposta de citocinas a hierarquia identificada foi: D. pteronyssinus > E. maynei > D. farinae. Estas observações permitiram inferir que a indução de resposta não estará especialmente relacionada com as endotoxinas, mas com as proteases presentes nos extratos de ácaro. Observou-se também que aqueles três ácaros induziam a secreção de citocinas pró-inflamatórias IL-1α, mas que os níveis de indução eram muito mais elevados por D. pteronyssinus e por E. maynei que por D. farinae. Essa secreção é induzida nos queratinócitos, o que contribui para a inflamação da pele. No entanto, considerando que estas observações foram realizadas em culturas celulares, poderão ocorrer algumas diferenças relativamente ao ecossistema cutâneo43.
O microbioma cutâneo
Também a flora microbiana na pele pode ser de especial relevância para diminuir a incidência de sensibilização e alergia, em virtude de a diversidade do microbioma cutâneo (microrganismos e seu material genético) se revelar importante para “educar” o sistema imunitário adaptativo da pele e para dificultar o crescimento de microrganismos patogénicos. Uma diminuição da diversidade do microbioma cutâneo pode estar relacionada com inflamação crónica da pele, em associação com doença alérgica. A diminuição da exposição ao microbioma vai criar uma desregulação dos recetores Th2 e o desenvolvimento de alergia6,25, verificando-se que animais atópicos apresentavam menor biodiversidade e maior prevalência de Staphylococcus coagulase positivo, quando comparados com animais saudáveis6,27. Persiste, no entanto, a dúvida de se o agravamento da DAc se poderá ficar a dever à disbiose ou se a mesma se produz devido ao desenvolvimento de Staphylococcus consequente ao défice na barreira cutânea7,25.
Assim, um domínio que deverá observar importante desenvolvimento também em medicina veterinária, visando a qualidade das barreiras epiteliais, num contexto profilático para sensibilização e alergia, é o da saúde do microbioma cutâneo e intestinal45,46.
Segundo Rafaels et al.47 mutações relacionadas com a filagrina estão fortemente associadas à dermatite atópica e à sua gravidade, observando-se também uma predisposição para a colonização por S. aureus, devida à diminuição da filagrina e dos seus produtos com propriedades antiestafilocócicas, com a mutação R501-X da molécula de filagrina a afetar a suscetibilidade para a colonização cutânea por S. aureus nas suas fases iniciais. No entanto, perante quadros graves de dermatite atópica, esta mutação não apresentou associação com variação na suscetibilidade.
Um estudo realizado por Pierezan et al.45 identificou que alterações inerentes ao desenvolvimento das lesões cutâneas associadas a disbiose bacteriana podem persistir durante semanas após a recuperação clínica em cães sensibilizados a ácaros do pó doméstico. Foi também demonstrado que Staphylococcus pseudintermedius desempenha um papel importante naquela disbiose bacteriana10,45.
Para além de um aumento da predisposição para infeções por S. pseudointermedius, também se verificou um aumento de infeções secundárias por Malassezia sp. na pele e ouvidos em cães com dermatite atópica, devido ao défice de resposta imunitária inata da pele, à diminuição do efeito de barreira cutânea e à própria inflamação desenvolvida em resposta aos microrganismos10.
A abordagem terapêutica
Já em 1991 Holleran et al.48 apontavam para o papel das ceramidas do estrato córneo da pele de mamíferos,
como essencial à sua função de barreira. Em 2008, Piekutowska et al.49 viriam a demonstrar a vantagem da aplicação tópica de um complexo lipídico na melhoria da estrutura intercelular do extrato córneo, levando à produção de lípidos lamelares e ao preenchimento dos espaços intercelulares com lípidos lamelares formados de novo. Em 2011, Fujimura et al.50 verificaram uma diminuição significativa da gravidade clínica da dermatite atópica no cão, através da terceira versão do Canine Atopic Dermatitis Extent and Severity Index (CADESI-03) modificado, na sequência da aplicação tópica de um complexo lipídico cutâneo, ainda que não em monoterapia. Nesse contexto, novos tratamentos tópicos destinados a melhorar a barreira cutânea têm-se revelado muito positivos no tratamento da DAc, em conjugação com os protocolos clássicos (Figura 2).

Figura 2 Fotomicrografias eletrónicas do extrato córneo da pele de cão atópico: a) Lamelas lipídicas raras e desorganizadas; b) Reconstituição da estrutura lamelar, na sequência de tratamento tópico com preparado contendo fitoesfingosina (imagens gentilmente cedidas por Laboratórios Sogeval, Laval, França)
Em 2010, a task force internacional para a dermatite atópica canina havia já publicado um conjunto de diretivas clínicas, práticas, para o tratamento da dermatite atópica canina51. Uma das abordagens terapêuticas vantajosas consiste na realização de banhos semanais, com aplicação durante 10 minutos de um champô contendo lípidos, glúcidos complexos e antisséticos, e que conduzirá em 24h a um alívio de cerca de 25% dos scores de prurido.
Esta lavagem favorece a remoção das causas de irritação e sensibilização cutâneas, podendo ainda fornecer lípidos reconstituintes do extrato córneo e promover adicionalmente a hidratação e o efeito de barreira, pela deposição de “filmes” cutâneos protetores. De facto, alguns produtos tópicos emolientes, baseados em misturas de lípidos, vêm demonstrando contribuir para a restauração da estrutura organizada de lípidos cutâneos5. Também pela incorporação de substâncias especificamente antisséticas, ou mesmo por ação de lípidos como a esfingosina, uma pró-ceramida, pode promover-se a redução da carga microbiana e combater processos de infeção superficial, com inegáveis vantagens para a saúde da pele5,52.
A toma de ácidos gordos essenciais, especialmente ómega-6, como o ácido linoleico, apresenta também efeitos positivos, melhorando o estado da pele e do pelo, e desfavorecendo a perda transepidérmica de água53. Dietas especificamente ricas em ácidos gordos essenciais contribuirão igualmente para a melhoria da condição da barreira cutânea, sem que tenha sido identificada superioridade de qualquer marca específica52. Em todo o caso, só é previsível que a suplementação com ácidos gordos essenciais demonstre efeitos positivos máximos após cerca de dois meses54,55, pelo que, em termos de monoterapia, tem sido considerada insuficiente51. A utilização de suplementos alimentares com outros nutrientes, como pantotenato, inositol, nicotinamida, colina e histidina (protocolo PINCH) demonstrou contribuir para aumentar a síntese cutânea de ceramidas e diminuir a perda transepidérmica de água em animais saudáveis7,56.
Novos estudos deverão confirmar a eficácia clínica desses suplementos na DAc51. Para além do tratamento mais direcionado ao restabelecimento da barreira cutânea, importa referir a importância do controlo sintomatológico, reservando-se atualmente especial relevo para fármacos de controlo da IL-31, cujo papel no desencadeamento do prurido é bem conhecido. São eles o oclacitinib (apoquel; zoetis, EUA) um inibidor da janus quinase 1 e o lokivetmab (cytopoint; Zoetis, EUA) um anticorpo monoclonal, caninizado, anti-IL-317,10.
De acordo com Marsella et al.27, a utilização tópica de glicosaminoglicanos (GAG) e ácido hialurónico mostrou-se favorável no controlo do prurido e da perda transepidérmica de água em animais com dermatite atópica ao fim de 4-8 semanas de tratamento.
Na vertente imunoalergológica deve sempre considerar-se a hipótese da abordagem com imunoterapia específica após a identificação das espécies alergénicas sensibilizantes implicadas, dispondo-se atualmente de diferentes protocolos vacinais, quer para animais, quer para humanos, constituindo presentemente a opção com potencial curativo, através do recondicionamento da resposta imunitária57,58.
Uma perspetiva ambiental
Numa perspetiva profilática, mais propriamente no que respeita às medidas de evicção ambiental, para além daquelas já clássicas, uma atenção especial deve ser concedida ao efeito de fatores como a poluição e as alterações climáticas sobre as barreiras epiteliais e a carga alergizante.
Segundo Cecchi et al.59, o aumento da prevalência de alergia, observado nas últimas décadas, explica-se exclusivamente pelas mudanças ambientais que vêm ocorrendo, considerando que, de entre um expossoma externo, aeroalergénios de interior e exterior, bem como poluentes, apresentam um papel-chave na etiopatogenia da resposta inflamatória aos alergénios, com as consequentes manifestações alérgicas. Avançaram mesmo que fatores civilizacionais, como emissões poluentes, urbanização, perdade biodiversidade e alterações climáticas, associadas a variações da concentração de aeroalergénios, se encontram entre os principais desafios para a saúde e qualidade de vida de um cada vez maior número de alérgicos. Condições como o agravamento de quadros asmatiformes na iminência de tempestades no período pré-precipitação, as quais vêm sendo cada vez mais frequentes e de maiores consequências, podem dever-se à ação de campos elétricos que levam à rotura de grãos polínicos, com a maior disponibilidade de alergénios moleculares e o consequente agravamento sintomatológico.
A nível das barreiras epiteliais, um repetido contacto com alguns agentes poluentes parece predispor para um acréscimo de sensibilização e alergia, ao promover a rotura das junções intercelulares, contribuindo para a diminuição do efeito de barreira, que permite uma maior taxa de penetração de alergénios em profundidade60.
Também as alterações climáticas, sobretudo no que ao aquecimento global respeita, vêm levando a situações de maior carga polínica e mais cedo, e de espécies ante-riormente infrequentes em determinadas latitudes, favorecendo novos padrões de agravamento alérgico. A concomitância de situações de poluição, agravando o défice da barreira epitelial, com inflamação, e de uma superior prevalência de aeroalergénios, pode resultar particularmente gravosa para a saúde60,61.