INTRODUÇÃO
Estudos metagenómicos revelaram que diversos e complexos ecossistemas microbianos coabitam na pele e são conhecidos coletivamente como microbioma cutâneo1. Nos últimos anos, o estudo da composição do microbioma cutâneo tem sido alvo de interesse científico, pelo que, além da relevância da caracterização do microbioma da pele de indivíduos saudáveis, importa conhecer a composição do microbioma em doenças cutâneas, como é o caso da DA. Esta é uma doença complexa e multifatorial que afeta crianças e adultos e se caracteriza pela presença de xerose e prurido cutâneos, recorrência das queixas e distribuição característica das lesões de acordo com a faixa etária2.
Para a patofisiologia da DA contribuem fatores ambientais e do hospedeiro, que interagem entre si, sendo o microbioma cutâneo um dos fatores ambientais mais importantes3. A avaliação do microbioma cutâneo nestes doentes tem demonstrado uma alteração da composição microbiana comparativamente a pessoas saudáveis, essencialmente com diminuição da diversidade microbiana e aumento de estirpes estafilocócicas, o que se torna mais evidente na presença de exacerbações da doença4.
Atualmente dispomos de várias intervenções terapêuticas com o objetivo de tratar e controlar a DA, nomeadamente emolientes, corticoides tópicos e inibidores da calcineurina tópicos, imunossupressores, fototerapia e imunomoduladores. Existem ainda terapêuticas menos utilizadas, mas que têm demonstrado efeito benéfico no controlo da doença, como é o caso da utilização de têxteis funcionais com propriedades antisséticas, recursos naturais, como a climatoterapia e a realização de banhos com hipoclorito de sódio. A mais recente evidência científica demonstra que a maioria destes tratamentos tem impacto significativo ao nível do microbioma cutâneo, pelo que o rumo atual é o de avaliar a utilidade da modulação direta do microbioma da pele - através da utilização de probióticos orais ou tópicos, aplicação tópica de antimicrobianos ou transplantes autólogos/heterólogos de microbioma - com o intuito de controlar a doença cutânea.
O objetivo deste artigo de revisão é o de resumir a evidência existente até ao momento relativamente à patofisiologia da DA e no que respeita à composição do microbioma cutâneo em humanos saudáveis e doentes com DA, avaliando de que forma as várias abordagens terapêuticas existentes para a doença contribuem para a modulação do microbioma cutâneo. Por outro lado, será ainda avaliado o potencial terapêutico e mesmo preventivo do microbioma cutâneo no desenvolvimento de DA.
O MICROBIOMA CUTÂNEO
A pele é o maior órgão do corpo humano e encontra‑se colonizada por uma variedade de comunidades microbianas que são influenciadas por múltiplos fatores. A epiderme e a derme contêm diferentes comunidades com funções distintas, sendo que o ambiente tem um impacto mais amplo nas comunidades das camadas mais superficiais5. Novas ferramentas moleculares têm permitido identificar e caracterizar as comunidades microbianas (a microbiota), bem como a identificação genómica de todos os microrganismos presentes num determinado ambiente (o microbioma). A caracterização do microbioma cutâneo teve início em 1950 e tem crescido nos últimos anos, assim como a sua importância na patofisiologia de várias doenças, como é o caso da DA3,6. De uma maneira geral, o microbioma cutâneo é composto essencialmente por membros dos mesmos quatro filos que compõem o microbioma intestinal, embora com abundâncias relativas diferentes, sendo eles: bacteroidetes, firmicutes, actinobacteria e proteobacteria2. A região do corpo revela‑se importante no que respeita às espécies mais prevalentes, sendo que as espécies de Propionibacterium predominam em regiões sebáceas, como é o caso da região frontal (face), área retroauricular e no dorso, ao passo que as espécies de Staphylococcus e Corynebacterium predominam em regiões húmidas, como a zona axilar4. A Tabela 1 pretende resumir as principais características do microbioma intestinal e cutâneo de um individuo saudável.
Tabela 1 Principais características do microbioma intestinal e cutâneo (Adaptado 7).
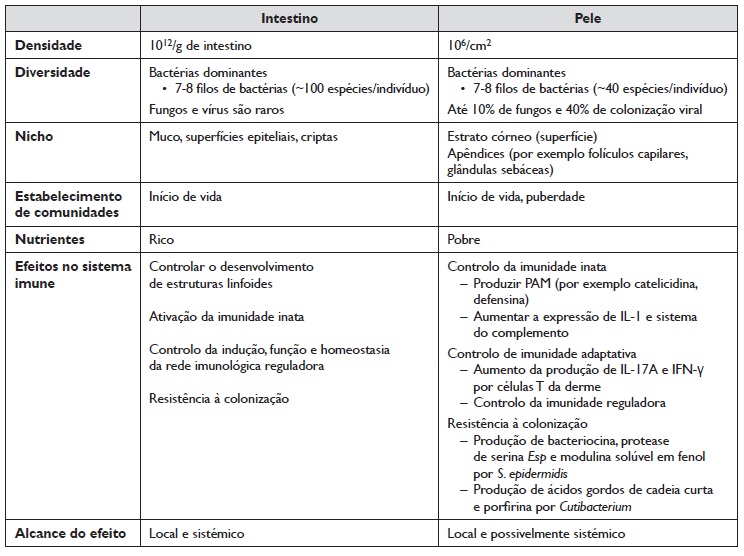
PAM: Peptídeo antimicrobiano; IFN: Interferão; IL: Interleucina; S. epidermidis: Staphylococcus epidermidis
Variação do microbioma cutâneo em função da idade
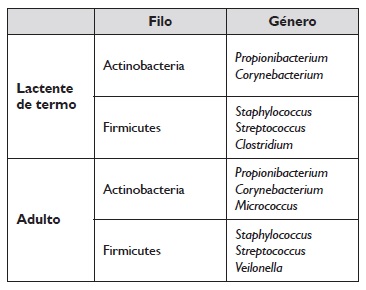
Os estudos têm demonstrado uma variação do microbioma cutâneo em função da idade8. De uma maneira geral, a diversidade bacteriana é superior nas crianças, sendo que o filo firmicutes (especificamente os géneros Staphylococcus e Streptococcus) predomina, seguido dos filos actinobacteria, proteobacteria e bacteroidetes9,10,11.
Por outro lado, os adultos apresentam por ordem decrescente um predomínio de bactérias dos filos actinobacteria, firmicutes, proteobacteria e bacteroidetes, sendo os géneros Propionibacterium, Corynebacterium, Staphylococcus e Streptococous os mais prevalentes9,11,12.
Um estudo conduzido por Oh et al., que caracterizou o microbioma da pele e das narinas de crianças e adultos saudáveis observou diferenças significativas na abundância relativa dos diferentes filos bacterianos de acordo com a escala de maturidade sexual de Tanner. Os autores encontraram um predomínio de firmicutes, bacteroidetes e proteobacteria nas crianças (estadio 1 de desenvolvimento de Tanner) comparativamente aos adultos (estádio 5 de desenvolvimento de Tanner), em que as actinobactérias predominam13.
Embora a composição microbiana da pele de indivíduos saudáveis permaneça bastante estável durante a idade adulta, pensa‑se que mudanças fisiológicas relacionadas com a idade - particularmente alterações na secreção de sebo, diminuição da produção de suor e alterações da imunidade - possam afetar o microbioma cutâneo de indivíduos mais velhos, com uma diminuição da diversidade microbiana associada ao envelhecimento, particularmente no sexo feminino8,14. A composição do microbioma pode ainda variar de acordo com a etnia ou a raça, embora as alterações cutâneas fisiológicas pareçam ser mais determinantes(8). A Tabela 2 resume a composição bacteriana predominante de lactentes de termo (com 1 a 3 meses de vida) e de adultos.
Tabela 2 Composição bacteriana predominante do microbioma cutâneo em lactentes de termo (com 1 a 3 meses de vida) e adultos (Adaptado (9)).
PATOGÉNESE DE DERMATITE ATÓPICA
A dermatite atópica (DA) é uma doença inflamatória crónica cutânea que afeta cerca de 10‑20% das crianças e 2-10% dos adultos em países desenvolvidos15. Clinicamente a doença manifesta‑se por xerose, prurido cutâneo e aparecimento de lesões com localização diferente consoante a faixa etária e características clínicas variáveis de acordo com a duração16. As lesões típicas de fase aguda consistem em erupções eritematosas, papulovesiculares, exsudativas e com crosta que evoluem, na fase crónica, para lesões descamativas, por vezes com liquenificação cutânea17. Tipicamente na primeira infância, a DA poupa a região da fralda, podendo atingir a restante superfície corporal; na adolescência, o envolvimento dos membros é o mais habitual, com particular destaque para as regiões flexoras. Na idade adulta, as lesões de eczema localizam‑se sobretudo nas porções distais dos membros (mãos e pés), superfície flexora dos membros e região cervical16,17.
A patofisiologia da doença é complexa e resulta da interação entre fatores do hospedeiro e ambientais, que desempenham papéis essenciais no desenvolvimento e modulação da doença: alterações estruturais da barreira cutânea, predisposição genética, desregulação imunológica com predomínio de inflamação T helper do tipo 2 (Th2), além de fatores externos, como exposição alergénica, clima, consumo tabágico e microbioma cutâneo4,18.
As influências relativas e temporais de todos estes mecanismos podem explicar a heterogeneidade clínica observada entre os doentes2.
Fatores do hospedeiro
Desregulação imunológica e inflamação
A inflamação cutânea é um mecanismo central na patofisiologia da DA16. O perfil inflamatório é complexo e variado, incluindo inicialmente ativação de células dendríticas inflamatórias residentes na pele, células linfoides inatas e células de Langerhans. As lesões cutâneas de DA apresentam tipicamente um infiltrado celular constituído maioritariamente por células Th2, bem como células dendríticas.
Contudo, a pele sem lesões também apresenta alterações estruturais e inflamatórias, como espongiose (acumulação anormal de fluido intercelular) e infiltração de células T, semelhantes às regiões com lesões, embora de forma mais subtil19.
As alterações da barreira cutânea, que serão abordadas em maior detalhe mais à frente nesta revisão, permitem a extensão de projeções das células dendríticas com o fim de se ligarem e apresentarem antigénios20. Em simultâneo, os queratinócitos da epiderme lesionada libertam sinais pró‑inflamatórios conhecidos vulgarmente por alarminas e que incluem quimiocinas, IL‑1β, IL‑33 e linfopoietina do estroma tímico (TSLP), que contribuem para o agravamento da lesão tecidular, recrutamento de células inflamatórias Th2 e ativação de células linfoides inatas de tipo 2 residentes na pele, que por sua vez produzem IL‑5 e IL‑13 que ativam eosinófilos e células Th221.
Por sua vez, as células Th2 ativadas libertam IL‑ 4 e IL‑13, promovendo a diferenciação de células B em plasmócitos e a produção de anticorpos do tipo IgE22.
Várias interleucinas envolvidas na resposta imunológica Th2, como IL‑4, IL‑13, IL‑31 e IL‑33 regulam negativamente a produção de várias proteínas de barreira epidérmica (vide infra)23. Além disso, ocorre uma diminuição da produção de lípidos do estrato córneo induzida pela inflamação Th2, como é o caso das ceramidas e dos ácidos gordos de cadeia longa23. Da mesma forma, os mediadores inflamatórios Th2, em particular IL‑4, IL‑13 e IL‑31, bem como o TSLP libertado pelos queratinócitos, ativam diretamente neurónios sensitivos presentes na epiderme e derme, contribuindo para a patogénese do prurido2,16.
Apesar do padrão inflamatório predominante ser Th2, existe evidência da ativação de células Th22, Th1 e Th17, cuja importância na patogénese da DA ainda não está completamente esclarecida24,25. Estes grupos celulares foram descritos mais frequentemente em lesões cutâneas crónicas, particularmente em crianças e indivíduos de ascendência asiática, mas a sua utilização como alvo terapêutico na DA atualmente não parece ser eficaz25,26.
Estão a decorrer ensaios clínicos com novos fármacos imunomoduladores que pretendem atuar nos vários intervenientes do processo inflamatório da doença2.
Por último, alterações na imunidade inata, nomeadamente redução da modulação imunológica por células natural killer (NK) parece ser outro mecanismo associado à patogénese da DA23. Recentemente, um estudo de Mack et al. demonstrou níveis diminuídos de células NK no sangue periférico numa grande proporção de doentes adultos com DA moderada a grave comparativamente aos controlos27. Tendo em conta estes resultados, os autores propuseram um modelo em ratinhos em que a estimulação da migração e ativação de células NK através da IL‑15 (ou
de um agonista da mesma) permitiria aumentar a actividade destas células a nível da epiderme, resultando numa inibição da resposta imunológica do tipo 2. Não existem, até ao momento, fármacos em desenvolvimento que atuem nesta via inflamatória, podendo ser uma opção de investigação futura. A Figura 1 pretende resumir os mecanismos imunológicos envolvidos na patofisiologia da DA.
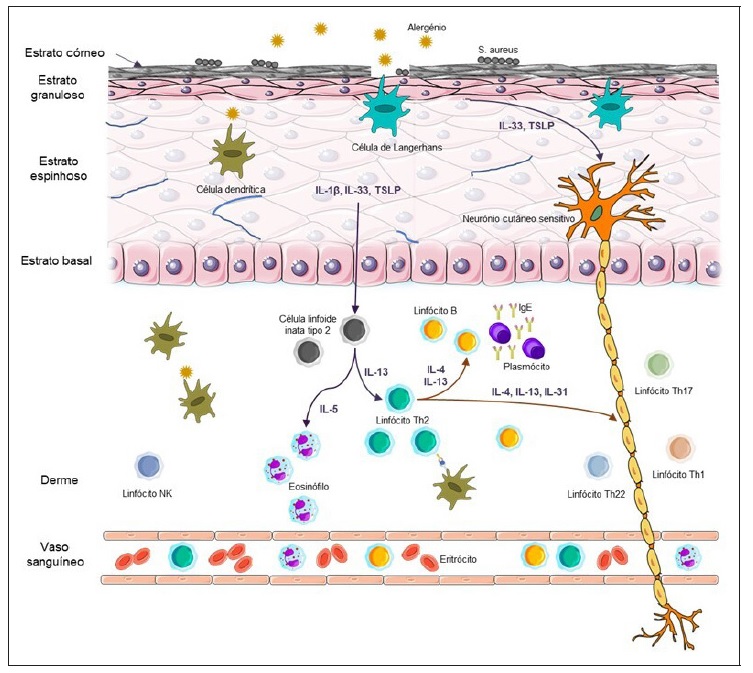
Figura 1 Mecanismos imunológicos envolvidos na patofisiologia da dermatite atópica. De uma forma geral, ocorre disfunção da barreira epidérmica com subsequente redução da diversidade do microbioma cutâneo e aumento de estirpes de Staphylococcus aureus. Nas zonas com lesões, células de Langerhans, células dendríticas epidérmicas inflamatórias e células dendríticas dérmicas absorvem alergénios e antigénios. Em simultâneo, os queratinócitos da epiderme lesionada libertam alarminas como quimiocinas, IL‑1β, IL‑33 e linfopoietina do estroma tímico, que contribuem para o agravamento da lesão tecidular, recrutamento de células inflamatórias Th2 e ativação de células linfoides inatas de tipo 2 residentes na pele, que por sua vez produzem IL‑5 e IL‑13 que ativam eosinófilos e células Th2. As células Th2 ativadas libertam IL‑4 e IL‑13, promovendo a diferenciação de linfócitos B em plasmócitos e produção de anticorpos do tipo IgE(22). Da mesma forma, os mediadores inflamatórios Th2, em particular IL‑4, IL‑13 e IL‑31, bem como o TSLP e IL‑33 libertados pelos queratinócitos ativam diretamente neurónios sensitivos presentes na epiderme e derme, contribuindo para a patogénese do prurido. Apesar do padrão inflamatório predominante ser Th2, existe evidência da ativação de células Th22, Th1 e Th17, principalmente em lesões crónicas. A espongiose (acumulação de fluido intercelular), diminuição de ceramidas e ácidos gordos de cadeia longa no estrato córneo, bem como a diminuição de células NK na derme, são outras alterações presentes nesta doença. IL: Interleucina; NK: Natural killer; S. aureus: Staphylococcus aureus; TSLP: Linfopoietina do estroma tímico; Th1: T‑helper 1; Th2: T‑helper 2; Th17: T‑helper 17; Th22: T‑helper 22.
Predisposição genética
A presença de história familiar de doença atópica, particularmente DA, é um fator de risco importante para o desenvolvimento da doença. Sabe‑se que a DA tem herdabilidade na ordem dos 75% em gémeos28 e estudos de associação genómica identificaram 34 loci que cumulativamente representam cerca de 20% desta hereditariedade29. Não foram identificadas variantes genéticas funcionais na maioria destes loci, embora estas regiões do genoma contenham vários genes associados à resposta imunológica Th2, ativação da imunidade inata, bem como codificação de proteínas da barreira cutânea30.
Por outro lado, o mais importante fator de risco genético identificado diz respeito a mutações da proteína filagrina (FLG), codificada pelo gene com a mesma designação (FLG)30,31. A FLG é uma proteína-chave na estrutura do estrato córneo, garantindo uma barreira cutânea resistente e rígida, pelo que mutações da FLG resultam na perda da integridade da barreira cutânea32. Além disso, conferem um risco três a cinco vezes superior de desenvolvimento de DA comparativamente a indivíduos sem mutação, predispondo ainda ao desenvolvimento de asma e alergia alimentar, por exemplo ao amendoim33. Alguns autores defendem que as mutações da FLG se associam a maior gravidade da DA, início mais precoce da doença e maior risco de infeções, como eczema herpético31,32.
Embora a mutação da FLG seja muito importante na patogénese da DA, apenas se encontra presente em 20‑40% dos doentes, sugerindo a importância de outros fatores genéticos no desenvolvimento da DA34. De facto, polimorfismos de vários genes da via imunológica estão associados a um risco aumentado de DA por aumento da resposta Th223. Polimorfismos com ganho de função dos genes que codificam respetivamente a IL‑4 e a IL‑13 reduzem a expressão de FLG, o que contribui para defeitos da barreira cutânea31. Outros genes com mutações identificadas que contribuem para o desenvolvimento da DA incluem os responsáveis pela expressão de IL‑31, IL‑33, recetores da IL‑4 e IL‑13, bem como TSLP23.
Alterações da barreira cutânea
A disfunção da barreira epidérmica é observada de forma consistente em zonas com e sem lesões de doentes com DA e pode ser mediada quer por mecanismos primários, como mutações da FLG, quer por mecanismos secundários, de entre os quais diminuição da expressão de proteínas estruturais epidérmicas e/ou lípidos em resposta à inflamação Th2, e o ciclo “prurido‑lesões de coceira”, conhecido em inglês por itch-scratch cycle2. Podem ser observadas várias alterações a nível da barreira cutânea: redução da expressão de proteínas estruturais relacionadas com a diferenciação epidérmica, alteração da composição lipídica cutânea, disrupção das junções apertadas epiteliais e alteração do microbioma cutâneo, com maior abundância de S. aureus. Estas alterações levam ao aumento da perda de água transepidérmica, do pH e da permeabilidade cutânea, bem como a um aumento da suscetibilidade a infeções23.
Por um lado, as alterações primárias da barreira cutânea facilitam o contacto com os alergénios, a libertação de alarminas pelos queratinócitos e o desenvolvimento subsequente de uma resposta inflamatória maioritariamente de tipo 22. Por outro lado, a inflamação Th2 presente contribui para a disrupção do mecanismo de barreira: regulando negativamente a produção de proteínas de barreira epidérmica, incluindo FLG, queratinas, loricrina, involucrina e moléculas de adesão celular23; causando diminuição da quantidade de ceramidas e ácidos gordos de cadeia longa que constituem a matriz lipídica cutânea4,23; e diminuindo a produção de peptídeos antimicrobianos pelos queratinócitos (incluindo catelicidina [LL‑37] e β‑defensinas), fundamentais na defesa contra infeções e com importância adicional na regulação da inflamação e na regeneração epidérmicas23. O ato de coçar em resposta ao prurido frequentemente percepcionado pelos doentes provoca disrupção da barreira cutânea e aumento dos mediadores inflamatórios. Estes, por conseguinte, ativam diretamente neurónios aferentes presentes na epiderme e derme, agravando a sensação de prurido e perpetuando o ciclo “prurido‑lesões de coceira”16.
Fatores ambientais
Alergénios
Os defeitos de barreira cutânea presentes na DA facilitam o contacto com alergénios, sendo que a inflamação Th2 contribui de forma significativa para o mecanismo de sensibilização alérgica2. Atualmente sabe‑se que em alguns fenótipos de DA existe uma resposta imune a alergénios mediada por IgE e por células T, bem como através de alterações na imunidade inata e na função da barreira cutânea, dado alguns alergénios possuírem propriedades que facilitam a rotura da barreira e a sensibilização cutânea4. Os aeroalergénios (como ácaros do pó doméstico, pólenes e epitélios de animais), bem como alergénios alimentares (como é o caso do ovo e das proteínas do leite de vaca), parecem poder causar exacerbações da DA17.
A utilização de imunoterapia específica para os aeroalergénios em causa apresenta efeitos benéficos no que concerne ao controlo da DA. Porém, relativamente aos alergénios alimentares, não há evidência de que as medidas de evicção alimentar na presença de sensibilização alérgica se traduzam num melhor controlo da doença.
Detergentes abrasivos
O pH ácido da pele humana contribui para o efeito de barreira contra vários antigénios e serve como agente antibacteriano. No doente com DA, tanto a pele sã como as lesões de DA evidenciam disfunção da barreira cutânea, com subsequente aumento do pH (como referimos), com perda destes mecanismos antimicrobianos.
Os sabonetes e outros detergentes abrasivos contribuem para o aumento do pH cutâneo, bem como aumento da permeabilidade paracelular e dos níveis de IL‑33 e TSLP, além de originarem emulsificação lipídica na superfície da pele35,36. Estes aspetos, no seu conjunto, são factores agravantes da doença, exacerbando os defeitos da barreira cutânea.
Clima e tabagismo
Fatores externos como humidade, temperatura e sensibilidade aos raios ultravioleta (UV) condicionam o aparecimento de lesões cutâneas de DA36. A combinação de elevadas temperaturas com alta intensidade de UV (como é o caso da fototerapia, que será abordada mais à frente nesta revisão) tende a ter um efeito protetor no desenvolvimento de lesões, ao passo que o aumento da humidade e da precipitação estão correlacionadas com um impacto progressivo na DA37. O tabagismo ativo não foi considerado um fator de risco na DA, porém o tabagismo materno foi identificado como um fator de risco em crianças com a doença36.
Microbioma cutâneo
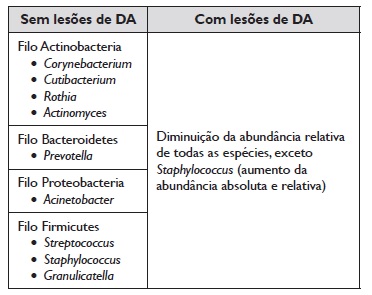
Nos últimos anos, a possibilidade de examinar comunidades microbianas completas através de tecnologias avançadas de sequenciamento de ADN permitiu demonstrar que os doentes com DA apresentam uma diminuição da diversidade microbiana cutânea31. Verifica‑se que a diversidade bacteriana da pele de doentes com DA diminui à medida que aumenta a gravidade da doença e na presença de exacerbações, o que se traduz numa diminuição da abundância absoluta e relativa de diferentes espécies bacterianas e ao aumento significativo de estirpes de estafilococos, nomeadamente S. aureus38. O S. aureus é habitualmente isolado na pele de doentes com DA, com prevalência estimada entre 30% a 100%, variando de acordo com a idade do doente, a gravidade da DA, o tamanho da amostra avaliada e os métodos de detecção bacteriana2. Esta bactéria tem a capacidade de produzir superantigénios (enterotoxinas A, B e C e toxina‑1 da síndrome do choque tóxico), que estimulam a produção de IgE específica para S. aureus, ativam e estimulam linfócitos B e T e macrófagos, aumentam a produção de quimiocinas, responsáveis por aumentar o recrutamento de células inflamatórias para a derme, reduzem a actividade imunossupressora de células T reguladoras e ainda são responsáveis por induzir resistência aos corticoides, dificultando o tratamento da DA4,16,25,39. Além do aumento absoluto de S. aureus, o microbioma cutâneo de doentes com DA apresenta outras alterações. Um estudo prospetivo de Kong et al. com avaliação do microbioma cutâneo de 12 crianças com DA moderada a grave (classificação de acordo com o SCORAD, Scoring Atopic Dermatitis) e 11 crianças saudáveis demonstrou que a abundância de géneros bacterianos de Veillonella (firmicutes), Prevotella (bacteroidetes), Porphyromonas (bacteroidetes), Leptotrichia (fusobacteria) e Agrobacterium (proteobacteria) é menor na DA grave e na presença de exacerbações, sendo que o tratamento tópico (com corticoides, inibidores da calcineurina e antibacterianos) levou a um aumento significativo da diversidade microbiana40. Os autores referem ainda que as estirpes de S. aureus e Staphylococcus epidermidis (S. epidermidis) aumentaram significativamente durante as exacerbações da doença e que o tratamento tópico se associou a uma diminuição da abundância relativa de S. aureus por aumento da diversidade microbiana. Relativamente a este estudo, importa referir que o aumento da diversidade microbiana pós‑tratamento tópico se associou a um aumento de espécies de Corynebacterium40. Zheng et al. avaliou o microbioma cutâneo de 48 lactentes com DA ligeira a grave (classificação de acordo com o EASI, Eczema Area and Severity Index) e 20 controlos saudáveis, dos 0 aos 12 meses de idade. Os autores demonstraram que a diversidade microbiana era menor nos doentes com DA grave e que a composição microbiana dos controlos era mais estável comparativamente à dos lactentes com DA41. Observou‑se ainda uma diminuição significativa da abundância absoluta dos filos bacteroidetes e fusobacteria com o aumento da gravidade da doença, ao passo que o género Corynebacterium (actinobacteria) aumentou. Por outro lado, a avaliação do microbioma das lesões periorais dos lactentes com DA demonstrou maior colonização pelo filo firmicutes (Streptococcus foi o género dominante) nessas regiões, seguido em abundância por proteobacteria, actinobacteria e bacteroidetes. O tratamento das lesões com emoliente e corticoide tópico associou‑se a uma melhoria do EASI, aumento da diversidade microbiana e redução da abundância de espécies de Staphylococcus41. Contrariamente ao estudo de Kong et al., neste estudo os autores interpretaram o aumento de Corynebacterium como associado à DA mais grave. Serão necessários mais estudos no sentido de avaliar a importância deste género bacteriano na patofisiologia da DA.
Tal como referido, existem diferenças no microbioma cutâneo dependentes da idade, que também se verificam em doentes com DA. Shi et al. conduziu um estudo que avaliou o microbioma cutâneo de 68 controlos (3 a 59 anos) e 128 doentes com DA, incluindo 59 crianças (2 a 12 anos), 13 adolescentes (13 a 17 anos) e 56 adultos (18 a 62 anos). Os autores verificaram que, na pele sem lesões, as crianças com DA apresentavam maior diversidade microbiana comparativamente aos adolescentes e aos adultos, ao passo que as regiões com lesões de DA apresentavam diminuição significativa da diversidade microbiana em todas as faixas etárias11. Relativamente a este estudo, os autores não descrevem a etnia/raça dos participantes e apenas referem que o mesmo decorreu num hospital em Los Angeles.
Por fim, verifica‑se ainda que a presença de mutações da FLG tem implicações no microbioma cutâneo, dado que doentes que expressam mutações com perda de função da FLG apresentam menor diversidade microbiana e maior abundância de estirpes de S. aureus no microbioma cutâneo, comparativamente a doentes sem a mutação31,32.
Por outro lado, convém relembrar que a inflamação Th2 predominante nesta doença inibe a produção de peptídeos antimicrobianos pelos queratinócitos, o que também contribui para uma maior predisposição à colonização por S. aureus4. Deste modo, é importante não esquecer que a DA é uma doença multifatorial, e a relação causal entre a disbiose e a DA ainda não está totalmente esclarecida, sendo difícil distinguir eventos primários que levam ao desenvolvimento de DA dos eventos secundários resultantes da própria doença2.
A maioria da evidência científica atual centra a sua atenção nas bactérias constituintes do microbioma cutâneo.
Contudo, outros organismos, incluindo leveduras, têm provavelmente papéis substanciais, nomeadamente do género Malassezia2. Sparber et al. desenvolveu um modelo em ratinhos em que a colonização da pele dos animais por Malassezia spp. se associou ao aumento da produção de IL‑17 e IL‑2342. Serão necessários estudos em humanos no sentido de avaliar o papel destes fungos no microbioma cutâneo. A Tabela 3 resume as principais variações do microbioma cutâneo nos doentes com DA, respetivamente na presença e ausência de lesões cutâneas.
MICROBIOMA CUTÂNEO COMO POTENCIAL PREVENTIVO E TERAPÊUTICO NA ABORDAGEM DA DERMATITE ATÓPICA
O tratamento da DA passa, em primeiro lugar, pela utilização diária de creme emoliente, que irá permitir restabelecer a barreira cutânea2. Na presença de exacerbações, torna‑se necessário recorrer a terapêuticas anti‑inflamatórias, nomeadamente corticoides e inibidores da calcineurina tópicos. Em casos mais graves, pode ser necessário utilizar imunossupressores sistémicos, como corticoides, azatioprina, metotrexato e ciclosporina, embora apresentem efeitos adversos indesejáveis com a sua utilização crónica16. Nos últimos anos, surgiram imunomoduladores para o tratamento de várias doenças alérgicas, como é o caso do dupilumab, anticorpo monoclonal anti‑IL‑4 e IL‑13, aprovado para utilização nas formas de DA moderada a grave a partir dos 6 anos de idade2,43. Existem ainda terapêuticas da DA menos utilizadas, porém com efeito benéfico no controlo da doença, como é o caso da utilização de têxteis funcionais com propriedades antisséticas, recursos naturais como a climatoterapia e a realização de banhos com hipoclorito de sódio44‑46.
O estudo do microbioma cutâneo de doentes submetidos às diversas intervenções terapêuticas tem demonstrado um impacto significativo a este nível, pelo que também se têm desenvolvido estratégias de modulação direta do microbioma da pele, nomeadamente utilizando probióticos orais ou tópicos, antimicrobianos tópicos ou transplantes autólogos/heterólogos de microbioma. De seguida, será feita uma revisão da evidência existente, até ao momento, do efeito das terapêuticas ao nível do microbioma cutâneo dos doentes com DA, bem como o potencial preventivo e/ou terapêutico do microbioma na abordagem da doença.
Medidas gerais
É fundamental adotar uma rotina diária de cuidado da pele no tratamento da DA. Os doentes são aconselhados a tomar banhos de água morna, utilizando de preferência agentes de limpeza com ação hidratante, evitando sabonetes abrasivos e agentes perfumados, que poderão irritar a pele e agravar o prurido, a disidrose e a xerose36.
Além disso, a limpeza da pele deverá ser realizada com uma toalha suave de algodão, seguindo‑se a aplicação de creme emoliente para evitar a desidratação e xerose após o banho.
Relativamente aos efeitos a nível do microbioma cutâneo, Capone et al. realizaram um ensaio clínico randomizado com 61 doentes caucasianos com DA ligeira a moderada (de acordo com o EASI) e idades compreendidas entre os 16 e os 50 anos, randomizados para utilização de um emoliente contendo 1% de aveia coloidal durante 14 dias, versus aplicação de um emoliente padrão47. Os autores verificaram que a utilização do emoliente de aveia se associou a uma diminuição do SCORAD em 54% e do score EASI em 51%, diminuição do pH cutâneo e menor prevalência de espécies de Staphylococcus, com maior diversidade de microbioma nos locais com lesões47. O papel preventivo dos emolientes no desenvolvimento da DA através da modulação do microbioma cutâneo permanece pouco esclarecido. Glatz et al. Realizou um estudo de casos‑controlos que comparou parâmetros fisiológicos de barreira cutânea, desenvolvimento de DA e as sequências genéticas de RNA 16S ribossómico bacteriano de amostras da região jugal e das regiões anterior e posterior do antebraço, em 23 lactentes com seis meses de idade e história familiar de atopia, a quem foi aplicado diariamente emoliente (n=11), desde as três semanas de vida, versus ausência de aplicação (n=12)48. Neste estudo, os autores observaram que o grupo tratado com emoliente apresentou pH cutâneo inferior ao grupo-controlo, bem como uma maior diversidade bacteriana, nomeadamente com maior proporção de Streptococcus salivarius48. McClanahan et al. conduziu um ensaio clínico com 100 lactentes de termo com risco de desenvolver DA (considerado na presença de história familiar de primeiro grau de DA, asma ou rinite alérgica), randomizados para aplicação diária de emoliente contendo manteiga de karité e ceramida, desde as três semanas de vida versus ausência de aplicação diária49. Os autores verificaram uma tendência a favor da intervenção, isto é, a DA foi diagnosticada aos 12 meses de vida em 13,2% no grupo de intervenção versus 25,0% no grupo-controlo, embora os resultados não tenham sido significativos. Não houve diferenças significativas entre os grupos nas avaliações de barreira cutânea ou do microbioma49. Finalmente, um ensaio clínico de Simpson et al. avaliou o desenvolvimento de DA em 20 lactentes com história familiar de 1.º grau de doença alérgica (asma, rinite alérgica ou DA), em quem foi aplicado diariamente um emoliente (Cetaphil™)50. A avaliação aos 24 meses de idade demonstrou que apenas três lactentes tinham DA, com idade média de diagnóstico aos 11 meses. Neste estudo, não foi avaliada a composição do microbioma.
Por outro lado, o recurso a têxteis funcionais (têxteis com propriedades potencialmente antibacterianas e imunomoduladoras) também tem sido abordado.
Estes têxteis envolvem a impregnação de sais de prata e outros nanopolímeros, embora a maioria dos estudos possua limitações que impossibilitam a recomendação formal da sua utilização de forma generalizada46.
Lopes et al. conduziu um ensaio clínico com 102 doentes caucasianos com DA e idades compreendidas entre os 18 e os 34 anos, randomizados em grupo-controlo e grupo-intervenção, em que foram utilizados pijamas impregnados com quitosano, um biopolímero natural com propriedades imunomoduladoras e antimicrobianas, durante oito semanas51. Os autores observaram uma melhoria significativa do SCORAD em 43,8% no grupo intervencionado e no grupo-placebo em 16,5%; e melhoria no índice de qualidade de vida dermatológico, mas sem significância estatística na comparação entre os grupos51. Verificou‑se um aumento significativo do número total de Staphylococci no grupo de intervenção.
Tratamentos tópicos
Relativamente a fármacos tópicos, o tratamento com corticoide tópico tem demonstrado efeitos benéficos ao nível do microbioma cutâneo. Stalder et al. levou a cabo um estudo randomizado envolvendo 40 crianças com DA, com idades compreendidas entre 4,5 meses e 15 anos, que comparou a colonização de S. aureus no grupo‑intervenção que utilizou desonida tópica, versus o grupo‑controlo que utilizou placebo52. Os autores observaram que o tratamento com corticoide levou a uma melhoria significativa dos sintomas de xerose, eritema, descamação e escoriação cutânea (p<0,001), redução do prurido (p<0,01) e diminuição da densidade de S. aureus (p<0,001), com um aumento de bactérias comensais típicas da pele saudável, tais como Streptococcus, Propionibacterium e Corynebacterium52. A utilização de inibidores da calcineurina tópicos também se associou a alterações do microbioma: um estudo de Wongpiyabovorn et al. demonstrou que a aplicação tópica diária de tacrolimus durante quatro semanas em nove doentes asiáticos com DA versus 12 controlos saudáveis (idades entre 15 e 38 anos) resultou no aumento da diversidade microbiana no primeiro grupo, com aumento das espécies de Dermacoccus, Pseudomonas, Corynebacterium, Proteus, Micrococcus luteus e Lactococcus53.
Não foram encontrados estudos do efeito do crisaborole tópico (inibidor da fosfodiesterase 4 utilizado no tratamento tópico da DA) no microbioma cutâneo. Por outro lado, estão atualmente em desenvolvimento terapêuticas anti‑inflamatórias tópicas que atuam através da inibição da via JAK (Janus kinase) e do recetor de hidrocarboneto arílico (AhR, Aryl hydrocarbon Receptor), mas que ainda não apresentam dados relativos ao seu papel no microbioma. Imunossupressores.
Os autores não encontraram artigos científicos com avaliação, em humanos, das alterações no microbioma cutâneo por ação de imunossupressores utilizados no tratamento da DA, nomeadamente ciclosporina, azatioprina e metotrexato.
Imunomoduladores
Os fármacos imunomoduladores atualmente aprovados para o tratamento de formas graves de DA apresentam efeito ao nível do microbioma cutâneo. Relativamente ao dupilumab, Callewaert et al. pretendeu avaliar qual o efeito do fármaco na colonização da pele por S. aureus e na diversidade microbiana43. Para isso, foram colhidas zaragatoas de regiões com lesões e sem lesões de DA provenientes de 54 doentes adultos com DA moderada a grave (classificação de acordo com o EASI), randomizados para tratamento com dupilumab (400 mg de dose inicial, seguidos de 200 mg semanais) ou tratamento placebo, durante 16 semanas. Previamente ao tratamento, a pele com lesões possuía menor diversidade microbiana e maior abundância absoluta de S. aureus, comparativamente às regiões sem lesões. O tratamento com dupilumab associou‑se a uma tendência para melhoria clínica do EASI, aumento significativo da diversidade microbiana e diminuição significativa da abundância absoluta e relativa de S. aureus nas regiões com e sem lesões, comparativamente ao grupo placebo43.
Estão a decorrer vários ensaios clínicos utilizando novos imunomoduladores no tratamento da DA, tendo como alvo diferentes intervenientes no processo patofisiológico da doença: interleucinas envolvidas na resposta imune Th2 e Th22, fármacos que atuam como antipruriginosos e terapêuticas anti‑inflamatórias.
Não existe evidência, até ao momento, do efeito destas terapêuticas no microbioma cutâneo. Da mesma forma, os ensaios clínicos recentemente publicados relativos aos inibidores da via da JAK aprovados no tratamento da DA grave, baricitinib e upadacitinib, não avaliam os efeitos a nível do microbioma cutâneo.
Outras terapêuticas
Atualmente existem outras terapêuticas utilizadas no tratamento de doentes com DA cujo efeito ao nível do microbioma cutâneo tem sido estudado, nomeadamente banhos intermitentes com hipoclorito de sódio, mupirocina intranasal e fototerapia. Huang et al. conduziu um ensaio clínico em idade pediátrica com 31 doentes com DA moderada a grave (de acordo com o EASI) e idades compreendidas entre os seis meses e os 17 anos, randomizados para aplicação intranasal de mupirocina e banhos de hipoclorito de sódio versus tratamento placebo, durante três meses54. Os autores demonstraram uma diminuição significativa da gravidade da doença comparativamente ao grupo-controlo, contudo não foram avaliadas as características do microbioma cutâneo. Um estudo conduzido por Gonzalez et al. contou com a participação de 21 crianças com DA moderada a grave (idades compreendidas entre três meses e cinco anos; classificação de acordo com o EASI), randomizadas para utilização de propionato de fluticasona tópico isoladamente ou em associação com banhos intermitentes de hipoclorito de sódio, durante quatro semanas, versus um grupo‑controlo com 14 crianças saudáveis45. Os autores observaram normalização da composição bacteriana nas regiões de pele com lesões de DA, tornando‑se similar à pele sem lesões, bem como aumento da diversidade microbiana em ambos os grupos intervencionados e assemelhando‑se à composição dos controlos45.
Relativamente à fototerapia, Silva et al. realizou um estudo em idade pediátrica com 10 doentes com DA moderada a grave (de acordo com o SCORAD) e 10 crianças com vitiligo, todos com idades compreendidas entre os nove e os dez anos55. Os autores verificaram que a utilização de fototerapia UVB de banda estreita permitiu uma redução significativa da contagem absoluta de S. aureus, com diminuição da capacidade de produção de enterotoxinas por este microrganismo55. Neste estudo, porém, não é referida a frequência nem a duração total do tratamento preconizado. Por outro lado, Dotterud et al. demonstrou que 20 tratamentos de fototerapia UVB durante quatro semanas em 20 adultos com DA se associou de forma não significativa a uma diminuição da abundância de S. aureus na pele56. Lossius et al., por sua vez, conduziu um ensaio com 16 adultos com DA sob fototerapia UVB três vezes por semana, durante seis a oito semanas, verificando‑se um aumento significativo da diversidade microbiana (p=0,013) nas regiões com lesões ativas(57. Não existem dados, até à data, dos efeitos no microbioma cutâneo da fototerapia com PUVA (Psoralen plus ultraviolet light therapy).
Outra abordagem complementar que pode interferir na composição do microbioma cutâneo consiste na utilização de recursos físicos com fins medicinais. A balneoterapia é uma técnica que consiste na imersão, total ou parcial, do corpo em água para fins terapêuticos e que tem sido utilizada no tratamento de várias doenças cutâneas.
A climatoterapia utiliza as propriedades curativas dos recursos naturais, isto é, das condições climatéricas (ar, temperatura, humidade, pressão atmosférica e exposição solar). Geralmente, verifica‑se a combinação da climatoterapia com a balneoterapia, de modo a obter melhores resultados. Ao longo dos anos, vários autores demonstraram o benefício destas terapêuticas numa variedade de patologias cutâneas, nomeadamente na dermatite seborreica, psoríase, acne e DA, sendo que actualmente os estudos tentam compreender os mecanismos subjacentes, sendo a modulação do microbioma um fator em destaque44. Após três semanas de climatoterapia e balneoterapia no Mar Morto, um estudo de Brandwein et al. com 35 doentes com DA moderada a grave (de acordo com o SCORAD) e 10 controlos, todos com idades compreendidas entre os 4 e os 53 anos, demonstrou uma alteração significativa do microbioma cutâneo nos doentes com DA grave, com redução significativa de Staphylococcus epidermidis, Streptococcus mitis e Micrococcus luteus nas lesões destes doentes58. Por sua vez, um ensaio clínico randomizado levado a cabo por Van Mierlo et al. teve como objetivo comparar o efeito terapêutico da climatoterapia nos Alpes suíços versus na Holanda, durante seis semanas, avaliando 79 doentes pediátricos (10 aos 15 anos) com DA refratária, definida pelos autores como dependência de corticoide tópico de média potência ou utilização de imunossupressor sistémico, ou terapêutica frequente com corticoide tópico de alta potência, ou história prévia de uso de terapêutica sistémica, ou significativo impacto da DA na qualidade de vida da criança ou da família, ou doença aparentemente sem resposta à terapêutica convencional59. Os autores demonstraram que as sessões de climatoterapia nos Alpes suíços se associaram a mudanças significativas no microbioma cutâneo, comparativamente ao clima moderado da Holanda, com redução significativa de espécies de Staphylococcus59. Neste estudo, porém, não foi avaliado o controlo da DA.
Atualmente, a realização de antibioterapia encontra‑se reservada para casos de infeção cutânea associada, não tendo demonstrado eficácia clínica como terapêutica da DA por si só2,4. Contudo, estudos mais recentes têm vindo a centrar‑se na utilização do microbioma cutâneo no tratamento da DA através de transplante autólogo/alogénico de microbioma, que se caracteriza pela aplicação tópica de uma formulação hidratante contendo espécies bacterianas com propriedades imunomoduladoras provenientes do próprio doente ou de um dador saudável60. Um estudo de Nakatsuji et al. analisou a utilidade do transplante autólogo de microbioma na diminuição do número de estirpes de S. aureus61. Em cinco doentes adultos com DA, as estirpes de S. epidermidis e Staphylococcus hominis foram colhidas de locais sem lesões, incubadas e cultivadas em meio apropriado e posteriormente foi aplicada, nas lesões de DA, uma formulação de creme hidratante contendo as espécies previamente cultivadas na concentração de 1x107 unidades formadoras de colónias (UFC)/cm2, o que diminuiu significativamente o número de estirpes de S. aureus no local da aplicação, após 24 horas61. Neste estudo, porém, não foi avaliado o SCORAD. Por sua vez, o ensaio clínico de Myles et al.demonstrou que o transplante alogénico de microbioma cutâneo contendo estirpes de Roseomonas mucosa provenientes de adultos saudáveis se associou a uma melhoria clínica do SCORAD, menor necessidade de corticoterapia tópica e diminuição da abundância de S. aureus nos 10 adultos e cinco crianças com DA intervencionados62. Atualmente encontra‑se em desenvolvimento um ensaio clínico que pretende avaliar a eficácia e a segurança da aplicação tópica de uma loção contendo microbioma autólogo em doentes adultos com DA moderada a grave (de acordo com o EASI), com o objetivo de a comercializar (NCT03151148).
Para além do microbioma cutâneo, pensa‑se que o microbioma intestinal poderá ser útil como abordagem terapêutica na DA. De facto, a evidência tem demonstrado que os doentes com DA apresentam, desde os primeiros anos de vida, menor diversidade microbiana intestinal, mais especificamente de espécies pertencentes aos géneros Bifidobacterium e Lactobacillus, importantes na modulação da inflamação sistémica39. Diversas estirpes de Bifidobacterium e Lactobacillus são capazes de interagir com o sistema imunológico, modulando a produção de citocinas Th1, inibindo a resposta Th2 e regulando a produção de células T reguladoras. A nível cutâneo, um estudo em ratinhos demonstrou que estirpes intestinais de Bifidobacterium longum promovem a produção de lípidos e peptídeos antimicrobianos pelos queratinócitos, o que contribui para a manutenção da integridade da barreira cutânea63. Não obstante, até ao momento a utilização de probióticos na terapêutica da DA é controversa. Enquanto uma revisão sistemática Cochrane de 2008 não revelou eficácia terapêutica do uso de probióticos orais na DA, uma meta‑análise de 2014 concluiu que os probióticos podem ajudar no tratamento de crianças e adultos com DA moderada a grave64. Este último estudo incluiu 25 ensaios clínicos randomizados que estudaram mais do dobro do número de doentes (n=1599), comparativamente à revisão anterior. Além disso, foi analisada a diferença média ponderada dos valores SCORAD e observou‑se que, embora os efeitos dos probióticos fossem significativos em crianças (p<0,001; idade superior a 12 meses) e adultos (p<0,001), a diferença média ponderada no SCORAD entre probióticos e placebo não foi significativa em lactentes com menos de 12 meses (p=0,63). Por outro lado, a análise de subgrupos demonstrou que foi observado maior efeito com mistura de diferentes espécies bacterianas, em oposição à utilização isolada de Lactobacillus ou Bifidobacterium. Nos últimos anos surgiram estudos baseados na aplicação tópica de probióticos com o objetivo de avaliar a sua eficácia terapêutica na DA65. Os probióticos tópicos demonstraram a capacidade de aumentar as ceramidas cutâneas, melhorar o eritema, descamação e o prurido e diminuir a concentração de S. aureus66,67. Um ensaio clínico realizado por Blanchet‑Réthoré et al. Demonstrou que a aplicação de uma loção hidratante contendo Lactobacillus johnsonii duas vezes por dia, durante três semanas,nas lesões de 31 doentes adultos com DA ligeira a moderada (de acordo com o SCORAD), resultou na redução da abundância absoluta de S. aureus, o que se correlacionou com uma diminuição da gravidade da doença com base no SCORAD66. Curiosamente, os doentes com maior colonização por S. aureus na fase inicial foram os que apresentaram melhor resposta clínica66.
Existem atualmente vários ensaios clínicos a decorrer que se focam na utilização de probióticos tópicos na DA. Totté et al. estão a desenvolver um ensaio clínico que pretende avaliar o efeito terapêutico da aplicação tópica de bacteriolisina, uma enzima com capacidade de dissolver a parede celular do S. aureus em 100 doentes adultos com DA moderada a grave (de acordo com o EASI) durante 12 meses68. A Tabela 4 pretende resumir as diferentes abordagens terapêuticas e preventivas da DA através da modulação do microbioma cutâneo.
Tabela 4 Diferentes abordagens terapêuticas e preventivas na dermatite atópica, com influência ao nível do microbioma cutâneo.
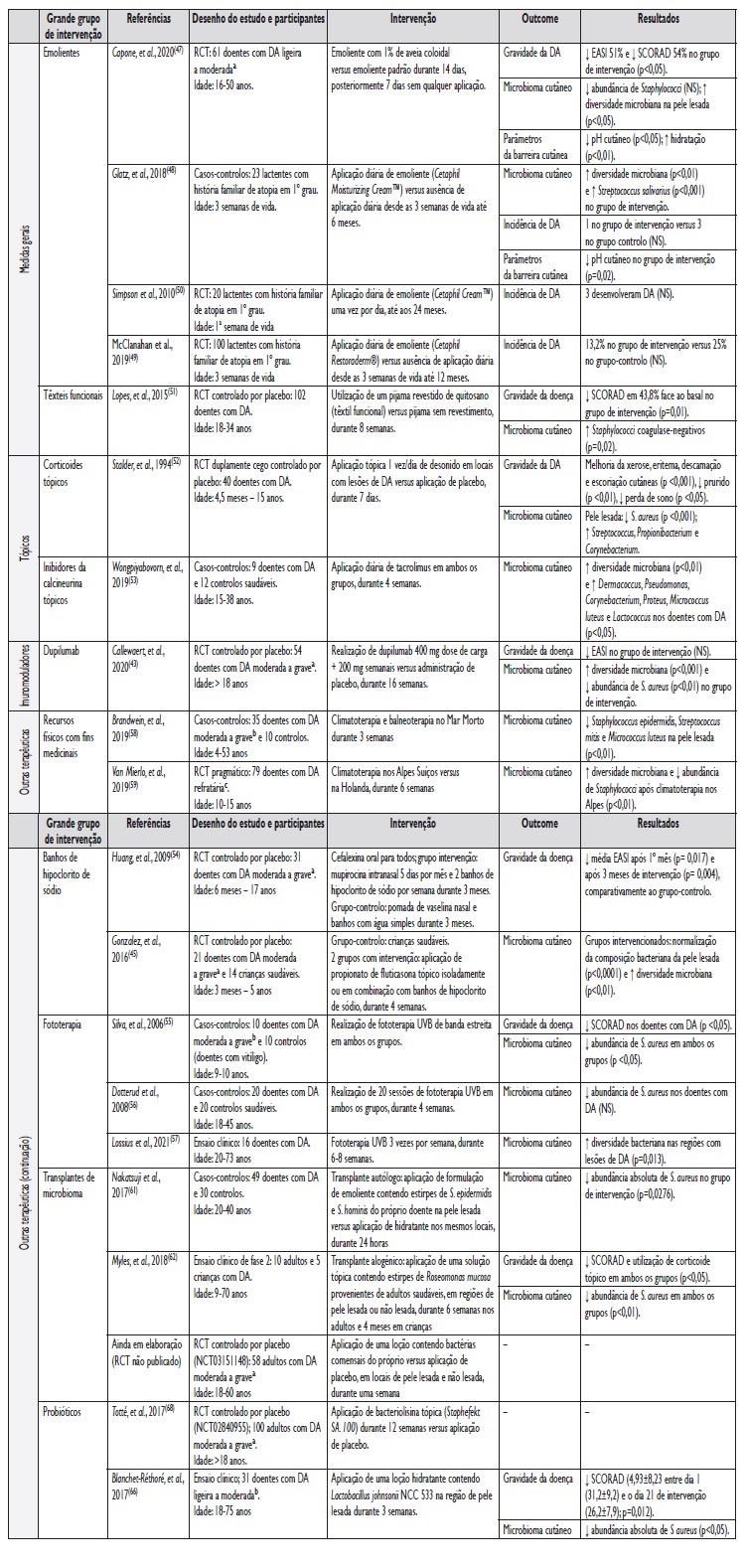
EASI - Eczema Area and Severity Index; SCORAD - Scoring Atopic Dermatitis; RCT - Randomized clinical trial; DA - Dermatite Atópica; NS - Não significativo; a Classificação de gravidade de acordo com o EASI. b Classificação de gravidade de acordo com o SCORAD; c Definida pelos autores como: dependência de corticoide tópico de média potência ou utilização de imunossupressor sistémico, ou terapêutica frequente com corticoide tópico de alta potência, ou história prévia de uso de terapêutica sistémica, ou significativo impacto da DA na qualidade de vida da criança ou da família, ou doença aparentemente sem resposta à terapêutica convencional (58).
DISCUSSÃO E PERSPETIVAS FUTURAS
Foi abordada, de uma forma geral, a evidência existente até ao momento do efeito no microbioma cutâneo das diversas terapêuticas utilizadas no controlo da DA.
A maioria dos resultados decorre de ensaios clínicos randomizados e de estudos prospetivos de casos‑controlos com um número reduzido de participantes.
Deste modo, serão necessários mais estudos, nomeadamente de vida real e com maior número de participantes, de forma a obter resultados mais robustos. Adicionalmente também se verifica que a metodologia varia consideravelmente entre os estudos, no que concerne à avaliação da gravidade da doença utilizando diferentes escalas de classificação, sendo que nem todos os estudos
avaliam o microbioma cutâneo, e naqueles em que existe essa avaliação os parâmetros variam - avaliação de diversidade versus quantificação de algumas espécies em específico. Além disso, há estudos nos quais os doentes com DA estavam sob outras terapêuticas além das que estavam a ser alvo de análise. Deste modo, a avaliação do efeito individual de cada terapêutica poderá estar enviesada, dada a possibilidade de ocorrer influência de mais do que uma intervenção ao nível do microbioma cutâneo.
Como referido, a variação do microbioma está dependente de outros fatores que não a presença de DA, nomeadamente idade, localização na região da pele, raça, etnia, produção de sebo, localização geográfica, entre outros. Embora a idade seja frequentemente referida nos estudos, na maioria não há informação relativa à localização geográfica, raça, nem etnia dos participantes.
Apesar de estes fatores parecerem ser menos relevantes do que a doença, consideramos importante tê‑los em conta na interpretação dos resultados. É importante referir que alguns estudos não descrevem o local em que foi avaliada a composição do microbioma. Porém, há estudos que referem que essa avaliação ocorreu ao nível da região flexora do antebraço, sendo esta uma região frequentemente afetada por lesões de DA, ocorrendo alterações no microbioma cutâneo dependentes da doença2. Seria fundamental uniformizar o local de avaliação, de forma a tornar comparáveis os resultados entre os diversos estudos.
No que respeita à avaliação do potencial preventivo do microbioma cutâneo no tratamento da DA, bem como terapêuticas dirigidas à doença que atuam por modulação do microbioma (como é o caso dos probióticos tópicos e dos transplantes de microbioma), os resultados parecem promissores, embora escassos e com grande variabilidade entre as composições utilizadas, sendo necessária maior investigação nesta área. Por sua vez, a evidência existente relativa à utilização de probióticos orais parece ser atualmente contraditória, revelando uma grande heterogeneidade entre as formulações utilizadas.
Na avaliação do microbioma cutâneo é importante ter em conta que existem outras bactérias importantes além do S. aureus. Estudos recentes demostram um aumento de S. aureus de 35% a 90% durante os surtos, com aumento concomitante de S. epidermidis38. Ainda não está claro se S. aureus e S. epidermidis aumentam mutuamente a colonização um do outro ou se o aumento de S. epidermidis reflete uma resposta antagónica à presença de uma população crescente de S. aureus4. Por outro lado, nem todos os estudos demonstram um aumento concomitante de S. epidermidis, como é o caso do estudo de Brandwein et al., em que esta espécie estava reduzida na presença de lesões cutâneas dos doentes com DA(58). Além disso, existe evidência da utilidade desta espécie no transplante de microbioma, com diminuição do número de estirpes de S. aureus por competição direta61. Por fim, a presença de outros microrganismos além de bactérias, como é o caso de fungos do género Malassezia, demonstra a importância de avaliar a contribuição do microbioma para a patofisiologia da DA2.
CONCLUSÃO
Das técnicas clássicas de cultura de microrganismos utilizadas no início dos anos 1970, aos procedimentos de sequenciamento de última geração desenvolvidos na última década, tornou‑se evidente a importância do microbioma cutâneo na manutenção de uma pele saudável. Para fortalecer e eventualmente restaurar um microbioma saudável em doentes com condições dermatológicas como a DA, é importante considerar os fatores que influenciam a composição do microbioma, nomeadamente a produção de sebo, a localização, o pH da pele, o grau de hidratação e a integridade da barreira cutânea.
O arsenal terapêutico da DA tem aumentado de forma significativa nos últimos anos. A melhoria clínica e o controlo da doença estão dependentes de vários aspetos, sendo que o microbioma cutâneo representa um papel central na patofisiologia da DA. A possibilidade de utilizar o microbioma cutâneo per se como alvo terapêutico na DA - através de transplantes de microbioma, probióticos tópicos, bacteriolisinas, entre outros -, bem como a sua modulação para prevenção da doença em crianças com história familiar de atopia, poderão ser opções no futuro, carecendo ainda de maior investigação científica.
A avaliação do microbioma cutâneo na DA e a identificação de espécies específicas poderá permitir a sua utilização como biomarcadores na avaliação da gravidade da doença e na resposta ao tratamento, embora sejam necessários estudos de maior dimensão que permitam validar os resultados de pequenas séries(40,41).