O presente artigo integra uma série de artigos educacionais sobre rinite onde é inicialmente exposto um caso clínico ilustrativo de um problema clínico frequente. Posteriormente, é apresentada a evidência relativa a essa patologia, focando diferentes aspetos que se consideram clinicamente relevantes, incluindo formas de abordagem. O artigo termina com as recomendações clínicas dos autores, tendo por base o caso clínico inicial.
CASO CLÍNICO
Doente do sexo masculino, 20 anos, enviado à consulta de Imunoalergologia por quadro compatível com asma não controlada (queixas de sibilância e dispneia >2 vezes por semana com comprometimento da sua atividade diária e necessidade de utilização quase diária de terapêutica de alívio), com 3 anos de evolução.
Concomitantemente, apresentava queixas nasais de prurido, esternutos, rinorreia mucopurulenta, períodos de congestão nasal sugestivos de rinite persistente moderada/grave (sintomas mais de 4 dias por semana e mais de 4 semanas por ano, com interferência na qualidade de vida) e polipose nasal com hiposmia, disgeusia e episódios de cefaleia, seguido em consulta de otorrinolaringologia, tendo sido submetido a septoplastia e cirurgia endoscópica dos seios perinasais.
Apresentava ainda história de dois episódios de anafilaxia a ibuprofeno, com dispneia, tosse, dessaturação, eritema pruriginoso dos pés e mãos, edema das mãos, lábios e periorbitário, e diarreia, menos de 1 hora após toma do mesmo. Em ambos os episódios, após administração de adrenalina intramuscular, desenvolveu quadro de fibrilhação auricular com resposta ventricular rápida, que foi controlada com amiodarona, seguido de internamento em unidade de cuidados intensivos coronários e unidade de cuidados intensivos polivalente.
INTRODUÇÃO
O termo rinossinusite crónica (RSC) refere‑se a um grupo heterogéneo de doenças caracterizadas pela presença de inflamação dos seios perinasais e mucosa nasal1‑3,4. É uma entidade frequente, estimando‑se que a sua prevalência ronda os 11% na Europa(5) e os 2,5% em Portugal6. Atualmente, é considerado um problema de saúde pública pelo seu grande impacto na qualidade de vida, no absentismo laboral (média de 5,67 dias/ano) e nos custos de saúde, sendo responsável por 7,1% de toda a prescrição anual de antibioterapia nos EUA4.
A sua etiologia é multifatorial, resultando da interação entre fatores genéticos, estruturais, ocupacionais, ambientais, infeções, alergias, disfunção imunológica e doenças sistémicas5.
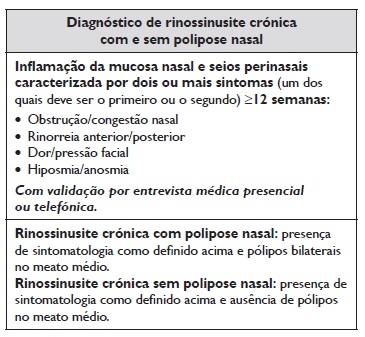
De acordo com o European Position Paper on Rhinosinusitis and Nasal Polyps 2020 (EPOS) e a maioria dos consensos internacionais, a rinossinusite no adulto é clinicamente definida pela presença, durante 12 semanas ou mais, de 2 ou mais dos seguintes sintomas: rinorreia anterior ou posterior, obstrução/congestão nasal, hiposmia/anosmia e dor/pressão facial, sendo que um dos sintomas deve ser a rinorreia ou a obstrução/congestão nasal1‑4).
Uma vez que cada sintoma apresenta elevada sensibilidade, mas baixa especificidade para o diagnóstico de RSC, a evidência clínica ou imagiológica de inflamação nasossinusal, nomeadamente por endoscopia nasal ou tomografia computorizada (TC), aumenta a fiabilidade do diagnóstico4‑8,9.
Em crianças, a RSC é definida e diagnosticada de forma semelhante aos adultos. Clinicamente, a presença da tosse assume um papel de destaque, substituindo a hiposmia nos critérios diagnósticos. De acordo com documentos de consenso, os quatro sintomas mais frequentes de RSC em crianças com idade inferior a 12 anos são cefaleias, obstrução nasal, rinorreia posterior e tosse7.
Com base nos critérios clínicos e/ou radiológicos, a RSC pode ser subdividida em rinossinusite crónica sem polipose nasal (RSCsPN) e em rinossinusite crónica com polipose nasal (RSCcPN)2. Embora ambas possam apresentar todos os sintomas característicos nasossinusais, a dor/pressão facial é mais característica da RSCsPN,
enquanto a hiposmia/anosmia é mais característica da RSCcPN5. Os pólipos nasais são lesões inflamatórias que se projetam nas vias aéreas nasais. Tipicamente são bilaterais e têm como ponto de origem os seios etmoidais10.
A sua fisiopatologia decorre de alterações na barreira epitelial dos seios perinasais e mucosa nasal, que podem aumentar a exposição a microrganismos e respetiva colonização, promovendo uma desregulação imune10.
A RSCcPN é diagnosticada em adultos e crianças após confirmação endoscópica dos pólipos nasais2. Frequentemente está associada à asma, rinite alérgica e hipersensibilidade a anti‑inflamatórios não esteroides (AINES), contudo os seus mecanismos ainda são amplamente desconhecidos.
Dentro dos dois grandes grupos (RSCsPN e RSCcPN) existem vários fenótipos associados a diferentes comorbilidades, com diferentes graus de complexidade clínica e gravidade.
DIAGNÓSTICO
O diagnóstico de RSC baseia‑se na presença de pelo menos 2 sintomas nasossinusais característicos (sendo que um dos sintomas deve ser a rinorreia, anterior ou posterior, ou a obstrução/congestão nasal) por um período mínimo de 12 semanas (Tabela 1).
De acordo com os vários consensos publicados, os 4 sintomas cardinais são obstrução nasal, rinorreia anterior/posterior, dor/pressão facial e hiposmia, este último mais frequente nos doentes com RSCcPN. Halitose, otalgia, odontalgia e/ou sintomas sistémicos, como mal‑estar e fadiga, podem surgir em relação com o quadro de rinossinusite2,4,11. Nas crianças, o quarto sintoma cardinal é a tosse (em vez da hiposmia).
O exame físico deve incluir a realização de rinoscopia e observação da orofaringe, podendo revelar a presença de obstrução nasal por edema ou muco, hipertrofia dos cornetos inferiores ou médios, desvio do septo nasal, rinorreia anterior e/ou posterior ou pólipos nasais. Os pólipos nasais são habitualmente bilaterais. Um pólipo nasal unilateral deve levantar a suspeita de outros diagnósticos, nomeadamente tumores (por exemplo, papiloma invertido). Os pólipos nasais são menos comuns em crianças, devendo, quando presentes, ser consideradas outras hipóteses diagnósticas, nomeadamente a fibrose quística (FQ)2,4,11.
A realização de endoscopia nasal ou TC SPN é recomendada nos doentes com história clínica e exame físico sugestivos, visto que aumenta significativamente a especificidade diagnóstica2,11.
A endoscopia nasal é o método de eleição para a demonstração de patologia ao nível do complexo osteomeatal, que não é completamente visualizado na rinoscopia. Esta pode revelar edema da mucosa, secreções e/ou pólipos nasais no complexo osteomeatal ou no recesso esfenoetmoidal2,4,11. A TC SPN é o método imagiológico de eleição para confirmar inflamação das cavidades dos seios perinasais2,4,11. No entanto, deve ser pedida de forma criteriosa, quando a suspeita clínica é elevada, visto que as alterações imagiológicas que surgem habitualmente nestes doentes são também frequentes em infeções agudas das vias aéreas superiores, virais ou bacterianas,
ou até em doentes com rinite alérgica após exposição ao aeroalergénio a que estão sensibilizados4. É também utilizada para planeamento cirúrgico nos casos refratários à terapêutica médica.
A biópsia do tecido mucoso raramente é necessária para o diagnóstico, estando preconizada na polipose unilateral. No entanto, o exame histopatológico pode fornecer informações prognósticas úteis, visto que a eosinofilia tecidual (> 10 células por campo de grande ampliação) tem sido associada a maiores taxas de recorrência2. Os dois subtipos de RSC apresentam características histopatológicas distintas5,10,12. Na RSCsPN verifica‑se um predomínio de inflamação neutrofílica, bem como fibrose, com deposição excessiva de colagénio na matriz extracelular e ausência de pseudoquistos. Por outro lado, a RSCcPN caracteriza‑se tipicamente pela presença de pseudoquistos, edema e falta de colagénio na matriz extracelular, com infiltração excessiva por eosinófilos5.
As indicações da radiografia dos seios perinasais são limitadas, restringindo‑se, em casos pontuais, à deteção de corpos estranhos12.
A ressonância magnética nuclear (RMN) dos seios perinasais tem um custo muito superior ao da TC, mas permite uma melhor caraterização de tecidos moles, nomeadamente quando se suspeita de um tumor ou em doentes com complicações2,4,13.
Gravidade e controlo
Na observação de rotina de cada doente devem ser incluídas avaliações da gravidade e controlo da doença como forma de apoio à decisão terapêutica4,5.
A escala visual analógica (VAS) é recomendada pelos consensos mais recentes para avaliação da gravidade2,4,5. Trata‑se de uma escala de 0 a 10 pontos, através da qual o doente classifica a gravidade dos seus sintomas, sendo que uma pontuação <3 indica doença ligeira, entre 3‑7 doença moderada e >7 doença grave.
Apesar da importância da avaliação do controlo da doença, não só do ponto de vista clínico, mas também para fins de investigação, ainda não existe uma escala de classificação de controlo considerada gold‑standard para a RSC2,4,5. O Sinonasal Outcome Test (SNOT‑22) é um questionário de 22 itens que tem sido amplamente utilizado, não só na avaliação da qualidade de vida em doentes com RSC, mas também na previsão do controlo da doença, embora várias variáveis não sejam específicas de RSC4,5. No EPOS de 20204 é recomendada a utilização de uma lista de sete itens: presença e gravidade (VAS≤5 vs VAS>5) dos quatro sintomas nasossinusais cardinais, bem como distúrbio do sono e/ou fadiga, no último mês; avaliação endoscópica nasal, caso disponível, sendo considerada alterada na presença de pólipos nasais, secreções mucopurulentas ou mucosa inflamada; necessidade de terapêutica de resgate (um ou mais cursos nos últimos 6 meses ou persistência de sintomas apesar da terapêutica de resgate). A doença classifica‑se como controlada na ausência de qualquer item, parcialmente controlada na presença de um ou dois itens e não controlada na presença de três ou mais.
Adicionalmente, nos doentes que não atingem um nível aceitável de controlo apesar de cirurgia adequada, tratamento com corticosteroide tópico intranasal e até dois ciclos curtos de antibioterapia ou corticoterapia sistémica no último ano, é considerada a presença de RSC de difícil tratamento4.
Subfenótipos e patologias associadas
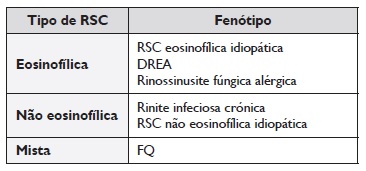
De acordo com o conhecimento atual, a presença de eosinofilia associa‑se a um processo patogénico diferente (fenótipo) que vai ser importante para definir a resposta
clínica e o prognóstico da RSC. Dessa forma, a RSC pode ser classificada em eosinofílica, não eosinofílica e mista (Tabela 2)(14). Assim, existem várias patologias que podem ser consideradas como subfenótipos da RSCcPN, nomeadamente doença respiratória exacerbada pela aspirina (DREA), fibrose quística (FQ), discinesia ciliar primária (DCP) e rinossinusite fúngica alérgica14.
No que diz respeito à classificação da RSC, esta também pode ser dividida, de uma forma mais útil para a prática clínica, em primária ou secundária (Figura 1) e, em cada uma destas divisões, em localizada ou difusa, tendo em conta a sua distribuição anatómica. Na RSC primária a patologia é dividida de acordo com o endótipo dominante - tipo 2 (caracterizado por uma inflamação tipo 2 em que existe maior ativação e recrutamento de eosinófilos e mastócitos) e não tipo 24. Esta classificação por endótipos (RSC tipo 2 vs não tipo 2) torna‑se útil sobretudo pelo interesse prognóstico. Sabe‑se que doentes com o endótipo tipo 2 tendem a ser mais resistentes à terapêutica instituída, demonstrando maior taxa de recorrência da doença, quando comparados com doentes com o endótipo não tipo 2. A RSC primária localizada subdivide‑se em dois fenótipos - rinossinusite alérgica fúngica (tipo 2) ou sinusite isolada (não tipo 2). No caso da RSC difusa, os fenótipos clínicos são determinados de acordo com a quantificação histológica do número de eosinófilos (>10 por campo de grande ampliação - RSC eosinofílica). Por outro lado, no caso da RSC secundária a subdivisão é feita de acordo com quatro categorias dependentes da patologia local (no caso da localizada, odontogénica, bola fúngica ou tumor), fatores mecânicos (DCP, FQ), inflamatórios (granulomatose eosinofílica com poliangeíte e granulomatose com poliangeíte) e imunológicos (imunodeficiência seletiva)4.
A asma é uma comorbilidade major em doentes com RSCcPN (até 60% dos doentes), sendo particularmente distinta do ponto de vista clínico, uma vez que se associa a um fenótipo de asma caracterizado por início tardio e de difícil tratamento. Esta patologia é mais frequente em doentes com RSC refratária e padrão inflamatório Th2 predominante, sendo menos comum em doentes com RSC não refratária, não eosinofílica15.
A DREA é causada por uma hipersensibilidade não alérgica (intolerância) e caracteriza‑se por um quadro respiratório grave (obstrução nasal, rinorreia e/ou broncospasmo) causado pela toma de AINE que têm uma maior atividade inibitória da cicloxigenase 1 (COX‑1), como a aspirina. Normalmente, estes doentes toleram inibidores seletivos da COX‑2.
O diagnóstico baseia‑se na presença de sintomatologia respiratória superior e/ou inferior após a toma da dose habitual de um AINE e pela presença de polipose nasal e asma. A prova de provocação oral com aspirina é o método de diagnóstico gold standard4,16.
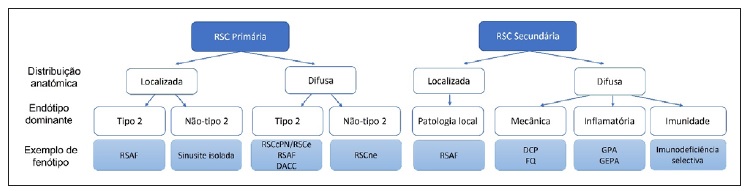
Figura 1 Classificação da RSC (Adaptado(4)). RSAF - Rinossinusite alérgica fúngica; RSCcPN - Rinossinusite crónica com polipose nasal; RSCe - Rinossinusite crónica eosinofílica; DACC - Doença atópica do compartimento central; RSCne - Rinossinusite crónica não eosinofílica; DCP - Discinesia ciliiar primária. FQ - Fibrose quística. GPA - Granulomatose com poliangeíte. GEPA - Granulomatose eosinofílica com poliangeíte.
A FQ é uma doença multissistémica que decorre de uma mutação no gene CFTR. Estima‑se que a prevalência de RSCcPN em doentes com FQ clássica seja de 100%(17), podendo a polipose nasal ocorrer em qualquer idade. Deve suspeitar‑se desta patologia nas seguintes situações: crianças com polipose nasal antes dos 6 anos de idade, infeção sinusal ou pulmonar por Pseudomonas aeruginosa, Burkholderia cepacia ou Achromobacter xylosoxidans, infeções pulmonares recorrentes ou bronquiectasias.
Na presença de uma das anteriores, em conjunto com insuficiência pancreática, mau desenvolvimento estaturo ponderal e/ou diarreia crónica, devem efetuar‑se testes diagnósticos para exclusão de FQ.
Além disso, uma biópsia de um pólipo nasal com uma histologia atípica, com baixo número de eosinófilos e aumento do número de neutrófilos, também é bastante sugestiva de FQ17.
A DCP é uma doença rara, autossómica recessiva, em que diferentes mutações genéticas causam alterações na motilidade dos cílios, levando a uma alteração da clearance mucociliar. Assim, cursa habitualmente com infeções respiratórias recorrentes e rinossinusite crónica, por vezes com polipose nasal, de aparecimento durante a infância. Associadamente podem surgir bronquiectasias, otite crónica, infertilidade masculina e feminina. Além disso, cerca de metade dos doentes podem ter cardiopatia congénita, asplenia ou poliesplenia. A medição de baixos níveis de óxido nítrico nasal é um método sensível e específico para o diagnóstico de DCP em crianças com >5 anos, quando associada a um quadro clínico compatível com esta patologia18.
Algumas imunodeficiências primárias, nomeadamente défice de IgA, IgG, hipogamaglobulinemia e imunodeficiência comum variável podem cursar com RSCcPN19. Têm sido identificados novos defeitos imunitários em doentes com RSCcPN, nomeadamente défice de células T CD8+ e múltiplos defeitos nos Toll‑like receptors19.
Este diagnóstico deve ser excluído em doentes que apresentem infeções recorrentes (respiratórias, gastrointestinais ou cutâneas) ou que não apresentem imunidade vacinal4.
A rinossinusite de etiologia fúngica pode surgir em doentes com RSCcPN, verificando‑se uma inflamação alérgica crónica e exuberante contra fungos colonizadores dos seios perinasais11,13. Esta pode cursar com infiltração da mucosa e tecidos adjacentes (forma invasiva) ou pode não infiltrar a mucosa (não invasiva)20. Dentro das formas não invasivas a mais comum é a rinossinusite fúngica alérgica, que tem uma apresentação clínica muito semelhante à RSCcPN. Deve suspeitar‑se desta entidade em doentes jovens com rinossinusite refratária ao tratamento convencional, apresentando uma boa resposta a corticosteroides sistémicos, mas com recidivas frequentes. Os seios mais afetados são, normalmente, os etmoidais21. O diagnóstico definitivo requer a demonstração da presença de hifas de fungos na mucina eosinofílica de um ou mais seios perinasais, habitualmente apenas obtidos através de cirurgia. Adicionalmente, estes doentes apresentam evidência de alergia IgE mediada a um ou mais fungos. Na TC SPN, estes doentes apresentam áreas de hiperdensidade e ocasionalmente erosão óssea. A RMN habitualmente revela hipocaptação central em T1 e T2, correspondente a áreas de mucina eosinofílica, com hipercaptação periférica correspondente a áreas de inflamação13.
Diagnóstico diferencial
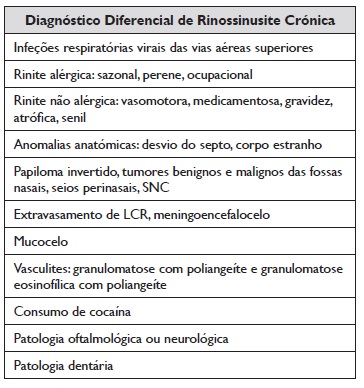
O diagnóstico diferencial da RSC engloba várias patologias que devem ser consideradas consoante a sintomatologia apresentada pelo doente. No caso de dor facial acompanhada por cefaleia deve ser excluída enxaqueca, cefaleia de tensão ou em salvas e nevralgia do trigémio.
Em caso de dor periorbitária devem ser excluídas patologias oculares. No caso de obstrução nasal unilateral com ou sem rinorreia hemática devem ser excluídas causas odontogénicas, patologias que causem extravasamento de LCR e neoplasias malignas4,12,20.
De acordo com o EPOS 20204, existem alguns sinais de alarme que devem motivar uma avaliação imagiológica e referenciação cirúrgica emergentes: edema ou eritema periorbitário, proptose, diplopia, oftalmoplegia, diminuição da acuidade visual, cefaleia grave, edema frontal, sinais neurológicos, de sépsis ou meningite, sintomas unilaterais, hemorragia, formação de crostas ou cacosmia.
As principais patologias que devem ser incluídas no diagnóstico diferencial estão referidas na Tabela 3.
TRATAMENTO
O tratamento da RSC divide‑seem tratamento médico e cirúrgico. O tratamento médico, de primeira linha, envolve uma série de opções que serão descritas de seguida. O tratamento cirúrgico poderá estar indicado em alguns doentes com RSC, habitualmente por má resposta ou contraindicação para o tratamento médico.
Tratamento médico
Lavagem nasal com solução salina
A irrigação da mucosa nasal com solução salina isotónica é uma medida clássica e segura, bastante útil na mobilização das secreções e hidratação da mucosa, como tratamento adjuvante e preventivo das doenças inflamatórias e infeciosas nasossinusais22. As irrigações nasais realizadas com grande volume (>200 mL) e baixa pressão positiva são mais eficazes do que as lavagens por pulverização salina para o tratamento dos sintomas da RSC23.
De acordo com documentos de consenso internacionais, a lavagem nasal com solução salina está recomendada em todos os doentes com RSC como tratamento adjuvante e preventivo,, bem como tratamento pós‑operatório das cirurgias nasossinusais24. Porém, não existem ensaios clínicos de qualidade e em número suficiente para validar a sua indicação25.
Corticosteroides
Tanto os corticosteroides (CCT) tópicos como os sistémicos demonstraram eficácia no tratamento da RSC. Contudo, a taxa de resposta varia entre 50‑80% e não
existem dados suficientes que permitam distinguir, a priori, doentes respondedores de não respondedores24,26,27.
Corticosteroides tópicos
Os CCT tópicos intranasais permanecem a primeira linha de tratamento na RSC24. Quando comparados com placebo, os CCT tópicos intranasais induzem uma redução dos sintomas nasais (obstrução nasal, rinorreia e hiposmia), sendo este efeito nos sintomas superior nos doentes com RSCcPN, em comparação com RSCsPN25,28.
Na RSCcPN, os CCT tópicos intranasais reduzem o tamanho dos pólipos e, quando utilizados após uma cirurgia nasal endoscópica, previnem a sua recorrência25,28.
Para além da melhoria clínica, os CCT tópicos têm um impacto positivo na qualidade de vida dos doentes com RSC28. Não parece existir diferença significativa entre as diferentes formulações de CCT tópicos25. A biodisponibilidade sistémica dos CCT de segunda geração (mometasona e fluticasona) é inferior a 1%, tornando seguro o seu uso a longo prazo29. Os efeitos adversos locais são mínimos, mas pode ocorrer irritação nasal e epistaxes; a perfuração do septo nasal associada ao tratamento prolongado com CCT está descrita, mas é extremamente rara28.
Apesar disso, estes fármacos permanecem subutilizados, provavelmente devido à baixa adesão à terapêutica. Um estudo demonstrou que apenas 20% dos doentes com RSC usavam CCT tópicos e na sua maioria em dose subterapêutica30.
Em doentes com sintomatologia moderada a grave, a administração de CCT pode ser otimizada quer pelo recurso a gotas tópicas nasais, quer através da irrigação nasal com alto volume28. A eficácia dos CCT tópicos parece aumentar após tratamento cirúrgico, provavelmente devido a uma maior disponibilidade in situ da terapêutica tópica28,31.
Assim, os doentes com RSC devem ser orientados quanto ao uso correto dos dispositivos nasais, de forma a facilitar a adesão ao tratamento a longo prazo e a garantir a efetividade do mesmo.
Corticosteroides sistémicos
Em doentes com sintomatologia grave ou refratários ao tratamento tópico prévio, pode considerar‑se a realização de um ciclo curto de CCT sistémico32,33. Uma revisão Cochrane de oito ensaios clínicos randomizados demonstrou benefício a curto prazo, em relação ao placebo, da utilização de um curso de CCT sistémico em esquema curto (entre 2 a 3 semanas), em doses variáveis (média 0,5 mg/kg e máximo 60 mg de prednisolona/dia)32.
Apesar da eficácia no que respeita à sintomatologia nasal, à melhoria da qualidade de vida e à redução de pólipos, a sua utilização deve ser bem ponderada, tendo em conta os seus inúmeros efeitos adversos1.
Antibióticos sistémicos
O Staphylococcus aureus pode ser isolado em até em 50% dos doentes com RSCcPN, com maior incidência de S. aureus produtor de superantigénios(34). O tratamento antibacteriano visa reduzir ou mesmo erradicar a carga bacteriana; no entanto, o papel do microbioma sinusal nas exacerbações ou no processo inflamatório permanece incerto(33).
Até à data, existem dois ensaios clínicos randomizados publicados que compararam o efeito de antibióticos sistémicos a curto prazo (≤4 semanas) com um grupo‑controlo com placebo34,35. Num dos estudos, 32 doentes com exacerbação aguda da RSC foram randomizados em dois grupos - tratamento com amoxicilina/ácido clavulânico vs placebo durante 2 semanas. Apesar de ambos os grupos apresentarem melhoria significativa da rinorreia e da obstrução nasal, não houve diferença significativa entre os dois grupos quanto à VAS ou SNOT‑22.
Noutro estudo randomizado com 28 doentes com RSCcPN foi avaliado o efeito do tratamento com doxiciclina e metilprednisolona durante 3 semanas. A doxiciclina demonstrou uma redução significativa da rinorreia posterior na semana 2 e da rinorreia anterior na semana 8, uma redução ligeira do tamanho dos pólipos e dos marcadores pró‑inflamatórios em relação ao grupo placebo. O tratamento com doxiciclina não teve efeito significativo na obstrução nasal, na hiposmia, na rinorreia anterior ou posterior para além das semanas referidas35. A metilprednisolona demonstrou ter um início de ação mais rápido, enquanto a doxiciclina revelou um efeito mais sustentado. Estes dados sugerem que a doxiciclina pode ser considerada como adjuvante ao tratamento em doentes com RSCcPN35.
Um pequeno número de ensaios clínicos randomizados controlados com placebo avaliou o potencial do uso de macrólidos (>4 semanas) a longo prazo no tratamento da RSC. Não foi demonstrada diferença em comparação com o placebo, ou com outros tratamentos com eficácia comprovada, como CCT tópicos intranasais ou cirurgia. Existem dados que sugerem que os macrólidos possam ser mais eficazes em doentes com IgE baixa. Os macrólidos apresentam risco de toxicidade cardíaca, pelo que este efeito adverso potencialmente grave deve ser ponderado aquando da sua prescrição36,37.
Apesar do papel das infeções bacterianas na RSC ser cada vez mais evidente, a vantagem da utilização de antibióticos sistémicos a curto ou longo prazo no tratamento desta patologia ainda não se encontra totalmente estabelecida.
Deste modo, existe a necessidade de mais estudos que avaliem o impacto antibacteriano vs anti‑inflamatório, incluindo avaliação do efeito na resistência a antibióticos24,35.
Antibióticos tópicos
O papel dos antibióticos tópicos no tratamento da RSC é controverso. Seis estudos randomizados controlados avaliaram a eficácia da terapêutica com antibioterapia tópica na RSC. Em 4 estudos controlados com placebo (n=141), a terapia antibacteriana tópica (nebulização ou pulverização) não parece ser mais eficaz do que o placebo na melhoria dos sintomas em doentes com RSC38,39,40,41.
Contudo pode haver uma melhoria clinicamente não relevante nos sintomas, SNOT‑22 e nos achados endoscópicos, em comparação com antibióticos orais42,43.
A falta de estudos robustos, com acompanhamento adequado e a variabilidade dos grupos de tratamento levam a que não haja evidência que permita recomendar os antibióticos tópicos nasais como terapêutica de primeira linha ou como terapêutica prolongada na RSC24.
Antifúngicos
Estudos randomizados não demonstraram qualquer benefício (sintomas, sinais ou qualidade de vida) da terapia antifúngica, por via oral ou tópica, nos doentes com RSC28,44. Deste modo, não está recomendado este tratamento nos doentes com RSC28.
Surfactantes
Os surfactantes são compostos orgânicos anfifílicos capazes de reduzir a tensão superficial, o que pode impedir a formação de biofilme24. Está descrita a diminuição da acumulação de muco e da escorrência nasal posterior, assim como a melhoria do olfato com o uso de surfactantes. Contudo, o surfactante ideal e o papel no tratamento de endótipos específicos ainda estão por determinar24.
Antagonistas dos recetores dos leucotrienos
A evidência atual permanece inconsistente em relação a um possível benefício do uso de antileucotrienos como adjuvantes ao CCT nasal. No entanto, alguns estudos apontam para um benefício terapêutico do montelucaste em alguns doentes com polipose nasal, nomeadamente nos subgrupos com rinite alérgica concomitante e DREA45.
Anticorpos monoclonais
Dado o conhecimento atual do papel da inflamação tipo 2, subjacente à rinossinusite crónica grave com polipose nasal, diversos anticorpos monoclonais que atuam diretamente na via inflamatória, direcionados às interleucinas (IL‑4, IL‑5, IL‑5Rα, IL‑13), bem como à IgE, têm sido alvo de estudos de avaliação da eficácia como possíveis alternativas terapêuticas.
Estudos randomizados com pequena amostragem e de curta duração demonstraram que os agentes biológicos aprovados para o tratamento de asma alérgica refratária, omalizumab (anti‑IgE), mepolizumab (anti‑IL‑5), benralizumab (anti‑IL‑5Rα) e dupilumab (anti‑IL‑4 e anti‑IL‑13) reduzem de forma significativa a sintomatologia nasal e o tamanho dos pólipos46,47,48.
Dois estudos de fase III (POLYP 1; POLYP 2), randomizados, multicêntricos, duplocegos e controlados por placebo, incluindo 265 doentes no total, avaliaram a eficácia do omalizumab no tratamento RSCcPN(49). Ambos cumpriram os objetivos primários do estudo, demonstrando melhoria significativa do SNOT‑22, escala University of Pennsylvania Smell Identification Test, sensação de olfato, escorrência nasal posterior e rinorreia após o tratamento com omalizumab, quando comprado com o placebo49. O omalizumab encontra‑se aprovado pela Food and Drug Administration (FDA) e pela European Medicines Agency para o tratamento da RSC.
Um estudo randomizado, multicêntrico, duplocego e controlado por placebo incluindo 407 doentes, demonstrou a melhoria do tamanho dos pólipos nasais e da obstrução nasal com o tratamento com mepolizumab vs placebo50.
Atualmente encontram‑se em curso ensaios clínicos de fase III, randomizados, multicêntricos, duplocegos e controlados por placebo, que visam a avaliação do benralizumab (OSTRO, ORCHID) em doentes com polipose nasal51‑52.
O benralizumab mostrou‑se promissor na RSCcPN. A eficácia e a segurança do dupilumab foram demonstradas em dois estudos de Fase III (SINUS‑24, SINUS‑52), randomizados, multicêntricos, duplo‑cegos e controlados por placebo, que incluíram 724 doentes adultos com RSCcPN não controlados com CCT53. O dupilumab (Dupixent®) foi aprovado nos EUA e na UE para o tratamento da rinossinusite crónica grave com polipose nasal em adultos, tornando‑se o primeiro biológico aprovado com esta indicação terapêutica.
Dessensibilização ao ácido acetilsalicílico
A dessensibilização à aspirina demonstrou eficácia na redução de marcadores da atividade da doença em doentes com DREA54. Vários estudos demonstraram diversos
benefícios, nomeadamente na melhoria da qualidade de vida, na redução de sintomas nasais e de asma e na melhoria do olfato. Este tratamento também pode reduzir a frequência da formação de pólipos, os episódios de agudização da rinossinusite, a necessidade de CCT sistémicos e, quando realizado no período pós‑operatório (3 a 4 semanas), parece reduzir o risco de recorrência dos pólipos54. Os regimes atuais são variáveis, preconizando tratamento com 325 mg a 650 mg de ácido acetilsalicílico duas vezes por dia54,55. No entanto, os efeitos adversos, nomeadamente gastrointestinais, contribuem para baixas taxas de adesão à terapêutica continuada. Uma alternativa que permite melhorar a adesão terapêutica consiste na adoção de uma dose de manutenção mínima eficaz.
No entanto, estudos comparativos da eficácia entre diferentes doses são escassos.
Tratamento cirúrgico
O tratamento cirúrgico é geralmente reservado a doentes refratários, com contraindicação para a realização de tratamento médico ou com efeitos adversos graves.
Está também indicada em doentes com complicações iminentes, como perda de visão. De acordo com um documento de consenso recente, o tratamento cirúrgico da RSCcPN não complicada está recomendado quando existe evidência de RSC na tomografia computorizada, após tratamento com CCT intranasal tópico e sistémico e SNOT ≥ 2056. Esta abordagem demonstra uma melhoria sintomática mais significativa na RSCcPN em relação à RSCsPN56.
Na RSCcPN, a cirurgia visa a remoção dos pólipos e promove a melhoria da eficácia do tratamento com CCT intranasal. Num estudo de coorte com elevado número de doentes submetidos à cirurgia foi observada uma melhoria significativa da qualidade de vida a longo prazo57. No entanto, a recorrência dos pólipos é comum, tendo sido encontrada em 20% dos doentes que foram submetidos a uma revisão do procedimento num prazo de 5 anos57. Um outro estudo demonstrou que 40% dos doentes tinha recorrência dos pólipos após 18 meses da cirurgia58. Estudos randomizados demonstraram que a utilização de CCT intranasais no período pós‑operatório melhorou os sintomas nasais e reduziu a necessidade de CCT sistémico59. A terapêutica médica é, portanto, considerada uma parte fulcral e complementar da abordagem cirúrgica.
CONCLUSÃO
O doente referido na vinheta clínica inicial apresenta um quadro compatível com RSCcPN, associada a asma e a hipersensibilidade a anti‑inflamatórios não esteroides
(DREA). Para esclarecimento do quadro, na consulta de Imunoalergologia foram realizados testes cutâneos por picada com aeroalergénios (negativos) e estudo analítico, do qual se salienta IgE total de 171 kU/L e eosinofilia (530/uL).
Foi instituída terapêutica inalatória com budesonida/formoterol 160/4,5 μg/dose bid e em SOS, montelucaste 10 mg id e budesonida nasal 100 μg/dose bid. Foi decidido não realizar dessensibilização com aspirina, devido à presença de anafilaxia com efeitos adversos cardiovasculares associados à administração de adrenalina. Assim, foi realizada prova de provocação oral com Etoricoxib (negativa), de modo a providenciar ao doente um fármaco anti‑inflamatório seguro.
Por persistência das queixas brônquicas e nasais, dado o rápido recrudescimento da polipose nasal após cirurgia, estando o doente medicado com a terapêutica referida (e na ausência de outros anticorpos monoclonais disponíveis à data da decisão), optou‑se por instituir omalizumab 300 mg de 4 em 4 semanas (dose calculada com base no peso do doente e valor de IgE total). Dois anos após início de omalizumab, o doente apresentava‑se com queixas brônquicas controladas, sem queixas nasais histaminérgicas, discreta melhoria da obstrução nasal e sem alterações a nível do olfato ou paladar.
A RSC é uma patologia frequente que compromete a qualidade de vida dos doentes de forma significativa. Pode surgir associada a diversas comorbilidades, como asma, DREA, FQ, DCP, imunodeficiências, entre outras. O seu diagnóstico é clínico, mas carece de confirmação imagiológica (TC SPN) e/ou endoscópica. Os CCT tópicos intranasais são utilizados em primeira linha no tratamento, tanto na RSCcPN como na RSCsPN, devendo ser acompanhados por lavagens nasais com soluções salinas. O tratamento cirúrgico está indicado em situações de refratariedade ao tratamento médico, ou em que o mesmo está contraindicado. De entre as restantes terapêuticas recomendadas é de salientar a importância crescente dos anticorpos monoclonais, nomeadamente, na RSCcPN refratária ao tratamento cirúrgico. Neste momento, apenas o dupilumab e o omalizumab estão aprovados pela FDA no tratamento da RSCcPN. Porém, são meios terapêuticos de custo elevado.
No caso aqui descrito, o omalizumab permitiu o controlo das queixas brônquicas, apresentando apenas benefício parcial no controlo das queixas de obstrução nasal e da polipose nasal. Assim, são necessários mais estudos que comprovem a eficácia dos anticorpos monoclonais e que avaliem se a relação custo‑benefício é aceitável.