INTRODUÇÃO
A clorohexidina (CHX) é uma bisbiguanida com ação antissética com amplo espetro de atividade antibacteriana e antifúngica, com efeito persistente na pele e mucosas e por isso é um dos mais utilizados nos cuidados de saúde e na comunidade, pois é considerado o antissético de primeira linha pela World Health Organization (WHO) desde 1979 1.
Na comunidade, a CHX é encontrada em muitos produtos comercialmente disponíveis, como elixires bucais, pastas de dente, emplastros, curativos, pomadas, supositórios, soluções desinfetantes e cremes antisséticos. Em meio hospitalar é o principal antissético tópico, existe impregnada em cateteres venosos centrais (CVC) e outros dispositivos médicos, bem como na composição de lubrificantes(2).
A verdadeira incidência de hipersensibilidade tipo I (Imunoglobulina E (IgE) mediadas) à CHX permanece desconhecida, porém dados recentes apontam para uma tendência crescente 2. Vários estudos indicam uma incidência que varia de 5,5 a 8,8% 3. As reações alérgicas mais comuns são reações tardias (hipersensibilidade tipo IV) mediadas por células T, que ocorrem frequentemente após a exposição tópica e manifestam-se sob a forma de dermatite de contacto 4.
As reações de hipersensibilidade tipo I foram menos reportadas, caracterizam-se fisiologicamente pela ativação e desgranulação basofílica e mastocitária, que conduz à libertação de mediadores vasoativos que podem desencadear reações com espetro de gravidade variável, desde quadros ligeiros de urticára até choque anafilático 1.
As exposições mucosas e parentéricas são fatores de risco para reações de hipersensibilidade sistémicas graves 5, assim, a utilização de cateteres urinários com lubrificantes (44%), CVC (35%) e antisséticos tópicos (16%) surgem como os eventos mais frequentemente implicados 5.
O diagnóstico é feito pela história clínica, com recurso a testes in vivo (testes cutâneos pelo método prick (TCP), e intradérmicos com a CHX) e/ou in vitro (doseamento de IgE específica e, quando disponível, poderá ser complementado com teste de ativação de basófilos (BAT)) 1,6,7.
CASO CLÍNICO
Os autores apresentam o caso clínico de um homem de 74 anos, com hipertensão arterial e diabetes mellitus tipo 2 como doenças conhecidas, medicado com ramipril 5 mg, metformina 1000 mg e sitagliptina 50 mg e antecedentes cirúrgicos de herniorrafia inguinal e colecistectomia. Negava antecedentes do foro imunoalergológico.
Após o diagnóstico imagiológico de uma fístula arteriovenosa dural da ráquis foi submetido a uma embolização de território arterial. Neste procedimento foram administrados os seguintes fármacos: remifentanil 1 mcg/kg/min, lidocaína 1,5 mg/kg, propofol 2,5 mg/kg, rocurónio 0,6 mg/kg, escopalamina 20 mg, enoxaparina 40 mg, dexametasona 10 mg, ondansetron 4 mg, sugamadex 16 mg/kg; contraste Iopromida (Ultravist) 370 mg, 100 ml.
O procedimento foi realizado com um microcateter Magic® 1.2F e microguia Hybrid® 0.07. Foi cateterizada a artéria aferente e, após progressão até ao nível de L3, foi injetada cola de fibrina (diluição 1:3), que permitiu preencher o ponto de fístula e a porção mais proximal da veia de drenagem. O procedimento decorreu sem intercorrências.
O desinfetante cutâneo utilizado foi a iodopovidona a 10%.
Cerca de 12 horas após o procedimento, procedeu-se a algaliação pós-cirúrgica por queixas de dificuldade na micção espontânea. Foi utilizada uma algália de látex e Cathejell® (composição: 20 mg de cloridrato de lidocaína e 0,5 mg de dicloridrato de CHX) para anestesia/lubrificação.
Aproximadamente 10 minutos após colocação da algália e Cathegell® foi documentado o aparecimento de um exantema maculopapular pruriginoso disperso pelo ronco, membros superiores e inferiores, edema dos lábios e periorbitário, dispneia moderada, cianose labial, com utilização de músculo intercostais e supraesternais e hipoxemia de 88%.
Foi administrada de imediato clemastina 0,025 mg/kg/dose endovenosa (ev), ranitidina 0,5 mg/kg/dose ev, hidrocortisona 250 mg ev, adrenalina 0.5 ml (1:1000/ 1 mg/mL) intramuscular e oxigenoterapia a 2l/min por cânula nasal, com melhoria sintomática em menos de 1 hora, tendo-se mantido sempre hemodinamicamente estável.
Fez colheita seriada de triptase: no momento da reação (9,3 μg/L); 2 horas após (24,08 μg/L); 24 horas após (4,33 μg/L).
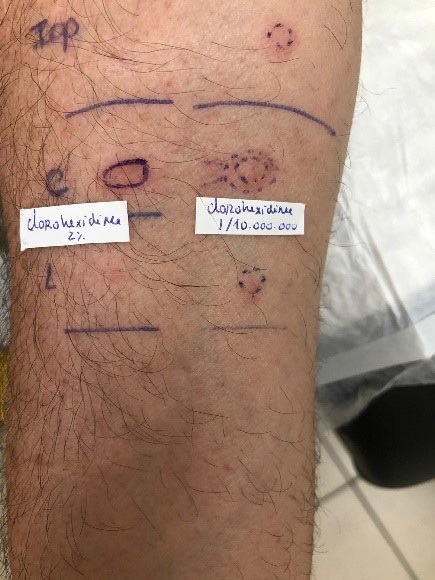
Foi encaminhado para consulta de Imunoalergologia por suspeita de anafilaxia perioperatória, onde realizou TCP ao látex, lidocaína (20 mg/ml), iopromida (370 mg/ml), iodopovidona (100 mg/ml), ondansetron (2 mg/ml), dexametasona (5mg/ml), ramifentanil (0,05 mg/ml), rocurónio (10 mg/ml), propofol (10 mg/ml), escopalamina (20mg/ml), que foram negativos e à CHX a 2%, que foi negativo, porém com surgimento de eritema com diâmetro médio de 7 mm (Figura 1). Doseamento de IgE total: 752 KU/L; IgE CHX: 1,12 kUA/L; IgE óxido de etileno: 0,01 kUA/L; IgE látex 0,01 kUA/L.
Foram realizados testes cutâneos intradérmicos, que foram positivos para a solução alcoólica corada de CHX a 2% na diluição de 1/10 000 000 (8), com aumento do diâmetro médio da pápula de 5 para 9 mm (critério para positividade: aumento do diâmetro médio da pápula ≥ 3mm) na leitura aos 20 minutos (Figura 1) e negativos para lidocaína (20 mg/ml) na diluição de 1/10, iopromida (370 mg/ml) na diluição de 1/10, iodopovidona (100 mg/ml) na diluição de 1/10 000, ondasetron (2 mg/ml) na diluição de 1/100, dexametasona (5mg/ml) na diluição de 1/100‑1/10, ramifentanil (0,05 mg/ml) na diluição de 1/10, rocurônio (10 mg/ml) na diluição de 1/100, propofol (10 mg/ml) na diluição de 1/10 e escopalamina (20mg/ml) 1/1000‑1/10 8.
Foi realizado BAT para a CHX e para o látex, que revelou um aumento na expressão de CD63 nos basófilos após estimulação com CHX. Foi utilizado o digluconato de clorohexidina a 20% (1062 mg/mL) a 0,05%, 0,005%, 0,005% e 0,00005%. A população de basófilos foi identificada como células HLA-DR-CD123+ CD203c+ e a ativação pela expressão de CD63. O BAT foi positivo em 0,005%, 0,0005% e 0,00005% com ativação de 9,4%, 10,7% e 19,7% e índice de estimulação de 6,71, 7,64 e 14,07, respetivamente.
Não foi detetado aumento da ativação dos basófilos após estimulação com látex. Portanto, o diagnóstico de hispersensibilidade grave à CHX foi confirmado. O doente foi alertado para evitar todos os produtos contendo este alergénio e foi prescrita medicação de recurso, nomeadamente bilastina 20 mg, prednisolona 20 mg e caneta de adrenalina autoinjetora 0,3 mg.
DISCUSSÃO
A CHX é um antissético ubiquitário, utilizado de forma generalizada nos mais variados setores da saúde e mesmo pela população geral. Contudo, excecionalmente são descritos casos de hipersensibilidade IgE mediada à CHX 9,10. O primeiro caso de anafilaxia reportado foi em 1984 no Japão, sendo até 2014 descritos mais 36 casos de anafilaxia perioperatório à CHX 11.
A maioria das reações descritas ocorreu após a aplicação de CHX em tecido cutâneo danificado (feridas, queimaduras, incisões cirúrgicas), nas mucosas (urogenital, conjuntiva ocular e nasal) ou após a inserção de dispositivos médicos impregnados com CHX 12. Uma revisão à anafilaxia induzida por CHX em doentes cirúrgicos por Sharp et al. (Austrália, 2016) 11 incluiu um total de 68 reações anafiláticas, demostrando que os casos mais frequentes ocorrem com a CHX presente no lubrificante do cateter urinário (n = 30 [44,12%]), seguindo-se os de CHX no CVC (n=24 [35,29%]) e em soluções tópicas (n=11 [16,18%]).
Raramente os doentes apresentam história prévia de atopia, como demonstra um estudo português de 2019, após a revisão de 24 casos entre 2014 e 2018, demonstrando ainda ser mais frequente no sexo masculino (83%)4.
A apresentação clínica é variável, a maioria das vezes sob a forma de uma erupção eritematosa/urticariforme no momento da reação e hipotensão. O broncoespasmo é raramente relatado 4. Apesar de muito raros, existem casos descritos de paragem cardiorrespiratória.
O facto de uma grande quantidade de produtos estarem mal rotulados e não referirem a presença de CHX resulta em exposições inadvertidas, o que pode originar que os doentes apresentem mais do que uma reação alérgica antes do diagnóstico, aumentando o risco de anafilaxia grave.
No caso do doente descrito, do sexo masculino, a reação anafilática ocorreu após a utilização de CHX no lubrificante do cateter urinário. Não havia história prévia de reação mucocutânea, mas já tinha sido exposto a este antissético em cirurgias prévias.
Perante um doente com suspeita de reação de hipersensibilidade no perioperatórios, além dos agentes tipicamente implicados (antibióticos, anestésicos locais/gerais, miorrelaxantes, látex), também os desinfetantes deverão ser tidos em conta no estudo, pelo que a inclusão destes produtos no relato cirúrgico/anestésico é determinante. A identificação do agente causal terá implicações em futuras abordagens, neste caso específico, pela necessidade de se utilizar material médico sem CHX, de forma a permitir o tratamento destes doentes de forma segura.
Perante a suspeita de hipersensibilidade à CHX o doente deve ser encaminhado para uma consulta de Imunoalergologia para que seja possível proceder a um correto diagnóstico. Utilizando testes cutâneos por picada e intradérmicos, que apresentam, respetivamente, sensibilidade de 95%, 68% e especificidade de 97% e 100%.
A IgE específica geralmente aumenta na maioria dos doentes no momento da reação. Se negativa, deve ser repetido o teste entre 1 a 4 meses após o evento 13.
O BAT apenas está disponível em alguns centros especializados e requer uma amostra de sangue fresca (colheita realizada em menos de 24h). Apresenta uma sensibilidade de 50% e especificidade de até 99%. Este teste é geralmente usado para confirmar o diagnóstico após outros testes apresentarem resultados ambíguos 13. Há uma série de fatores que podem afetar as curvas de dose-resposta dos marcadores de ativação de superfície de basófilos, como afinidade do antígeno para a IgE, diversidade de epitopos do anticorpo IgE, densidade da IgE específica de epitopo na superfície celular e características intrínsecas do próprio basófilo. A combinação desses fatores determina a concentração ideal de alergénios para ativação de basófilos, que varia significativamente entre indivíduos e entre diferentes alergénios no mesmo indivíduo.
Portanto, é preferível incluir uma ampla gama de concentrações de alergénios para melhor apreciar o efeito do alérgeno na resposta dos basófilos, uma vez que esta não é apenas dependente da dose, como se verifica neste caso 14.
O teste de provocação é considerado o gold-standard para diagnóstico, mas é contraindicado em doentes com reações graves prévias ou anafilaxia, e não existe até à data publicado nenhum protocolo-padrão para o teste de provocação com CHX 13.
Salienta-se a importância de os hospitais estarem preparados para o aumento da incidência de alergia à CHX e terem protocolos apropriados que promovam a abordagem multidisciplinar entre imunoalergologista, anestesista, cirurgião, urologista, entre outras especialidades, e equipa de enfermagem.
CONCLUSÕES
Os autores apresentam o caso clínico de uma anafilaxia à CHX para alertar a comunidade médica e promover a consciencialização sobre esta causa cada vez mais comum, mas muitas vezes esquecida, de alergia. Devido ao seu grande uso como desinfetante, a CHX é um dos alergénios ocultos mais importantes, provavelmente subestimando-se a verdadeira incidência de anafilaxia. A subavaliação de reações anteriores à CHX aumenta o risco de um desfecho fatal para reexposições futuras em procedimentos médico-cirúrgicos.
Um encaminhamento imediato para uma consulta especializada e um estudo detalhado de alergia é crucial. A história pormenorizada e os testes diagnósticos permitem confirmar o diagnóstico de alergia à CHX.