Introdução
A doença celíaca (DC) é uma doença crónica e autoimune que afeta o intestino delgado em indivíduos geneticamente predispostos e que é precipitada pela ingestão de glúten.1
Durante várias décadas a DC foi considerada uma enteropatia de crianças e adultos jovens.2Contudo, com o crescente uso das técnicas endoscópicas e serológicas, assistiu-se a uma identificação massiva de novos casos e a uma mudança de paradigmas.3A prevalência global da DC é de cerca de 1%, sendo expectável o seu contínuo aumento.4Atualmente, sabe-se ainda que pode surgir em qualquer idade.3Atendendo ao envelhecimento da população e ao aumento da prevalência da DC, há uma clara necessidade de investigação da DC no idoso. O espetro clínico é bastante abrangente e sobrepõe-se a várias entidades. De facto, a associação de perda peso e anemia deve motivar a exclusão de neoplasias gastrointestinais.5Porém, após exclusão de malignidade, as queixas dos doentes idosos podem ser erradamente atribuídas a patologias funcionais, psiquiátricas ou mesmo como parte do processo de envelhecimento.6
Alguns estudos apontam que uma proporção considerável de doentes é diagnosticada como tendo síndrome do intestino irritável vários anos antes do diagnóstico de DC, o que leva a um atraso médio no diagnóstico de 17 anos.7
A heterogeneidade clínica, vasto diagnóstico diferencial e o baixo nível de suspeita médica levam a um atraso no diagnóstico e a um considerável número de casos subdiagnosticados de DC na idade geriátrica.2
Ainda que em primeira instância a dieta sem glúten (DSG) pareça uma medida simples, a abordagem terapêutica no idoso é complexa e desafiante.5Esta implica a decisão de mudança radical de hábitos dietéticos de longa data, em doentes com queixas frequentemente frustes, que fazem questionar o valor do diagnóstico e tratamento da DC no idoso.3No outro extremo da apresentação clínica, o tratamento exige a gestão de complicações potencialmente graves.5
Apesar do crescente número de casos no idoso, muitos outros continuam por diagnosticar.2É essencial alertar para a importância do diagnóstico de DC no idoso, de forma a prevenir complicações associadas e reduzir a morbilidade. Para além disso, apesar da vasta literatura sobre DC, as revisões narrativas sobre DC no idoso são escassas e encontram-se desatualizadas. Esta revisão tem como objetivo a sistematização da evidência atual quanto à DC no idoso.
Epidemiologia
Nos últimos anos, vários estudos demonstraram um aumento considerável do número de diagnósticos de DC na idade adulta, sobretudo no idoso. Um estudo de coorte realizado no Reino Unido, referente aos anos entre 1990 e 2017, reportou que a proporção de diagnósticos de DC no idoso aumentou de 0% em 1990-1991 para 18,7% em 2016-2017. Desta forma, no período de tempo do estudo, a DC foi diagnosticada em 12,9% dos casos após os 65 anos de idade.2Uma proporção superior foi identificada num estudo de Ludvigssonet alem que 17% dos doentes foram diagnosticados depois dos 65 anos.8Outros dados epidemiológicos estimaram que 28% e 21% dos diagnósticos de DC ocorrem após os 60 anos e 65 anos de idade, respetivamente. Nesse estudo, foi ainda relatado um aumento da prevalência de 1:9000 para 1:406 entre 1984 e 2014 nos indivíduos com 60 ou mais anos.9Outro cenário epidemio- lógico em Itália demonstrou uma tendência semelhante em 2012, em que a prevalência de DC no idoso quase duplicou após uma década.10Contudo, apesar desta tendência, o diagnóstico no idoso continua a ser uma minoria e a sua prevalência é na generalidade menor que na população em geral.2
Quanto ao género, apesar da DC ser mais comum no sexo feminino, esta diferença diminui no idoso.9,11A partir dos 60 anos aponta-se para um rácio de 1,4:1.9
Fisiopatologia
A fisiopatologia da DC envolve uma resposta do sistema imune inato e adaptativo em indivíduos geneticamente predispostos, que é precipitada pela ingestão de glúten.
A componente genética é bem ilustrada pela presença dos haplótipos do HLA-DQ2 e HLA-DQ8 em mais de 95% dos doentes.12,13Não obstante, 30%-40% da população caucasiana expressa também HLA-DQ2.13
O maior fator desencadeante na componente ambiental tratase da ingestão de glúten. Em indivíduos geneti- camente predispostos, o glúten é reconhecido como um agente nocivo, despoletando uma resposta inflamatória anormal.14,15
Após ser ingerido, é parcialmente digerido em fragmentos de gliadina que, na presença de um aumento da permeabilidade da mucosa intestinal, podem ultrapassar a barreira epitelial.
Na lâmina própria, como resultado da atividade da enzimatissue transglutaminase(tTG) a gliadina é desamidada, tornando-se uma molécula mais imunogénica. A cascata de mediadores inflamatórios resultante da resposta imune leva à lesão cumulativa na mucosa intestinal.14
A perda da tolerância ao glúten pode ocorrer em qual- quer altura da vida, em consequência de outros fatores ambientais, como o microbioma intestinal.12Por esta ou outra via, têm sido apontados vários fatores precipitantes de DC, tais como infeções gastrointestinais, antibióticos, inibidores da bomba de protões, interferão-ae cirurgias.16-18
Manifestações Clínicas
A DC é uma doença multissistémica, podendo o seu estudo e diagnóstico constituir um desafio, atendendo às suas numerosas formas de apresentação e termos relacionados.19
TERMOS E CONCEITOS RELACIONADOS COM DOENÇA CELÍACA
A forma clássica de DC no adulto cursa necessariamente com sinais e sintomas de má absorção como diarreia, esteatorreia ou perda de peso.1,19Por oposição, a forma não clássica de DC inclui sintomas gastrointestinais inespecíficos e manifestações extraintestinais (Tabela 1).1,12,19No adulto a apresentação clínica não clássica é atualmente a mais frequente.19
Para além dos sintomas, algumas condições associadas à DC, bem como situações que aumentam o risco de DC, podem contribuir para a suspeita clínica (Tabela 2).19
Tabela 1: Sinais e sintomas de DC não classica no idoso.
| Anemia ferropenica |
| Distensao abdominal |
| Dor abdominal recorrente |
| Obstipacao |
| Crise celiaca (cholera-like) |
| Fadiga persistente |
| Enxaqueca cronica |
| Manifestações dermatologicas (como rash cutaneo e psoriase) |
| Neuropatia periferica |
| Ataxia |
| Hipertransaminasemia cronica inexplicada |
| Artrite ou artralgias |
| Defice de acido folico |
| Defice de vitamina B12 |
| Osteopenia, osteoporose |
| Estomatite aftosa |
| Dispepsia, saciedade precoce, anorexia |
| Humor depressivo, ansiedade e irritabilidade |
| Defeitos do esmalte dentario |
| Menopausa precoce |
| Hipoesplenismo |
Tabela 2: Doenças associadas e condições com aumento do risco de DC.
| Dermatite herpetiforme |
| Diabetes mellitus tipo 1 |
| Defice seletivo de IgA |
| Doencas autoimunes da tiroide |
| Familiar em primeiro grau com DC provada |
| Colite microscopica |
| Sindromes de Down, Turner e William |
| Hepatite autoimune |
| Psoriase |
| Lupus |
PARTICULARIDADES DA APRESENTAÇÃO CLÍNICA NO IDOSO
Vários estudos compararam a apresentação clínica da DC no idoso e em adultos mais jovens, sendo alguns dos resultados dissonantes. No idoso, por razões desconhecidas, a apresentação gastrointestinal com diarreia, esteatorreia, dor ou distensão abdominais, é menos comum que no adulto jovem.2,5,6A diarreia é geralmente ligeira ou intermitente, e ocasionalmente, doentes celíacos idosos podem apresentar obstipação.20
Assim, os idosos aparentam ser menos sintomáticos que os adultos jovens sendo as manifestações não clássicas de doença, como défices de micronutrientes, osteopenia e osteoporose, os principais achados que levam à investigação da hipótese de DC.2Shihaet alreportaram que 29,3% dos idosos apresentaram-se com anemia ferropénica, 23,2% com osteopenia/osteoporose, 23,2% com défice de ácido fólico e 20,2% com défice de vitamina B12.2Estes resultados refletem a natureza assintomática da DC no idoso, sendo os doentes identificados em virtude da maior utilização dos testes serológicos.2,20
Em contrapartida, um estudo realizado em 2016 por Tortoraet aldemonstrou que os idosos têm o dobro do risco de serem diagnosticados por sintomas de má absorção (diarreia e/ou perda ponderal) quando comparados com adultos jovens.6
Estes achados podem sugerir que idosos com sintomas não clássicos ou subtis de DC continuam por diagnosticar.3
3. ANEMIA E OUTRAS ALTERAÇÕES ANALÍTICAS
Estudos apontam que 54%-80% dos idosos com DC apresentam anemia no momento do diagnóstico.2,20,21A anemia pode ser atribuível ao défice de micronutrientes, sobretudo ferro.22 Contudo, esta deve ser entendida como tendo origem multifatorial, sobretudo pela contribuição da inflamação sistémica subjacente.23
Um achado intrigante relaciona-se com o défice de vitamina B12 ser significativamente mais marcado no idoso em relação ao adulto jovem, segundo Shiha et al.2
A má absorção pode causar ainda hipoalbuminemia, hipocalcemia e hipomagnesemia. Os doentes podem apresentar edema e ascite pela hipoalbuminemia.5
A DC associa-se frequentemente a alteracoes hepatocelulares - hepatite celíaca.5,24Esta situação deve motivar a investigação para exclusão de outras causas de doença hepática.5
DISTÚRBIOS DO METABOLISMO ÓSSEO E FRATURAS
Os distúrbios do metabolismo ósseo na DC são comuns e de etiologia multifatorial. O espetro da doença óssea metabolica na DC inclui a osteopenia e a osteoporose, o hiperparatiroidismo secundário e a osteomalacia. A redução da densidade mineral óssea (DMO) - osteopenia ou osteoporose é o distúrbio mais comum.25
O mecanismo da diminuição da DMO na DC é atribuído sobretudo ao défice da absorção de cálcio, que conduz ao aumento da secrecao da hormona paratiróide que, por sua vez, estimula os osteoclastos.26 A absorção de vitamina D pode tambem estar comprometida.5 Para além disso, constata-se uma hipersecreção de citocinas próinflamatorias que estimula a reabsorção óssea.5,26
A prevalência da diminuição da DMO fornecida pela densitometria óssea em doentes adultos com DC e variável pois o grau de afeção óssea depende do género, idade, estado pré ou pós-menopausa, gravidade e duração da doença, bem
como doenças associadas.26 Desta forma, como seria expectável, a diminuição da DMO e mais prevalente nos doentes celiacos idosos.3 Segundo Casella et al, cerca de 70% dos doentes celiacos diagnosticados apos os 65 anos tinham osteoporose no momento do diagnóstico.10
O impacto da desmineralização óssea no risco de fratura deve também ser alvo de estudo. Numa recente meta-análise, as fraturas ósseas foram quase duas vezes mais comuns em Indivíduos com DC, do que naqueles sem doenca.27 Outros estudos sugerem que muitas das fraturas ocorrem antes do diagnóstico de DC, podendo um diagnóstico e avaliações precoces prevenir a sua ocorrencia.5,28Vilpulla et al reportaram que 23% dos doentes diagnosticados após os 50 anos, apresentavam história de fraturas de baixo impacto (versus 4% no grupo controlo).29
5. DOENÇAS AUTOIMUNES
As doenças autoimunes são outra forma de apresentação clínica, que compartilham com a DC a associação com haplótipos HLA peculiares, ocorrencia de autoanticorpos, envolvimento de vários orgãos e, finalmente, uma desregulação das respostas do sistema imunitário.5
Alguns autores defendem que a probabilidade de desenvolver uma doenca autoimune esta diretamente relacionada com a idade ao diagnóstico, pela duração da exposição ao glúten, enquanto outros negam esta associação.5 Recentemente, Tortora et al relataram que não existe diferença significativa entre a associação de doenças autoimunes e a idade de diagnóstico no adulto.6 Kalkan et al avaliaram também esta relação num estudo retrospetivo de 2017 e os resultados foram surpreendentes.
Nos idosos com DC 66% foram diagnosticados com pelo menos uma doenca autoimune, enquanto que nos restantes adultos o correspondente foi verificado em apenas 25% dos doentes. A doença autoimune múltipla, definida como a coexistência de 3 ou mais patologias autoimunes num indivíduo, foi significativamente maior nos idosos (47% vs 4%).30
A tiróidite de Hashimoto, dermatite herpetiforme (DH), psoríase, diabetes mellitus tipo 1 e síndrome de Sjogren são as doenças autoimunes mais frequentemente associadas a DC no idoso, apesar das variações das suas frequências na literatura.6,30,31Muitas outras doenças foram também descritas como associadas a DC como doenças autoimunes hepáticas e doença de Graves.30,31No caso da doença autoimune da tiróide a frequência no idoso varia entre 9% e 17%.5,6,10,31Quanto a diabetes tipo 1 importa referir que na grande maioria dos casos o seu diagnóstico precede o de DC.35.1. Dermatite herpetiforme
A DH e a manifestação cutânea clássica da DC e caracteriza-se pela presença de várias vesículas e pápulas pruriginosas e agrupadas, conferindo um aspeto herpetiforme. As regiões mais frequentemente afetadas são os cotovelos, joelhos e região nadegueira.3,32
A DH e caracteristicamente diagnosticada no adulto sendo ligeiramente mais comum no homem.33 No idoso apresenta especial relevo pois a maior incidência da DH verifica-se nos indivíduos entre os 50 e 69 anos, seguindo-se dos idosos com mais de 69 anos.11
Aproximadamente 75% dos doentes com DH tem evidência de atrofia das vilosidades intestinais ao diagnóstico, tendo os restantes, inflamação característica de DC.33 Desta forma, os doentes diagnosticados com DH devem ser testados para DC.32
Para além do cenário clínico típico, o diagnóstico de DH inclui biopsia perilesional com demonstração por imunofluorescência direta de depósitos granulares de IgA nas papilas dérmicas.3,32
O tratamento de escolha e a DSG estrita e ad eternum.
No entanto, como esta tem um efeito lento na resolução da erupção da DH, os doentes com sintomas graves podem ser tratados concomitantemente com dapsona.32
6. MANIFESTAÇÕES NEUROPSIQUIÁTRICAS
Vários dados apontam para uma associação entre DC e sintomas neurológicos e psiquiátricos como neuropatia periférica, ataxia, cefaleias, epilepsia, distimia e ansiedade.5,34
A ataxia cerebelar e a neuropatia periférica são as manifestações neurológicas mais frequentemente reconhecidas na DC e surgem, em média, aos 55 anos.3,34,35O tratamento pode ser bastante complexo pois os distúrbios do equilíbrio aumentam o risco de queda, e consecutivamente o risco de fratura, que se encontrava previamente elevado pela diminuição da DMO.5
Quanto a demência nos doentes celíacos idosos, os resultados são controversos. Num estudo de 2015, os idosos com DC não apresentaram um risco aumentado de demência em relação a população geral.36 Contudo, um estudo anterior de menores dimensões com idosos celíacos relatou uma melhoria sintomática de doentes previamente diagnosticados com demência tipo Alzheimer após a introdução da DSG.37
Casella et al avaliaram também a função cognitiva em doentes diagnosticados com DC após os 65 anos, constatando pior performance cognitiva que o grupo controlo, apesar de cumprirem a DSG.38
Quanto aos distúrbios psiquiátricos de destacar que a ansiedade e depressão tem sido descrita sobretudo quando a DC é diagnosticada após os 60 anos de idade.34,39
7. DOENÇA CARDIOVASCULAR
Os mecanismos pelos quais a DC e doença cardiovascular se relacionam não estão totalmente esclarecidos.5 Para além da DC associar-se a inflamação crónica, os doentes que levam uma DSG nem sempre tem uma dieta equilibrada, o que pode contribuir para o processo aterosclerótico.5,40
Estudos previos tem relatado um aumento moderado do risco cardiovascular nos doentes celíacos (enfarte agudo do miocardio, acidente vascular cerebral e morte por causa cardiovascular).41,42
Num recente estudo comparativo, 37,67% dos idosos com DC apresentavam doença coronária, prevalência essa significativamente superior à do grupo controlo. Para além disso, 12,1% dos idosos celíacos tinham história de enfarte agudo do miocárdio, o que mais uma vez, mostrou ser estatisticamente significativo.40
8. MALIGNIDADE E MORTALIDADE
A DC associa-se a um aumento da mortalidade devido as suas complicacoes.43 Ainda que raras, as complicacoes malignas são as mais temíveis por se associarem a um prognóstico muitas vezes reservado.44 Neste ambito devem ser consideradas condições associadas a malignidade: a DC refrataria (DCR) tipo 1 e 2, linfoma de celulas T associado a enteropatia, jejunoileite ulcerativa, carcinoma do intestino delgado e linfoma de células B.43
Nos últimos anos, vários fatores foram apontados com tendo influência na mortalidade como a idade de diagnóstico, forma clínica e adesão à DSG.3,5,43Segundo um estudo de 2017, os doentes celíacos com idade superior a 60 anos ao diagnóstico, apresentaram um risco de complicações malígnas 18 vezes superior ao dos doentes entre os 18 e 40 anos e 9 vezes superior em relação aos doentes diagnosticados entre os 40 e 60 anos.43 Casella et al identificaram uma diferença significativa na prevalência de linfoma não-Hodgkin consoante a idade, tendo surgido em 5% dos idosos e em apenas 0,3% dos restantes adultos.10 Desta forma, o risco de malignidade associado à DC aparenta ter especial relevo no idoso.
Ao contrário dos doentes celíacos em geral, os doentes com DH tem particularmente um risco acrescido de linfoma de celulas B.3 Este risco tem sido associado a baixa adesao à DSG.3,32
Diagnóstico
O diagnóstico de DC no idoso combina habitualmente achados clínicos, serológicos e histológicos e segue as mesmas orientações do diagnóstico no adulto mais jovem.12,16,19,45,46
1. SELEÇÃO DE DOENTES E ABORDAGEM INICIAL
O grau de suspeição de DC no idoso deve ser tão elevado como nos restantes adultos.5 Se probabilidade pré-teste elevada são requeridos tanto um teste serológico como endoscopia digestiva alta (EDA) com biópsias intestinais, mesmo que serologia negativa.12,16,46Para os indivíduos com sintomas gastrointestinais ligeiros, doenças associadas ou condições em maior risco de DC, considera-se uma probabilidade pré-teste baixa e, por isso, e adequado e custo-efetivo a realização de serologia seguida de biópsia, caso o resultado serológico seja positivo.16,45,46
A sensibilidade da avaliação serológica e histológica é substancialmente afetada pela eliminação do glúten da dieta pelo que o diagnóstico deve ser preferencialmente estabelecido durante uma dieta com glúten.12,19
2. ANTICORPOS SÉRICOS
Vários anticorpos têm apresentado elevadas sensibilidade e/ou especificidade perante suspeita clinica de DC não tratada.16,19A utilização de IgA anti-tTG associada ao doseamento de IgA total parece ser o metodo serológico preferencial.16,46
Perante a suspeita de defice de IgA pode ainda ser utlizada a combinacao de IgA e IgG.16,46Outros anticorpos contra os peptídeos deaminados de gliadina (DGP) e contra o endomisio podem auxiliar no diagnóstico.16,45,46
Os falsos-positivos são mais prováveis para títulos inferiores, sobretudo na presença de cirrose, insuficiência cardíaca ou doenças autoimunes concomitantes.19 Os falsos-negativos são geralmente explicados pelo início prévio de DSG, défice de IgA ou enteropatia ligeira.19
Estudos prévios relataram não existir diferenças nos achados serológicos entre idosos e adultos mais jovens.6,31
3. ENDOSCOPIA DIGESTIVA ALTA
A DC afeta sobretudo a mucosa do intestino delgado proximal, embora possa estender-se distalmente.12
Ainda que a EDA não seja suficientemente sensível nem específica para detetar DC, alguns achados endoscópicos levantam a suspeita.12Independentemente da sua presença perante suspeita clínica são recomendadas múltiplas biópsias duodenais.16
É prudente ponderar o atraso da biópsia confirmativa de DC no idoso com comorbilidades, ainda que na prática a EDA seja frequentemente realizada no idoso.5
Recentemente, Shiha et al levantaram a hipótese de existir lesão distal mais pronunciada nos idosos que nos adultos mais jovens, inacessível por EDA. Este pressuposto justificaria a elevada prevalência do défice de vitamina B12 no idoso, já que esta é absorvida no ileo distal.2
4. HISTOPATOLOGIA
Sob microscopia ótica, o aumento de linfóticos intaepiteliais, hiperplasia das criptas e atrofia das vilosidades são achados histológicos característicos de DC.12 Contudo estas alterações não são patognomonicas de DC.19 A infiltração linfocítica do duodeno é comum nos individuos com serologias negativas, mas na maioria dos casos não representa DC.45
Outras causas devem ser excluídas, tais como a infeção por Helicobacter pylori e o uso de anti-inflamatórios não esteróides.16,45
Vários estudos reportaram não existir associação entre o grau de inflamação intestinal e a idade de diagnóstico.6,10,31Recentemente Kalkan et al, demonstraram que os idosos apresentaram com maior frequencia atrofia das vilosidades.30
5. OUTROS TESTES
A presença de HLA-DQ2 e HLA-DQ8 não permite diagnosticar DC, porém a sua ausência é particularmente útil para a descartar.19 A sua utilização deve ser reservada para situações clínicas selecionadas.16,45,46
A videocapsula endoscópica raramente é necessária no diagnóstico de DC. Contudo, pode ser útil em doentes que não reúnem condições para a realização de EDA e na deteção de complicações associadas, por exemplo lesão extensa da mucosa, úlceras ou linfoma.16,46Se a hipótese de Shiha et al se verificar, que postula que os idosos tem doenca intestinal mais distal, a video capsula pode vir a ser vantajosa.2
6. COMO ESTABELECER O DIAGNÓSTICO?
O diagnóstico é facilmente estabelecido nos doentes que, enquanto consomem uma dieta com glúten, apresentam uma serologia positiva e uma biópsia duodenal com histologia sugestiva com atrofia das vilosidades intestinais.45,46
Contudo, indivíduos com atrofia das vilosidades, mas serologia negativa podem corresponder a DC, embora seronegativa.46,47A situacao inversa de serologia positiva mas biópsia normal pode representar tanto DC potencial, como um falso-positivo.47 Na Fig. 1 e apresentado um algoritmo orientativo e sumarizado do diagnostico de DC no idoso.
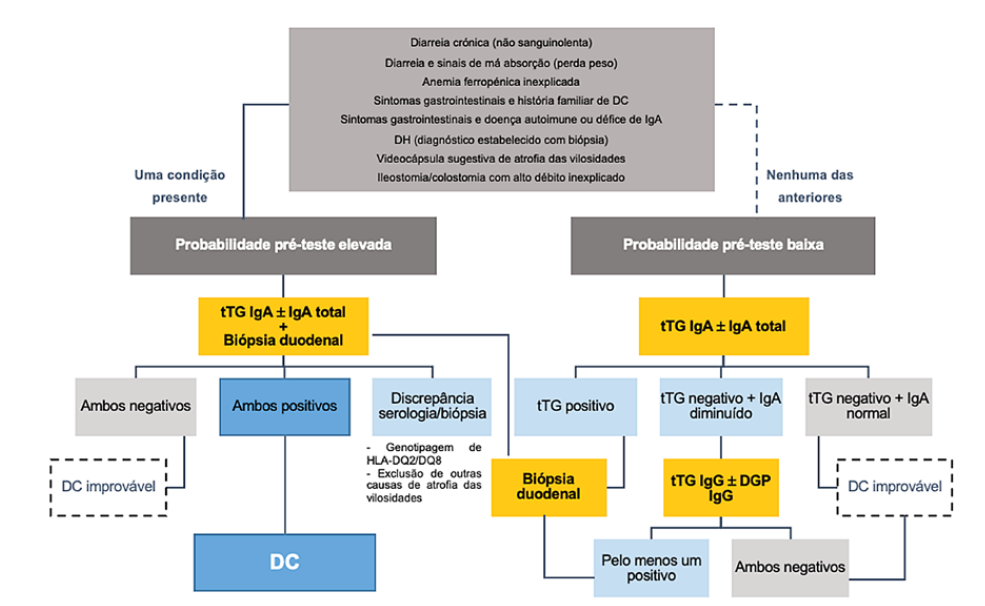
Figura 1: Algoritmo de diagnóstico da doença celíaca (DC) no idoso. DGP, deamidated gliadin peptides (peptídeos deaminados de gliadina); DH, dermatite herpetiforme; HLA, human leukocyte antigen; Ig, imunoglobulina; tTG, tissue transglutaminase (transglutaminase tecidular). Adaptado de Al-Toma A, et al. European Society for the Study of Coeliac Disease (ESsCD) guideline for coeliac disease and other gluten-related disorders. United European Gastroenterol J. 2019;7:583-613.16; e de Rubio-Tapia A, et al. ACG Clinical Guidelines: Diagnosis and Management of Celiac Disease. Am J Gastroenterol. 2013;108:656-7646
Diagnóstico diferencial
A diversidade clínica da DC resulta num vasto leque de diagnósticos diferenciais, especialmente relevante no idoso.5 A investigação é muitas vezes dirigida para descartar condições malignas, como é o caso da anemia microcitica que levanta a hipótese de neoplasia do colon.3,5Também a síndrome da fragilidade do idoso, pode sobrepor-se clinicamente a DC com perda peso, astenia, alterações do humor ou até mudanças nos hábitos intestinais.5 Diarreia, perda peso e dor abdominal são comumente mais indicativas de síndrome do intestino irritavel que DC nesta faixa etária.5
À medida que a investigação avança outras patologias do idoso constam no diagnóstico diferencial de síndrome de má absorção como é caso do sobrecrescimento bacteriano do intestino e insuficiência pancreática exocrina.5 Para além disso, algumas destas situações podem igualmente cursar com atrofia das vilosidades do duodeno, sendo por isso importante conhecer esses diagnósticos diferenciais, particularmente em casos de suspeita de DC seronegativa (Tabela 3).16,46,47
Tabela 3: Outras causas de atrofia das vilosidades do duodeno.
| Infecoes: doenca de Whipple, virus da imunodeficiencia humana, tuberculose, Helicobacter pylori, Giardia |
| Tropical sprue |
| Sobrecrescimento bacteriano do intestino delgado |
| Enteropatia autoimune |
| Enteropatia por farmacos: olmesartan, anti-inflamatorios nao esteroides, micofenolato de mofetil |
| Linfoma intestinal |
| Enterite microscopica |
| Enterite radica |
| Amiloidose |
| Isquemia cronica |
| Desnutricao severa |
| Enterite eosinofilica |
| Doenca de Crohn |
| Doenca do enxerto versus hospedeiro |
| Enteropatia associada a imunodeficiencia comum variavel |
Abordagem Terapêutica
O tratamento mais eficaz da DC consiste na DSG.48 A otimização da gestão da doença exige acompanhamento regular especializado e uma abordagem multidisciplinar e individualizada.3,16,46,49Os objetivos são o controlo dos sintomas, promoção da adesão a dieta e prevenção ou deteção precoce de possíveis complicações.46
1. DESAFIOS DA DIETA SEM GLÚTEN NO IDOSO
O tratamento da DC passa pela adesão estrita e eterna a uma DSG, evitando assim trigo, cevada e centeio.48 Ao contrário do que se poderia esperar, segundo Vilppula et al, os doentes idosos apresentaram uma adesão à terapêutica superior a 90%.29 Na literatura, o diagnóstico em idade avançada constitui frequentemente um fator de risco para má adesão a terapêutica, atendendo aos desafios específicos que os idosos enfrentam.10,19A adoção de uma DSG exige mudança radical nos habitos dieteticos adquiridos ao longo de varios anos.3 O custo e disponibilidade de alimentos alternativos sem gluten habitualmente preocupam os doentes, sobretudo quando se associam a problemas como a mobilidade limitada.24
Já a diminuição da acuidade visual pode impedir a leitura dos rótulos dos alimentos, tornando o idoso celíaco dependente de terceiros nas suas atividades de vida diária.3 A abordagem multidisciplinar com especial relevo para nutricionistas experientes e essencial para que os doentes estejam devidamente informados, e assim aptos para cumprirem uma DSG mas equilibrada.19,50Muitas vezes a DSG e pobre em fibras, o que pode levar a obstipacao.16 A inclusão na consulta de familiares ou o responsável pela alimentação da entidade onde o idoso se encontra institucionalizado, é vantajosa.24
2. SEGUIMENTO E EFEITO DA DIETA SEM GLÚTEN
Após o estabelecimento do diagnóstico é razoável proceder a uma avaliação inicial geralmente analítica e densitometrica para detetar possiveis complicações da má absorção.16,46 No primeiro ano o seguimento deve ser frequente para a avaliação da adesão à DSG. Após estabilização da doença, a avaliação anual é geralmente suficiente.16
O alívio sintomático é tipicamente rápido, em algumas semanas, nos doentes celíacos adultos que iniciam DSG.19,51Vilppula et al relataram uma melhoria significativa dos sintomas gastrointestinais no idoso celíaco com exceção da obstipação.29 Já segundo Casella et al, o alivio sintomático completo após 2 anos de DSG foi menos frequente, com persistência de sintomas em 31% dos idosos, a qual foi atribuída sobretudo a distúrbios funcionais.10
Os títulos serológicos dos idosos respondem significativamente à dieta, com diminuição marcada dos seus valores aos 6 meses.10,19,29Quanto aos achados histológicos, a resposta a DSG por si só é mais demorada, sendo que no idoso a recuperação é ainda mais lenta.52
A DSG habitualmente leva a recuperação da absorção dos micronutrientes.16Vilppula et al, relataram uma melhoria significativa nos valores de ferritina, vitamina B12, D e E nos idosos em DSG.29 Porém, é indispensável uma vigilância dos défices de micronutrientes previamente identificados, recorrendo se necessário a suplementação destes.16,46
Nos doentes celíacos com osteopenia ou osteoporose tem sido descrita uma resposta favorável da DMO a DSG.53 Vilppula et al relataram um aumento significativo do Z-score femoral dos doentes idosos após 2 anos de DSG.29Casella et al descreveram também um aumento da DMO no idoso após a evicção de glúten.10 Para além da DSG, deve ainda ser ponderada a suplementação com vitamina D e cálcio e tratamento com bifosfonatos.16,19,53A repetição da densitometria só deve ser considerada apos 2 anos do início da DSG.53
Segundo Vilppula et al, a qualidade de vida não se alterou após 1 a 2 anos do início da DSG. Ainda assim, o achado e relevante ja que nao se assistiu a uma deterioracao da qualidade de vida.29
Em suma, a evicção do glúten nos doentes celíacos adultos apresenta múltiplos benefícios, possivelmente sobreponíveis no idoso.10,29A adesão à dieta leva a uma melhoria da sintomatologia e da lesão da mucosa, que pode refletir-se no risco cardiovascular e de malignidade.54,55Para além disso, a evicção do glúten facilita a obtenção do peso corporal adequado.56
2.1. Slow-responders
Os slow-responders correspondem aos doentes com persistência ou recorrência de sintomas após 6 a 12 meses de DSG.16 Antes de mais, é importante rever meticulosamente o diagnóstico, embora a etiologia mais frequente seja a contaminação da dieta com glúten sobretudo inadvertidamente.16,19,46
A EDA com biópsias duodenais está recomendada para esclarecer a etiologia dos sintomas.16,46A presença de diarreia persistente, sobretudo com serologias negativas, deve motivar a realização de colonoscopia com biópsias aleatórias para excluir colite microscópica, dada a associação com a DC e a frequência no idoso.57 Outros diagnósticos diferenciais devem ser discutidos.16,19,46
2.2. Doença celíaca refratária
A DCR caracteriza-se pela presença de sintomas persistentes ou recorrentes e lesão intestinal, como atrofia das vilosidades, apesar da evicção estrita de glúten durante pelo menos 12 meses e após exclusão de outras causas para a ausência de resposta, bem como malignidade.12,19Deve ser considerada especialmente nos doentes diagnosticados após os 50 anos de idade.12 Apesar de rara e clinicamente relevante por se associar a malignidade.3,12
São reconhecidos 2 tipos de DCR: tipo 1, com linfócitos intraepiteliais policlonais e com imunofenotipo normal, e tipo 2 com expansão clonal de linfócitos intraepiteliais com imunofenótipo aberrante.12,19Para além da sua associação a complicações como má nutrição, gastrite linfócitica e jejunite ulcerativa, é frequente o desenvolvimento de linfoma de celulas T associado a enteropatia, sobretudo na DCR tipo 2.58 Desta forma, a DCR tipo 2 tem sido considerada uma forma de linfoma intraepitelial de baixo grau.12
Em ambos os tipos de DCR a sobrevida está reduzida, apesar do prognóstico da DCR tipo 2 ser mais reservado (sobrevida aos 5 anos de 50% vs 80% na tipo 1).59
Os doentes com DCR devem ser tratados em centros especializados em DC.19 A DCR tipo 1 apresenta uma boa resposta à terapêutica com corticosteróides e azatioprina.60
Em relação a DCR tipo 2 não há consenso quanto ao melhor tratamento.19 Algumas das terapêuticas propostas incluem: corticosteróides, imunossupressores, ciclosporina, alentuzumabe, cladribina e transplante autologo de celulas hematopoiéticas.61 Os inibidores da IL-15 estão em estudo. Ainda assim, suporte nutricional intensivo associado ao pen-capsule budesonide, e frequentemente a opção terapêutica inicial.19
3. PERSPETIVAS FUTURAS
A terapêutica atual da DC carece de novas opcoes não dietéticas alternativas ou adjuvantes à DSG.19 Atualmente decorrem vários ensaios com novos agentes terapêuticos em diferentes fases de desenvolvimento, alguns destes ja em fases clínicas com recrutamento de doentes celíacos.62 A utilização de endopeptidases bem como de reguladores das tight junctions apresentam resultados promissores.16 Outras opções incluem a indução de tolerância com imunoterapia epitopo-específica, polímeros sequestradores de glúten, inibidores da tTG e bloqueadores HLA-DQ2.16,45
Conclusão
A prevalÊncia da DC no idoso aumentou significativamente nas duas últimas décadas. É fundamental conhecer as particularidades da apresentação clínica e os riscos associados.
Apesar da escassez de resultados, a adesão à dieta não parece ser problemática na idade avançada e a qualidade de vida aparenta não diminuir, apesar das barreiras pessoais, sociais e económicas que os idosos enfrentam. É essencial confirmar os benefícios e averiguar possíveis riscos da DSG no idoso, nomeadamente eventual impacto na qualidade de vida. Uma das questões que se levanta é se compensará diagnosticar a DC e aconselhar uma DSG em idosos com queixas frustes.
Para além da gestão de complicacões da má absorção, os estudos no idoso sugerem a necessidade de uma vigilância adaptada aos seus riscos específicos. Uma avaliação cuidada dos fatores de risco cardiovascular, bem como uma vigilÂncia adaptada ao risco de doença linfoproliferativa, com EDA ou outros exames de imagem, deverão ser consideradas na prática clínica. Evidências adicionais são necessárias para suportarem a necessidade destas medidas.
Nesta revisão proporcionou-se ao leitor o conhecimento e as ferramentas necessárias que podem contribuir para a redução da morbimortalidade no idoso celíaco, reforçando a importância de uma avaliação individualizada que deve melhorar, ou pelo menos nã agravar, a qualidade de vida na idade avancada.