Introdução
As hemorragias intracerebrais (HIC) podem ser classificadas como primárias e secundárias. As HIC primárias, ou espontâneas, representam 70%-80% do total e ocorrem na ausência de trauma, malformações arteriais ou venosas ou cirurgias, estando associadas à rutura de pequenos vasos danificados pela hipertensão arterial (HTA) crónica não controlada ou, nos doentes mais idosos, pela angiopatia amiloide.1Estas podem ainda ser classificadas como lobares (geralmente associadas à angiopatia amiloide) e não-lobares, e ainda como supra e infratentoriais.2 As hemorragias não lobares, ou profundas, estão associadas à HTA crónica não controlada e afetam geralmente as pequenas artérias perfurantes dos gânglios da base, tálamo, protuberância e cerebelo, levando a hemorragias profundas e com frequente dissecção para o espaço in-traventricular. As HIC secundárias estão associadas a diversas patologias congénitas e adquiridas, como as malformações vasculares, tumores, distúrbios da coagulação, vasculites com envolvimento cerebral e trombose venosa cerebral.1
A HIC afeta anualmente mais de 1 milhão de pessoas a nível mundial, representando 9% a 27% do total de acidentes vasculares cerebrais (AVCs) e é o evento vascular cerebral com maior taxa de mortalidade e morbilidade.1,3,4Esta patologia deve ser encarada como um evento agudo parcialmente reversível. Embora exista uma agressão inicial que é irreversível, o efeito de massa e edema gerados pelo hematoma contribuem de forma importante para os défices observados e para uma lesão secundária que pode ser reduzida, em grande parte, pela instituição de medidas médicas imediatas, com comprovadas implicações no prognóstico vital e funcional do doente.
A HTA é o fator de risco mais importante na HIC espontânea, sendo o fator desencadeante em cerca de 60% dos casos.1,5,6Existem, no entanto, outras etiologias da HIC cuja incidência varia com a idade. Nos jovens, as etiologias mais frequentes são as malformações vasculares, os aneurismas e o abuso de drogas quando associados a vasculites, HTA ou aneurismas micóticos. Nos idosos, a HTA, angiopatia amiloide, tumores, vasculopatia e coagulopatia são as patologias mais frequentemente associadas a estes eventos. Estudos recentes identificaram uma mortalidade de 40% no 1º mês após a HIC, que sobe para 54% no primeiro ano, o que demonstra a importância de uma atuação precoce com optimização dos cuidados médicos como principal prioridade.3,7-9
A abordagem neurocirúrgica desta patologia tem de ser enquadrada numa abordagem mais global. Apenas em casos de hidrocefalia aguda ou de compressão do tronco cerebral, como pode acontecer nos hematomas da fossa posterior, se impõe uma ação imediata por parte do neurocirurgião. Em todos os casos devem estar garantidos todos os cuidados médicos antes de ser considerada a cirurgia. Assim, este trabalho de revisão propõe-se a apresentar os dados mais atuais no que toca à abordagem desta patologia, propondo também um algoritmo de tratamento médico, à luz das recomendações das sociedades de maior relevo na área - European Stroke Organisation, Neurocritical Care Society e American Heart Association/American Stroke Association (AHA/ASA).
No restante documento, a sigla HIC passará a referir-se à hemorragia intracerebral primária ou espontânea.
Avaliação Inicial e Diagnóstico
Tratando-se de uma emergência médica, a suspeita clínica deve levar ao rápido diagnóstico e instituição de medidas tera-pêuticas com impacto reconhecido na mortalidade e morbilidade, uma vez que a deterioração clínica é comum nas primeiras horas após o início da hemorragia.1,9Os estudos mostram que mais de 20% dos doentes sofrem uma deterioração do estado de consciência (de 2 ou mais pontos na Glasgow Coma Scale (GCS)) desde a avaliação pré-hospitalar inicial, até à ava-liação inicial no Serviço de Urgência (SU) e que 15%-23% dos doentes mantém uma deterioração clínica continuada ao longo das primeiras horas após a admissão hospitalar.1,9,10Assim, é referida na literatura a “golden hour”, a hora em que deve ser realizado o conjunto seguinte de intervenções6:
Estabilização clínica e avaliação constante do airway, breathing, circulation (ABC);
Rápido e correto diagnóstico através de exame de imagem, nomeadamente tomografia computorizada cranioencefálica (TC-CE);
Avaliação concisa do estado clínico do doente e das caraterísticas da HIC;
-
Avaliação direcionada a alterações potencialmente corrigíveis, nomeadamente:
-
5. Antecipar necessidades específicas de cada doente:
As recomendações da Neurocritical Care Society, sugerem uma lista de itens que devem ser realizados/cumpridos duran-te a primeira hora, no doente com HIC (Fig. 1).6

Adaptada de Hemphill III JC, et al. Emergency Neurological Life Support: Intracerebral Hemorrhage Neurocrit Care. 2017;27:89-101.6
Figura 1: Checklist da HIC para a primeira hora após admissão hospitalar
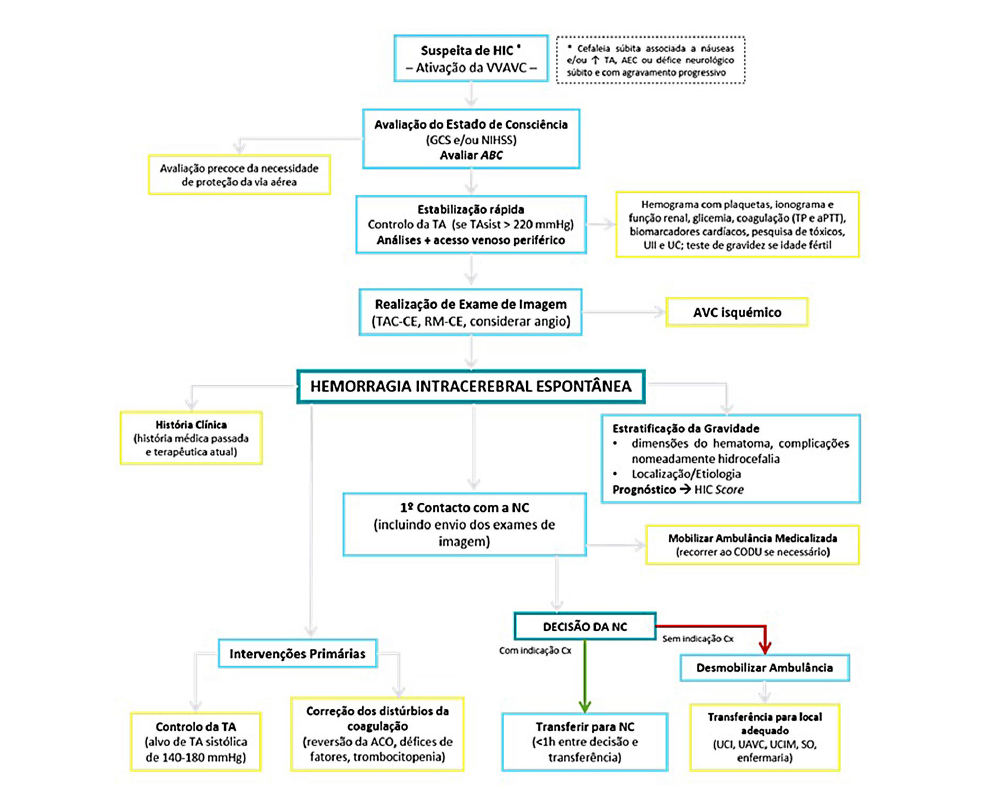
Deve ser colocada a hipótese de HIC em qualquer doente com défices neurológicos focais de início súbito, cefaleia intensa, vómitos, elevação da TA sistólica ou alteração do estado de consciência.1,11Independentemente da causa ser isquémica ou hemorrágica, a abordagem inicial no pré-hospitalar ou no SU é semelhante, sendo os exames de imagem fundamentais para o diagnóstico mais preciso.
PRÉ-HOSPITALAR
A abordagem no pré-hospitalar deve ser também ela focada no ABC, com suporte ventilatório e cardiovascular conforme necessário, colheita de uma anamnese sumária - tempo de início dos sintomas, antecedentes pessoais, medicação utilizada, nomeadamente utilização de anticoagulantes/antiagregantes e uso de substâncias ilícitas e o rápido transporte para uma unidade hospitalar capaz de avaliar e orientar o doente, idealmente com contacto prévio de forma a agilizar a orientação do doente à chegada ao hospital, minimizando os tempos de atuação.6,9
SERVIÇO DE URGÊNCIA
Segundo as recomendações, todos os Serviços de Urgência/Hospitais devem estar preparados para tratar os doentes com HIC confirmada ou para os transferir rapidamente para um Hospital de referência com essa capacidade.
Os elementos essenciais da avaliação de um doente em termos de história clínica, exame físico e exames complemen-tares de diagnóstico estão espelhados na Fig. 2.9
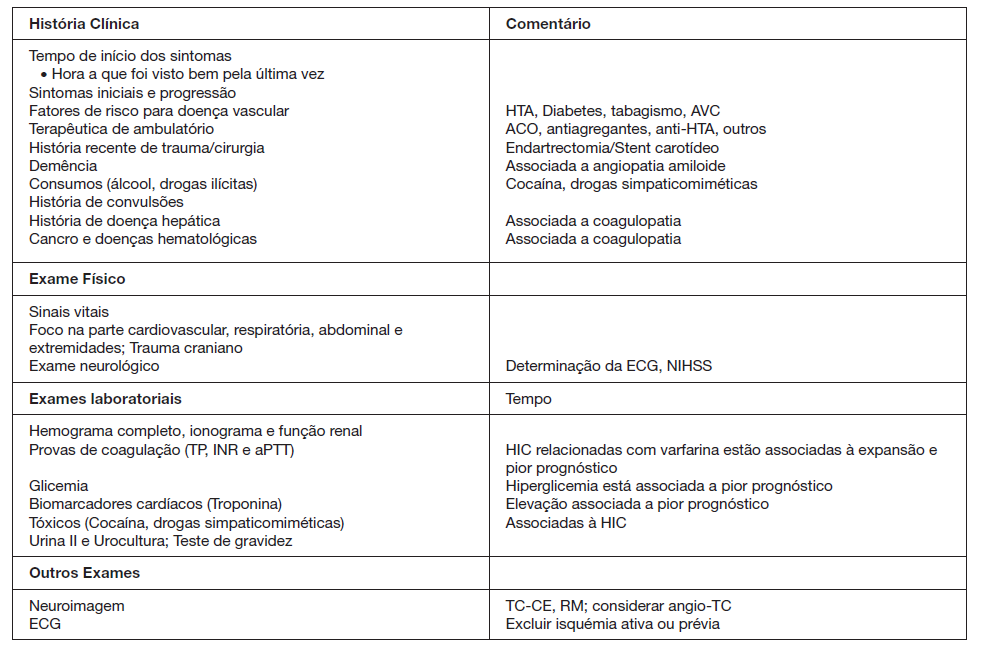
Adaptada de Hemphill JC III, et al. Guidelines for the management of spontaneous intracerebral hemorrhage: a guideline for healthcare professionals from the American Heart Association/American Stroke Association. Stroke. 2015;46:2032-60.9
Figura 2: Componentes da história clínica, exame físico e exames complementares de diagnóstico nos doentes com suspeita e/ou diagnóstico de HIC.
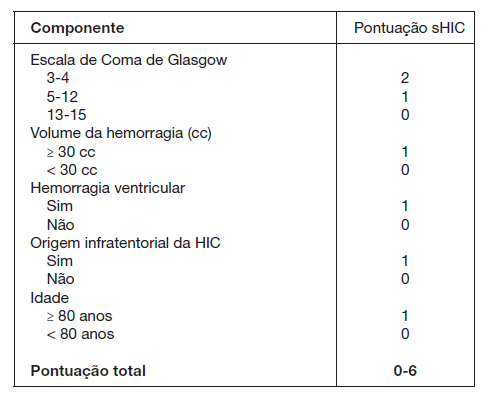
A avaliação do doente é obtida pela realização do exame neurológico juntamente com a aplicação de escalas de gravi-dade como a GCS, a National Institutes of Health Stroke Scale (NIHSS) score oscore HIC (sHIC). O sHIC é, atualmente, a escala de gravidade mais comummente utilizada na classificação de doentes com HIC, combinando dados demográficos, condição clínica e exames de neuroimagem (Fig. 3). Estes core é mais uma ferramenta de avaliação, não sendo recomendada a sua utilização como forma de triagem de doentes com prognóstico vital mais reservado ou como justificação para limitação terapêutica.12 Após o diagnóstico, a transferência do doente com HIC para uma unidade com nível de vigilância adequado à gravidade do quadro - Unidades de AVC, de Cuidados Intermédios ou Intensivos - deve ser agilizada com a maior brevidade possível.3,6
NEUROIMAGEM
Em situações de início súbito de défices neurológicos focais, a etiologia vascular é presumida até ser descartada. Não existe um conjunto de sinais/sintomas que permita distinguir a etiologia isquémica da hemorrágica com precisão, embora sintomas como os vómitos, TA sistólica > 220 mmHg, cefaleia intensa, alteração do estado de consciência ou agravamento progressivo dos défices ao longo de minutos ou horas, são mais sugestivos de HIC. Desde modo, é mandatória a realização de um exame de imagem que permita definir rapidamente a etiologia.6 Tanto a TC, como a ressonância magnética (RM) são eficazes nesta distinção. Dada a maior acessibilidade e elevada sensibilidade na deteção de hemorragia intracerebral, a TC cranioencefálica (TC-CE) é, atualmente, considerada como o gold standard do diagnóstico de HIC, apesar de a RM apre-sentar uma sensibilidade semelhante à da TC.1,13,14
Embora a localização do hematoma seja importante, como mostra o sHIC, o volume do hematoma é um maior preditor do outcome. A utilização da fórmula ABC/21 é uma forma razoável de fazer esta estimativa: deve ser selecionado o corte axial com a maior extensão de hematoma, de forma a obter o maior diâmetro do hematoma (A); no mesmo corte axial, perpendicular a (A), é medido o maior diâmetro da hemorragia (B); finalmente, são contabilizados o número de cortes em que o hematoma está presente e este número é multiplicado pela espessura em centímetros dos cortes axiais, de forma a obter (C). Se num determinado corte, a área de hematoma corresponder entre 25-75% da área de referência (onde foram determinados A e B), este corresponde a meio corte e se a área de hematoma for <25% da área de referência, este corte não é contabilizado.6,15,16
O agravamento neurológico nas primeiras horas é comum, e em grande parte relacionado com o aumento das dimensões do hematoma devido a hemorragia ativa, estando associado a pior prognóstico funcional e aumento da mortalidade. Diversos estudos sugerem que a realização de contraste endovenoso (EV) durante a TC inicial pode identificar extravasamento do mesmo no interior do hematoma e que a presença deste sinal -spot sign- é um grande preditor de crescimento do hematoma.6,17
Assim, as recomendações mais recentes sugerem que o protocolo de TC na HIC inclua o TC-CE sem contraste inicial, seguida de TC-CE com angiografia de forma a detetar este spotsign, bem como eventuais malformações vasculares.6
Tratamento Médico Primário da Hemorragia Intracerebral
As intervenções médicas na HIC podem dividir-se em primárias e secundárias, dependendo do tempo da sua instituição. Em termos de intervenções primárias, as recomendações mais recentes definem 3 pilares - controlo rigoroso da TA, correção da coagulopatia, avaliação e rápida intervenção neurocirúrgica no sentido de drenagem do hematoma, caso indicado.6
CONTROLO DA TENSÃO ARTERIAL
Elevação da TA é extremamente frequente na HIC. Este aumento da TA está associado à expansão do hematoma, mas também a um aumento da PIC com agravamento do edema cerebral e a um pior outcome funcional. Por outro lado, a diminuição abrupta da TA pode estar associada a aumento da isquémia nas áreas perihematoma, pela diminuição da perfusão, embora estas suposições não tenham sido observadas nos estudos mais recentes.1,6,18-20
As recomendações mais recentes são a favor da redução da TA sistólica para <140 mmHg. Estas recomendações têm como base 3 estudos - INTERACT, INTERACT2 E ATACH.3,21-24Posteriormente à publicação das mesmas, foram publica-dos os resultados do estudo ATACH2,25 que mostrou não haver diferenças em termos de outcome quando comparados os dois grupos, um com TA sistólica <140 mmHg e outro com TA sistólica <180 mmHg. Deste modo, segundo as recomendações da Neurocritical Care Society (de 2017) é razoável o objetivo de TA sistólicas entre os 140-180 mmHg.6 Para TA sistólicas >220 mmHg, o ideal de TA é menos claro, mas a redução rápida com labetalol, associada a monitorização frequente, é uma estratégia razoável.1
O labetalol é um fármaco com efeito de ação rápido com antagonismo alfa e beta adrenérgico. As doses iniciais devem ser entre 5-20 mg ou 0,25-0,5 mg/kg a cada 15 minutos, seguidos de infusão de 2-4 mg/min até ser atingido o valor alvo de TA e manutenção entre 5-20 mg/hora, numa dose máxima de 300 mg/dia em algumas recomendações. Dada a ausên-cia de antagonistas dos canais de cálcio como a nircadipinina ou a clevedipina, não disponíveis em Portugal, está recomendado, como 2ª linha e apenas nos casos em que o labetalol na dose máxima de 300 mg/dia não é suficiente, a utilização de nitroprussiato. O nitroprussiato causa vasodilatação cerebral, alterações na autorregulação cerebral e elevação da PIC, pelo que apenas deve ser utilizado após a titulação máxima do labetalol e nunca de forma isolada, dado os seus efeitos potencialmente deletérios. Doses entre 0,25-10 μg/kg estão preconizadas.6 Em Portugal existe ainda o urapidilo, um bloqueador α1-adrenérgico com formulação endovenosa e utili-zado em contexto de crise hipertensiva, que pode constituir uma alternativa ao labetalol e nitroprussiato.
REVERSÃO DA COAGULOPATIA
Alterações da coagulação são uma das potenciais causas de HIC, com relevância crescente com o envelhecimento da população e aumento da utilização de anticoagulantes orais (ACO) ou antiagregantes plaquetários (AAP).6 Para além de causa precipitante de HIC, os anticoagulantes/antiagregantes são um fator de risco para a expansão do hematoma. Os números mais recentes publicados na literatura apontam para que 12%-20% dos doentes com HIC estejam sob terapêutica com ACO, sendo os antagonistas da vitamina K (AVK), como a varfarina, os mais frequentes, embora com taxas crescentes de utilização dos novos ACO (NOACs).1,9Os grandes estudos por trás dos NOACs, nomeadamente ROCKET AF para o rivaroxabano,26 RE-LY para o dabigatrano,27ARISTOTLE para o apixabano28 e ENGAGE AF-TIMI 48 para o edoxabano,29 todos mostraram superioridade no que diz respeito ao risco de HIC.
No que diz respeito à reversão da coagulopatia associa-da aos AVK as recomendações internacionais mais recentes dizem que em todos os doentes com INR > 1,4 deve ser administrada terapêutica capaz de reverter rapidamente esta anticoagulação para valores de INR < 1,4.1,6,9A administração de vitamina K por si só é insuficiente para uma reversão rápida e eficaz nas primeiras horas, uma vez que a sua ação começa cerca de duas horas após a administração e atinge o pico apenas às 24 horas, em doentes sem alterações hepáticas relevantes. Mesmo assim, todas as recomendações preconizam a administração desta em doses entre 5-10 mg EV como parte da terapêutica de reversão da coagulopatia associada aos AVK.3 A reversão da coagulopatia em poucos minutos é fundamental e tem impacto na sobrevida e outcome funcional dos doentes, pelo que, para além da vitamina K, está indicada a utilização de concentrado protrombinico (CPT) ou plasma fresco congelado (PFC).9 O CPT contém elevadas concentrações de fatores II, VII, IX e X, e é capaz de reverter totalmente o efeito dos AVK em poucos minutos, tal como acontece com o PFC, que contém os fatores I (fibrinogénio), II, V, VII, IX, X, XI e XIII e antitrombina. As recomendações atuais defendem a utilização de CPT em primeira linha, com a utilização de PFC apenas em situações em que o primeiro não está disponível.1,30Esta preferência prende-se com o facto de que, para atingir a rápida reversão da coagulopatia associada aos AVK são necessários grandes volumes de PFC, com risco importante de hipervolémia e edema pulmonar bem como o atraso na administração associado à tipagem. Não estando propriamente definido nas recomendações, doses de CPT de 25-50 UI/kg e de PFC 10-20 mL/kg são razoáveis, devendo haver ajuste consoante o valor de INR. Esta terapêutica deve ser realizada com o apoio de especialistas de Imunohemoterapia.
Em relação aos doentes sob terapêutica com AAP, o estudo PATCH, um ensaio clínico que estudou a transfusão de plaquetas em doentes com HIC sob terapêutica antiagregante durante pelo menos 1 semana após o evento, não mostrou benefício em termos de outcome e esteve associado a um risco aumentado de morte e ocorrência de eventos adversos. Deste modo, as recomendações mais recentes não preconizam a transfusão de plaquetas na maior parte dos casos de HIC em doentes sob antiagregação.6,30,31
Tal como já referido, os NOACs são cada vez mais uma realidade, embora existam ainda poucos estudos no que diz respeito especificamente à HIC. Apesar de os grandes estudos dos NOACs mostrarem que a taxa de HIC é inferior à da varfarina, a reversão rápida do efeito desta última é possível e tem impacto na mortalidade. Os estudos mais recentes mostram uma incidência anual de hemorragia major na ordem dos 3%-4%, sendo que a HIC representa 13% (8%-16%) do total de hemorragias. Apesar de representar apenas cerca de 1/8 do total de hemorragias causadas por NOACs, a mortalidade associada representa quase metade do total de mortes relacionadas com os NOACs.32,33
No que diz respeito ao inibidor direto da trombina (dabigatrano), existe o idarucizumab, um anticorpo monoclonal que se liga com maior afinidade ao local de ligação do dabigatrano na trombina. Este é atualmente recomendado como estratégia inicial de reversão da coagulopatia associada ao dabigatrano. Segundo o estudo REVERSE AD, mais de 99% dos doentes obtiveram uma reversão completa da coagulopatia, com esta a iniciar-se apenas alguns minutos após a administração. A dose recomendada pelo fabricante é de 5 g, dividido em duas administrações EV que devem ser realizadas com 15 minutos de intervalo.34 Alguns estudos mostram que, após 12-24 horas da administração do idarucizumab, podem reaparecer os efeitos anticoagulantes do dabigatrano. Este facto deve-se a uma redistribuição da molécula dos tecidos para o plasma e, nesse caso, pode ser necessária nova administração do antídoto. A administração de carvão ativado na dose de 50 mg está indi-cada nas situações em que a última administração de dabigatrano tenha ocorrido há menos de 2 horas.6
No que diz respeito aos inibidores do fator Xa (rivaroxa-bano, apixabano e edoxabano), existe o andexanet alfa, uma molécula de fator Xa recombinante que mostrou ser eficaz na reversão da inibição do fator Xa, estando já aprovado pela European Medicines Agency. Um bolus inicial seguido de infusão durante 2 horas mostrou reduzir a atividade anti-fator Xa em doentes com hemorragia major associada a estes anticoagulantes.35 Tal como acontece com os inibidores diretos da trombina, pensa-se que a utilização de CPT tenha uma eficácia limitada na reversão da coagulopatia associada ao apixabano e rivaroxabano.6 No caso da última ingestão ter ocorrido há menos de 2 horas, administração única de carvão ativado.1
Em termos de outras formas de reversão descritas na literatura é particularmente importante destacar o papel da hemodiálise nas hemorragias associadas ao dabigatrano, principalmente em situações de sobredosagem, e ainda o CPT ativado (CPTa) na reversão da coagulopatia associada aos inibidores do fator Xa e inibidores diretos da trombina apenas se o CPT não for eficaz.9 A dose preconizada nas recomendações mais recentes é de 50 UI/kg.
A reversão da coagulopatia associada à heparina não fraccionada (HNF) é feita com o sulfato de protamina (SP) na dose de 1 mg por cada 100 UI de HNF administrada nas 2 horas anteriores, numa dose máxima de 50 mg.6,36Dada a curta semi-vida da HNF, as recomendações não preconizam administração de SP se a última dose tiver sido administrada há mais de 4 horas. No caso das heparinas de baixo peso molecular (HBPM) - enoxaparina, dalteparina, tinzaparina ou nadropari-na, também está recomendada a administração de SP apenas em situações de administração terapêutica e não profilática, sendo que o seu efeito na reversão destas pode ser incompleto. No caso da enoxaparina, se a administração tiver ocorrido até 8 horas antes, deve ser administrado 1 mg de SP por cada mg de enoxaparina e se tiver sido administrada 8-12 horas antes, deve ser administrado 0,5 mg de SP por mg de enoxaparina. Em relação às restantes HBPM, deve ser administrado 1 mg de SP por cada 100 U anti-Xa, numa dose máxima de 50 mg, podendo ser repetida metade da dose inicial se mantiver hemorragia ativa ou em casos de insuficiência renal.1
Finalmente, no que diz respeito à administração de fárma-cos trombolíticos, nomeadamente rtPA, não existe atualmente recomendação por parte das principais sociedades. No entanto, os estudos mais recentes mostram que a administração de 10 U de crioprecipitado, um preparado colhido a partir do PFC e rico em fator VIII e fibrinogénio, pode ser considerado na reversão da coagulopatia associada. Se o nível de fibrinogénio após a administração do crioprecipitado for inferior a 150 mg/dL, pode ser considerada nova administração. No caso de este não estar disponível ou estar contraindicado, um antifibrinolítico pode ser tentado, nomeadamente ácido tranexâmico na dose de 10-15 mg/kg EV ou ácido ε-aminocapróico 4-5 g EV.1
Estas recomendações estão resumidas na Fig. 4.
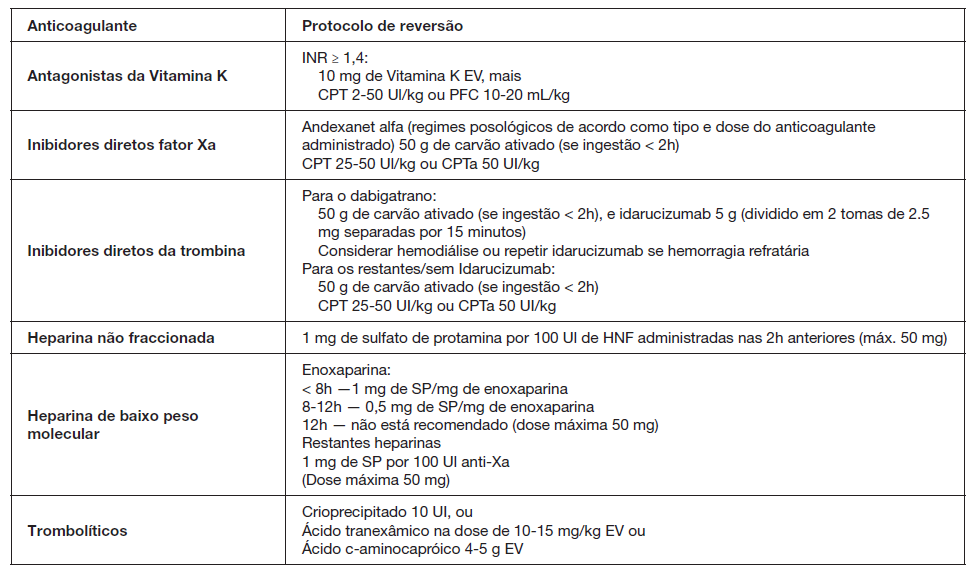
Adaptada de Frontera JA, et al. Guidelines for reversal of antithrombotics in intracranial hemorrhage: a statement for healthcare professionals from the Neurocritical Care Society and Society of Critical Care Medicine. Neurocrit Care.2016;24:6-46.30
Figura 4: Resumo das recomendações para reversão da coagulopatia em doentes com HIC
Intervenções Médicas Secundárias e Vigilância e a HIC
As recomendações defendem que os doentes com HIC devem idealmente manter vigilância e tratamento em Unidade de Cuidados Intensivos (UCI), dado o risco de agravamento clínico por expansão do hematoma, hidrocefalia ou edema cerebral e incapacidade de proteger a via aérea. A admissão destes doentes em unidades de cuidados neurocríticos melhora o outcome quando comparado com admissão em outras unidades.6,9Nos casos em que é necessária a transferência do doente para hospitais com esta valência, a mesma deve ser realizada de forma precoce.
Para além do controlo apertado da TA e a correção de coagulopatias, fazem também parte da abordagem terapêutica médica uma série de fatores que podem e devem ser pesquisados ativamente e corrigidos de forma precoce e rápida, nomeadamente a monitorização da glicémia, o controlo da temperatura corporal, a identificação e tratamento de crises convulsivas e estados de mal não epiléticos, a identificação de sinais/sintomas de hipertensão intracraniana e a minimização do risco de eventos tromboembólicos.6
HIPER/HIPOGLICEMIA
A hiperglicemia na admissão hospitalar dos doentes com HIC, está associada a um aumento do risco de morte e mau outcome funcional, independentemente de o doente ser ou não diabético.1,37Apesar de haver estudos que mostraram uma melhoria em termos de outcome com o controlo apertado da glicémia (80-110 mg/dL) através de perfusões de insulina, estudos mais recentes mostraram uma maior incidência de hipoglicémia cerebral nestes doentes, associada a uma maior taxa de mortalidade.9,38As últimas recomendações não definem valores alvo de glicémia, mas são unânimes no que diz respeito à evicção da hiperglicemia e sobretudo da hipoglicemia, tentando manter ao máximo a normoglicemia, com alguns ensaios a definirem valores alvo entre 100-150 mg/dL.1,9,39
HIPERTERMIA/FEBRE
Dados publicados na literatura mostraram que a hipertermia está associada a um pior outcome.3,40,41A hipertermia mantida é um fator independente de mau prognóstico, principalmente nos doentes que sobrevivem após as primeiras 72 horas. Apesar destes resultados, os estudos mais recentes tanto com hipotermia terapêutica, como com normotermia não mostraram melhorias no prognóstico funcional nem na mortalidade.42,43Assim, atualmente não existem recomendações taxativas, embora tanto as recomendações da AHA/ASA como da Neurocritical Care Society preconizem o controlo/tratamento da hipertermia.
PROFILAXIA DO TROMBOEMBOLISMO VENOSO (TEV)
Hoje em dia sabe-se que os doentes com HIC têm risco aumentado de TEV, com taxas de TVP sintomática que variam entre 1%-5% e de tromboembolismo pulmonar (TEP) entre 0,5%-2%, sendo que até metade das embolias pulmonares nestes doentes são fatais. É recomendado o início da tromboprofilaxia, através da utilização de sistemas de compressão pneumática intermitente, desde o dia da admissão.3,44,45 Apesar de poderem ser utilizadas em caso de indisponibilidade dos sistemas de compressão pneumática intermitente, as meias de compressão elásticas não ajudam a reduzir o risco de TVP.3
O início de profilaxia farmacológica com HBPM ou HNF, pode ser iniciada após 48 horas se documentada a estabilização do hematoma por neuroimagem. Em caso de TVP ou TEP, a anticoagulação terapêutica pode e deve ser equacionada, devendo ser tida em conta a estabilidade do hematoma, a causa da hemorragia e o tempo de apresentação. Em caso de contraindicação para a anticoagulação, deve ser considerada a colocação de filtro na veia cava inferior.1,9,46
CRISE CONVULSIVA
Os doentes com HIC apresentam um risco aumentado de ocorrência de crises convulsivas, sendo de aproximadamente 16% na primeira semana, com a maioria dos casos a ocorrer na admissão ou nas primeiras horas.1,47,48Em doentes comatosos, o risco de estado de mal não-convulsivo pode chegar aos 20%. O principal fator de risco é a presença de hematoma lobar com envolvimento cortical.6,49
Alguns estudos mostraram que a administração profilática de terapêutica anticonvulsivante reduz a ocorrência de crises convulsivas em doentes com HIC lobar. No entanto, dois estudos mais recentes, concluem que a administração profilática de anticonvulsivantes, principalmente de fenitoína, está associada a pior outcome funcional.50,51Assim, as recomendações atuais não preconizam a utilização de anticonvulsivantes profiláticos.9 Por outro lado, a crise convulsiva deve ser tratada e a monitorização com eletroencefalograma (EEG) deve ser realizada em todos os doentes cuja alteração do estado de consciência não seja completamente explicada pela lesão.1,3,9,38
ELEVAÇÃO DA PIC E MEDIDAS MÉDICAS DE CONTROLO
A hipertensão intracraniana (HTIC) aguda é definida como uma elevação da PIC >20 mmHg por mais de 5 mi-nutos em doentes não estimulados.6,52Nos doentes com HIC, esta ocorre geralmente no contexto de edema cerebral associado à lesão hemorrágica ou em doentes com hemorragia intraventricular, com risco aumentado de hidrocefalia. Independentemente da causa, a HTIC é uma emergência médica que requer rápido diagnóstico e instituição de terapêutica (médica ou cirúrgica), já que está associada a maior morbilidade e mortalidade.52 As recomendações atuais derivam das realizadas para a lesão cerebral traumática53 e preconizam a monitorização da PIC em doentes com GCS < 8, hematomas de grandes dimensões com sinais de efeito de massa e elevação da PIC e doentes com hidrocefalia. O alvo da PIC deve ser de <20 mmHg, com uma pressão de perfusão cerebral (PPC) entre 50-70 mmHg. A colocação de sensores de PIC, sejam eles intraparenquimatosos ou intraventriculares (em doentes com hidrocefalia aguda) permitem a monitorização constante e, no caso dos sensores intraventriculares, efetuar ainda a drenagem de líquido cefa-lorraquidiano de forma a resolver a hidrocefalia.6,9,52
Em hospitais sem a especialidade de Neurocirurgia, a monitorização invasiva da PIC é impossível, pelo que se torna fundamental prestar atenção aos sinais clínicos de HTIC. Os mais comuns são o agravamento progressivo do estado de consciência, presença de défices neurológicos focais (mais associado à presença de herniação), anisocoria, pupilas médias e não reativas, respiração de Cheyne-Stokes, diabetes insipidus, náuseas/vómitos ou a tríade de Cushing (HTA, bradicardia e bradipneia) em situações mais tardias com afeção do tronco cerebral.
A abordagem desta condição faz-se através de medidas gerais, como a elevação da cabeceira a 30º, o posiciona-mento da cabeça na linha média sem desvios ou rotações, preenchimento vascular e a evicção da hipertermia e da hiperglicemia. As medidas cirúrgicas, não serão abordadas pois excedem o objetivo deste protocolo.3,9
Em doentes com alteração do estado de consciência, incapazes de proteger a via aérea ou com quadros de desorientação e agitação psicomotora, é necessária sedação para entubação orotraqueal e ventilação mecânica invasiva (VMI). A sedoanalgesia dos doentes é idealmente realizada com a combinação de um agente sedativo/hipnótico como o propofol ou midazolam, com um analgésico opióide, nomeadamente fentanilo ou remifentanilo.52,54
A otimização da perfusão cerebral é outro aspeto importante da intervenção médica nestes doentes. Nos doentes hipotensos, pela autorregulação existente, a vasodilatação compensatória das arteríolas intracerebrais leva a um aumen-to do fluxo sanguíneo cerebral e consequente aumento da PIC. Neste caso, a utilização de terapêutica vasopressora (ex. noradrenalina), permite aumentar a TA média (TAm), com au-mento da PPC e consequente vasoconstrição das arteríolas intracerebrais e diminuição da PIC. Por outro lado, os doentes com elevação da TAm (> 110 mmHg) e da PIC (>20 mmHg) podem ser candidatos a terapêutica vasodilatadora de curta ação, nomeadamente labetalol, de forma a neutralizar o efei-to do aumento da PIC associado ao aumento da TAm. Esta regulação deve ser feita de forma muito cuidadosa, evitando fármacos como o nitroprussiato pelo efeito vasodilatador intracerebral e consequente aumento da PIC.52,53
Nos doentes sob VMI, a hiperventilação com objetivo de induzir uma alcalose respiratória, com pressão parcial de dióxido de carbono (pCO2) na ordem dos 25-30 mmHg, leva a uma vasoconstrição das arteríolas intracerebrais e redução da PIC. O pico de efeito da hiperventilação ocorre nos primeiros 30 minutos e tem uma duração de cerca de 1-3 horas, após o qual deixa de ser tão eficaz devido aos mecanismos de compensação do LCR. Deve, por isso, ser utilizado como uma medida temporária, como ponte para outras terapêuticas. Pensa-se ainda que a hiperventilação “exagerada”, com pCO2 < 25 mmHg pode condicionar isquémia cerebral devido à vasoconstrição extrema.52-55
As medidas osmóticas são talvez a principal arma da tera-pêutica médica no controlo da PIC. Os diuréticos osmóticos reduzem o volume cerebral através da remoção da água livre para a circulação sanguínea. Dentro destes, está preconiza-da a utilização de manitol ou de soro hipertónico.1 A dose recomendada de manitol não é consensual, variando entre 0,25-2 g/kg/dose, com as principais recomendações a preconizarem doses na ordem dos 1-2 g/kg administradas a cada 6-8 horas, infundidas ao longo de 30 minutos. No que diz respeito ao soro hipertónico, a administração de bólus de 150 mL de cloreto de sódio a 3% tem um efeito relativamente rápido, podendo ser repetido, mantendo uma monitorização rigorosa.56 Os estudos mais recentes apontam para superioridade do soro hipertónico em comparação com o manitol.57 Em doentes euvolémicos e com função renal normal qualquer uma das opções parece válida e eficaz na redução rápida da PIC. Em doentes hipovolémicos e taquicardicos, a utilização de manitol pode agravar a hipotensão no contexto da diurese osmótica provocada.52 Em doentes com hipernatrémia pode eventualmente ser preferível a utilização de manitol em detrimento do soro hipertónico, dado o potencial de agravamento da hipernatrémia.
Está provado clinicamente que a hipotermia, com uma temperatura alvo de 33ºC é capaz de reduzir a PIC dos doentes com HTIC, no entanto, apesar desta redução consistente, os estudos não mostraram que esta intervenção tenha tido impacto em termos de outcome a longo prazo.3,52,58
OUTRAS COMPLICAÇÕES MÉDICAS
A frequência de complicações médicas no doente internado por HIC é bastante elevada, com alguns estudos a mostrar a ocorrência de pelo menos um evento adverso em até 88% dos doentes. Destas, 40% são complicações graves e que conduziram a prolongamento do tempo de internamento ou mesmo a desfechos fatais. As complicações mais frequentes são a pneumonia, com uma incidência de 5,6%, aspiração em 2,6% dos casos, falência respiratória em 2% dos casos, TEP, com uma incidência de 1,3% e sépsis em 1,7% dos doentes. Até 50% das mortes em doentes com HIC ocorreram em contexto de complicações médicas, geralmente após 7 dias de internamento.9
A disfagia é um dos fatores de risco major para a ocorrência de aspiração e consequentemente de pneumonia, tendo impacto no prognóstico tanto em termos de mortalidade, como de morbilidade. Testar formalmente a disfagia ajuda a reduzir este risco, pelo que esta avaliação é recomendada em todos os doentes. A entubação nasogástrica é fundamental em doentes com alteração do estado de consciência ou em doentes conscientes com disfagia grave, uma vez que está recomendado o início da alimentação entérica nas primeiras 24 horas após o evento hemorrágico.9
Os eventos cardiovasculares podem também ocorrer em doentes com HIC. Embora não seja comum a ocorrência em simultâneo de HIC e enfarte agudo do miocárdio, esta associação apresenta uma mortalidade elevada, pelo é recomendado o screening através de ECG e doseamento de biomarcadores cardíacos nos doentes com HIC.9
Outras complicações que podem ocorrer em doentes com HIC incluem a lesão renal aguda, a hiponatrémia ou hipernatrémia (muitas vezes associada à terapêutica médica para controlo do aumento da PIC), hemorragia gastrintestinal, défices nutricionais, infeções do trato urinário e depressão pós-AVC. Recomenda-se a monitorização rigorosa para prever e evitar ou tratar precocemente as complicações que vão surgindo.9
Algoritmo de Abordagem
Para concluir, na Fig. 5 apresentamos um resumo da avaliação e abordagem terapêutica dos doentes com HIC.