Introdução
A área oncológica encontra-se em constante evolução científica, com uma utilização crescente da imunoterapia em doenças hematológicas. Porém, a aplicação clínica destas terapêuticas acentua a necessidade de se avaliar os seus possíveis efeitos adversos, assim como compreender qual a correta abordagem e terapêutica dos mesmos.
A síndrome de libertação de citocinas (SLC), também denominada por tempestade de citocinas, corresponde a uma resposta inflamatória sistémica, com libertação massiva de citocinas e uma resposta imune exacerbada.1Esta síndrome pode ser desencadeada por diversos fatores, tais como infeções e/ou fármacos.1 A SLC é o efeito adverso mais frequente após a infusão de células T com recetores de antigénio quimérico (CAR-1). As CAR-T são células T autólogas geneticamente modificadas para expressar o domínio intracelular de um recetor de células T, fundindo o domínio de ligação ao antigénio de um receptor de células B.2•3Portanto, esta terapêutica baseia-se na colheita de células T e na sua alteração genética em CAR-T, infundindo-as posteriormente no doente de forma a destruir as células cancerígenas. As células T ativadas produzem citocinas e quimiocinas, tais como interleucina (IL) 1, IL-2, IL-2R-a solúvel, interferão-y (IFN-y), IL-6, IL-6R solúvel, IL-8, IL-10, fator de necrose tumoral (TNF) e fator estimulador de colónia de granulócito-macrófago (GM-CSF). As células imunológicas circundantes, tais como monócitos, macrófagos e células dendríticas, também produzem citocinas, contribuindo para um estado generalizado de ativação imunológica.2-4
Diversos ensaios clínicos evidenciaram a eficácia da infusão de CAR-T no tratamento de neoplasias hematológicas.5 Dois tipos de CAR-T dirigidas a CD19, axicabtagene ciloleucel e tisagenlecleucel, foram recentemente aprovados no tratamento de linfoma não-Hodgkin (LNH) refratário/recidivante (R/R), encontrando-se este último também aprovado na leucemia linfóide aguda (LLA) R/R.5•6
Apesar do maior conhecimento e incidência da SLC em doentes sob tratamento com CAR-T, esta sintomatologia já foi descrita após terapêuticas baseadas em anticorpos, fármacos anti-tumorais não baseados em proteínas (como a oxaliplatina e a lenalidomida), bem como em cenários de transplante de células estaminais de dadores haploidênticos.1 Para além disso, foi também reportado em doentes sob blinatumomab e em terapêuticas com células recetoras de antigénio quimérico natural killer, segundo estudos préclínicos.6
Este trabalho de revisão propõe-se caracterizar a SLC em doentes oncológicos sob terapêutica com CAR-T, com um enfoque particular na clínica e gestão terapêutica desta síndrome.
EPIDEMIOLOGIA E FATORES DE RISCO
A incidência de SLC em doentes oncológicos sob imunoterapia depende da terapêutica em causa.7 O risco associado ao tratamento com CAR-T encontra-se devidamente descrito em diversos estudos.7·8De facto, diversos ensaios clínicos de doentes adultos e pediátricos com neoplasias hematológicas tratadas com CAR-T relataram uma incidência variável da síndrome, com a incidência de SLC de qualquer grau a variar de 35% a 100% e de SLC grave de 1 % a 28%.7 Acredita-se que as crianças apresentem um risco superior comparativamente aos adultos.8
O início precoce de SLC após infusão, principalmente quando surge nas primeiras 72 horas, é indicador de uma maior probabilidade de SLC grave. Adicionalmente, o "efeito primeira dose", ou seja, o aparecimento de efeitos adversos mais graves após a primeira infusão de CAR-T, relacionase com a carga da doença, e são ambos preditores de SLC grave.1 De facto, está descrita uma maior incidência deste fenómeno em doentes com LLA com elevada carga de doença, assim como após administrações de alta dose de CAR-T.1-4
Uma maior incidência de SLC foi observada em doentes com LLA comparativamente aos com LNH e leucemia linfocítica crónica (LLC), bem como em doentes após linfodepleção com ciclofosfamida ou fludarabina antes da infusão de CAR-T.1,4
Além disso, o estado inflamatório pré-existente (valores de ferritina elevados) e a ativação endotelial de base (trombocitopenia) parecem ser preditores de graus superiores de SLC.2 Fatores como a estrutura do recetor de antigénio quimérico, assim como o antigénio alvo da CAR-T, necessitam de mais estudos para clarificar o seu papel na toxicidade.9
MANIFESTAÇÕES CLÍNICAS E ACHADOS LABORATORIAIS
A SLC é justificada por diversos fenómenos de desregulação imune, estando associada a um largo espectro de manifestações, algumas delas fatais. Esta síndrome pode culminar em falência de órgão se não for instituído tratamento adequado.3-10Apesar da infusão da CAR-T durar entre meia a uma hora, o início e duração da SLC pode variar. Geralmente, os sintomas surgem nas primeiras duas semanas após a infusão,9 com uma mediana de início de 3 dias e mediana de tempo até resolução de 8 dias. Por esse motivo, a European Medicines Agency (EMA) recomenda a monitorização diária dos doentes durante os primeiros O dias após perfusão, assim como a que estes se mantenham nas proximidades (até 2 horas de viagem) de um centro qualificado durante pelo menos 4 semanas após a infusão.11-12
As manifestações clínicas mais comuns encontram-se descritas na Fig. 1.

Figura 1: Manifestações clínicas mais frequentes da SLC e manifestações neurológicas após infusão de CAR-T. CID: coagulação intravascular disseminada; CK: creatinina quinase; IC: insuficiência cardíaca; LRA: lesão renal aguda; PCR: paragem cardiorrespiratória; SLT: síndrome de lise tumoral
Frequentemente, a febre é o primeiro sintoma a surgir, sendo comum atingir valores acima dos 40ºC.3 Para além disso, os doentes podem também apresentar fadiga, anorexia, mialgias, artralgias, rash e edema.1,9,13
Em termos cardiovasculares, pode ocorrer taquicardia associada à febre. Em casos mais graves, pode surgir hipotensão, arritmias e diminuição da fração de ejeção do ventrículo esquerdo (FEVE). Existem casos descritos de paragem cardiorrespiratória 7 dias após a infusão em doentes com FEVE<25%, sob tratamento para a LLA, assim como de fibrilhação auricular e prolongamento do intervalo QT assintomático.13-15
Os sintomas respiratórios são comuns nestes doentes, podendo evoluir para uma síndrome respiratória aguda grave (SARS) com dispneia, hipoxemia, edema pulmonar e opacificações bilaterais na radiografia torácica. De acordo com a gravidade, pode ser necessário iniciar ventilação mecânica (VM) invasiva e não invasiva. No entanto, o início de ventilação mecânica invasiva encontra-se maioritariamente relacionado com a incapacidade de proteger a via aérea secundária à neurotoxicidade concomitante.13·15
Inclusivamente, pode existir uma lesão renal aguda por hipoperfusão, sendo a maioria reversível. Distúrbios hidroeletrolíticos, como hiponatrémia, hipocaliémia e hipofosfatémia, também podem ocorrer.13 Hepatomegalia e manifestações do trato gastrointestinal, tais como diarreia e vómitos, são passíveis de surgir.9
Em termos hematológicos, as citopenias são frequentes, predispondo estes doentes a infeções oportunistas.9 O risco de hemorragia espontânea é elevado devido à combinação de inflamação sistémica, coagulopatia e trombocitopenia. Em casos graves, pode ocorrer anasarca e cardiomiopatia Takotsubo-like.9-13
Os achados laboratoriais são variados e influenciados pela causa subjacente. Frequentemente, há um aumento de marcadores de inflamação, tais como a ferritina e a proteína e-reativa. Esta última encontra-se relacionada com a gravidade da doença. Como referido anteriormente, as citopenias são recorrentes, estando associadas ao mecanismo de mielossupressão mediado por citocinas, encontrandose reportados casos de anemia (graus 3-4), trombocitopenia, leucopenia, neutropenia e linfopenia.9 A elevação dos D-dímeros e os distúrbios da coagulação (com prolongamento do tempo de protrombina, aumento do tempo de tromboplastina parcialmente ativada e hipofibrinogénio) são comuns, podendo evoluir para estado de coagulação intravascular disseminada.9 Além disso, é também frequente a elevação de citocinas inflamatórias no soro, tais como IFN-y (ou CXCL9 e CXCL 10, quimiocinas induzidas por IFN-y), IL-6, IL-10 e IL-2R-u solúvel. Podem ocorrer outras alterações analíticas, tais como hipogamaglobulinemia, hiperbilirrubinemia, hipertrigliceridemia, aumento dos valores de transaminases e creatinina quinase.9,13
Neurotoxicidade
As manifestações neurológicas aparentam uma fisiopatologia distinta da SLC, uma vez que os fenómenos neurológicos podem ocorrer antes, após ou mesmo na ausência de SLC.1,16Atualmente, é aceite na comunidade científica que a neurotoxicidade é o segundo efeito adverso mais frequente após infusão de CAR-T.1,16 A incidência desta toxicidade varia, podendo atingir os 50%.1,16As manifestações neurológicas apresentam um largo espectro, nomeadamente alucinações, cefaleias, afasia, ataxia, dismetria, paresia, sonolência e convulsões. Em casos mais graves, pode haver uma evolução para encefalopatia.1,13,16
Porém, mais estudos são necessários para uma melhor compreensão da clínica e fisiopatologia da neurotoxicidade e da sua relação com a SLC.
Graus de Toxicidade
Durante os últimos anos, foram vários os autores e instituições que apresentaram sistemas de classificação de graus de toxicidade da SLC: "Common Terminology Criteria for Adverse Events" (CTCAE), (versão 4, 4.03 e 5.0),17critérios de Penn,7 critérios "Memorial Sloan-Kettering Cancer Center'' (MSKCC)18 e critérios "CAR T-Cell Therapy-Associated TOXicity" (CARTOX).19 Contudo, estes critérios diferiam em vários parâmetros, o que levou à necessidade da sua uniformização. Assim, em Junho de 2018, a American Society for Blood and Marrow Transplantation reuniu diversos especialistas nesta área, publicando um novo sistema de classificação de graus de toxicidade da SLC em doentes sob terapêutica com CAR-T,6 representado na Tabela 1.
Tabela 1: Sistema de classificação da SLC do consenso de 2018 da American Society for Blood and Marrow Transplantation.
| 1 | Febre> 38ºC |
| 2 | Febre > 38ºC + hipotensão sem necessidade de suporte vasopressor e/ou hipoxia com necessidade de cânula nasal |
| 3 | Febre > 38ºC + hipotensão com necessidade de 1 vasopressor e/ou hipoxia com necessidade de cânula nasal de alto débito, máscara facial ou máscara de Venturi |
| 4 | Febre > 38ºC + hipotensão com necessidade de múltiplos vasopressores (excluindo vasopressina) e/ou hipoxia com necessidade de ventilação com pressão positiva |
| 5 | Morte |
A neurotoxicidade pode ser classificada de acordo com uma escala desenvolvida em 2018 pelo grupo de trabalho CARTOX.19 Esta engloba as seguintes dez tarefas, sendo que por cada tarefa realizada de forma correta é atribuído 1 ponto: questionar o doente relativamente ao ano, mês, cidade, hospital e Presidente / Primeiro-ministro do seu local de residência (total de 5 pontos); nomear 3 objetos (máximo de 3 pontos); escrever uma frase (1 ponto); contar os números a partir do 100 de forma retrógrada com intervalo de 10 (1 ponto).19 Dessa forma, é possível avaliar alterações da concentração, fala e escrita. Recomenda-se a realização desta avaliação com intervalo de 8 horas nos doentes internados após terapêutica CAR-T.19 Uma pontuação total de 10 corresponde a um doente com normal função cognitiva. Quando pontuação total inferior a 10, considera-se a existência de algum grau de neurotoxicidade.19 Com base na pontuação total ou, caso doente obnubilado, na incapacidade de realização das tarefas, a toxicidade neurológica é classificada em quatro diferentes graus (Tabela 2).19
Diagnósticos Diferenciais
A SLC é uma síndrome inflamatória sistémica e, como tal, apresenta manifestações clínicas variadas e pouco específicas, podendo sobrepor-se a outras patologias inflamatórias. Torna-se assim imperativo equacionar outros diagnósticos diferenciais, de forma a dirigir o tratamento adequado.
A síndrome da lise tumoral (SLT) é uma emergência oncológica regularmente encontrada em doentes com neoplasias hematológicas, nomeadamente LNH e leucemias agudas.20 Esta síndrome ocorre pela libertação do conteúdo das células tumorais para a corrente sanguínea de forma espontânea ou após tratamento, podendo levar a febre e disfunção renal e cardiovascular. Desta forma, compreende-se que clinicamente seja difícil a distinção de SLT da SLC. No entanto, certos achados analíticos, como a hiperuricemia, hipercalemia, hiperfosfatemia e hipocalcemia, indiciam uma maior probabilidade de se tratar de SLT.20,21
A sépsis é atualmente definida como uma disfunção multiorgânica causada por uma resposta desadequada do hospedeiro a uma infeção. Por sua vez, o choque séptico corresponde a um subtipo de sépsis com uma particular afeção pelos sistemas circulatório, celular e metabólico.22 Apesar de apresentarem uma fisiopatologia distinta, a SLC e a sépsis estão frequentemente associadas a hipotensão e febre, o que as torna clínica e analiticamente indistinguíveis.1,21
As infeções são um dos principais riscos dos doentes com neoplasias sob tratamento imunossupressor. Clinicamente, é difícil distinguir a SLC de um processo infecioso. De facto, quando assumido um diagnóstico de SLC, o tratamento imunossupressor administrado pode mascarar a presença de uma infeção. Desta forma, é fundamental uma avaliação clínica, analítica e imagiológica pormenorizada. A presença de uma clínica típica de infeção, associada a uma elevação da procalcitonina e a identificação de um foco infecioso em exames de imagem/microbiológicos aumenta a probabilidade de se tratar de um processo infeccioso.9
No entanto, está também descrito que a própria SLC pode aumentar o risco de infeções. O mecanismo não se encontra devidamente caracterizado, sendo uma hipótese o facto de a SLC poder induzir um estado de paralisia imune.23 Dessa forma, é fundamental monitorizar os doentes com febre após infusão de CAR-T pela possibilidade de ocorrer uma infeção e SLC simultaneamente.9
A linfohistiocitose hemofagocítica (LHH) é uma síndrome de ativação imune excessiva, que pode ser classificada como primária (associada a mutações genéticas) ou secundária.23 A LHH leva a mielosupressão e dano do endotélio vascular.24 A síndrome de ativação macrofágica (SAM) é uma forma de LHH secundária. Está descrito que em doentes com SLC grave pode ocorrer uma cascata imune suficiente para o aparecimento de LHH/SAM. De facto, a fisiopatologia da SLC e da LHH/SAM é semelhante, havendo uma ativação imunológica excessiva.16,21Esses doentes geralmente apresentam febres refratárias, hepatoesplenomegalia, disfunção hepática, coagulopatia e uma elevação acentuada da ferritina.16
Finalmente, as reações de hipersensibilidade, relacionadas com a estimulação excessiva de células T, podem mimetizar os sintomas da SLC. Pode surgir febre e disfunção multiorgânica, dificilmente distinguível da SLC.21,25No entanto, existem apenas alguns casos descritos na literatura de reações de hipersensibilidade após infusão de CAR-T.13
Abordagem Terapêutica
Perante o diagnóstico de SLC, torna-se essencial a estabilização hemodinâmica do doente. Um dos desafios na gestão e abordagem terapêutica é conseguir atenuar o efeito da cascata inflamatória sem diminuir o efeito anti-tumoral da terapêutica com CAR-T.26
A estratégia de monitorização e terapêutica da SLC é dirigida consoante o grau de classificação. A abordagem deverá envolver uma equipa multidisciplinar, podendo ser necessário referenciar para uma Unidade de Cuidados lntensivos.13
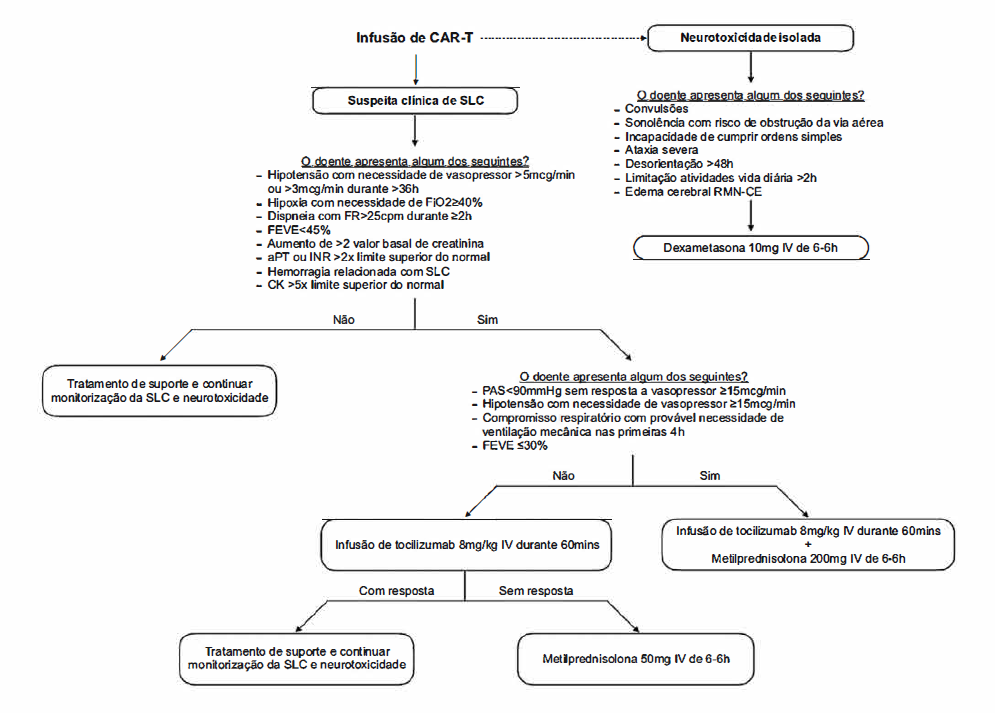
Diversos estudos foram realizados com o intuito de criar recomendações relativas à gestão e tratamento da SLC. 8,13,19Brudno e Kochnderfer propuseram em 2019 uma nova abordagem terapêutica com base em critérios específicos de estabilidade hemodinâmica e disfunção de órgãoalvo.9 A Fig. 2 retrata um possível algoritmo de abordagem, adaptado dessa mesma proposta.
Doentes com SLC de baixo grau têm indicação para tratamento sintomático com antipiréticos, anti-histamínicos e fluidoterapia.16,27Meios complementares de diagnóstico adicionais devem ser realizados de forma a excluir o amplo espectro de diagnósticos diferenciais.27 Quando não é possível excluir, com um alto grau de certeza, um processo infecioso, recomenda-se o início de antibioterapia empírica.1
As formas mais severas de SLC, geralmente caracterizadas pela necessidade de suporte vasopressor, são situações ameaçadoras de vida que requerem uma rápida abordagem e tratamento dirigido.1,16
De acordo com alguns autores, está recomendada a administração de imunoglobulina (lg) G intravenosa quando o valor de lgG é inferior a 400 mg/dl.9
Dada a sua boa penetrância na barreira hemato-encefálica, a corticoterapia sistémica é a primeira linha terapêutica nos doentes com neurotoxicidade isolada,9 conforme pode ser consultado na Fig. 2.
1. Tocilizumab
O tocilizumab é um anticorpo monoclonal humanizado antagonista do recetor da IL-6 utilizado no tratamento de patologias reumatológicas. Atualmente, encontra-se aprovado pela Food and Drug Administration (FDA) e pela EMA no tratamento de SLC grave em doentes adultos e pediátricos com idade igual ou superior a 2 anos.10,27Geralmente, utiliza-se na dose de 8 mg/kg, exceto nos doentes com peso inferior a 30 kg, em que está recomendada uma dose de 12 mg/kg.28 O seu perfil farmacocinético é não linear e apresenta uma eliminação bifásica na circulação sanguínea. Na ausência de melhoria clínica após a primeira dose, podem ser administradas até 3 doses adicionais, com intervalo mínimo de 8 horas. Doses que excedam 800 mg por perfusão não são recomendadas.11,12Apesar de se crer que este fármaco não afete a expansão e eficácia a longo prazo do tratamento com CAR-T, está descrito um aumento do risco de citopenias e infecções em doentes com artrite reumatóide, assim como um aumento hipotético da incidência e gravidade da neurotoxicidade associada a estas terapêuticas.9,13,29
2. Alternativas ao tocicizumab
Diversos estudos estão a ser desenvolvidos com o intuito de avaliar a eficácia de novas terapêuticas.9,26A corticoterapia poderá apresentar um papel importante no tratamento da SLC.3,9Fármacos como o siltuximab, anacinra e suicide gene estão também a ser ponderados como possíveis opções terapêuticas.2,9,26
2.1. Corticoterapia
Apesar do uso corrente de corticoterapia sistémica no controlo da SLC, a evidência sugere que a sua administração pode diminuir a eficácia antitumoral e persistência das CAR-T.3 Desta forma, o seu uso está reservado para SLC refratário ao tocilizumab ou de forma concomitante em casos mais graves.3 Por outro lado, perante doentes com neurotoxicidade isolada, esta deverá ser a primeira linha terapêutica.9,27Perante esse cenário, recomenda-se a administração de dexametasona 10 mg por via endovenosa com um intervalo de 6 horas.9
2.2. Siltuximab
O siltuximab é um antagonista da IL-6 ainda não aprovado pela FDA e EMA para o tratamento de SLC, apenas indicado no tratamento de adultos com doença de Castleman multicêntrica não infetados com vírus da imunodeficiência humana e herpes vírus humano tipo 8.30 Contudo, alguns autores defendem que este deva ser administrado em todos os casos de SLC refratários ao tocilizumab, uma vez que apresenta uma maior afinidade para a IL-6.31 Inclusive, poderá ter um papel importante no tratamento da neurotoxicidade induzida pelas CAR-T, uma vez que o complexo siltuximab-lL-6 não atravessa a barreira hematoencefálica. No entanto, mais estudos são necessários para avaliar e validar a sua utilização na SLC.2,9,26
2.3. Anacinra
Este fármaco, obtido a partir de Escherichia coli por tecnologia de ADN recombinante, é um antagonista do recetor humano da IL-1 . A EMA aprovou o seu uso terapêutico no tratamento da artrite reumatóide com resposta inadequada ao metotrexato isoladamente, da doença de Still e síndromes febris periódicas autoinflamatórias, tais como as síndromes associadas à criopirina (CAPS) e a febre mediterrânica familiar.32 O bloqueio da IL-1 mediado por este fármaco poderá ter um papel importante no tratamento da SLC, pois acredita-se que a IL-1 produzida pelos macrófagos esteja envolvida na fisiopatologia da SLC e neurotoxicidade associada à CAR-T.2 Porém, são necessários mais estudos para aprofundar o conhecimento relativo a esta terapêutica.
2.4. Suicide Gene
Em situações de toxicidade refratária, pode ser necessária a utilização de suicide genes. Estes correspondem a elementos geneticamente modificados que são incorporados em células e, após a administração de um agente ativador (pró-fármaco), destroem seletivamente essas células.33
No caso da CAR-T, um mecanismo atualmente em estudo é o da caspase 9 (iCasp9) / AP1903.2,31Este consiste na inserção da iCas9 nas CAR-T. Na presença de toxicidade refratária, pode ser administrado por via endovenosa o prófármaco AP1903, que ativa a cascata de apoptose celular. Dessa forma, as células CAR-T são eliminadas, assim como a toxicidade associada.31
2.5. Ensaios Clínicos em uso
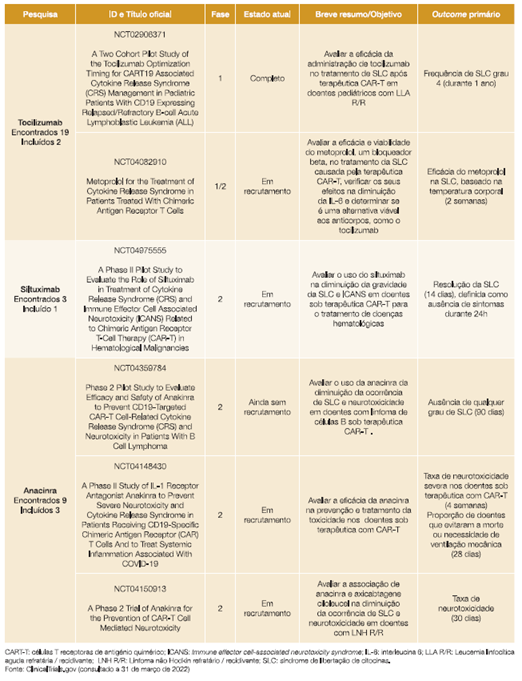
De forma a avaliarmos o estado da arte relativamente às novas terapêuticas da SLC após infusão de CAR-T, realizámos uma pesquisa no Clinical Trials.gov (efetuada a 31/03/2022), usando como condição/doença (condition ar disease) a cytokine release syndrome, e outros termos (other terms) cada fármaco avaliado separadamente (tocilizumab, siltuximab e anakinra). Pretendemos assim apresentar os ensaios clínicos que atualmente estão a ser desenvolvidos no contexto da SLC. Foram apenas incluídos os ensaios dirigidos ao tratamento da SLC induzido por CAR-T. Os resultados encontram-se disponíveis no Anexo 1.
Conclusão
O avanço do conhecimento na área da imunoterapia, nomeadamente através da infusão de CAR-T, torna cada vez mais evidente a necessidade de compreender quais os possíveis efeitos adversos associados a essas terapêuticas. A SLC é o efeito adverso mais comum da terapêutica CAR-T, sendo necessário um elevado índice de suspeição para o seu diagnóstico. Por se tratar de uma situação potencialmente fatal, é fundamental a capacitação dos clínicos relativamente a este problema, assim como à sua gestão e abordagem terapêutica. Em termos de opções terapêuticas, está preconizada a utilização de tocilizumab, podendo associar-se corticoterapia sistémica nos casos mais graves. Na presença de neurotoxicidade isolada, recomenda-se corticoterapia sistémica. Mais estudos dirigidos a esta temática são necessários no futuro, nomeadamente ensaios de grande escala, de forma a clarificar e uniformizar os conhecimentos relativos à SLC após infusão de CAR-T.