Introdução
Calcula-se a nível mundial, um aumento do número de pessoas com diabetes de 537 milhões para 783 milhões entre 2021 e 2045.1
Este aumento brutal é maioritariamente decorrente das taxas crescentes de obesidade, o principal indutor do aparecimento da diabetes.2 Esta realidade atinge não só os países mais desenvolvidos, mas também muitos países em vias de desenvolvimento, nos quais vemos simultaneamente desnutrição e dismetabolia, com as diferentes classes sociais a apresentarem padrões alimentares díspares, mas com consequências igualmente nefastas.2
As razões para este incremento da obesidade de forma tão global e generalizada nas últimas décadas, é multifatorial, mas decorre principalmente do ambiente obesogénico em que vivemos, em que a um estilo de vida sedentário se asso-cia comida de pior qualidade, em doses maiores e a preços mais baixos, que potencia de forma exponencial a genética humana, desenvolvida ao longo dos milénios.3,4
Como espécie fomos sobrevivendo à fome, às doenças e às guerras através da conservação e armazenamento de energia nos períodos de abundância. Mas estes mecanismos, perante a realidade alimentar das sociedades atuais, não nos são claramente favoráveis. A abundância é permanente e a acumulação é ininterrupta e progressiva, levando à obesidade de forma quase inexorável4 e consequentemente à diabetes.2,5
As armas que temos tido ao nosso dispor para combater a obesidade e consequentemente evitar ou remitir a diabetes, têm sido limitadas, sendo que esta é um dos fatores de risco cardiovascular mais importantes, com 65% dos doentes com diabetes a morrerem de doença cerebrocardiovascular. E cerca de 30% dos doentes internados com acidente vascular cerebral ou enfarte agudo do miocárdio a terem diabetes.6-9
Entre 2021 e 2022, foram publicados vários ensaios clínicos, com o tirzepatide, um agonista duplo também denominado co-agonista da GLP1 e do GIP, o primeiro da sua classe, com efeitos francamente positivos sobre o controlo glicémico, mas acima de tudo com reduções de peso nunca antes atingidas por um fármaco.
Estes dados de eficácia com o tirzepatide na diminuição da adiposidade, permitem colocar a hipótese de conseguirmos evitar a instalação da diabetes ou até a sua remissão, nos indivíduos em que a obesidade é causadora de dismeta-bolia, mudando o centro da abordagem terapêutica da diabetes para a perda de peso.10-12
Neste artigo faz-se uma revisão do desenvolvimento, mecanismos de ação e ensaios clínicos do tirzepatide, que tudo indica será um modificador de prognóstico nas áreas da obesidade e da diabetes.13-15
MECANISMOS FISIOPATOLÓGICOS: DA OBESIDADE À DIABETES
Nas últimas décadas têm sido estudados de forma aprofundada os mecanismos fisiopatológicos que condicionam o aparecimento da diabetes, a sua relação com a obesidade e de como a redução da ingestão de calorias e a perda de peso permitem a reversão destes mecanismos.11,16
Até à data, não há a certeza sobre qual a primeira alteração fisiopatológica a surgir na diabetes, mas é mais ou menos consensual, que a doença se desenvolve à medida que a ingestão sistemática de excesso de energia alimentar leva à acumulação de gordura hepática, condicionando um ciclo vicioso de hiperinsulinemia e resistência à insulina.16
Sob condições fisiológicas normais, o aumento dos níveis de glicose levam à secreção aumentada de insulina, deste modo estimulando a transferência da glicose para os tecidos periféricos e inibindo a lipólise, neoglicogénese e a glicogenolise hepáticas.
Nos indivíduos com ‘insulino resistência’ o uptake da glu-cose a nível do tecido adiposo e muscular é deficitário por uma estimulação ineficaz da insulina, e há consequentemente uma alteração na supressão da libertação de glicose pelo fígado, que fica aumentada.10,11,16
Em particular, no tecido adiposo a inibição da lipólise, me-diada pela insulina está diminuída, o que leva a um aumento dos ácidos gordos livres circulantes (AGL), o que por sua vez aumenta a resistência à insulina ao interferir com a sinalização em cascata da insulina nos diferentes órgãos, levando à hiperinsulinemia, criando um ciclo vicioso. Em paralelo, os AGL atuam no fígado e promovem a neoglicogénese e a lipogénese. Sendo produzidos a nível hepático triglicéridos, que são transportados nas lipoproteínas de baixa densidade (VLDL), que se acumulam a nível periférico. Se a deposição de gordura subcutânea não conseguir acomodar este excesso de lípidos, a gordura ectópica acumular-se-á, incluindo no pâncreas. Em pessoas com células β suscetíveis, a resposta aguda da insulina aos alimentos é diminuída e a lipogénese a partir da glicose aumenta.10,11
Os estudos mais antigos apontavam para que quando a diabetes era diagnosticada, a redução em 50% da capacidade funcional das células pancreáticas, já presente, era irreversível.16-17 No entanto investigação mais recente comprovou que a função celular β pode ser restaurada se a gordura do fígado for reduzida através da perda de peso.16,17
O que também é interessante, é que o nível de gordura a ser acomodado a nível hepático, por cada individuo, é variável, o que poderá explicar a existência de um número significativo de doentes não obesos que desenvolvem diabetes, os chamados magros metabolicamente obesos.18Estes, se perderem peso também conseguem reverter a diabetes, assim como os obesos que não atingem peso normal, em ambos, a redução de gordura hepática pode ser o suficiente para normalizar o metabolismo.
Assim como há gordos metabolicamente magros, provavelmente porque a sua capacidade de acomodação de gordura hepática e periférica é maior,19 ainda que esta capacidade vá desaparecendo com o tempo, só que de forma mais lenta.
TRATAMENTO DA OBESIDADE E REMISSÃO DA DIABETES
Perante os mecanismos fisiopatológicos descritos, a perda de peso é fundamental na abordagem da diabetes e foi sempre um objetivo terapêutico.20
Tem-se tornado claro que, independentemente da forma como se perde peso: dieta, jejum intermitente, cirurgia bariátrica, fármacos, etc. e especialmente se esta perda for sustida e conseguida nos primeiros 10 anos de doença, a remissão da diabetes é atingida numa percentagem significativa de doentes.16 Calcula-se que para tal acontecer será necessária uma perda de peso de cerca de 15% (o que na maioria dos doentes corresponde entre 10 a 15 kg).16 Sendo que, remissão é definida como HbA1c< a 6,5% por mais de 3 meses, sem terapêutica dirigida.21
No entanto, perdas de peso significativas, sustidas e con-sequente reversão da diabetes, em geral, só são atingidas com a cirurgia bariátrica, conseguindo-se aos 2 anos taxas de remissão até aos 72%, e no longo prazo (até aos 10 anos) até aos 36%,22 dependendo muito dos estudos.
A cirurgia é tão ou mais eficaz, se efetuada em fases mais iniciais da doença, mantendo-se a discussão se a remissão é apenas decorrente da diminuição de ingestão de alimentos e consequente perda de peso ou se a cirurgia, com a ablação de determinadas áreas de secreção de hormonas intestinais, tem um efeito benéfico na remissão da dismetabolia. Aliás, esta é uma polémica que seguramente continuará nos próximos tempos.23
Quanto aos fármacos aprovados até à data para o tratamento da obesidade foram sempre, claramente insuficientes para permitir pensar em reverter a diabetes, pois a sua eficácia situa-se entre os 3% a 8% de perda ponderal.24
Claro que as medidas de estilo de vida são um tratamento eficaz para a obesidade, mas a dificuldade da sua implementação, com baixa adesão inicial e elevada taxa de abandono a médio, longo prazo, tornam-nas pouco eficazes.
Mesmo em estudos com intervenções de estilo de vida com seguimento intensivo e multidisciplinar só 2 em 10 pessoas têm resultados positivos a longo prazo.25 O que não é surpreendente, pois a obesidade é muito mais complexa do que o resultado de um estilo de vida errado ou de um comportamento desviante, com a genética a ter um papel preponderante.
Finalmente, a prevenção terá de ser uma aposta em termos de políticas de saúde pública, se quisermos de alguma forma reverter este caminho para o abismo, em que pela primeira vez corremos o risco de a esperança média de vida de quem nasce ser inferior à dos progenitores.26
A acrescer que uma vez instalada, a obesidade, mesmo quando tratada, tem uma elevada taxa de recidiva - quem já foi gordo, tem uma muito maior probabilidade de voltar a sê-lo, com os mecanismos deste processo de recuperação de peso ainda não totalmente esclarecidos.27
Por isso, as intervenções nas idades mais jovens, com a promoção de estilos de vida saudáveis, são tão importantes e nós médicos temos seguramente um papel na sua elaboração e implementação.2,28
MECANISMO DE AÇÃO DOS AGONISTAS DAS INCRETINAS - O TIRZEPATIDE
O termo incretina foi inicialmente descrito em 1932 e referia-se a hormonas segregadas pelo intestino, que regulavam a resposta da insulina aos alimentos. Num artigo seminal de 1964 Elrick et al,29 demonstrou uma subida significativa e sustida da insulina em resposta à ingestão de glucose, quando comparada com a administração endovenosa. Este fenómeno ficou conhecido mais tarde como o efeito das incretinas e é responsável por 65% da secreção da insulina.
Existem duas hormonas principais, responsáveis por este efeito: O glucagon-like peptide 1 (GLP-1) e o glucose-dependent insulinotropic polypeptide (GIP, previamente conhecido como gastric inhibitory polypeptide), chamadas de hormonas da saciedade segregadas pelo intestino, surgindo como alvos terapêuticos óbvios.
Inicialmente foram desenvolvidos os agonistas da GLP1, produzido pelas células L do intestino, que atuam através da estimulação da secreção da insulina no estado hiperglicémicos, suprimindo a secreção de glucagon na hiper e euglicemia, atrasando o esvaziamento gástrico, diminuindo apetite e reduzindo o peso.
Este agonismo das vias das hormonas endógenas estimuladas pela ingesta é eficaz e seguro no tratamento da diabetes e da obesidade, como temos vindo a constatar pelos resultados dos ensaios clínicos publicados nos últimos dez anos e consequente utilização crescente na prática clínica diária. Referindo-se ainda claros benefícios cardiovasculares, com redução da morbimortalidade cardiovascular, nos doentes com doença aterosclerótica coronária conhecida.30
Apesar da grande eficácia que os agonistas das GLP1 têm demonstrado, o interesse pelo péptido inibidor gástrico (GIP) o outro polipéptido dependente da glucose, produzido pelas células k do intestino, que regula o balanço energético através de recetores de superfície presentes no tecido adiposo e no cérebro, manteve-se, tendo os estudos demons-trado que o GIP, a principal incretina em pessoas saudáveis é insulinotrópica, contudo ao contrário do GLP-1 também é glucagontrópica, dependendo da glicémia. Na hiperglicemia estimula a libertação de insulina, baixando desta forma os níveis de glucagon e nos estados euglicemicos ou hipoglicémicos, aumenta os níveis de glucagon, prevenindo as hipoglicemias.31,32
Sabe-se ainda que o GIP atrasa o esvaziamento gástrico e aumenta simultaneamente a capacidade de regulação pós-prandial dos lípidos no tecido adiposo branco e a sua sensibilidade à insulina, o que pode prevenir a deposição ectópica da gordura.
Coloca-se ainda a hipótese de que o agonismo do GIP no sistema nervoso central, potencie a redução de ingestão de alimentos induzida pelo agonismo do GLP-1 a este nível.33 Todas as ações conhecidas estão esquematizadas na Fig. 1.
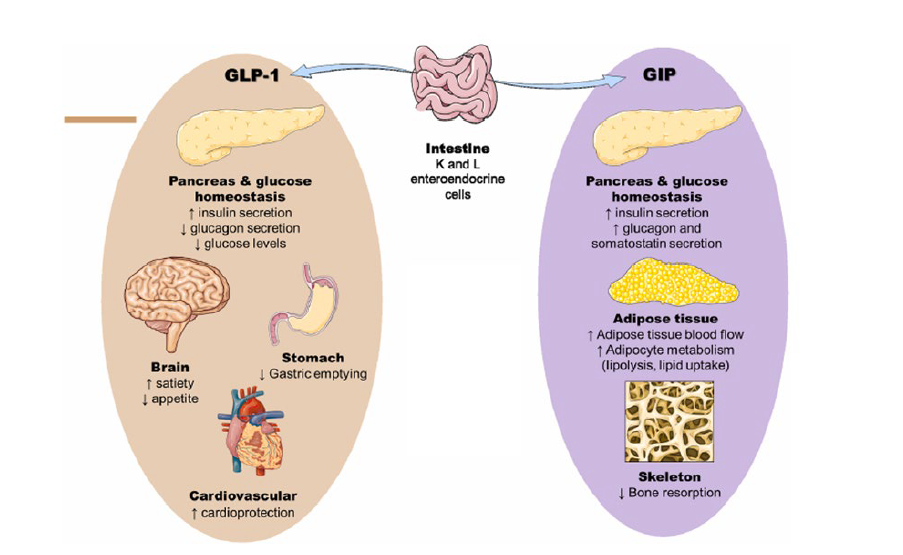
Figura 1 - Resultados fisiológicos do agonismo dos recetores GIP e GLP-1 nos vários órgãos - GIP (secretado pelas células k no segmento inicial do jejuno) e GLP-1 (secretado pelas células L em todo o intestino). Reproduzido com autorização: Lempesis IG, et al. The catcher in the gut: Tirzepatide, a dual incretin analog for the treatment of type 2 diabetes mellitus and obesity. Metabol Open. 2022;16:100220.33
A ativação dos dois recetores com a mesma molécula, teoricamente apresentava-se como uma hipótese terapêutica mais eficaz e potente.
Na última década do seculo XX e primeira do XXI, foram sendo publicados artigos que mostraram este efeito sinérgico do agonismo dos recetores destas duas hormonas, sendo desenvolvido e publicado em 2013 por Finan et al o primeiro artigo com resultados positivos, em animais e humanos, do efeito agonista duplo de uma única molécula chamada de “twincretin”.34
Baseado nisto foi desenvolvido um polipéptido sintético, tirzetapide (Fig. 2), com uma semivida de 5 dias, que permite uma administração semanal, subcutânea.14
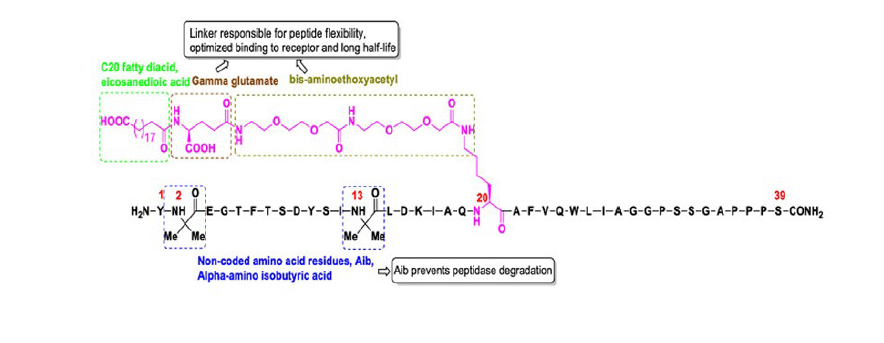
Figura 2 Características estruturais do tirzepatide, com os aminoácidos em letras maiúsculas. Reproduzido com autorização: Chavda VP, et al. Tirzepatide, a new era of dual-targeted treatment for diabetes and obesity: a mini-review. Molecules. 2022;27:4315.14
QUAL A EVIDÊNCIA?
Os primeiros ensaios de fase 1 e 2, com tirzepatide, foram publicados em 2018 e 2020.35-37Os benefícios apresentados com reduções de HbA1c entre os 1,6% e os 2,4% nas doses de 5 e 15 mg respetivamente (os estudos incluíram doses mais baixas, mas com reduções menores) levaram ao desenvolvimento do SURPASS clinical trial programme, com 12 estudos de fase 3,38-49destinado a avaliar a eficácia e segurança do tirzepatide, como tratamento para melhorar o controlo glicémico nas pessoas com diabetes e com obesidade, sendo que 6 já foram publicados.38-43
O SURPASS-1,38o primeiro estudo desta série a ser publicado em junho 2021, o tirzepatide contra placebo demonstrou diminuições médias de HbA1c de 1,87% com tirzepatide 5 mg, 1,89% com tirzepatide 10 mg e 2,07% com tirzepatide 15 mg versus + 0,04% com placebo.
Já no SURPASS-2,39 publicado em agosto de 2021, desenhado como um estudo de não inferioridade contra sema-glutide, 3 doses de tirzepatide, 5 mg, 10 mg e 15 mg foram avaliadas e todas demonstraram não inferioridade e superioridade quer em termos de redução de HbA1c, o endpoint primário (respetivamente -0,15% (p = 0,02), -0,39% (p <0,001) e -0,45% (p <0,001)), quer na redução do peso, um dos end-points secundários, tudo isto com dados de segurança tranquilizadores e dentro do que era expectável. De referir que mais de 70% dos doentes eram obesos com IMC>30 kg/m2 e que a redução de peso média foi de −13,1% ou −12,4 kg, na dose mais alta e não estabilizou às 40 semanas, a duração do ensaio. A comparação direta com o semaglutide não é possível no tratamento da obesidade, visto a dose utilizada com este, para a obesidade ser de 2,4 mg e aqui ter sido usada a dose de 1,0 mg (recomendada para a diabetes).
Ressalva-se como extra, uma redução significativa dos valores tensionais e melhoria do perfil lipídico, cujos mecanismo não são claros (será da perda de peso? da melhoria da rigidez arterial?), mas que está em avaliação, esperando-se respostas a médio prazo nesta área. Estes dados de redução dos valores tensionais e dos lípidos foram sendo consistentes em todos os ensaios publicados até à data.
Nas recomendações atuais sobre terapêutica farmacológica da diabetes, a introdução de medicação injetável deve ser feita quando não se verifica um bom controlo metabólico com a terapêutica oral, sendo que pode ser iniciada com agonistas da GLP-1 ou insulina, com os primeiros a serem favorecidos como primeira escolha, dado o bom controlo metabólico que permitem, a redução de peso e o efeito benéfico na doença cardiovascular e renal, com menor risco de hipoglicemia.50,51
O desenho do estudo SURPASS-3,40 publicado também em agosto de 2021, decorre desta recomendação com o tirzepatide a ser comparado com insulina degludec uma vez por dia, em doentes com HbA1c elevadas entre os 7% e os 10% e com excesso de peso ou obesidade, sendo mais uma vez os resultados claramente favoráveis ao tirzepatide em todos os endpoints primários e secundários avaliados, com redução de HbA1c de - 0,59% a 1,04% (p <0,0001), redução de peso ao contrário da insulina, como aliás era expectável e muito menor incidência de hipoglicemias, também expectável. Acrescenta ainda, à redução dos valores tensionais e melhoria do perfil lipídico observados nos outros ensaios, a redução das transaminases, o que levanta a hipótese de poder ter efeitos benéficos na hepatite esteatósica não alcoólica, companheira de viagem frequente da diabetes, com uma clara potenciação negativa bidirecional e para a qual temos poucas armas.
Quanto aos efeitos secundários, predominantemente gastrintestinais, os resultados são semelhantes aos já referidos nos estudos anteriores, com as náuseas e os vómitos a serem os mais frequente, claramente diferente dos da insulina, com a qual predominam as hipoglicemias.
Os efeitos secundários gastrointestinais poderão ter efeitos contraditórios, por um lado é levantada a hipótese de contribuírem para a perda de peso, com a óbvia diminuição da ingestão de alimentos que condicionam, o que ajudaria à eficácia do fármaco. Por outro lado, podem levar a uma menor adesão à terapêutica, o que já sabemos se verifica com os agonistas da GLP-1 cuja taxa de adesão ao ano é apenas de 50%, em estudos de vida real.52 Teremos de esperar mais dados para tirar conclusões definitivas sobre o seu impacto.
Outro dado muito importante, é que 30% dos doentes estavam sob terapêutica dupla com inibidores do transportador tipo 2 de sódio e glicose (iSGLT2) e metformina, tendo estes, resultados semelhantes aos doentes apenas sob metformina, o que nos tranquiliza em termos de segurança e nos abre perspetivas sobre a terapêutica de associação.
Este estudo demonstrou mais uma vez perdas de peso na ordem dos 12% em média, com a dose mais alta de tirzepatide, muito próximo do que tem sido observado como necessário para se verificar a remissão da diabetes.
No SURPASS-4,41 mais um estudo publicado em 2021 com o tirzepatide, as diferentes doses (5 mg, 10 mg, ou 15 mg por semana) foram comparadas com insulina glargina. No entanto, esta população é diferente das estudadas nos restantes ensaios publicados, pois foram incluídos doentes que para além de terem a diabetes não controlada (HbA1c em média de 8,52%) e terem excesso de peso/obesidade (IMC médio de 32,6 kg/m2), tinham risco cardiovascular (RCV) aumentado com doença isquémica coronária, doença arterial periférica, doença cerebrovascular, doença renal crónica ou insuficiência cardíaca (classe II/III da New York Heart Association). A acrescentar ao RCV aumentado, a duração da diabetes era em média, superior a dez anos, estando sob terapêutica oral que podia ser metformina, sulfonilureias ou iSGLT2, ou uma combinação destes.
Mais uma vez, os resultados foram favoráveis ao tirzepatide em todas as doses com reduções de HbA1c e peso significativas, mas o que foi realmente interessante, foi verificar a inexistência de acréscimo de RCV nos doentes sob tirzepatide em relação com os sob insulina, o que se manteve até às 104 semanas, o que reforça o otimismo quanto a um possível efeito benéfico ou pelo menos neutro no estudo de segurança cardiovascular em curso a ser terminado em 2024,49 em que o comparador é o dulaglutide.
Este ensaio é de grande importância, pois também nos dará respostas sobre o impacto que este fármaco poderá ter sobre as doenças micro e macrovascular da diabetes, sobre as quais já se sabe que os agonistas da GLP-1 são muito favoráveis.30
De forma global, o SURPASS-4 alarga a população alvo deste fármaco aos doentes “mais doentes”, nos quais demonstrou eficácia e segurança.
Quanto ao estudo SURPASS 5,42 que foi publicado já em fevereiro de 2022, o tirzepatide foi estudado contra placebo em doentes já sob insulina glargina e apresentou resultados mais uma vez favoráveis, sobreponíveis aos já mencionados.
Estes dados permitiram a sua aprovação para o tratamento da diabetes pela Food and Drug Administration (FDA) nos Estados Unidos em maio de 2022, aguardando-se a sua autorização e comercialização na Europa.
Os dados de evidente eficácia na perda de peso levaram ao desenvolvimento do estudo SURMOUNT-1 publicado em julho de 2022,43 que mostrou perdas de peso significativas em doentes não diabéticos (entre 85% a 91% dos doentes conseguiram perdas ponderais superiores a 5%, dependendo da dose de tirzepatide, e entre 35% a 57% dos doentes perdas superiores a 20%, sem efeitos adversos significativos o que prenuncia uma mudança significativa na área da terapêutica da obesidade, com perdas médias expectáveis acima dos 10%, valor superior a qualquer medicamento testado e aprovado até à data.
De seguida mostram-se duas tabelas em que se compilam os principais resultados dos estudos SURPASS.53
PERSPECTIVAS FUTURAS
Em conclusão, o caminho do agonismo duplo das incretinas começou há várias décadas, com o tirzepatide, o primeiro fármaco com esta capacidade a confirmar no SUR-PASS1 as expectativas em relação a este mecanismo de coagonismo como alvo eficaz e seguro no tratamento da diabetes. Os restantes estudos SURPASS evidenciaram ainda mais a sua eficácia em comparação com os agonistas da GLP-1 e a insulina.
Claro que há ainda muitos dados em falta relativos aos benefícios a médio e longo prazo, impacto sobre micro e macroangiopatia na diabetes e não só, efeitos secundários a longo prazo e qual o esquema posológico de manutenção mais conveniente.44-49
Mas claramente, a abordagem glucocêntrica da diabetes que evoluiu nos últimos anos para uma abordagem de prevenção do risco cardiovascular global,50,51irá ser substituída ou pelo menos complementada pela abordagem centrada no tratamento da obesidade como objetivo primário, no sentido de obter a remissão da diabetes de forma sustida, o que finalmente parece estar ao nosso alcance.
A matriz terapêutica deverá ser redirecionada para a perda de peso, como uma intervenção modificadora de prognóstico, na pessoa com diabetes que tenha doença crónica da adiposidade complicada por hiperglicemia.54 Ou seja, mais do que obesidade devemos estar preocupados com adiposidade, reconhecendo-a como o elemento chave que condiciona o continuum de obesidade, DM tipo 2 e doença cardiovascular.
Esta mudança de alvo terapêutico é agora atingível, vislumbrando-se no horizonte não só as incretinas, estando em estudo o agonismo triplo que inclui o glucagon, mas também outras vias com potencial para permitir esta mudança, como sejam os antagonistas das amilinas.55
Seguramente que o futuro nos trará muitos e difíceis desafios, mas o desenvolvimento de novas terapêuticas da Diabetes, nomeadamente o tirzepatide, muito provavelmente permitirá uma mudança no paradigma do seu tratamento e seguimento. O que nos permite vislumbrar um maior e impactante progresso no sentido de reduzir a sua morbimortalidade.
Não é todos os dias que conseguimos mudar o curso de uma doença.















