Introdução
O herpes zoster (HZ), vulgarmente conhecido por zona, é causado pela reativação do vírus varicela zoster (VVZ) latente.1 Caracteriza-se pelo aparecimento de rash vesicular unilateral, com dor aguda associada, e pode originar complicações crónicas potencialmente debilitantes e incapacitantes, sendo a NPH a principal.2,3Todos os indivíduos infetados por VVZ estão em risco de desenvolver HZ, particularmente os idosos e os imunocomprometidos, devido ao declínio da imunidade celular, fator potenciador da reativação do vírus.1,2Nos EUA, 99,5% dos adultos com 40 ou mais anos de idade mostram evidência serológica de infeção por VVZ e uma em cada três pessoas desenvolve zona durante a sua vida.2 Em Portugal, a varicela e o HZ não são doenças de declaração obrigatória, pelo que os dados epidemiológicos relativos a estas patologias são limitados.4 O 2.º Inquérito Serológico Nacional (Portugal Continental), que decorreu em 2001-2002, mostrou que 94,2% dos jovens dos 15-19 anos tinham contraído o VVZ e que apenas 2,85% das mulheres em idade fértil eram suscetíveis à infeção pelo vírus.5 Um estudo realizado em Portugal verificou a ocorrência de 1 706 internamentos hospitalares com diagnóstico principal de HZ, entre 2000 e 2010; a duração média dos internamentos foi de 9,3 dias, a qual aumentou com a idade.6
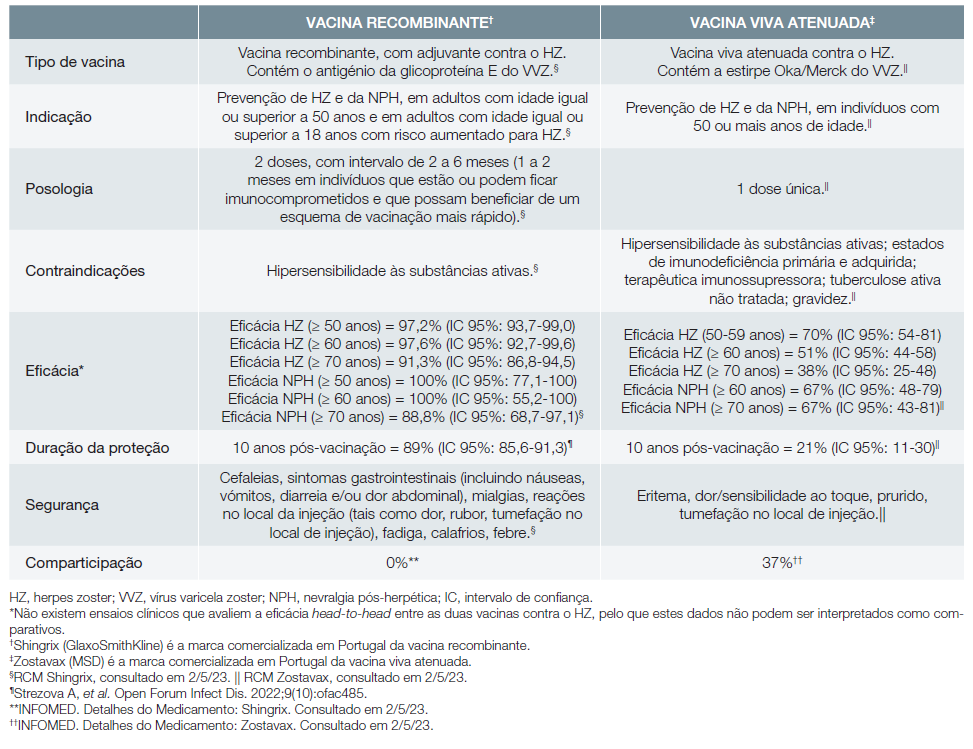
O HZ é, pois, uma doença com elevada incidência, associada a grande morbilidade e que pode originar ou agravar uma situação de fragilidade do doente, o que realça a importância da prevenção da zona, através da vacinação. A vacinação contra o HZ assume particular relevância em contexto pós-pandémico da COVID-19, uma vez que alguns dados apontam para um risco aumentado de HZ em adultos com idade igual ou superior a 50 anos diagnosticados com COVID-19.7 Em Portugal, à data, estão disponíveis duas vacinas contra o HZ: a vacina recombinante8 e a vacina viva atenuada9 (Tabela 1).
A vacina contra o HZ não consta do Programa Nacional de Vacinação nem existem recomendações nacionais específicas para a imunização, ao invés do que se verifica noutros países europeus, como Alemanha,10 Áustria,11 Bélgica,12,13Espanha,14,15França,16 Grécia,17 Holanda,18 Irlanda,19,20Itália,21 Reino Unido,22 República Checa,23,24Suécia25 e Suíça,26 nos EUA27,28e na Austrália,29 que emitiram recomendações para guiarem os clínicos na implementação e gestão da vacinação contra o HZ. Neste contexto, um painel de peritos da Sociedade Portuguesa de Medicina Interna (SPMI) e da Associação Portuguesa de Medicina Geral e Familiar (APMGF) elaborou um documento de consenso que estabelece orientações para a vacinação contra o HZ, a partir da revisão da bibliografia e das recomendações de outros países, com vista à prevenção da infeção e das complicações associadas nas populações de risco.
Recomendações
ADULTOS COM IDADE IGUAL OU SUPERIOR A 50 ANOS
RECOMENDAÇÃO 1
A vacinação contra o HZ é recomendada em todos os adultos com idade igual ou superior a 50 anos, com especial prioridade para:
Adultos com idade igual ou superior a 60 anos.
Adultos com as seguintes doenças crónicas: doença pulmonar obstrutiva crónica (DPOC), diabetes mellitus, asma brônquica, doença renal crónica, doença cardiovascular, doença inflamatória intestinal, doença hepática crónica.
Adultos imunocomprometidos (conforme definido para os adultos com idade entre 18 e 49 anos - vide Recomendação 2).
A Fig. 1 ilustra o algoritmo de vacinação contra o HZ. As Tabelas 2 e 3 resumem os grupos de adultos com doenças crónicas ou com imunossupressão para os quais a vacinação contra o HZ é recomendada.
Tabela 2: Grupos de adultos com doenças crónicas para os quais a vacinação contra o HZ é recomendada.
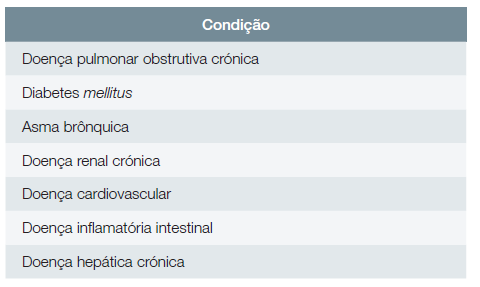
Tabela 3: Grupos de adultos com imunossupressão para os quais a vacinação contra o HZ é recomendada.

Fundamento da recomendação
A idade é um dos principais fatores de risco para o desenvolvimento de HZ,30 devido ao declínio da imunidade celular específica para o VVZ.1 De facto, a incidência de HZ aumenta acentuadamente em indivíduos com idade igual ou superior a 50 anos.3 Além disso, o risco de desenvolver NPH é particularmente elevado a partir dos 50 anos de idade, variando entre 4% e 15% dos casos de HZ na faixa etária dos 50-59 anos, 7% a 26% dos casos de HZ na faixa etária dos 60-69 anos, e 14% a 34% dos casos de HZ em indivíduos com 70 ou mais anos de idade, conforme demonstrado em estudos de coorte prospetivos.3
Por outro lado, uma metanálise de vários estudos relatou um aumento significativo do risco relativo (RR) de HZ, comparativamente com os controlos, para diversas comorbilidades, nomeadamente: DPOC (RR = 1,41; IC 95%: 1,28-1,55), diabetes mellitus (RR = 1,24; IC 95%: 1,14-1,35), asma (RR = 1,24; IC 95%: 1,16-1,31), doença renal crónica (RR = 1,29; IC 95%: 1,10-1,51), doença cardiovascular (RR = 1,34; IC 95%: 1,17-1,54) e doença inflamatória intestinal (RR = 1,32; IC 95%: 1,24-1,40).30 A evidência que suporta a recomendação de vacinação prioritária em adultos imunocomprometidos é apresentada no fundamento da recomendação 2.
O ensaio clínico ZOE-50 demonstrou a eficácia da vacina recombinante contra o HZ (97,2%; IC 95%: 93,7-99,0) e contra a NPH (100%; IC 95%: 77,1-100) em indivíduos com idade igual ou superior a 50 anos.8,31,32Mais concretamente, a eficácia vacinal contra o HZ foi de 96,6% (IC 95%: 89,6-99,4) na faixa etária dos 50-59 anos e de 97,4% (IC 95%: 90,1-99,7) na faixa etária dos 60-69 anos. Por sua vez, a análise agrupada dos estudos ZOE-50 e ZOE-70 revelou a eficácia da vacina recombinante contra o HZ (91,3%; IC 95%: 86,8-94,5) e contra a NPH (88,8%; IC 95%: 68,7-97,1) em indivíduos com idade igual ou superior a 70 anos.8,32A eficácia vacinal contra o HZ foi de 91,3% (IC 95%: 86,0-94,9) na faixa etária dos 70-79 anos e de 91,4% (IC 95%: 80,2-97,0) na faixa etária com 80 ou mais anos. Em ambos os estudos, as reações adversas de grau 3 (i.e., sintomas graves causando incapacidade para as atividades do dia a dia e que requerem alguma intervenção médica ou hospitalização) foram mais frequentes no grupo que recebeu a vacina recombinante do que no grupo controlo; a proporção de participantes que sofreram reações adversas graves, doenças imunomediadas ou que morreram foi semelhante nos dois grupos.31,32As condições médicas presentes no recrutamento (ex. distúrbios respiratórios, diabetes mellitus, asma, distúrbios renais, doença cardíaca coronária) não influenciaram a eficácia e a segurança da vacina recombinante contra o HZ, conforme demonstrou a análise post-hoc agrupada dos dados dos ensaios clínicos ZOE-50 e ZOE-70.33
A vacina viva atenuada apresentou uma eficácia contra o HZ de 69,8% (IC 95%: 54,1-80,6) em indivíduos com idade entre 50 e 59 anos, 64% (IC 95%: 56-71) na faixa etária dos 60-69 anos e 37,6% (IC 95%: 25-48) em indivíduos com idade igual ou superior a 70 anos (estudos ZEST e SPS, respetivamente).9,34,35 A eficácia vacinal contra o HZ foi de 41%(IC 95%: 28-52) na faixa etária dos 70-79 anos e de 18% (IC 95%: -29-58) na faixa etária com 80 ou mais anos.9,34-36A eficácia da vacina viva atenuada contra a NPH foi de 66,8%(IC 95%: 43,3-81,3) na população com 70 ou mais anos de idade.9,35Em ambos os estudos, as reações no local de injeção foram mais frequentes no grupo imunizado com a vacina viva recombinante do que no grupo controlo, sendo geralmente de intensidade moderada; a proporção de indivíduos que apresentaram reações adversas graves foi semelhante nos dois grupos.34,35A eficácia e a segurança da vacina viva atenuada contra o HZ não foi especificamente avaliada em indivíduos com comorbilidades médicas no recrutamento.
ADULTOS COM IDADE ENTRE 18 E 49 ANOS
RECOMENDAÇÃO 2
A vacinação contra o HZ é recomendada em adultos com idade entre 18 e 49 anos com risco elevado de zona, tais como:
Doentes com comorbilidades médicas, tais como DPOC, diabetes mellitus, asma brônquica, doença renal crónica, doença cardiovascular, doença inflamatória intestinal, doença hepática crónica.
Doentes com imunossupressão
Natural (associada a doenças): artrite reumatoide, conectivites (lúpus eritematoso sistémico, miopatias inflamatórias, esclerose sistémica), imunodeficiência congénita. Deve ser dada especial prioridade a doentes com artrite reumatoide, lúpus eritematoso sistémico ou miopatias idiopáticas inflamatórias.
Iatrogénica: corticoterapia crónica (equivalente a ≥20 mg/dia de prednisolona por mais de 10 dias no último mês ou >1 g cumulativo de corticoide), fármacos antirreumáticos modificadores de doença (DMARDs) sintéticos ou biotecnológicos. Deve ser dada especial prioridade a doentes sob terapêutica de depleção de células B ou terapêutica com inibidores da Janus cinase.
Nos seguintes grupos de doentes há benefício da vacinação contra o HZ, devendo a decisão de quando vacinar o doente ficar a cargo do médico assistente, de acordo com o seu estado imunológico: transplantados ou a aguardar transplante de células estaminais ou de órgão sólido, doentes hemato-oncológicos ou oncológicos, doentes infetados com o vírus da imunodeficiência humana (VIH) com linfócitos T CD4 ≥200/mm3, doentes com imunodeficiência congénita ou adquirida.
Fundamento da recomendação
Os doentes com as referidas comorbilidades médicas têm um risco superior de HZ, conforme exposto na recomendação 1.30 Por outro lado, em indivíduos imunocomprometidos, a infeção por HZ traduz-se em doença exacerbada, com maior risco de desenvolvimento de complicações e de maior gravidade, bem como maior probabilidade de HZ recorrente.37,38Um estudo de coorte retrospetivo que envolveu três bases de dados de grande dimensão concluiu que os indivíduos com imunossupressão apresentam um risco superior de desenvolvimento de HZ e de NPH.39 Comparativamente com a população total, a incidência de HZ é 9 vezes superior em doentes que receberam transplante de medula óssea ou de células estaminais, 4 vezes superior em doentes VIH+ ou que receberam transplante de órgão sólido, 3 vezes superior em doentes com lúpus eritematoso sistémico ou artrite reumatoide e 2 vezes superior em doentes oncológicos ou com doença inflamatória intestinal.39 Um outro estudo de metanálise demonstrou o risco aumentado de HZ em doentes VIH+ (RR = 3,22; IC 95%: 2,40-4,33), doentes oncológicos (RR = 2,17; IC 95%: 1,86-2,53), doentes com lúpus eritematoso sistémico (RR = 2,08; IC 95%: 1,56-2,78) e doentes com artrite reumatoide (RR = 1,51; IC 95%: 1,31-1,75).30
Em termos de imunossupressão iatrogénica, uma revisão sistemática e metanálise de vários estudos revelou que os indivíduos sob terapêutica imunossupressora com fármacos biológicos apresentam um risco aumentado de HZ comparativamente com os controlos (ensaios clínicos aleatorizados, RCTs: OR = 1,71; IC 95%: 1,11-2,64; estudos observacionais: OR = 1,58; IC 95%: 1,39-1,81).40Observou-se também um aumento do risco de desenvolvimento de HZ em doentes sob terapêutica com DMARDs não-biológicos, nomeadamente inibidores da Janus cinase (RCTs: OR = 2,16; IC 95%: 0,84-5,58), assim como em doentes sob corticoterapia (estudos observacionais: OR = 1,73; IC 95%: 1,57-1,89).40 De acordo com o Green Book of Immunisation, os indivíduos sob corticoterapia com o equivalente a ≥20 mg/dia de prednisolona por mais de 10 dias no último mês encontram-se em imunossupressão severa.41
As recomendações da maioria dos países em relação à vacinação contra o HZ na população de imunocomprometidos são bastante generalistas.42 Contudo, as orientações espanholas definem seis grupos de risco em adultos com idade superior a 18 anos: transplantados com células estaminais, transplantados com órgão sólido, doentes sob terapêutica com inibidores da Janus cinase, doentes VIH+, doentes hemato-oncológicos e doentes oncológicos sob quimioterapia.14 Mais recentemente, a Sociedade Espanhola de Imunologia propôs a criação de um sétimo grupo de risco - os doentes com imunodeficiência congénita -, em virtude da morbilidade grave associada a HZ neste grupo de doentes.15,43
A eficácia da vacina recombinante contra o HZ em recetores de transplante autólogo de células estaminais e em doentes com neoplasias hematológicas, com idade igual ou superior a 18 anos, foi comprovada nos ensaios clínicos Zoster-002 e Zoster-039, respetivamente.44-45Adicionalmente, a vacina recombinante contra o HZ induziu também respostas humorais e celulares robustas e persistentes tanto nestas duas populações de doentes, como em doen-tes VIH+ com função imunitária preservada, em doentes transplantados renais e em doentes com tumores sólidos, com um perfil de segurança idêntico ao reportado em adultos imunocompetentes.44-49
A análise post-hoc agrupada dos dados dos ensaios clínicos ZOE-50 e ZOE-70 demonstrou ainda a eficácia e a segurança da vacina recombinante contra o HZ em indivíduos com doenças imunomediadas pré-existentes, incluindo doentes com artrite reumatoide.50 Um estudo retrospetivo verificou a segurança da vacina recombinante em doentes reumáticos, incluindo doentes com artrite reumatoide ou lúpus eritematoso sistémico.51 Outros dois trabalhos documentam a imunogenicidade e a segurança da vacina recombinante contra o HZ em doentes com artrite reumatoide sob terapêutica com inibidores da Janus cinase.52,53
A vacina viva atenuada contra o HZ está contraindicada em indivíduos imunocomprometidos,9 devido ao maior risco de efeitos secundários, incluindo o desenvolvimento de doença sintomática e progressiva pelo VVZ, e menor probabilidade de eficácia vacinal.54
Momento ideal de vacinação
RECOMENDAÇÃO 3
A vacinação contra o HZ deve ser preferencialmente realizada em indivíduos com doença associada a imunossupressão controlada (em baixa atividade ou remissão), com exceção das artropatias inflamatórias. Em circunstâncias de doença em elevada atividade, a decisão deve ser individualizada, tendo em atenção o risco de agravamento da doença de base por efeitos imunomediados e o potencial benefício da vacinação.
Em todas as patologias que, previsivelmente, irão precisar de imunossupressão crónica, o momento ideal de vacinação com, pelo menos, uma dose da vacina contra o HZ é anterior ao início da terapêutica ou o mais precocemente possível.
Fundamento da recomendação
As vacinas só devem ser administradas em indivíduos com doença imunomediada compensada ou em fase precoce, a fim de evitar potenciais efeitos adversos imunomediados.55
Embora não exista um momento definido, é transversal a todas as patologias que requerem imunossupressão crónica (ex. artrite reumatoide) que a vacinação deve realizar-se antes do início da terapêutica imunossupressora, para evitar perda de eficácia das vacinas. Caso não seja possível, o doente deve ser vacinado quando a resposta imunitária for previsivelmente mais robusta, ou seja, em períodos de menor imunossupressão e de doença mais estável.28,56
Vacina preferencial
RECOMENDAÇÃO 4
Os adultos imunocompetentes devem ser preferencialmente imunizados com a vacina recombinante contra o HZ. A vacina viva atenuada pode ser considerada, no entanto, em situações pontuais, nomeadamente: indisponibilidade da vacina recombinante; reação adversa grave que contraindique a vacina recombinante; hipersensibilidade às substâncias ativas ou a qualquer um dos excipientes da vacina recombinante.
Os adultos imunocomprometidos só podem ser imunizados com a vacina recombinante contra o HZ.
Fundamento da recomendação
A preferência pela vacina recombinante em adultos imunocompetentes é justificada pela sua eficácia elevada contra o HZ e a NPH nesta população, incluindo em indivíduos mais idosos ou com condições médicas, tal como referido na recomendação 1.8,31-33Além disso, a vacina recombinante apresentou eficácia sustentada contra o HZ em adultos com idade igual ou superior a 50 anos durante pelo menos 10 anos (89%; IC 95%: 85,6-91,3).57 Por sua vez, a eficácia da vacina viva atenuada contra o HZ avaliada aos 10 anos após vacinação foi consideravelmente inferior (21%; IC 95%: 11-30), ainda que os ensaios clínicos não sejam diretamente com-paráveis.9,58Face a esta evidência, a vacina recombinante contra o HZ é a vacina preferencial para adultos imunocom-petentes ou mesmo a única disponível, na maioria dos países que definiram orientações específicas para a vacinação con-tra esta patologia, entre os quais Alemanha, Austrália, Áustria, Canadá, Espanha, EUA, Holanda e Reino Unido.29,42
A vacina viva atenuada contra o HZ está contraindicada em indivíduos imunocomprometidos, pelo que este grupo de doentes só pode ser imunizado com a vacina recombinante.9
História prévia de zona
RECOMENDAÇÃO 5
Os indivíduos com episódio prévio de zona devem ser vacinados contra o HZ, com um intervalo de pelo menos um ano desde a resolução dos sintomas.
Deve ponderar-se encurtar este intervalo em indivíduos com HZ recorrente e em indivíduos imunocomprometidos (intervalo não inferior a 2 meses desde a resolução dos sintomas).
Fundamento da recomendação
Os indivíduos com antecedentes de zona continuam em risco de HZ recorrente, o que torna pertinente a sua vacinação.59 Num ensaio clínico não controlado de pequena dimensão, realizado em adultos com idade igual ou superior a 50 anos com história clinicamente documentada de zona, a vacina recombinante contra o HZ provocou uma resposta humoral forte similar à observada noutros estudos, com reações adversas locais e sistémicas transitórias e maioritariamente ligeiras a moderadas.8,60A vacina viva atenuada contra o HZ foi administrada a indivíduos com 50 ou mais anos de idade com história prévia de zona, num ensaio clínico aleatorizado, tendo induzido uma resposta imunitária significativamente superior comparativamente com o placebo, com um perfil de segurança semelhante ao observado em estudos anteriores.9 Na ausência de dados concretos sobre o intervalo ótimo entre o episódio de zona e a vacinação contra o HZ e tendo em conta as recomendações emitidas por peritos de outros países,29,42consideramos aceitável o período mínimo de um ano, o qual poderá ser eventualmente encurtado em indivíduos com HZ recorrente ou imunocomprometidos, devido ao risco superior de desenvolvimento de HZ.39
Vacinação prévia com a vacina viva atenuada contra o HZ
RECOMENDAÇÃO 6
Os indivíduos previamente imunizados com a vacina viva atenuada contra o HZ devem ser imunizados com a vacina recombinante, com um intervalo entre vacinas de pelo menos 1 ano.
Fundamento da recomendação
Esta orientação baseia-se na eficácia elevada e persistente da vacina recombinante contra o HZ.8,31-33,57Além disso, o es-tudo Zoster-048 demonstrou a imunogenicidade e a segurança da vacina recombinante em indivíduos com idade igual ou superior a 65 anos vacinados com a vacina viva atenuada contra o HZ há mais de cinco anos.8,61,62Não existem dados específicos relativamente ao intervalo ótimo entre a toma da vacina viva atenuada e a vacina recombinante contra o HZ. Assim, a recomendação emitida neste documento tem em atenção o facto de já existirem peritos que consideram seguro o intervalo mínimo de um ano,29,42bem como o facto de a recomendação de intervalos de tempo superiores, como os cinco anos do estudo Zoster-048, não ser baseada em evidência.
Coadministração da vacina contra o HZ com outras vacinas
RECOMENDAÇÃO 7
A vacina recombinante contra o HZ pode ser administrada concomitantemente com a vacina da gripe sazonal inativada, sem adjuvante, a vacina pneumocócica polissacárida 23-valente, a vacina pneumocócica conjugada 13-valente ou a vacina contra a difteria, tétano e tosse convulsa acelular com conteúdo reduzido de antigénios (Tabela 4).
A vacina viva atenuada contra o HZ pode ser administrada concomitantemente com a vacina da gripe inativada ou a vacina pneumocócica polissacárida 23-valente (Tabela 4).
Fundamento da recomendação
Esta recomendação baseia-se na informação contida no resumo das características do medicamento (RCM) das vacinas contra o HZ.8,9
A imunogenicidade e a segurança da coadministração da vacina recombinante contra o HZ com uma vacina da gripe sazonal inativada, sem adjuvante, uma vacina pneumocócica polissacárida 23-valente, uma vacina pneumocócica conjugada 13-valente ou uma vacina contra a difteria, tétano e tosse convulsa acelular com conteúdo reduzido de antigénios foram comprovadas em quatro RCTs de fase III.8,63-66
A imunogenicidade da vacina viva atenuada contra o HZ quando administrada concomitantemente com uma vacina da gripe inativada foi também demonstrada em ensaio clínico. Por outro lado, a administração concomitante da vacina viva atenuada contra o HZ com uma vacina pneumocócica polissacárida 23-valente resultou em imunogenicidade reduzida da vacina viva atenuada contra o HZ num pequeno ensaio clínico.9 Contudo, os dados recolhidos num estudo observacional de grande dimensão não indicaram um risco aumentado para o desenvolvimento de HZ após a administração concomitante das duas vacinas.9
As vacinas devem ser administradas em diferentes locais de injeção e o doente deve ser alertado para a possibilidade de a coadministração da vacina contra o HZ com outras vacinas levar a um aumento das reações adversas ligeiras a moderadas.8,9Não se recomenda a administração concomitante da vacina contra o HZ com outras vacinas além das mencionadas devido à falta de informação.8,9
Note-se que a necessidade da vacinação antigripal não deve condicionar a vacinação contra o HZ, uma vez que o intervalo entre a administração das duas vacinas pode ser de apenas duas semanas.
Prescrição da vacina contra o HZ
RECOMENDAÇÃO 8
É fundamental que o médico proponha a vacinação contra o HZ sempre que oportuno e que se relembre a recomendação, mesmo que o doente a tenha recusado previamente. O custo da vacina não deve ser um obstáculo à sugestão de prescrição. O ato de prescrição da vacina contra o HZ deve acom-panhar-se de intervenções dirigidas ao aumento da literacia sobre a zona e sua prevenção, nomeadamente:
Explicação sobre o que é a zona e relação com infeção prévia pelo VVZ;
Informação sobre a incidência e morbilidade da doença;
Esclarecimento sobre as vacinas disponíveis, sua eficácia, possíveis reações adversas e custo;
Chamada de atenção para a necessidade de tomar duas doses, com 2 a 6 meses de intervalo, para vacinação completa com a vacina recombinante;
Referência à flexibilidade do esquema vacinal da vacina recombinante (segunda toma até 6 meses após primeira toma poderá facilitar a gestão financeira do doente).
Fundamento da recomendação
Esta recomendação tem como base a opinião dos peritos, formulada de acordo com a sua prática clínica.
Reações adversas das vacinas contra o HZ
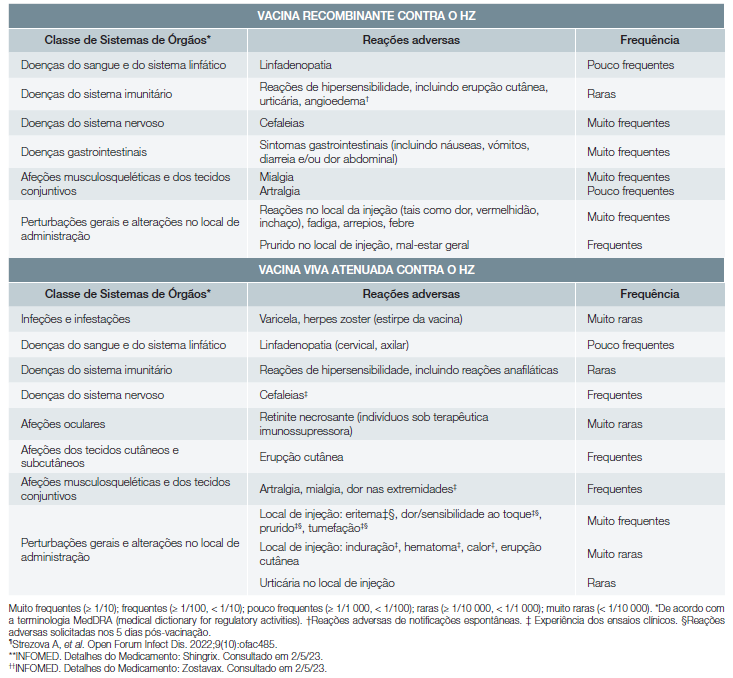
As reações adversas das vacinas contra o HZ encontram-se sumarizadas na Tabela 5.8,9
Contraindicações e precauções de utilização de vacinas contra o HZ
As vacinas contra o HZ não servem para prevenção da infeção primária da varicela.
A história prévia de varicela não é relevante para a vacinação contra o HZ, não estando recomendado o seu rastreio nem por história clínica nem por serologia.
Vacina recombinante contra o HZ8
Contraindicada em casos de hipersensibilidade às substâncias ativas ou de reação anafilática a dose prévia da vacina.
Não indicada no tratamento do HZ ou da NPH.
Não existem dados sobre a sua administração em mulheres grávidas ou a amamentar.
A vacinação deve ser adiada em indivíduos que sofram de doença febril aguda grave; a presença de infeção ligeira, como uma constipação, não deve resultar no adiamento da vacinação.
Para injeção por via intramuscular apenas, de preferência no músculo deltoide.
Vacina viva atenuada contra o HZ9
Contraindicada em casos de hipersensibilidade às substâncias ativas, estados de imunodeficiência primária e adquirida, terapêutica imunossupressora, tuberculose ativa não tratada ou gravidez.
Não indicada no tratamento do HZ ou da NPH.
Não existem dados sobre a sua administração em mulheres grávidas ou a amamentar.
A imunização deverá ser adiada na presença de qualquer doença febril aguda moderada a grave ou infeção.
Pode ser injetada por via subcutânea ou intramuscular, preferencialmente na região deltoide.
Conclusão
A vacinação é uma estratégia eficaz na prevenção da zona e da NPH, permitindo reduzir a morbilidade associada à doença e, assim, melhorar a qualidade de vida dos doentes e reduzir os custos com cuidados de saúde. As recomendações emitidas neste documento, fundamentadas pela evidência científica e pela experiência clínica, definem grupos prioritários para a vacinação contra o HZ, o que poderá ser particularmente relevante numa futura comparticipação da vacina recombinante. Estas orientações visam também sensibilizar os médicos e as autoridades de saúde para a importância de promover a vacinação contra o HZ e de melhorar a literacia dos doentes relativamente à zona.