Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Jornal Português de Gastrenterologia
versão impressa ISSN 0872-8178
J Port Gastrenterol. v.17 n.3 Lisboa maio 2010
Helicobacter pylori numa população dispéptica no Algarve: prevalência e caracterização genética
Hermano Santos2, Horácio Guerreiro2, Diamantino Sousa2, José Estevens3, Ana Prurito Gonçalves1, Ana Paula Carvalho1, Cristina Inácio2, Maria Leonor Faleiro1, Lídia Dionísio1
1Universidade do Algarve. Faculdade de Engenharia de Recursos Naturais;
2Serviço de Gastrenterologia, Hospital Central de Faro, EPE;
3Serviço de Gastrenterologia, Hospital do Barlavento Algarvio
Resumo
INTRODUÇÃO: Dado o papel nuclear do Helicobacter pylori (Hp) na etiopatogenia das doenças gastroduodenais, é fundamental conhecer a sua prevalência e as suas características em cada região. OBJECTIVOS: determinar, numa população dispéptica no Algarve, a prevalência da infecção por Hp, fazer a sua caracterização genética e correlacionar ambas com os diagnósticos endoscópicos. MÉTODOS: Seleccionamos, aleatoriamente, 205 doentes dispépticos submetidos a endoscopia digestiva alta. Para detecção de Hp utilizámos teste rápido da urease, exame cultural e exame histológico, admitindo-se infecção quando pelo menos dois testes foram positivos. Usámos a técnica de PCR para caracterizar os genes cagA, vacA, oipA e babA em 22 das estirpes isoladas. Estatística: testes χ2 e exacto de Fisher; IC – 95%. RESULTADOS: prevalência 44,9% (superior no sexo masculino e entre os 30 e os 59 anos); genes cagA + em 90,9%, oipA funcional em 78,9%, babA + em 50% e genótipo s1m1 em 31,8% das estirpes. Associação da infecção apenas com úlcera duodenal. CONCLUSÕES: 1) Prevalência da infecção de 44,9%, decrescente após os 60 anos. 2) Associação da infecção apenas com úlcera duodenal. 3) Estirpes cagA + e oipA ON em proporção superior à esperada num país ocidental.
Helicobacter pylori prevalence and genetic characterization in a group of dyspeptic patients from Algarve
Abstract
INTRODUCTION: The role of Helicobacter pylori (Hp) in the ethiology of several gastroduodenal diseases is well established; it is thus important to know its prevalence and characteristics in different geographical zones. AIMS: to evaluate the prevalence of Hp infection in a dyspeptic population, to identify its genetic characteristics and correlate them with endoscopic findings. METHODS: 205 dyspeptic patients submitted to endoscopy were included. Helicobacter pylori presence was evaluated by rapid urease test as well as bacteriology tests and histopathology; infection was admitted when at least two tests were positive. We used PCR to characterize the genes cagA, vacA, oipA and babA in 22 of the isolated strains. Statistical: χ2 and exact Fishers tests; CI – 95%. RESULTS: prevalence: 44,9% (higher between 30 and 59 years old); genes cagA + in 90,9%, oipA functional in 78,9%, babA + in 50% and genotype s1m1 in 31,8% of the strains. Infection was only associated with duodenal ulcer. CONCLUSIONS: 1) Prevalence of the infection: 44,9 %, decreasing after 60 years of age. 2) Association of the infection only with duodenal ulcer. 3) rate of cag A + and oipA ON strains higher than expected in a western country.
INTRODUÇÃO
A infecção por Hp é reconhecida como uma das infecções crónicas mais comuns estimando-se que cerca de metade da população mundial esteja infectada1,2. É conhecido também que a sua prevalência varia consideravelmente com diversos factores sendo, geralmente, superior em meios sócio-económicos desfavorecidos3,4 em que são comuns habitações com grandes aglomerados familiares e deficientes condições higieno-sanitárias – ambientes reconhecidos como propiciadores da transmissão da bactéria3-5. Dessa forma, o espectro de prevalências da infecção por Hp é muito amplo variando com o grau de desenvolvimento das regiões – a maioria dos países em desenvolvimento apresentam taxas superiores a 80% em contraste com os 20 a 40% dos países desenvolvidos3. Entre estes, Portugal é uma notável excepção apontando-se uma prevalência próxima dos 80% apesar da 26ª posição no ranking de desenvolvimento das Nações Unidas6.
Embora, na maioria dos casos, a infecção seja assintomática, a sua associação etiológica com a gastrite crónica, a úlcera péptica, o cancro gástrico e o linfoma MALT é universalmente aceite7-11. Contudo, a maioria dos doentes dispépticos não tem evidência de doença estrutural que claramente explique os sintomas12. Tem-se procurado implicar o Hp nestes doentes com resultados controversos. A sua prevalência na dispepsia não ulcerosa é sobreponível à da população geral13. Por outro lado, admite-se que a erradicação do Hp nestes doentes pode reduzir a incidência de úlcera péptica12, mas o seu efeito nos sintomas dispépticos é duvidoso14.
Desde as observações iniciais de Warren e Marshall, que a bactéria tem sido exaustivamente estudada, tendo sido já identificados vários mecanismos de virulência. Entre eles, os mais largamente estudados são a proteína imunodominante Cag A e a citotoxina vacuolizante Vac A. Relativamente à primeira, codificada pelo gene cag A, é produzida por cerca de 60% das estirpes ocidentais15 e mais de 90% das asiáticas16 e representa um factor de risco para o desenvolvimento de gastrite atrófica, neoplasia gástrica e úlcera péptica17-19. A citotoxina Vac A, produzida por cerca de 50% das estirpes, induz a formação de vacúolos em células eucarióticas. O gene vac A está presente em todas as estirpes, mas apresenta variações nas regiões sinal (tipos s1 ou s2), região média (tipos m1 ou m2) e intermédia (i1 ou i2). A combinação s1m1 confere elevada actividade citotóxica, s1m2 intermédia e s2m2 baixa actividade20. A proteína BabA, codificada pelo gene babA2, está igualmente implicada na patogenicidade da bactéria, ao permitir a sua adesão ao epitélio, e a sua presença associa-se ao desenvolvimento de adenocarcinoma, úlcera péptica e gastrite21-23. O gene oip A, presente em menos de metade das estirpes ocidentais, associa-se igualmente a maior inflamação da mucosa24.
Assim, pela importância etiológica do Hp e pela variabilidade da sua prevalência e da sua virulência, torna-se importante conhecer a realidade local. Neste estudo, estudámos a prevalência da infecção por Hp numa população de doentes dispépticos no Algarve submetidos a endoscopia digestiva alta, procurámos estabelecer a eficiência global dos testes de diagnóstico utilizados e caracterizar geneticamente as estirpes isoladas. Finalmente, tentámos correlacionar a infecção por Hp, e as suas características genéticas (genes cag A, vac A, oip A e babA2), com os achados endoscópicos.
MATERIAL E MÉTODOS
Seleccionámos, de modo aleatório, 205 doentes submetidos a endoscopia digestiva alta entre Janeiro de 2002 e Setembro de 2005, por queixas dispépticas. Todos deram o seu consentimento informado. Foram excluídos os doentes que realizaram terapêutica com antibiótico ou anti-ulceroso no ano antecedente. A todos foi efectuado um inquérito epidemiológico, registados os achados endoscópicos, realizado teste rápido da urease e colhidas 3 biópsias do antro e 3 do corpo gástrico para exames histológico, cultural e molecular de Hp. As biópsias para exame histológico foram colocadas em formol; as biópsias para exame molecular congeladas a seco e as biópsias para exame cultural foram colocadas em lactato de Ringer.
Para pesquisa da presença de Hp, usámos 3 métodos – teste rápido da urease, exame cultural e histopatológico – admitindo-se infecção na presença de pelo menos 2 testes positivos.
Exame cultural
As biópsias foram manuseadas assepticamente, tendo sido trituradas num pequeno volume de Caldo Mueller-Hinton (OXOID). O homogeneizado foi inoculado, segundo os procedimentos descritos pelo «National Committee for Clinical Laboratory Standards» (NCLLS), em meio selectivo (Columbia Agar; OXOID) suplementado com 10 % de sangue desfibrinado de cavalo (OXOID) e suplemento selectivo para Hp (SR 147; OXOID) e meio não selectivo (Columbia Agar; OXOID) suplementado com 10 % de sangue desfribinado de cavalo (OXOID). As placas foram incubadas a 36 ± 1ºC, em condições de microaerofilia (Gás Generating Kits for Campilobacter; OXOID) com cerca de 6 % de oxigénio, 10 % de dióxido de carbono e uma humidade relativa superior a 98%, durante 3 a 4 dias. A partir do 3º dia, faz-se uma observação diária até 5 a 7 dias. No entanto, as placas foram mantidas a 36 ± 1ºC em atmosfera de microaerofilia durante 12 dias antes de considerar a cultura negativa. A identificação foi feita através de observação da morfologia típica das colónias (colónias pequenas, brilhantes, convexas e de bordos regulares; não hemolíticas), citomorfologia característica com coloração de Gram (células Gram-, espiraladas ou encurvadas, com formas em U ou I), reacção positiva nos testes bioquímicos de urease (caldo ureia, com Suplemento SRO 20 K Oxoid).
Exame histológico
A pesquisa específica da presença de Hp foi realizada por 3 anatomopatologistas em amostras fixadas e coradas com hematoxilina-eosina.
Teste rápido da Urease
Foi testada a actividade da urease em 2 amostras do antro e 2 do corpo gástrico usando o CLOtest® (Kimberly-Clark/Ballard Medical Products, USA) de acordo com as instruções do fabricante. Resumidamente, as amostras são colocadas num meio contendo ureia e um indicador de pH. A hidrólise da ureia em amónia e CO2 na presença da urease altera o pH do meio com alteração da cor do indicador. A alteração da cor nas primeiras 24 horas foi interpretada como teste positivo.
Caracterização genotípica de factores de virulência de Hp
Em 22 das estirpes isoladas, realizámos a caracterização genotípica dos factores de virulência cag A, vac A, oip A e bab A. Para isso, foi efectuada a extracção de DNA cromossomal das estirpes isoladas a partir de biópsia gástrica, e pesquisada a presença do gene cag A e bab A2 e foram caracterizadas as regiões média e sinal do gene vac A pela técnica de PCR (Polymerase chain reaction) com iniciadores específicos. A região sinal foi amplificada, utilizando iniciadores específicos. Os fragmentos do gene oip A foram purificados e sequenciados num sequenciador automático 3100 Genetic Analyser (Abi-Prism).
Análise estatística
A análise estatística foi feita com recurso ao programa SPSS versão 15. Foram utilizados o teste x-quadrado e o teste exacto de Fisher para comparação de variáveis categóricas. Considerou-se estatisticamente significativo um p < 0,05.
RESULTADOS
Determinámos a presença de Hp em 205 doentes – 110 homens e 95 mulheres com idade média de 65,9 ± 16,9 anos (11 a 89). A prevalência da infecção foi 44,9% (92 doentes infectados), sendo superior no sexo masculino (49,1% vs 40%) sem, contudo, atingir significado estatístico (p=0,192) – Quadro I. A idade associou-se de forma estatisticamente significativa à infecção por Hp, com prevalências superiores nos escalões etários entre os 30 e os 60 anos (p=0,044) – Quadro 1 e Fig. 1.
Quadro 1. Distribuição e prevalência da infecção por Hp por sexo e grupo etário.
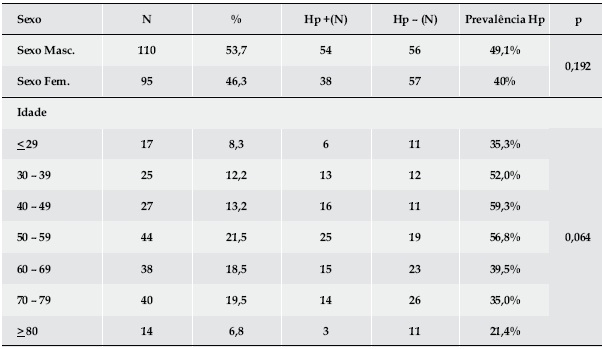
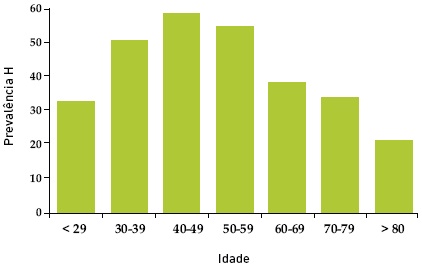
Fig. 1. Distribuição da prevalência da infecção por Hp por grupo etário.
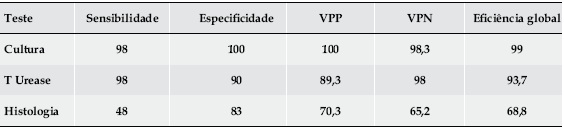
Relativamente aos testes diagnósticos usados, a cultura, com acuidade global de 99%, mostrou-se superior ao teste rápido da urease e ao exame histológico, cujas acuidades globais foram de 93,7% e 68,8% respectivamente – Quadro 2.
Quadro 2. Métodos de diagnóstico da infecção por Hp utilizados.
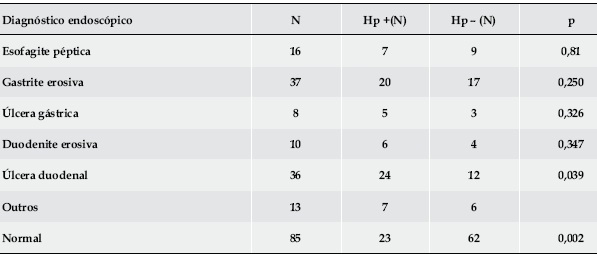
Os achados endoscópicos estão descritos no Quadro 3. A infecção por Hp associou-se, como esperado, à presença de úlcera duodenal (p=0,039), não se evidenciando associação com nenhuma das outras patologias. As endoscopias normais foram mais frequentes em doentes não infectados (p=0,002).
Quadro 3. Distribuição dos diagnósticos endoscópicos e correlação com infecção por Hp.
Caracterizámos, com recurso à técnica PCR, os genes cag A, vac A, bab A2 e oip A de 22 das estirpes isoladas. O gene cag A foi detectado em 20 das 22 das estirpes, 90,9%; relativamente ao gene vac A, 45,5% (10/22) das estirpes possuía o genótipo s2/m2, 22,7% (5/22) o genótipo s1/m2 e 31,8% (7/22) o s1/m1. O gene oip A encontrou-se funcional (ON) em 78,9% (15/19) das estirpes e o gene bab A2 foi detectado em 50% das 22 estirpes isoladas – Quadro 4.
Quadro 4. Caracterização genética das estirpes isoladas.
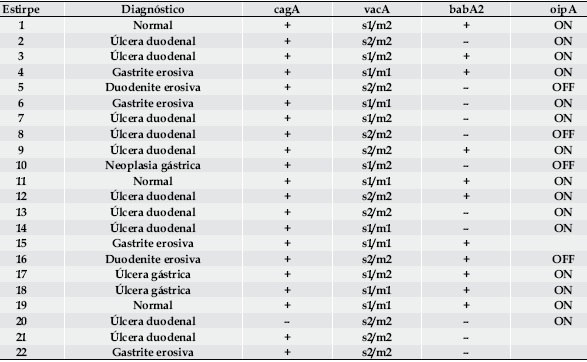
Não se conseguiu estabelecer associação entre os vários perfis genéticos com qualquer das patologias diagnosticadas.
DISCUSSÃO
O valor calculado da prevalência da infecção por Hp – 44,9% – foi consideravelmente inferior ao estimado para a população geral portuguesa e próximo do de vários países desenvolvidos da Europa Ocidental. Contudo, tendo em conta que se trata duma população dispéptica e que a prevalência desta infecção em doentes dispépticos é superior à da população geral, com um odds ratio de 2,325, o valor encontrado de 44,9% assume um valor relativo ainda mais baixo no contexto português. Neste sentido, poderemos dizer que estamos dentro dos valores habituais descritos para a Europa ocidental.
Ao olhar para a figura 1, torna-se evidente a redução progressiva da prevalência acima dos 60 anos. Outros trabalhos mostraram declínios da prevalência nestes grupos etários, apontando taxas de soroconversão que podem atingir os 7% anuais26,27. Este fenómeno pode ser devido à própria história natural da infecção por Hp, condicionada pelo surgimento da gastrite atrófica e consequente perda do nicho ecológico da bactéria28 ou mesmo ocasionada por condições sócio-económicas particulares envolvendo a infância desses grupos etários29. Contudo, na nossa população, registámos apenas 10 casos de gastrite atrófica e sem associação com a idade e, além disso, não há conhecimento, no Algarve, de circunstâncias específicas que tivessem dificultado a infecção por Hp no período que pode corresponder à infância do grupo etário estudado. Não dispomos de explicação evidente para esta observação, que merece ser aprofundada no aspecto epidemiológico e demográfico. Já as taxas inferiores abaixo dos 30 anos nos parecem explicáveis pela melhor condição sócio-económica a que se assistiu em Portugal nas últimas 2 – 3 décadas.
Relativamente aos meios de diagnóstico utilizados, a cultura, considerado por muitos autores, o gold standard no diagnóstico desta infecção, mostrou a melhor acuidade global classificando correctamente 99% dos doentes. Por sua vez, os resultados do exame histológico foram francamente desapontadores com sensibilidade de apenas 48%. O facto de ser muito operador-dependente, quer na colheita, quer na análise das amostras, de ter sido realizado por anatomopatologistas distintos tendo apenas sido usada uma coloração, pode justificar, em parte, estes resultados. Já o teste rápido da urease, com resultados de acordo com os habitualmente descritos, confirmou-se como um método eficaz, rápido e económico.
Estima-se que cerca de 80% dos doentes com úlcera duodenal e mais de 60% daqueles com úlcera gástrica estão infectados com Hp30. Na nossa população, no caso da úlcera duodenal, essa percentagem foi inferior – 67% – mas manteve-se a associação com significado estatístico.
No caso da úlcera gástrica e da duodenite erosiva, apesar de ambas mais frequentes nos doentes infectados, julgamos que a ausência de associação significativa se ficou a dever à insuficiência dos números de ambas as patologias. Todavia, a associação mais estreita verificou-se entre as endoscopias normais e a não infecção o que, de forma indirecta, atesta igualmente o papel etiopatogénico da bactéria.
Relativamente aos factores de virulência, pelo reduzido número das estirpes caracterizadas, não foi possível estabelecer associação com as patologias encontradas. Todavia, é notória a presença marcada de genótipos ditos virulentos. Relativamente às estirpes comuns nos países ocidentais, constatámos, na nossa amostra, significativamente maior presença do gene cagA (90,9%) e estado ON do gene oipA (78,9%); além disso, quase dois terços – 63,6% – das estirpes reuniram pelo menos 3 dos quatro genótipos reconhecidamente mais virulentos31. A fazer fé na nossa pequena amostra, cremos que as estirpes da nossa região têm elevado potencial patogénico, mas será necessário reunir um maior número de doentes e avaliar também indivíduos assintomáticos para melhor esclarecer estes dados.
REFERÊNCIAS
1. Cave DR. Transmission and epidemiology of Helicobacter pylori. Am J Med 1996;100:12-17.
2. Cave DR. How is Helicobacter pylori transmitted? Gastroenterology 1997;113(6 Suppl):9-14.
3. Brown LM. Helicobacter pylori: epidemiology and routes of transmission. Epidemiol Rev 2000;22:283-297.
4. Malaty HM, Graham DY, Wattigney WA, et al. Natural history of Helicobacter pylori infection in childhood: 12-year follow-up cohort study in a biracial community. Clin Infect Dis 1999;28:279-282.
5. Lin SK, Lambert JR, Nicholson L, et al. Prevalence of Helicobacter pylori in a representative Anglo-Celtic population of urban Melbourne. J Gastroenterol Hepatol 1998;13:505-510.
6. Fukuda-Parr S. Human development report 2004: Cultural liberty in todays diverse world. United Nations Development Programme, New York.
7. Mapstone NP, Lynch DA, Lewis FA, et al. Identification of Helicobacter pylori DNA in the mouths and stomachs of patients with gastritis using PCR. J Clin Pathol 1993;46:540-543.
8. Ebert MP, Schandl L, Malfertheiner P. Helicobacter pylori infection and molecular changes in gastric carcinogenesis. J Gastroenterol 2002;37:45-49.
9. Axon A. Review article: gastric cancer and Helicobacter pylori. Aliment Pharmacol Ther 2002;4:83-88.
10. Zhang C, Yamada N, Wu YL, et al. Helicobacter pylori infection, glandular atrophy and intestinal metaplasia in superficial gastritis, gastric erosion, erosive gastritis, gastric ulcer and early gastric cancer. World J Gastroenterol 2005;11:791-796.
11. Shirin H, Leja M, Niv Y. Helicobacter pylori and non-malignant diseases. Helicobacter 2008;13 Suppl 1:23-27.
12. Hsu PI, Lai KH, Tseng HH, et al. Eradication of Helicobacter pylori prevents ulcer development in patients with ulcer-like functional dyspepsia. Aliment Pharmacol Ther 2001;15:195-201.
13. Delaney BC, Wilson S, Roalfe A, et al. Cost effectiveness of initial endoscopy for dyspepsia in patients over age 50 years: a randomised controlled trial in primary care. Lancet 2000;356:1965-1969.
14. Moayyedi P, Soo S, Deeks J, et al. Systematic review and economic evaluation of Helicobacter pylori eradication treatment for non-ulcer dyspepsia. Dyspepsia Review Group. BMJ 2000;321:659-664.
15. Crabtree JE, Covacci A, Farmery SM, et al. Helicobacter pylori induced interleukin-8 expression in gastric epithelial cells is associated with CagA positive phenotype. J Clin Pathol 1995;48:41-45.
16. Xiang Z, Censini S, Bayeli PF, et al. Analysis of expression of CagA and VacA virulence factors in 43 strains of reveals that clinical isolates can be divided into two major types and that CagA is not necessary for expression of the vacuolating cytotoxin. Infect Immun 1995;63:94-98.
17. Blaser MJ. Role of vacA and the cagA locus of Helicobacter pylori in human disease. Aliment Pharmacol Ther 1996;10 Suppl 1:73-77.
18. Kuipers EJ, Pérez-Pérez GI, Meuwissen SG, et al. Helicobacter pylori and atrophic gastritis: importance of the cagA status. J Natl Cancer Inst 1995;87:1777-1780.
19. Rokkas T, Liatsos C, Karameris A, et al. Serologic detection of CagA positive Helicobacter pylori strains predicts the presence of peptic ulcer in young dyspeptic patients. Gastrointest Endosc 1999;50:511-515.
20. Soltermann A, Koetzer S, Eigenmann F, et al. Correlation of Helicobacter pylori virulence genotypes vacA and cagA with histological parameters of gastritis and patients age. Mod Pathol 2007;20:878-883.
21. Yamaoka Y. Roles of Helicobacter pylori BabA in gastroduodenal pathogenesis. World J Gastroenterol 2008;14:4265-4272.
22. Mizushima T, Sugiyama T, Komatsu Y, et al. Clinical relevance of the babA2 genotype of Helicobacter pylori in Japanese clinical isolates. J Clin Microbiol 2001;39:2463-2465.
23. Rad R, Gerhard M, Lang R, et al. The Helicobacter pylori blood group antigen-binding adhesin facilitates bacterial colonization and augments a nonspecific immune response. J Immunol 2002;168:3033-3041.
24. Yamaoka Y, Kwon DH, Graham DY. AM(r) 34.000 proinflamatory outer membrane protein (oip A) of Helicobacer pylori. Proc Natl Acad Sci USA 2000;97:7533-7538.
25. Armstrong D. Helicobacter pylori infection and dyspepsia. Scand J Gastroenterol 1996;31:38-47.
26. Potasman I, Yitzhak A. Helicobacter pylori serostatus in backpackers following travel to tropical countries. Am J Trop Med Hyg 1998;58:305-308.
27. Taylor DN, Sanchez JL, Smoak BL, et al. Helicobacter pylori infection in Desert Storm troops. Clin Infect Dis 1997;25:979-982.
28. Kodaira MS, Escobar AM, Grisi S. Epidemiological aspects of Helicobacter pylori infection in childhood and adolescence. Rev Saúde Pública 2002;36:356-369. [ Links ]
29. Asaka M. Epidemiology of Helicobacter pylori infection in japan. Nippon Rinsho 2003;61:19-24.
30. Feldman M, Lawrence SF, Lawrence JB. Sleisenger and Fordts Gastrointestinal and Liver desease. Philadelphia: Elsevier, 2006, 1094.
31. Saribasak H, Salih BA, Yamaoka Y, et al. Analyzis of Helicobacter pylori genotypes and correlation with clinical outcome in Turkey. J Clin Microbiol 2004;42:1648-1651.
Patrocínio: Este estudo foi parcialmente financiado pela Fundação para a Ciência e a Tecnologia e pelo FEDER através do Projecto POCTI (POCTI/ESP/41217/2001)
Correspondência: Hermano Santos, Serviço de Gastrenterologia – Hospital Central de Faro, Rua Leão Penedo, 8000 – Faro; E-mail: santos.hermano@gmail.com; Tel.: +351 965 329 507; Fax: +351 289 891 100.
Recebido para publicação: 13/10/2008 e Pronto para publicação: 15/04/2010.













