Serviços Personalizados
Journal
Artigo
Indicadores
Links relacionados
Compartilhar
Jornal Português de Gastrenterologia
versão impressa ISSN 0872-8178
J Port Gastrenterol. vol.19 no.3 Lisboa maio 2012
Peginterferão α2-a na co-infecção VHB --- VH delta --- Um caso de duplo sucesso terapêutico
Peginterferon_2-a in HBV − HVD coinfection − A case of double therapeutic success
Liliana Santosa,∗, Gonçalo Ramosa, Isabel Redondob, Rita Côrte-Realb e Filipe Calinasb
a Serviço Gastrenterologia, Centro Hospitalar de Lisboa Central, Hospital Santo António dos Capuchos, Lisboa, Portugal
b Serviço Patologia Clínica, Centro Hospitalar de Lisboa Central, Hospital Santo António dos Capuchos, Lisboa, Portugal
*Autor para correspondência
Resumo
O vírus da hepatite D (VHD) é um vírus satélite, que necessita do vírus da hepatite B (VHB) para a sua replicação. Na maioria dos casos, o VHD suprime a replicac¸ão do VHB e, nestas circunstâncias, está recomendado o tratamento com Interferão. Nos doentes em que não se observa resposta virológica após o 1.◦ ano de terapêutica, o seu prolongamento pode aumentar a taxa de resposta virológica sustentada.
Caso clínico: Homem, 42 anos, com hepatite crónica B, anti-HBe positivo e baixa carga viral. Apresentava aminotransferases aumentadas que persistiram, mesmo após negativação do ADNVHB. A positividade da fração IgM do AcVHD conduziu ao diagnóstico de co-infecção VHB-VHD. Foi tratado com PegInterfeão _-2a durante 102 semanas. Observou-se normalização das aminotransferases à 33.a semana, negativação da IgM do AcVHD à 88.a semana e resposta virológica sustentada com perda do AgHB.
Comentários: Este caso ilustra a importância de se manter o tratamento nos doentes com infecção VHD até resposta virológica, uma vez que a cura do VHD pode acompanhar-se da cura da infecção VHB.
PALAVRAS-CHAVE Co-infecção; VHB; VHD; Peginterferão
Abstract
Hepatitis D virus (HDV) is a satellite virus which needs hepatitis B virus (HBV) for its replication. In most cases, HDV suppresses HBV replication and in these circumstances the treatment should be with Interferon. In patients that have no virological response after the 1th year of therapy, continuing it will possible increase the virological response and the loss of the HBs antigen.
Case report: 42 years old man with chronic HBV, anti-HBe positive and low HBV viral load. He had increased transaminases which had persisted even after HBV-DNA negativation. We performed antibody anti-HDV that came positive and treated the patient with PegInterferon α-2ª during 102 weeks. We assist to normalization of the transaminases at week 33 and negativation of IgM-HVD at week 88. At the end of the treatment RNA-HDV was negative and the patient lost HBs antigen that persisted over the next sixth months.
Comments: This case illustrates the importance of maintaining treatment until HDV virological response since the cure of the HDV may be accompanied by the cure of HBV infection.
KEYWORDS Coinfection; HBV; HDV; Peginterferon
Introdução
O vírus da hepatite D (VHD) pertence à família Deltaviridae e é o único vírus animal satélite conhecido1. Foi descobertoem 1977 por Mario Rizzetto et al., em Itália2.
É um vírus de ARN que necessita da presença do vírus da hepatite B (VHB) para completar o seu ciclo biológico, pelo que a infecção pelo VHD ocorre apenas em doentes infectados pelo VHB1,3.
O seu genoma, o mais pequeno do reino animal, contém apenas 1700 nucleótidos, sendo constituído por um ARN circular, que codifica uma proteína estrutural que é o antigénio (Ag) delta2,3.
O virião do VHD consiste num complexo formado pelo ARN-VHD e o Ag delta, protegidos por um envelope proteico constituído pelo AgHbs. O AgHBs é necessário para a transmissão e replicação do VHD que ocorre exclusivamente no núcleo dos hepatócitos.
Estão identificados 8 genótipos do VHD, cada um com curso clínico e localizações geográficas características4,5.
Estima-se que mundialmente 15 a 20 milhões de doentes estejam infectados pelo VHD, correspondendo a 5% dos doentes com infecção crónica pelo VHB3.
O vírus partilha as vias de transmissão associadas ao VHB, nomeadamente parentérica, sexual e intrafamiliar2.
O VHD é transmitido apenas a indivíduos com infecção pelo VHB, podendo ocorrer em doentes com infecção crónica prévia pelo VHB (superinfecção) ou ser adquirido concomitantemente aquando da infecção aguda pelo VHB (coinfecção). No primeiro caso, pode manifestar-se com quadros de exacerbação de doença estável e possui habitualmente caráter dominante e de repressão sobre o VHB. O diagnóstico baseia-se no doseamento dos marcadores serológicos e da carga viral de ambos os vírus1,2.
Doentes com doença hepática crónica VHD-VHB têm indicação para tratamento, devendo este ser dirigido ao vírus dominante3,4.
Caso clínico
Apresentamos um doente do sexo masculino, 42 anos de idade, natural da Moldávia, residente em Portugal, desde 2001. Assintomático, referenciado à consulta de Hepatologia em fevereiro 2005 por infecção crónica VHB, conhecida desde os 28 anos de idade, sem sintomas na altura do diagnóstico.
Referia relações sexuais não protegidas, mas negava o consumo de drogas endovenosas, transfusões sangue, tatuagens ou piercings. Referia abstinência alcoólica, no último ano, e consumo inferior a 30 g/dia, nos 15 anos anteriores. Desconhecia a existência de doença hepática em qualquer familiar.
O exame objetivo não mostrava alterações.
Analiticamente, verificou-se elevação das aminotransferases (ALT 107 UI/L; valor de referência (VR) < 41 UI/L) e confirmou-se a presença de infecção pelo VHB: AgHBs, AcHBc total e AcHBe positivos e AcHBc IgM e AgHBe negativos, apresentando ADN-VHB igual a 1,8 × 103 UI/mL. Excluíram-se outras doenças concomitantes, nomeadamente síndrome metabólico, infecção pelos vírus da hepatite C (VHC) ou da imunodeficiência humana (VIH), assim como distúrbios do metabolismo do ferro ou cobre e de autoimunidade.
No seguimento, verificou-se subida progressiva dos valores de ALT (até 11xVR) e o ADN-VHB tornou-se persistentemente indetetável. Os valores de fosfatase alcalina, albumina e tempo protrombina mantiveram-se normais e a gamaGT nunca ultrapassou o dobro do valor de referência.
Em julho de 2006, foi submetido a biopsia hepática, tendo a avaliação histológica concluído por atividade necroinflamatória e fibrose moderadas: A2/F2 da classificação de Metavir. Em agosto de 2007, a pesquisa do AcVHD revelou positividade das frações IgG e IgM, fornecendo o diagnóstico de co-infecção ativa pelo VHD. Foi iniciado tratamento com PegInterferão α2-a (180αg/semana), que manteve durante 102 semanas, com boa tolerância, sem necessidade de ajuste de dose do fármaco.
Ao longo do tratamento, observou-se normalização das aminotransférases à 33.a semana e negativação da fração IgM do AcVHD à 88.a semana. Na 98.a semana, verificou-se perda do antigénio Hbs e negativação do RNA-VHD, de cujo conhecimento resultou a decisão de concluir o tratamento. Estes dados persistiam 24 semanas após o término da terapêutica (figs. 1 e 2).
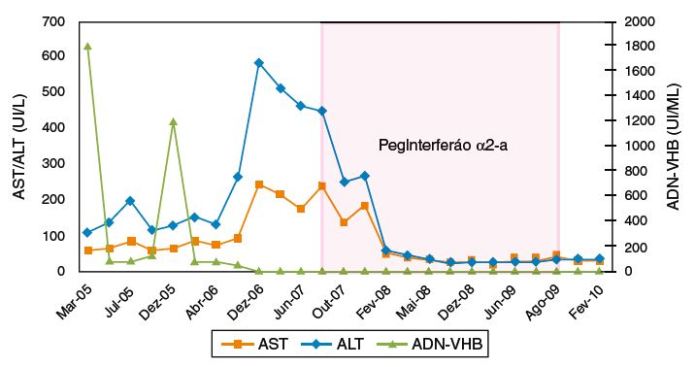
Figura 1 Evolução temporal do valor das transamínases e da carga viral VHB antes, durante e após o tratamento com PegInterferão α2-a.
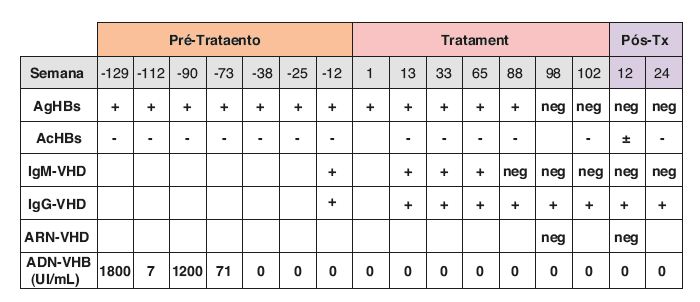
Figura 2 Evoluc¸ão temporal da carga viral VHB e das serologias VHB e VHD antes, durante e após o tratamento com PegInterferão α2-a.neg: negativo; Tx: tratamento; VHD: vírus hepatite D.
Discussão
A infecção VHD é endémica mundialmente, sendo considerada hiperendémica na Europa Central, no Médio Oriente, em África e na América do Sul2.
Na década de 80-90, a sua prevalência atingia os 20% na maioria dos países ocidentais, no entanto, nos últimos anos verificou-se uma mudança do padrão epidemiológico da doença, com redução das taxas de prevalência para 5-10%, particularmente no sul da Europa. Esta alteração acompanhou a redução da incidência da infecção crónica VHB, em consequência das medidas adotadas para controlo da infecção VHB, nomeadamente a vacinac¸ão universal e o controlo das vias de transmissão2,4. Em Portugal, não existem estudos epidemiológicos que mostrem a evoluc¸ão epidemiológica da infecção pelo VHD, existindo apenas um estudo publicado em 1987, que mostrou uma prevalência de 17,3% sendo a maioria dos doentes infectados utilizadores de drogas endovenosas5. Em Espanha, estudos longitudinais mostraram uma redução da prevalência da infecção de 15% para 7%6.
Apesar da redução da prevalência da doença nas últimas 2 décadas, não se verificou erradicação completa da infecção, tendo-se constatado que a prevalência da mesma se manteve estável, desde o final dos anos 90, particularmente nos países ocidentais, onde a infecção está praticamente confinada aos toxicómanos que são os principais reservatórios e transmissores do vírus1,4. Outro foco de persistência da doença é a imigração de indivíduos oriundos de áreas hiperendémicas, onde os principais modos de transmissão são a via sexual e intrafamiliar1,9.
O caso apresentado corrobora estes dados, sendo um doente natural da Moldávia, uma área hiperendémica9, com comportamentos sexuais considerados de risco.
As recomendações atuais das sociedades científicas europeia (EASL) e americana (AASLD) diferem, no que respeita à pesquisa de infecção concomitante pelo vírus delta nos doentes com infecção crónica pelo VHB: a sociedade americana considera que, na avaliação inicial destes doentes, se deve excluir co-infecção VHD apenas naqueles oriundos de áreas hiperendémicas e/ou com história de utilização de drogas endovenosas7; a sociedade europeia aconselha a pesquisa sistemática da co-infecção pelo VHD em todos os doentes8.
Assim, tendo em conta as recomendações internacionais, o diagnóstico do doente apresentado foi tardio, não só porque se tratava de um doente oriundo de uma área hiperendémica, como pelo típico padrão evolutivo laboratorial e histológico, mostrando persistência de baixa replicação do VHB (< 2000 UI/mL)7, mas com atividade inflamatória marcada, evidenciada pelo progressivo aumento das aminotransferases e pelos achados da biopsia hepática.
Pelo diagnóstico ter sido tardio, não foi possível distinguir superinfecção de co-infecção, uma vez que não se identificou o momento exato da aquisição da infecção VHD. De igual modo, também não é possível estabelecer a duração da infecção pelo VHB, sendo possíveis transmissões de tipo vertical, perinatal ou sexual. Os valores prévios de aminotransférases, dos Ac anti-VHD e do AcHBc IgM eriam fundamentais para aquela classificação. O Ac anti-VHD IgM pode estar presente tanto na co-infecção como na superinfecção pelo que não é útil para diferenciar as duas situações. A distinção depende da duração da infecção pelo HBV, se crónica ou aguda, pelo que a característica distintiva sorológica da co-infecção é a presença de anti-HBc IgM no soro1. Sabendo que apenas 2% dos doentes com coinfecção e que > 90% dos casos de superinfecc¸ão evoluem para cronicidade2, podemos afirmar que é maior a probabilidade de se tratar de uma situação de superinfecção. Também, a constatac¸ão da existência de um estádio de doenc¸a pouco avanc¸ado − fibrose moderada − permite especular a favor de uma recente superinfecção pelo VHD.
O método de diagnóstico, baseado na pesquisa de Ac VHD, foi suficiente para o diagnóstico de infecção ativa pelo VHD, dado estar presente a fração IgM do Ac VHD. A determinação do ARN-VHD não foi, naquela altura, possível. Este é o método mais específico e sensível para o diagnóstico da infecção, devendo ser considerado nos doentes com Ig G anti-VHD positiva, permitindo confirmar a presença de infecção ativa. A carga viral VHD tem também um papel importante durante o tratamento permitindo monitorizar a resposta à terapêutica2,4.
A infecção concomitante com outros vírus, nomeadamente VHB, VHC e VIH (que partilham as mesmos vias de transmissão), está associada a diversos processos de inibição da replicação viral recíproca. Em 70 a 90% dos casos, o VHD reprime a replicação do VHB, no entanto, a dominância viral pode alterar ou alternar ao longo da evolução da doença. Nas situações em que existe dominância do VHD, verificasse a presença de AcHBe e baixa carga viral VHB, quadro este similar ao do doente apresentado, em que de facto, os dados confirmaram que o VHD tinha um papel preponderante na atividade necroinflamatória da doença. Pode no entanto existir replicação do VHB (AgHBe positivo e elevados níveis de ADN --- VHB), devendo a terapêutica nestes casos ser dirigida ao VHB2,4,7,8.
Tendo em conta estes dados, e como apenas numa minoria de doentes a infecção VHD crónica se resolve espontaneamente, acompanhada de perda do AgHBs (0,94%/ ano) e formação de Ac Hbs (0,27%/ano)1, as recomendações atuais aconselham o início de terapêutica dirigida ao vírus dominante em todos os doentes com doença hepática crónica VHD-VHB compensada7,8. Antes do início do tratamento, devem avaliar-se as características da infecção VHB e excluir infecções concomitantes (nomeadamente, VHC e VIH). O correto estadiamento da doença hepática com biopsia hepática é essencial, uma vez que não existem estudos que validem os métodos não invasivos como a elastografia hepática na avaliação do grau de fibrose nos doentes com infecção VHD4. Nos doentes com infecção crónica, em que o VHD é o vírus dominante, apenas um fármaco está atualmente recomendado: o interferão-alfa (clássico ou peguilado)4,7,8. Vários estudos têm sido desenvolvidos nos últimos anos, utilizando outros fármacos nomeadamente a famciclovir, a ribavirina, o adefovir, a lamivudina e a clevudina, que não evidenciaram qualquer vantagem4.
Num estudo efectuado em Itália por Farci et al., a terapêutica com INF_ na dose de 9 MUI, 3x/semana, por um período de 1 ano, foi mais eficaz que o placebo e que o INF_ na dose de 3 MUI, 3x/semana, na normalização das aminotransférases. No entanto, o tratamento mostrou-se ineficaz na manutenção da resposta virológica sustentada (RVS)2,4. Apesar disso, no seguimento destes doentes, 10 anos depois, os autores observaram melhoria histológica no primeiro grupo de doente (INF_ --- 9 MUI), tendo inclusive ocorrido casos de completa regressão da fibrose e da cirrose hepática10.
Posteriormente, 2 estudos publicados em 2006 avaliaram a eficácia do PegINFα- 2b no tratamento da hepatite crónica VHD. A terapêutica mostrou RVS de 17 e 43%. Em 2007, Wedmeyer et al., estudaram a eficácia do PegINF_-2a tendo demonstrado uma taxa de resposta sustentada de 23% após 48 semanas de tratamento2,4.
As orientações internacionais são consensuais, no que diz respeito ao único tratamento aprovado para a infecção crónica VHD: interferão clássico ou peguilado. A sociedade europeia recomenda o doseamento do ARN-VHD às 24 semanas para avaliação da resposta ao tratamento7,8. Ambas as sociedades referem que a duração da terapêutica deverá ser de 1 ano. No entanto, no que diz respeito aos doentes em que no fim do primeiro ano de tratamento não se verifica negativação do ARN-VHD, as orientações internacionais não são concretas relativamente à sua abordagem, sendo que apenas a sociedade europeia considera a possibilidade de prolongar a duração do tratamento referindo não haver, no entanto, eficácia comprovada relativamente a esta estratégia7,8.
De facto, um estudo com pequeno número de doentes que comparou o tratamento com INF_ convencional durante um e 2 anos, não mostrou vantagem no segundo grupo de doentes4. No entanto, o estudo de Gunsar et al. mostrou uma taxa de RVS de 20% em doentes tratados durante 2 anos2.
Apesar de não existirem estudos randomizados e controlados que permitam responder a esta questão, relatos de casos clínicos parecem favorecer a manutenção do tratamento, desde que se observe evolução bioquímica favorável e boa tolerância do doente, mantendo-se até negativação do ARN-VHD e perda do AgHBs2,3. Inclusive há uma descrição de um caso de resposta virológica, ao fim de 12 anos de tratamento com INF_, com negativação do AgHBs e reversão da fibrose no final do tratamento11.
Em consonância com o que foi atrás referido, optámos pela utilização de PEG-IFNα-2a no doente apresentado. A terapêutica foi mantida por 102 semanas, tendo em conta que houve muito boa tolerância e aderência ao tratamento por parte do doente e que, desde o início, se observou descida progressiva das aminotransférases com normalização à 33.a semana. No entanto, apesar da resposta bioquímica favorável, não se assistiu a resposta virológica, pelo que se prolongou o tratamento, tendo-se assistido ao desaparecimento da IgM anti-VHD à 88.a semana, negativação do ARN-VHD à 98.a semana e perda do AgHBs no final do 3.◦ mês de seguimento, após término do tratamento. Estes dados persistiam no 6.◦ mês de seguimento.
Nos doentes em que se verifica perda do AgHBs, não há replicação do VHD, podendo ser este um dado importante para suspender a terapêutica12. Neste caso, é então possível afirmar à luz dos conhecimentos atuais que assistimos a um duplo sucesso terapêutico, devendo ser este o objetivo do tratamento nos doentes com co-infecção VHBVHD. Cautelosamente, este doente tem programada uma avaliação clínico-laboratorial com periodicidade semestral com o intuito de apreciar a sustentabilidade da resposta virológica, bem como para o reconhecimento de eventual passagem à positividade do AcHBs (seroconversão), expressão do controlo imunológico da infecção VHB e evento mais próximo da definição de cura.
Para melhor orientação da duração da terapêutica são necessários mais estudos que demonstrem os fatores preditivos de resposta ao tratamento, parecendo que a determinação da carga viral-VHD e a quantificação do AgHBs durante a terapêutica, são 2 fatores importantes que permitirão fundamentar esta decisão13.
Comentários
Este caso ilustra a importância do tratamento prolongado nos doentes com infecção VHD até resposta virológica mantida, particularmente se ocorrer resposta bioquímica e na ausência de efeitos secundários graves. Por outro lado, são necessários novos antivirais, inibidores específicos do VHD, que permitam ultrapassar as insuficiências associadas às únicas terapêuticas atualmente aprovadas.
Bibliografia
1. Feldman M, Scharschmidt BF, Sleisenger MH, Fordtran JS. Sleisenger and Fordtrans Gastrointestinal and Liver Disease: Pathophysiology/Diagnosis/Management, Vol. II, 8th ed; 2006, capítulo 75, p. 1669-80. [ Links ]
2. Wedemeyer H, Manns M. Epidemiology, pathogenesis and management of hepatitis D: update and challenges ahead. Nat Ver Gastroenterol Hepatol. 2010;7:31-40. [ Links ]
3. Farci P. Treatment of Chronic Hepatitis D: New Advances, Old Challenges. Hepatology. 2006;44:536-9. [ Links ]
4. Rizzetto M. Hepatitis D: Thirty years after. J Hepatol. 2009;50:1043-50. [ Links ]
5. Ramalho F, Carvalho G, Bonino F, Baptista A, Moura MC. Clinical and epidemiological significance of hepatitis delta virus (HDV) infection in chronic HBV carriers in Portugal. Prog Clin Biol Res. 1987;234:409-17. [ Links ]
6. Navascués CA, Rodríguez M, Sotorrío NG, Sala P, Linares A, Suárez A, et al. Epidemiology of hepatitis D virus infection: Changes in the last 14 years. Am J Gastroenterol. 1995;90:1981-4. [ Links ]
7. Lok A, McMahon B. Chronic Hepatitis B: Update 2009. Hepatology. 2009;50:1-36. [ Links ]
8. EASL, Clinical Practice Guidelines. Management of chronic hepatitis B. J Hepatol. 2009;50:227-42. [ Links ]
9. Georghe L, Jacob S, Vadan R, Gheoge C, Jacob R, Pâevulescu J, et al. Natural history of compensated viral B and D cirrhosis. Rom J Gastroenterol. 2005;14:329-35. [ Links ]
10. Farci P, Roskams T, Chessa L, Peddis G, Mazzoleni AP, Scioscia R, et al. Long-term benefit of interferon _ therapy of chronic hepatitis D: regression of advanced hepatic fibrosis. Gastroenterology. 2004;126:170-249. [ Links ]
11. Lau DT, Kleiner DE, Park Y, Dibisceglie AM, Hoofnagle JH. Resolution of chronic delta hepatitis after 12 years of interferon alfa therapy. Gastroenterology. 1999;117:1229-33. [ Links ]
12. Battegay M, Simpson L, Hoofnagle J, Sallie R, Bisceglie A. Elimination of hepatitis delta virus infection after loss of hepatitis B surface antigen in patients with chronic delta hepatitis. J Med Virol. 1994;44:389-92. [ Links ]
13. Manesis EK, Schina M, Le Gal F, Agelopoulou O, Papaioannou C, Kalligeros C, et al. Quantitative analysis of hepatitis D vírus RNA and hepatitis B surface antigen serum levels in chronic delta hepatitis improves treatment monitoring. Antivir Ther. 2007;12:381-8. [ Links ]
Conflito de interesses
Os autores declaram não haver conflito de interesses.
*Autor para correspondência
Correio eletrónico: llilibrazao@gmail.com (L. Santos).
Recebido a 27 de maio de 2010; aceite a 23 de janeiro de 2011













