Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Jornal Português de Gastrenterologia
versão impressa ISSN 0872-8178
J Port Gastrenterol. vol.19 no.5 Lisboa set. 2012
Reprocessamento em endoscopia digestiva
Guidelines for reprocessing in digestive endoscopy
Cristina Costaa, Elaine Pinab, Etelvina Ferreirac, Susana Ramosd, Marie Isabelle Cremerse,∗, Pedro Figueiredof, Joaquim Andradeg, Elsa Monteiroh, Leopoldo Maria Lemos Cunha Matosi e José Cotterj
a Divisão da Segurança do Doente, Direcção-Geral da Saúde
b Programa Nacional de Prevenção e Controlo de Infecção Associada aos Cuidados de Saúde, Direcção-Geral de Saúde
c Comissão de Controlo de Infecção, Hospital dos Lusíadas, Lisboa, Portugal
d Gabinete de Gestão de Risco, Hospital de Santa Marta, Lisboa, Portugal
e Serviço de Gastrenterologia, Hospital de São Bernardo, Centro Hospitalar de Setúbal, EPE, em representação da Sociedade Portuguesa de Endoscopia Digestiva
f Serviço de Gastrenterologia, Hospitais da Universidade de Coimbra, Coimbra, Portugal, em representação da Sociedade Portuguesa de Endoscopia Digestiva
g Unidade de Endoscopia, Hospital Senhora da Oliveira-Guimarães, Portugal, em representação da Associação Nacional de Enfermeiros de Endoscopia Digestiva
h Unidade de Técnicas de Gastrenterologia, Hospital de São Bernardo, Centro Hospitalar de Setúbal, EPE, Portugal, em representação da Associação Nacional de Enfermeiros de Endoscopia Digestiva
i Serviço de Gastrenterologia, Centro Hospitalar de Lisboa Ocidental, EPE, Lisboa, Portugal, em representação da Direcção do Colégio de Especialidade de Gastrenterologia
j Serviço de Gastrenterologia, Hospital Senhora da Oliveira-Guimarães, Portugal. Direcção-Geral da Saúde para a área da Gastrenterologia
*Autor para correspondência
Introdução
O reprocessamento adequado dos endoscópios flexíveis e dos respetivos acessórios é parte essencial do programa de segurança e de garantia da qualidade em endoscopia digestiva1. O material endoscópico tem algumas particularidades que dificultam a sua descontaminação, nomeadamente fatores relacionados com a presença de ângulos agudos, juntas, superfícies fechadas inacessíveis e mecanismos diversos, o número e tipo de canais, o seu comprimento e flexibilidade, a composição com materiais de várias características, e a termossensibilidade.
A descontaminação de endoscópios tem sido objeto de recomendações nacionais e internacionais. Contudo, algumas das recomendações nem sempre são aplicáveis na prática. Torna-se por isso necessário identificar e avaliar os riscos inerentes ao procedimento a fim de os categorizar e caracterizar, de forma a introduzir medidas para os eliminar ou, quando isso não é praticável, minimizá-los na medida do possível.
Apesar dos desenvolvimentos tecnológicos como máquinas de reprocessamento automático, introdução de novos desinfetantes e endoscópios de mais fácil desinfeção, os princípios orientadores de descontaminação continuam os mesmos2-4.
Por outro lado, a diversidade de locais onde se efetua o reprocessamento de material de endoscopia torna necessário desenvolver recomendações flexíveis que se adaptem às diferentes realidades, sem pôr em causa a eficácia do processo e a segurança dos profissionais e dos utentes.
É ainda necessário reconhecer que nem todas as medidas possuem evidências claras para a sua recomendação, nomeadamente: o tempo de armazenamento após o qual é necessário reprocessar o material endoscópico antes da sua utilização, o papel do controlo microbiológico do material endoscópico para assegurar a qualidade e eficácia dos procedimentos adotados, a durabilidade e longevidade dos endoscópios e a sua relação com a possibilidade de se obterem reduzidos níveis de desinfeção após determinado número de anos ou procedimentos efetuados1.
As Unidades de Endoscopia Digestiva (UED), na promoção de boas práticas para a melhoria contínua da qualidade e da segurança nos cuidados, devem seguir as seguintes recomendações:
Secção 1: organização e gestão
Desenvolver um procedimento escrito e datado que estabeleça as diretrizes para o reprocessamento de material endoscópico. O procedimento deve ser revisto a cada 3 anos.
Nomear um profissional como responsável pelo reprocessamento de material endoscópico, com definição das suas funções e responsabilidades, as quais devem incluir a autonomia para intervir sempre que se identifiquem falhas nas práticas de reprocessamento.
Nas UED integradas em unidades de saúde, onde é obrigatória a existência de Comissões de Controlo de Infeção, estas devem participar na definição e monitorização das diretrizes para o reprocessamento. Nas outras UED esta função será atribuída ao Responsável Técnico.
Efetuar uma avaliação de riscos anualmente ou sempre que as circunstâncias se alterem.
Promover reuniões regulares de equipa para a análise e discussão das diretrizes e outras questões relacionadas com o reprocessamento.
Registar e analisar os incidentes relacionados com falhas no reprocessamento na UE, com notificação para o sistema de reporte de eventos adversos da instituição.
Registar evidências de que foram tomadas as medidas apropriadas mediante os incidentes reportados.
Realizar auditorias internas aos procedimentos de reprocessamento.
Os relatórios das auditorias devem ser analisados e discutidos com o responsável e com a equipa.
Os relatórios das auditorias com as propostas de melhoria devem ser enviados ao Conselho de Administração/Responsável Técnico.
Disponibilizar as Fichas Técnicas e Fichas de Dados de Segurança dos detergentes, desinfetantes, e do material endoscópico de forma a garantir a sua utilização de acordo com as recomendações do fabricante.
Definir um plano de integração para os profissionais que trabalham na área do reprocessamento, com registos comprovativos de formação no manuseamento dos vários tipos de material endoscópico e de reprocessamento existentes na UED.
Secção 2: estrutura física e ambiente
A UED deve disponibilizar uma área separada para o reprocessamento com zonas específicas para sujos, limpos e armazenamento, possibilitando a circulação do material endoscópico num só sentido.
A área deve dispor de um sistema de ventilação e extração de ar adequado e controlo da temperatura e humidade. Cat IB e IC1,5-7
Deve existir uma bancada com 2 cubas para lavagem e enxaguamento do material endoscópico.
As cubas devem ter o tamanho adequado de modo a permitir a correta lavagem manual do material endoscópico, e a sua localização e disposição devem salvaguardar a exposição dos profissionais de saúde a riscos biológicos, químicos e ergonómicos.
Na área de reprocessamento deve existir um lavatório exclusivo para a higienização das mãos8.
Secção 3: segurança e saúde dos profissionais
A área de reprocessamento deve ser concebida de modo a garantir um serviço eficiente e efetivo sem risco para profissionais e utentes.
Os profissionais de saúde devem realizar exames de saúde periódicos. Cat 1C
O equipamento de proteção individual (EPI) necessário para a atividade de reprocessamento deve estar disponível na UED, em quantidade e qualidade adequadas. Cat I C8 Luvas de uso único, de punho elevado, resistentes a químicos.
Máscaras e óculos de proteção ou visores faciais completos.
Aventais de plástico com mangas ou batas impermeáveis, com mangas compridas e punho.
Todos os profissionais de saúde devem utilizar o EPI de acordo com a avaliação de risco efetuada.
Todos os profissionais envolvidos na utilização de químicos deverão estar informados acerca dos riscos que podem ocorrer durante a utilização destes produtos.
Deve existir um procedimento escrito e datado para a eliminação segura dos resíduos líquidos com risco biológico ou químico de acordo com as Fichas de Dados de Segurança dos detergentes e desinfetantes utilizados e a legislação em vigor. O procedimento deve ser revisto a cada 3 anos.
Deve existir um procedimento escrito e datado para situações de derramamentos de químicos. O procedimento deve ser revisto a cada 3 anos.
Deve existir um procedimento escrito e datado para situações de derramamentos de líquidos orgânicos. O procedimento deve ser revisto a cada 3 anos.
Secção 4: formação
Todos os profissionais que realizam o reprocessamento devem ser qualificados e ter formação e treino no manuseamento do material endoscópico e no cumprimento das precauções básicas para a prevenção e controlo de infeção. Cat. IA1,2,8,9
É essencial que haja prática regular e formação continua a fim de os profissionais se manterem atualizados. Mesmo sendo recomendável o uso de RAE, os profissionais devem ser treinados em métodos manuais a fim de garantir o reprocessamento nas pequenas UED assim como em caso de falha mecânica, de forma a não colocar em causa a eficácia do processo e a segurança do utente e dos profissionais.
Deve ser realizada formação interna obrigatória bienal e sempre que se verifiquem alterações significativas na área do reprocessamento, para todos os profissionais intervenientes no processo.
Toda a formação deve ser registada.
As instruções de todo o material endoscópico, as políticas e procedimentos, assim como as Fichas de Dados de Segurança dos produtos devem estar acessíveis aos profissionais.
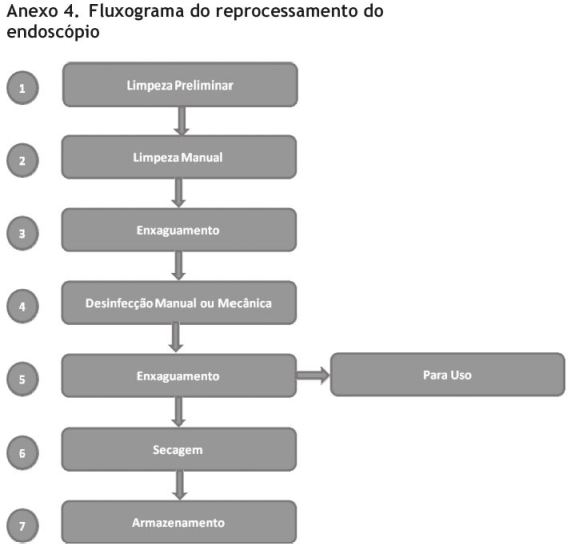
Secção 5: reprocessamento do endoscópio
A maioria das diretrizes para reprocessamento do endoscópio indica 6 passos:
1) Limpeza
a. Preliminar
b. Manual
2) Enxaguamento (para remover resíduos do detergente)
3) Desinfeção
4) Enxaguamento (para remover resíduos do desinfetante
5) Secagem
6) Armazenamento
Os endoscópios que entram em contacto com membranas mucosas, são classificados como artigo semicrítico e devem ser submetidos no mínimo a desinfeção de alto nível após cada utilização (Cat. IA1,5,6,9,10-12)
O reprocessamento dos endoscópios deve ser realizado por profissionais treinados e numa zona específica para o mesmo logo após cada procedimento.
O reprocessamento dos endoscópios deve ser realizado entre procedimentos e no fim de cada sessão1.
O reprocessamento no início de cada sessão irá depender do tipo de armazenamento dos endoscópios. Se houver um período de paragem superior a 72 h (endoscópios em armário com barreira sanitária) ou 12 horas (endoscópios em armário sem barreira sanitária) estes devem ser novamente reprocessados antes da utilização no utente, a não ser que, mediante uma avaliação de risco, se adote outro período limite. Cat II
A: limpeza preliminar
Antes de desconectar o endoscópio, o profissional de saúde deve limpar as superfícies externas do tubo de inserção com compressa macia e detergente enzimático, irrigar os canais de ar/água, e aspirar vigorosamente a solução de detergente. Cat. IB1,5,6,8-10,13 Nos endoscópios em que o canal de ar/água é combinado, deve-se posicionar e ativar a válvula de modo a permitir a irrigação do canal.
Durante o transporte para a zona de descontaminação, os endoscópios devem ser contidos de modo a prevenir a exposição dos profissionais de saúde, utentes e ambiente a microrganismos potencialmente infeciosos. Um contentor aberto pode ser suficiente se a sala de reprocessamento for imediatamente adjacente à sala de exames (não deve haver circulação por zonas de utilização comum). Caso haja passage por zonas comuns, o contentor deve ser fechado e estar identificado. Cat. II10
B: Limpeza Manual
O teste de fugas deve ser realizado de acordo com as instruções do fabricante e antes de cada ciclo de reprocessamento a fim de se verificar qualquer dano das superficies internas e externas do endoscópio. Cat. IB5,6,8-10 Em caso de deteção de fugas, o reprocessamento deve ser interrompido de imediato e ser providenciada a reparação do endoscópio. Neste caso, o profissional deve sinalizar que o endoscópio não se encontra desinfetado.
O endoscópio deve ser completamente imerso em água com detergente de acordo com as instruções do fabricante. Cat. IB1,5,6,8-10,12
Todas as válvulas e outros componentes removíveis do endoscópio devem ser retirados (válvula de sucção, válvula de ar/água, válvula do canal de trabalho e outros acessórios). Cat. IB1,5,6,8-10,12
As superfícies externas do endoscópio, as entradas das válvulas e respetivas aberturas, devem ser inspecionadas e limpas utilizando uma compressa de tecido não tecido e um escovilhão macio, a parte distal do endoscópio deve ser limpa com uma escova macia nomeadamente as pontes/ elevadores. Cat. IB1,5,6,8-10,12
Os escovilhões e escovas podem ser de uso único ou reutilizáveis. Caso sejam reutilizáveis, devem ser reprocessados de acordo com as indicações do fabricante.
Todos os canais e lúmenes devem ser preenchidos e irrigados com a solução de limpeza. Devem ser usados adaptadores de endoscópios específicos para garantir o preenchimento completo e a lavagem com detergente a fim de remover todo o material orgânico. Cat. IB1,5,6,8-10,12
Todos os canais acessíveis devem ser limpos com um escovilhão flexível com cerdas macias e intactas concebidas para esse fim, de tamanho adequado, de modo a garantir o contacto com as paredes do canal e até que o escovilhão se encontre visivelmente limpo no final do processo. Cat. II1,6,8,9,14
A água e o detergente enzimático devem ser eliminados após cada utilização. Cat IB1,6,8,9
Deve ser realizado um controlo visual para comprovar que o endoscópio está limpo e não está danificado.
O endoscópio deve ser transferido para outra cuba para enxaguamento a fim de remover o detergente residual. Todas as superfícies exteriores e todos os canais devem ser submetidos ao enxaguamento com água. Cat IC15
Caso a sala de desinfeção não seja adjacente à sala de limpeza manual, para evitar a circulação por zonas de utilização comum, o endoscópio deve ser transferido para o RAE, ou para a tina de desinfeção manual num recipient apropriado a fim de evitar a contaminação do ambiente.
C: válvulas e componentes desmontáveis
Antes de utilização das tampas das válvulas do canal de biopsia reutilizáveis, assegurar da sua integridade.
As superfícies e lúmenes das válvulas e as partes desmontáveis devem ser limpas e escovilhadas com um detergente enzimático e posteriormente enxaguadas com água limpa antes de serem desinfetadas.
A limpeza ultrassónica dos acessórios reutilizáveis garante a limpeza das áreas de difícil acesso.
Deve ser realizado um controlo visual para garantir que as válvulas estão visivelmente limpas e não estão danificadas.
As válvulas devem ser reprocessadas de acordo com as indicações do fabricante.
As válvulas incluindo as válvulas de irrigação e as partes desmontáveis devem ser mantidas junto com o endoscópio correspondente de modo a formarem um todo, a fim de garantir a rastreabilidade.
Secção 6: detergentes e desinfetantes
Recomenda-se um detergente enzimático, de baixa produção de espuma, compatível com o endoscópio, e que deve ser usado na temperatura e diluição apropriadas de acordo com as indicações do fabricante.
O desinfetante utilizado deve ter a marcação CE e ser compatível com todos os endoscópios. A concentração e tempo de contacto durante todo o processo e o período de utilização devem estar de acordo com as indicações do fabricante. Cat. IB1,8,9,16,17
Deve haver um registo dos lotes dos desinfetantes e dos detergentes, e as respetivas datas de validade.
Os endoscópios vindos do exterior devem ser compatíveis com os detergentes e desinfetantes usados na UED.
Secção 7: desinfeção dos endoscópios
Recomenda-se o uso de reprocessamento automático, porque permite um ciclo de reprocessamento padronizado e validado, permitindo ainda um registo de todos os passos do processo e, minimizando a exposição a químicos e à contaminação ambiental, facilita o trabalho dos profissionais e reduz o risco de dano dos endoscópios.
O reprocessamento manual produz resultados fiáveis, desde que todos os passos do procedimento sejam cumpridos rigorosamente. Contudo, não é possível validar o processo, havendo ainda a exposição dos profissionais a químicos e a material infecioso1.
A: reprocessador automático de endoscópios
O reprocessador automático de endoscópios (RAE) deve ser preferencialmente usado para todos os endoscópios, os quais devem ser sujeitos numa primeira fase a limpeza manual. Este passo (da limpeza manual) é obrigatório mesmo quando o fabricante indica que o RAE tem uma fase de lavagem.
O RAE deve ter o processo validado de acordo com a norma internacional aplicável (ter certificado de conformidade).
Todos os endoscópios devem ser devidamente ligados aos conectores apropriados para garantir a irrigação de todos os canais. Os profissionais devem verificar as ligações de todos os canais de trabalho antes do início do ciclo. Cat.IB1,6,8,9,18,19
A água de enxaguamento final deve ser de qualidade: livre de bactérias.
No caso da sua utilização a seguir, o endoscópio deve ser transportado individualmente para a sala num recipient coberto para evitar a recontaminação ou dano.
No caso de não ser utilizado a seguir, as superfícies internas e externas do endoscópio devem ser secas e o endoscópio imediatamente colocado no armário próprio.
B: reprocessamento manual de endoscópios
O endoscópio deve ser colocado numa tina com a solução desinfetante garantindo que fica completamente imerso na solução.
Todos os canais do endoscópio devem estar completamente preenchidos com desinfetante, usando-se para o efeito adaptadores de lavagem específicos do endoscópio, a fim de assegurar o completo contacto com o desinfetante e eliminação de espaços mortos.
As válvulas e tampas devem ser desinfetadas com o respetivo endoscópio.
A solução desinfetante deve ser preparada de acordo com as indicações do fabricante e deve ser utilizada cumprindo rigorosamente os tempos de contacto estabelecidos para uma desinfeção de alto nível.
Se a solução é utilizada por mais do que um dia, o teor do ingrediente ativo deve ser verificado diariamente antes do início da primeira sessão ou conforme indicação do fabricante e o resultado deve ser registado. Se o nível for inferior ao indicado, a solução deve ser descartada. Cat IA1,6,8,9,11
Após a desinfeção de nível elevado, o endoscópio e respetivos canais devem ser enxaguados com água estéril ou filtrada para remover a solução de desinfeção.
É preferível o uso de água estéril para o enxaguamento final.
A água deve ser descartada após cada uso/ciclo.
Se o endoscópio vai ser reutilizado a seguir, o professional deve verificar se é necessária a secagem manual. No decorrer da secagem manual o profissional de saúde deve dar especial atenção às partes externas do endoscópio, ao controlo do corpo de luz/conectores de vídeo, fichas e tomadas.
Antes do armazenamento, os canais devem ser irrigados com álcool etílico ou isopropílico de 70% a 90% e secos com ar comprimido medicinal à pressão indicada pelo fabricante do endoscópio. Cat IA1,5,6,8,9,11
Secção 8: armazenamento
Os endoscópios devem ser armazenados na posição vertical para evitar a retenção de líquido residual nos canais, e protegidos para prevenir o risco de contaminação. As partes desmontáveis devem manter-se separadas mas junto com os componentes específicos de cada endoscópio de modo a garantir a segurança do procedimento. Cat II1,6,8,9,11
Deve existir um procedimento documentado e datado no caso de se utilizar armário com barreira sanitária (por exemplo com indicações para a verificação do fluxo de ar filtrado, para o uso fora de horas). Os armários devem ser utilizados de acordo com as indicações do fabricante.
Secção 9: rastreabilidade
Deve existir um sistema (manual ou eletrónico) para a rastreabilidade do ciclo de reprocessamento que identifique o profissional, tipo e fase de reprocessamento e o doente associados a cada endoscópio reprocessado/utilizado e que possibilite a monitorização e auditoria.
Cada endoscópio deve possuir um código único de identificação, e deve ser implementado um sistema específico para endoscópios vindos do exterior.
O sistema de rastreabilidade deve ser avaliado regularmente (pelo menos uma vez por ano) para se assegurar da sua efetividade.
Secção 10: acessórios
O material (escovas, escovilhões, etc.) utilizado para a limpeza deve ser preferencialmente de uso único. Caso contrário, deve ser descontaminado após cada utilização de acordo com as indicações do fabricante. Cat IC e Cat II1,6,8,9
A limpeza ultrassónica dos acessórios endoscópicos reutilizáveis e componentes dos endoscópios, com uma frequência superior a 30 kHz, deve ser utilizada para remover sujidade e material orgânico de áreas de difícil limpeza de acordo com as indicações dos fabricantes. Cat II1,14
As pinças de biopsia e outros acessórios que têm a indicação para uso único devem ser descartados após a utilização.
As pinças de biopsia e outros acessórios reutilizáveis que violam a barreira mucosa devem ser submetidos a uma limpeza mecânica com detergente enzimático e esterilizados (a desinfeção de nível elevado não é suficiente). Cat. IA1,5,10-12,14,20
Os frascos de água e os tubos conectores, devem ser esterilizados ou submetidos a desinfeção de nível elevado de acordo com as indicações do fabricante. Os frascos de água devem ser esterilizados após cada sessão de endoscopia. A água utilizada nos frascos deve ser estéril. Cat. IB1,8-11,21
Secção 11: manutenção
Deve existir um registo da manutenção preventiva e das reparações dos endoscópios de acordo com as instruções do fabricante.
Deve existir um registo da manutenção preventiva e reparações do RAE de acordo com as instruções do fabricante.
O RAE deve ter um plano de manutenção.
Deve existir um registo específico do plano de manutenção e desinfeção de qualquer sistema de purificação de água do RAE.
Deve existir um registo da manutenção preventiva e reparações da tina ultrassónica de acordo com as instruções do fabricante.
Deve existir um registo de higienização periódica do Sistema do RAE.
Deve existir um registo da manutenção preventiva e reparações dos armários de armazenamento de acordo com as instruções do fabricante.
Secção 12: testes e validação
Deve existir evidência de que o RAE foi validado na instalação de acordo com as normas internacionais aplicáveis.
O RAE deve ser revalidado se houver introdução de um desinfetante novo.
Um profissional deve ser responsável pelos controlos diários, semanais, trimestrais e anuais de acordo com as normas europeias.
Deve existir um profissional responsável pela análise regular dos resultados obtidos e a implementação de ações de melhoria quando indicado.
Deve existir um plano de intervenção que define as medidas corretivas.
Quando os resultados não são satisfatórios deve haver evidências de intervenção para resolução do problema.
A Unidade deve ser informada sobre os resultados bacteriológicos da água da instituição/edifício havendo um plano de intervenção descrevendo medidas a tomar no caso de resultado bacteriológicos positivos.
Secção 13: aquisição do equipamento
A compra de material endoscópico e equipamento de reprocessamento deve envolver, sempre que aplicável, uma equipa multidisciplinar (os utilizadores e a Comissão de Controlo da Infeção e o Serviço de Saúde Ocupacional, Serviço de Instalações e Equipamento).
Deve haver um plano com critérios para substituição e manutenção dos endoscópios e do equipamento de reprocessamento dos endoscópios (a Rede de Referenciação Hospitalar de Gastrenterologia)22.
Nota introdutória
Na atualidade, a endoscopia digestiva tem vindo a tornar-se um procedimento progressivamente mais complexo e mais generalizado sendo realizado em todo o país, em hospitais, clínicas e consultórios médicos.
A descontaminação apropriada de material e equipamentos utilizados em endoscopia digestiva é uma component essencial dos programas de Segurança do Doente e Qualidade das Instituições de Saúde.
Assim, cumprindo o plano de ação do Programa Nacional de Controlo de Infeção (PNCI) e por determinação do Diretor-Geral da Saúde foi criado um Grupo de Trabalho para desenvolver as «Recomendações para o reprocessamento em Endoscopia Digestiva» por Despacho n.◦ 11/2011 a fim de uniformizar a prática baseada na evidência seguindo as orientações estabelecidas a nível europeu. O Grupo de Trabalho insere-se no âmbito da Divisão de Segurança do Doente do Departamento da Qualidade na Saúde.
Bibliografia
1. Beilenhoff U, Neukmann CS, Rey JF, Biering H, Blum R, Cimbro M, et al. ESGE-ESGENA guideline: Cleaning and disinfection in gastrointestinal endoscopy. Update 2008 Endoscopy. 2008;40:939-57. [ Links ]
2. Petersen BT, Chennat J, Cohen J, Cotton PB, Greenwald DA, Kowalski TE, et al. Multisociety Guideline on Reprocessing Flexible GI Endoscopes: 2011. Infect Control Hosp Epidemiol. 2011;32:527-37. [ Links ]
3. Rutala WA, Weber DJ e HICPAC. Guideline for disinfection and sterilization in healthcare facilities. 2008 [consultado 8 Jun 2011]. Disponível em:http://www.cdc.gov/hicpac/Disinfection Sterilization/3_0disinfectEquipment.html [ Links ]
4. British Society of Gastroenterology. Cleaning and disinfection of equipment for gastrointestinal endoscopy: report of a Working Party of the British Society of Gastroenterology Endoscopy Committee. Gut. 1998;42:585-93. [ Links ]
5. Recommended practices for high level disinfection. In: Perioperative standards and recommended practices. Denver (CO): AORN Inc; 2010. p. 389-404. [ Links ]
6. Banerjee S, Shen B, Nelson DB, Lichtenstein DR, Baron TH, Anderson AA, et al. Infection Control during GI endoscopy. Gastrointest Endosc. 2008;67:781-90. [ Links ]
7. Recommended practices cleaning and processing endoscopes and endoscope accessories. In: Perioperative standards and recommended practices. Denver (CO): AORN Inc; 2010. p. 405-19. [ Links ]
8. Society of Gastroenterology Nurses and Associates, Inc. Standards of infection control in reprocessing of flexible gastrointestinal endoscopes. Gastroenterology Nursing. 2006;29:142-8. [ Links ]
9. Rutala WA, Weber DJ. Disinfection of endoscopes: review of new chemical sterilants used for high level disinfection. Infect Control Hosp Epidemiol. 1999;20:69-76. [ Links ]
10. Rutala WA, Weber DJ. Importance of lumen flow in liquid chemical sterilization. Am J Infect Control. 1999;20:458-9. [ Links ]
11. Sorin M, Segal-Maurer S, Mariano N, Urban C, Combert A, Rachell JJ, et al. Nosocomial transmission of imipenemresistant Pseudomonas aeruginosa following bronchoscopy associated with improper connection to the Steris System 1 processor. Infect Control Hosp Epidemiol. 2001;20:514-6. [ Links ]
12. Alvarado CJ, Reichelderfer M. APIC guidelines for infection prevention and control in flexible endoscopy. Am J Infect Control. 2000;28:138-55. [ Links ]
13. Society of Gastroenterology Nurses and Associates, Inc. Guideline for use of high level disinfectants and sterilants for reprocessing flexible gastrointestinal endoscopes. 2007. Disponível em: http://infectioncontrol.sgna.org/SGNAInfectionControlResources/tabid/55/default.aspx#top.pdf [ Links ]
14. Weber DJ, RutalaWA. Occupational risks associated with the use of selected disinfectants and sterilants. In: Rutala WA, editor. Disinfection, sterilization and antisepsis in healthcare. Champlain (NY): Polyscience Publications; 1998. p. 211-26. [ Links ]
15. Spach DH, Silverstein FE, Stamm WE. Transmission of infection by gastrointestinal endoscopy. Ann Intern Med. 1993;118:117-28. [ Links ]
16. Bronowicki J-P, Venard V, Botté C, Monhovan N, Gastrin I, Choné L, et al. Patient-to-patient transmission of hepatitis C virus during colonoscopy. N Engl J Med. 1997;337:237-40. [ Links ]
17. Siegel JD, Rhinehart E, Jackson M, et al., the Healthcare Infection Control Practices Advisory Committe. Guideline for isolation precautions: preventing transmission of infectious agents in heathcare settings, 2007 [consultado 25 Nov 2010]. Disponível em:http://www.cdc.gov/hippac/pdf/disinfection_Sterilization/Pages68_72Disinfection_Nov 2008.pdf [ Links ]
18. Carr-Lock DL, Conn MI, Faigel DO, Laing K, Leung JW, Mills MR, et al. Personal protective equipment. Gastrointest Endosc. 1999;49:854-7. [ Links ]
19. Rutala WA, Weber DJ. Disinfection and Sterilization in healthcare facilities: what clinicians need to know. Clin Infect Dis. 2004;39:702-9. [ Links ]
20. International Organization for Standardization. EN ISO 15883 Washer-disinfectors --- Part 1: General Requirements, terms and definitions and tests. 2006 [consultado 11 Mai 2011]. Disponível em:www.iso.org [ Links ]
21. World Gastroenterology Organization/World Endoscopy Organization Practice Guidelines. Desinfeção de Endoscópios --- Um enfoque sensivel aos recursos. Fevereiro 2011. [ Links ]
22. A Rede de Referenciação Hospitalar de Gastrenterologia [consultado 20 Abr 2011]. Disponível em: http://www.acss.minsaude.pt/Portals/0/Gastrenterologia) [ Links ]
*Autor para correspondência
Correio eletrónico:cremers.tavares@gmail.com (M.I. Cremers).
Recebido a 17 de julho de 2012; aceite a 17 de julho de 2012
Anexo 1. Categorização dos níveis de evidência das recomendações
As categorias dos CDC e do HICPAC são estabelecidas do seguinte modo9:
· Categoria IA. Fortemente recomendado para implementação e de grande evidência baseada em estudos experimentais bem conduzidos, clínicos, ou estudos epidemiológicos.
· Categoria IB. Fortemente recomendado para implementação, baseada na racionalidade e evidência sugestiva de alguns estudos experimentais, clínicos, ou estudos epidemiológicos.
· Categoria IC. Recomendação sugerida por normas ou recomendações de outras federações e associações.
· Categoria II. Recomendação sugerida para implementação baseada na clínica sugestiva ou estudos epidemiológicos, ou uma forte fundamentação teórica.
Anexo 2. Legislação aplicável
Decreto-lei n.◦145/2009, de 17 de junho, que transpõe para a ordem jurídica interna as seguintes
Diretivas Comunitárias:
a. 2007/47/CE -altera a Diretiva 90/385/CEE
b. 90/385/CEE - DM implantáveis ativos
c. 93/42/CEE - relativa aos DM
d. 98/8/CE - relativa à colocação de produtos biocidas no mercado
Decreto-lei n.◦ 441/91, de 14 de novembro, que estabelece os princípios que visam promover a segurança, higiene e saúde no trabalho, nos termos dispostos nos artigos 59.◦ e 64. da Constituição
International Organization for Standarization EN ISO 15883. Washer-disinfectors - Part 1: General
Requirements, terms and definitions and tests, 2006;
International Organization for Standarization EN ISO 15883. Washer-disinfectors - Part 4:
Requirements and tests for washer-disinfectors employing chemical disinfection for thermolabile endoscopes. 2008
Anexo 3. Definições
Contaminação - presença de matéria orgânica ou outra sujidade e/ou microrganismos nos DM e superfícies.
Descontaminação/reprocessamento - Tratamento dado ao material para tornar seguro o seu manuseamento (pode ser o processo completo até à esterilização). Tem em conta a contaminação consequente à utilização dada ao material --- inclui a limpeza. Os processos subsequentes a que o material vai ser sujeito dependerão do uso a que ele se destina.
Desinfeção - processo físico (calor) ou químico (substâncias químicas) utilizado para reduzir a presença de microrganismos viáveis para níveis que não constituam um risco para os utentes. Não elimina necessariamente todas as formas vegetativas e pode não afetar as formas esporuladas. Este procedimento deve ser executado logo após a limpeza.
Desinfetante - substância ou produto químico capaz de destruir os microrganismos de uma superfície ou DM. Os desinfetantes são categorizados por níveis de risco conforme o grau de desinfeção requerido.
Desinfetante de nível elevado - um desinfetante que, desde que utilizado de acordo com as instruções do fabricante, elimina todos os microrganismos vegetativos, micobactérias, vírus não-lipídicos e lipídicos, esporos fúngicos e alguns, mas não todos, esporos bacterianos.
Detergente - um composto ou mistura de compostos que tem como objetivo facilitar a limpeza (remoção de sujidade).
Dispositivo Médico de Uso Múltiplo/Reutilizável - DM que tem indicação do fabricante para ser reprocessado/ reutilizado. O fabricante deve indicar os métodos de lavagem, desinfeção ou esterilização adequados. Neste contexto refere-se aos vários acessórios para os endoscópios, incluindo ansas de polipectomia, pinças de biopsias, esfincterótomos, equipamento de sucção de ar, de flush de água.
Dispositivo Médico de Uso Único - Um DM previsto para apenas um uso num utente individual. O seu processo de fabrico não garante a segurança do reprocessamento. Neste contexto refere-se aos acessórios fornecidos na forma estéril. A abertura da embalagem implica o uso imediato do DM
Enxaguamento - remoção de resíduos de detergente ou desinfetante com água corrente potável, destilada ou estéril.
Esterilização - processo de destruição ou eliminação total de todos os microrganismos na forma vegetativa ou esporulada. Por se tratar de um método probabilístico a eficácia do resultado final depende do nível de contaminação existente. Daí decorre a importância fundamental do procedimento de limpeza.
Limpeza - processo de remoção de sujidade incluindo a remoção dos microrganismos e eliminação de matéria orgânica (sangue e secreções) que favorece o desenvolvimento bacteriano no meio ambiente, superfícies ou DM.
Limpeza preliminar - irrigação e enxaguamento dos canais e limpeza da superfície externa do endoscópio no local de utilização.
Limpeza ultrassónica - sistema de limpeza em meio líquido através de um processo de «cavitação» e que permite a remoção de sujidade de locais inacessíveis.
Máquinas lavadoras/desinfetadoras - máquinas destinadas a limpeza e desinfeção de DM num sistema fechado obedecendo ao estipulado na EN 15883. Os RAE estão incluídos nesta categoria assim como as máquinas de lavagem e desinfeção do instrumental cirúrgico.
Reprocessador Automático de Endoscópios (RAE) - equipamento de desinfeção automática que tem como objetivo desinfetar os endoscópios num sistema fechado. O ciclo inclui obrigatoriamente desinfeção e enxaguamento e pode incluir lavagem prévia e secagem final. Não dispensa a lavagem manual prévia.
Unidade de Endoscopia Digestiva - unidade functional onde se realizam exames de endoscopia digestiva.
Anexo 4.
Anexo 5. Sistema de classificação de Spaulding
O sistema de classificação de Spaulding define os dispositivos médicos (DM) de acordo com o risco de infeção, aplica-se também aos endoscópios9
| Risco | Definições | Recomendações |
| Elevado Material crítico | Todo aquele que penetra nos tecidos subepiteliais, no sistema vascular e outros órgãos isentos de flora microbiana própria (estéreis), bem como todo o que esteja diretamente ligado com eles. ex. Pinças de biópsia; esfincterótomos | Limpeza seguida de Esterilização (1) |
| Médio Material semicrítico | É todo aquele que entra em contacto com as membranas mucosas ou com a pele não-íntegra mas geralmente não penetra tecidos estéreis. p. ex: endoscópios gastrintestinais | Limpeza seguida de Desinfeção de nível elevado (2; 3) (Exceção: instrumentos usados na vagina ou colo do útero, p.ex. espéculos que devem ser esterilizados) |
| Baixo Material não-crítico | É todo aquele que entra em contacto apenas com a pele íntegra ou que não entra em contacto direto com o doente | Limpeza |
a) Até à sua utilização, este material deve permanecer na embalagem hermeticamente fechada. Logo que a embalagem seja aberta ou se por qualquer motivo for danificada, o material deixa de ser considerado estéril.
b) Classificação dos desinfetantes:
Nível elevado - destrói todos os microrganismos incluindo esporos
Nível médio - destrói bactérias vegetativas, BK, maioria dos vírus e fungos
Nível baixo - destrói as bactérias Gram positivas, algumas Gram negativas, vírus lipídicos e alguns fungos
c) Na utilização dos desinfetantes deve-se ter sempre em conta as indicações do fabricante no que se refere às diluições, manuseamento, conservação e prazos de validade. Os desinfetantes devem ser manipulados com luvas de nitrilo ou de tipo doméstico. Relembra-se a importância da lavagem das mãos no fim do procedimento.
Anexo 6. Produtos químicos utilizados no reprocessamento de material endoscópico
Os produtos químicos utilizados no reprocessamento de material endoscópico devem ser concebidos e fabricados de acordo com a Diretiva dos Dispositivos Médicos
a) Os detergentes são classificados como produtos para DM de classe I sendo identificados pela marcação CE no rótulo.
b) Os desinfetantes são produtos para DM de classe ii devendo ostentar, para além da marcação CE, um código de 4 dígitos para identificar o organism responsável.
Os produtos químicos selecionados devem ser compatíveis com o material endoscópico e os RAE. Esta compatibilidade deve ser confirmada pelos fabricantes.
Os ingredientes dos detergentes devem ser compatíveis com o desinfetante e não alterar a sua atividade no caso de ficarem resíduos após o enxaguamento. Para garantir a compatibilidade, a ESGENA recomenda que sejam utilizados detergentes e desinfetantes do mesmo fabricante.
Embora os desinfetantes existam em formulações líquidas e em pó, devem ser preferidas as formulações líquidas (as formulações em pó apresentam o risco de poder reter grãos nas tubagens com possível entupimento).
Os seguintes fatores podem influenciar a escolha do desinfetante:
a) Processo de diluição
b) Estabilidade da solução
c) Número de reutilizações possíveis
d) Avaliação da concentração
e) Custo direto
f) Custos indiretos (p.ex. RAE apropriado, espaço de armazenamento, condições de uso, medidas de proteção dos profissionais
g) Recomendações do fabricante de material endoscópico
Os desinfetantes de dispositivos médicos usados manualmente ou nos RAE devem cumprir a norma EN ISO 14885.
Os desinfetantes usados no reprocessamento de material endoscópico devem ser de nível elevado: ter um espetro alargado de atividade contra bactérias, fungos, micobactérias, vírus lipídicos e não-lipídicos, por exemplo: produtos oxidantes (acido peracético, dióxido de cloro) e aldeídos (glutaraldeído, ortoftalaldeído).
Substâncias como álcoois, fenólicos, compostos de amónio, não são recomendadas para desinfeção de material endoscópico por não apresentarem um espetro de atividade adequado.
Nota: A nível nacional, o glutaraldeído foi retirado do mercado devido aos riscos para a saúde dos profissionais.
Ortoftalaldeído: Estes produtos apresentam-se em solução contendo 0,55% de substância ativa.
| Ortoftalaldeído (OPA) | |
| Vantagens | Desvantagens |
| A solução é estável durante cerca de 14 dias (2 semanas); É estável a um pH de 3-9; Tem excelente compatibilidade com os dispositivos médicos e não causa dano aos mesmos; Pode ser usado quer nos RAE quer na desinfeção manual; Estudos demonstram uma eficácia microbiológica melhor quando comparada com o glutaraldeído; A eficácia do OPA quando comparada com o glutaraldeido é maior, e o seu tempo de vida é longa (2 semanas) | Ação lenta contra esporos bacterianos; Não há dados suficientes sobre a fixação nos materiais; Requer maior tempo de exposição para ser eficaz contra micobactérias resistentes ao glutaraldeído; É muito importante a monitorização da sua concentração; Provoca coagulação e fixação de proteínas; É irritante para os olhos, vias respiratórias e pele; deve ser usado em contentores fechados; a ventilação é recomendada; Pode causar reações «tipo anafilático» com uso repetido/prolongado |
Ácido peracético
Estes produtos são apresentados em formulações líquidas, em pó ou mistos. Podem ser usados à temperature ambiente ou requerer temperaturas superiores. Podem ainda necessitar de diluição.
| Ácido Peracético | |
| Vantagens | Desvantagens |
| Desinfeção de ação rápida, de alto nível e com atividade esporicida; Dependendo da formulação, as soluções de utilização são estáveis de 1 a 14 dias; Não há reação química com resíduos proteicos (i.é. não é fixativo) | Dependente do pH pode ser irritante para a pele, olhos e vias respiratórias; forte odor a vinagre; a ventilação é recomendada; A compatibilidade do material depende do pH e da temperatura; É necessária uma avaliação de compatibilidade com os endoscópios e processadores; É possível a coagulação proteica dependendo do pH (ácido) |
Dióxido de cloro
Não está comercializado em Portugal. Existem formulações apenas para os RAE.
| Dióxido de Cloro | |
| Vantagens | Desvantagens |
| Desinfeção rápida, de alto nível com atividade esporicida; Solução em uso estável de 7 a 14 dias; | Irritante para a pele, vias respiratórias e olhos; forte odor a cloro: a ventilação é recomendada; É necessária uma avaliação de compatibilidade com os endoscópios e processadores; Alguns países restringem o seu uso (contaminação de águas residuais com cloro); Produz descoloração da camada de plástico dos endoscópios sendo apenas uma alteração cosmética |
Água ácida eletrolisada
Estes desinfetantes são produzidos in loco, funcionam a um pH = < 2,7, um potencial de oxidação-redução >1.000mV e uma concentração de cloro livre libertado de 10±2 ppm.
| Água ácida eletrolisada | |
| Vantagens | Desvantagens |
| Desinfeção rápida, de alto nível com atividade esporicida; A solução em uso é reutilizável durante o tempo de funcionamento do gerador; Não afeta a pele, olhos e vias respiratórias dos profissionais | Desativação rápida da solução em uso, na presença de carga orgânica; É possível a coagulação proteica dependente do valor do pH (ácido); Alguns países restringem o seu uso (contaminação de águas residuais com cloro); É necessária uma avaliação de compatibilidade com os endoscópios e processadores |
Anexo 7. Características dos reprocessadores automáticos de endoscópios
Reprocessamento em RAE
1. Definições e critérios básicos para os RAE
Os RAE têm como função a desinfeção de endoscópios flexíveis num sistema fechado, após uma limpeza manual. Assim, o seu ciclo inclui a desinfeção e o enxaguamento mas não a limpeza. Existem diversos modelos no mercado. Todos eles fazem a desinfeção e o enxaguamento mas, para além disso, alguns modelos oferecem adicionalmente:
a) Um teste de fugas integrado
b) Um enxaguamento automático com água.
A secagem opcional após o enxaguamento final pode ser de 2 tipos:
Secagem entre exames, que envolve remoção dos fluidos residuais das faces externas e do interior dos canais.
Secagem alargada no final do dia de trabalho de forma a manter os endoscópios armazenados em segurança pelo menos de um dia para o outro, para prevenir a recontaminação pelos líquidos residuais, ou por fatores ambientais.
Atendendo a que estes equipamentos não integram uma fase de limpeza, esta deve ser efetuada manualmente. A máquina deve ser eficaz, segura e confiável, e suportar o design dos endoscópios e respetivos acessórios.
Os RAE devem preencher os seguintes critérios básicos:
a) Assegurar a completa irrigação de todos os canais endoscópicos incluindo: biopsia, sucção, ar/água, canais auxiliares e elevadores.
b) Evitar a contaminação cruzada de endoscópios desinfetados a seguir.
c) Reduzir o risco de exposição dos olhos, pele e trato respiratório aos produtos químicos utilizados no processo (sistema fechado).
2. Especificações do processo para os reprocessadores automáticos de endoscópios
Os RAE devem apresentar as seguintes características, que podem ser diferentes conforme os modelos:
a) Monitorização da renovação do desinfetante.
b) Sistema de aquecimento para manter o desinfetante à temperatura especificada.
c) Adaptadores para o reprocessamento de todo o equipamento compatível.
d) Um sistema de tratamento da água de enxaguamento que evite a recontaminação dos endoscópios durante a fase de enxaguamento.
e) Autodesinfeção da água e dos componentes do Sistema de tratamento da água.
f) Interface de impressão para registo dos dados da desinfeção.
g) Indicador de falhas.
3. Recomendações específicas para os reprocessadores automáticos de endoscópios
É necessário cumprir numerosos passos manualmente antes que o endoscópio possa ser colocado no RAE. A limpeza manual prévia é obrigatória. É necessário garantir que os resíduos dos detergentes são removidos de forma eficaz porque podem interferir com a atividade do desinfetante no RAE.
Os fatores de processo mais importantes e determinantes do resultado final adequado são:
a) cumprimento rigoroso das instruções do fabricante no que se refere aos procedimentos prévios;
b) nos casos de reutilização das soluções de desinfetante, são necessários testes regulares de eficácia (de acordo com as indicações do fabricante dos produtos químicos e dependendo da frequência de utilização).













