Introdução
As leucemias linfoblásticas são caracterizadas por disfunção das células progenitoras hematopoéticas da medula óssea que culminam na proliferação clonal desordenada das células precursoras de origem linfoide.1 No caso da leucemia linfoblástica (LL), a transformação maligna ocorre nos progenitores das células do tipo B e/ou T, causando acúmulo de células blásticas preferencialmente na medula óssea.2
Segundo dados da IARC (Agência Internacional de Pesquisa em Câncer), estima‑se que as leucemias contabilizem, em média, 30% de todos os diagnósticos de neoplasias malinas entre 0 e 19 anos, configurando assim o câncer mais comum da infância e adolescência.3
Especificamente na região Norte do Brasil, de acordo com a Fundação de Hematologia e Hemoterapia do Amazonas (HEMOAM), entre 2005 e 2015 foram registrados 511 casos de LL em pacientes de 0 a 20 anos, predominantemente do sexo masculino. Dentre seus subtipos, a LL‑B é a prevalente, com 85% comparados com os casos de linhagem T.4
As LLs causam insuficiência hematopoética progressiva e fatal quando não contidas. Entretanto, são frequentemente quimiossensíveis, com taxas de sobrevida próximas aos 90% se implementado o regime terapêutico ideal.5,6 No Brasil, dois dos principais protocolos terapêuticos adotados são o do Grupo Brasileiro de Tratamento da Leucemia da Infância (GBTLI) e do Grupo Europeu Berlim‑Frankfurt‑Munster (BFM).7,8
Os pacientes diagnosticados com LL podem apresentar uma gama de manifestações bucais inerentes à própria doença de base e/ou ao seu tratamento. Referente à doença em si, a própria alteração da condição hematológica pode expor o paciente a tal desfecho. Quanto ao tratamento, a vulnerabilidade do paciente dá‑se em decorrência do potencial mucotóxico próprio dos quimioterápicos, que têm como células‑alvo as produzidas na medula óssea, com taxa mitótica semelhante às células da mucosa bucal.9‑11
Tais manifestações, quando presentes, são capazes de sugerir os sinais e sintomas iniciais da doença e podem primeiramente ser reconhecidas pelo cirurgião‑dentista, em especial o odontopediatra, o qual deverá referenciar esse paciente ao adequado serviço de diagnóstico e tratamento.9,10,12Dentre as manifestações bucais mais frequentes das LLs estão a mucosite bucal, candidíase bucal, periodontite e gengivite. Os locais de surgimento mais frequentes são as áreas de mucosa bucal não‑queratinizada.10
Dessa maneira, o objetivo desta pesquisa é trazer informações acerca das manifestações bucais de pacientes infanto-juvenis em dois momentos do tratamento quimioterápico, provenientes do único serviço público de referência no tratamento de leucemias no Amazonas.
Material e métodos
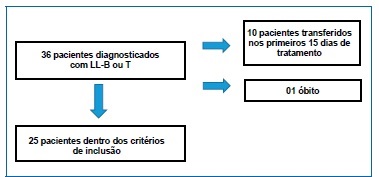
Esta pesquisa foi aprovada pelo Comité de Ética em Pesquisa da Fundação HEMOAM. Foi utilizado o checklist STROBE -Strengthening the Reporting of Observational Studies in Epidemiology para organização da pesquisa.13 Trata‑se de pesquisa observacional em pacientes infantojuvenis. Foram incluídos pacientes entre 1 e 18 anos, de ambos os sexos, diagnosticados com LL de células B ou T entre setembro/2018 e agosto/2019 prestes a iniciar o tratamento antineoplásico na Fundação HEMOAM, portanto, representando amostra de conveniência. O tratamento ocorreu sob dois protocolos terapêuticos que estiveram vigentes ao longo da coleta - o proposto pelo Grupo Brasileiro de Tratamento de Leucemia da Infância (GBTLI LLA‑2009)7 e Grupo Alemão Berlim‑Frankfurt‑Munique (ALL IC‑BFM2009).8
Foram excluídos do estudo pacientes que já haviam iniciado o tratamento quimioterápico, casos reiniciados por recaída da doença, pacientes sindrómicos, presença do cromossoma Philadelphia, pacientes que foram a óbito ou transferidos para outro hospital no período da pré‑fase/indução do tratamento.
Dessa maneira, foram considerados 25 pacientes elegíveis para a pesquisa, conforme Figura 1.
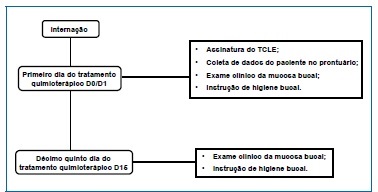
A mucosa bucal dos pacientes foi avaliada clinicamente no primeiro (D0/D1) e no décimo quinto dia (D15) da pré‑fase/indução do tratamento quimioterápico, conforme fluxograma apresentado na Figura 2. O procedimento foi executado por único examinador cirurgião‑dentista, especialista em odontopediatria, seguindo‑se a sequência de exame clínico preconizada pela disciplina de Estomatologia Clínica da Faculdade de Odontologia da Universidade Federal do Amazonas (FAO/UFAM). Foram analisados na sequência lábios, mucosas, língua, assoalho bucal, palato duro, palato mole, orofaringe e gengiva. O exame foi realizado com o paciente posicionado sentado ou em decúbito dorsal. Para o exame foram utilizadas espátulas de madeira e gaze com o cumprimento de todas as normas de biossegurança.14 Os registros foram feitos em ficha customizada para esse fim. A mucosite bucal foi graduada conforme sua gravidade (de 1 a 4) de acordo com a Escala de Toxicidade Oral da OMS,15 como mostrado na Tabela 1. O examinador foi calibrado por um cirurgião‑dentista atuante na Instituição quanto ao diagnóstico da gravidade da mucosite bucal. Em razão da baixa casuística, foi realizada a análise estatística descritiva dos dados.
Fonte: Adaptado da Escala de Toxicidade Oral da OMS.
Resultados
Da amostra, 64% (n=16) eram do sexo masculino, com todos os pacientes entre 1 e 14 anos. A média de idade ao diagnóstico foi de 6,9 anos e mediana de 5,5 anos, com maior frequência de LL provenientes de células B (96% n=24). Todos os pacientes eram residentes do Estado do Amazonas, sendo 92% (n=23) nascidos no mesmo Estado e 8% (n=2) naturais de outros Estados da região norte. Quanto ao protocolo terapêutico, 36% (n=9) foram tratados pelo protocolo GBTLI LLA‑2009 e 64% (n=16) foram tratados sob protocolo ALL IC‑BFM 2009.
Informações de acordo com o sexo, idade, tipo de LL, protocolo utilizado, grupo de risco e manifestações bucais durante a pré‑fase/indução do tratamento quimioterápico dos 25 pacientes avaliados no estudo estão apresentados na Tabela 2.
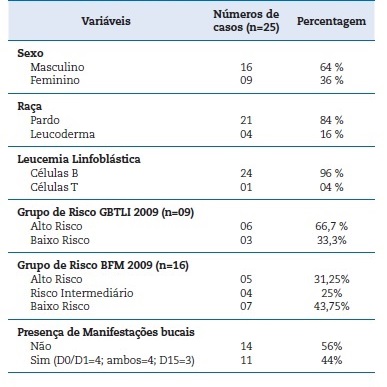
Tabela 2 Distribuição dos pacientes de acordo com o sexo, idade, tipo de leucemia, grupo de risco e manifestações bucais durante a prefase/indução do tratamento quimioterápico.
Desses pacientes, 56% (n=14) apresentaram mucosa hígida, enquanto 44% (n=11) mostraram manifestações bucais.
Estes somaram 19 ocorrências de manifestações bucais, sendo 52,6% (n=10) envolvendo o início do tratamento (D0/D1) (Figura 3). De maneira mais detalhada, quanto à distribuição dos achados, seis manifestações orais foram encontradas somente no D0/D1, distribuídas em 4 pacientes. Outras nove (09) manifestações aconteceram em 4 pacientes tanto em D0/D1 quanto D15. Ainda, quatro (04) manifestações bucais ocorreram somente em D15, distribuídas entre 3 pacientes, conforme Tabela 3.
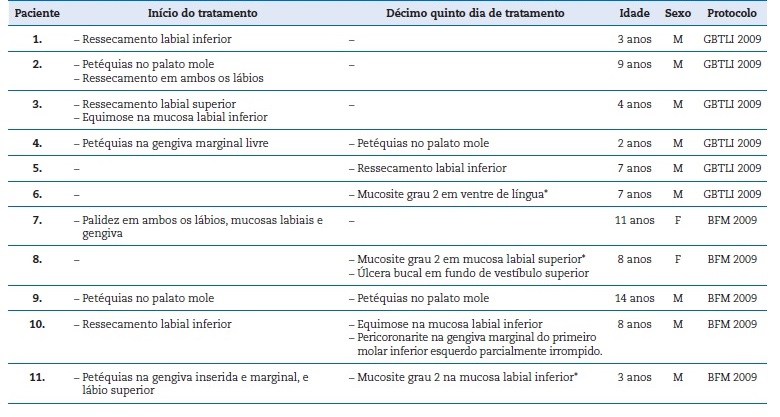
Tabela 3 Descrição individualizada dos 11 pacientes que apresentaram manifestações orais com o tipo e localização da manifestação bucal no início do tratamento (D0/D1) e no décimo quinto dia de tratamento (D15), bem como idade do paciente e protocolo de tratamento utilizado. Três pacientes apresentaram lesões nos dois momentos de avaliação. Os episódios de mucosite bucal* foram em D15 e em mucosa não queratinizada.
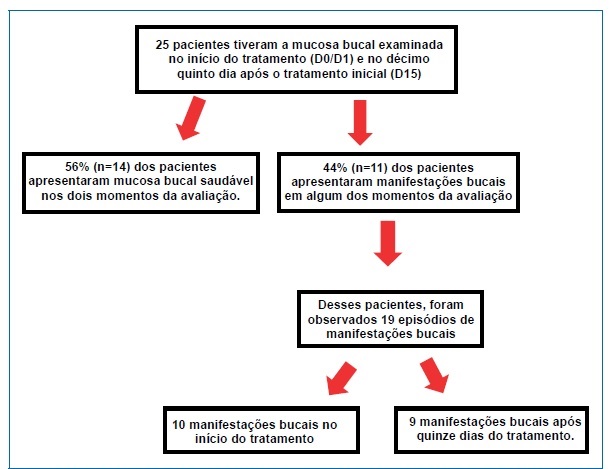
Figura 3 Distribuição dos 25 pacientes com mucosa bucal examinada no início do tratamento (D0/D1) e no décimo quinto dia de tratamento (D15), bem como a distribuição dos episódios de manifestações bucais encontradas nesses momentos. Parte dos episódios foram encontrados em ambos os momentos de avaliação
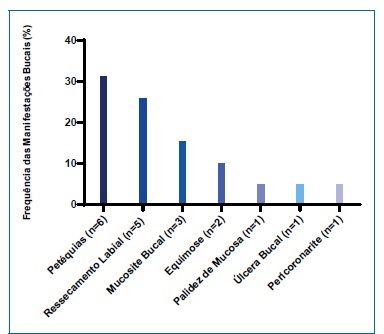
Quanto aos tipos e frequência das ocorrências de manifestações bucais, foram encontradas em ordem decrescente, petéquias (31,6%; n=6), ressecamento labial (26,3%; n=5), mucosite bucal (15,8%;n=03), equimose (10,5%; n=2) e palidez de mucosa, úlcera bucal e pericoronarite (5,3%;n=01 cada). A Figura 4 mostra a frequência desses achados.
A localização anatómica das manifestações foram lábios superior e inferior, mucosa labial, gengiva, palato mole, fundo de vestíbulo labial e ventre lingual, sendo a mucosa não‑queratinizada o sítio de predileção (84,2%, n=16). A Tabela 3 detalha todas as ocorrências de manifestações bucais com seus respetivos sítios anatómicos, além de idade dos pacientes e protocolo de tratamento utilizado.
Discussão
As leucemias linfoblásticas contabilizam, em média, 30% de todos os diagnósticos de neoplasias entre 0 e 14 anos e tem o maior impacto no total da incidência de câncer em pacientes infantojuvenis.3 Esse dado está em concordância com nosso estudo e nenhum paciente incluído tinha mais de 15 anos.
Em artigo com dados epidemiológicos sobre leucemias agudas no Estado do Amazonas de 2005 a 2015, dos 843 pacientes da pesquisa, 68,45% (n=577) foram diagnosticados com LL.
Desses, 91% (n=459) foram diagnosticados com LL de células B, enquanto 9% (n=52) foram diagnosticados com LL de células T.4 Esses valores estão proporcionalmente em concordância com os achados de nossa pesquisa, dado que dos 25 pacientes incluídos, n=16 (96%) tinham diagnóstico de LL‑B e n=1 (4%) LL‑T.
Está bem estabelecido na literatura que a ocorrência de mucosite bucal está relacionada à toxicidade dos medicamentos utilizados na quimioterapia, especialmente o Metotrexato,16,17presente nos protocolos em concentrações e frequências variadas. No entanto, não podemos afirmar o mesmo em relação as outras manifestações relatadas neste estudo. Não se evidencia na literatura se as outras manifestações bucais poderiam representar lesões inespecíficas, ou directamente sequela do tratamento ou se poderiam estar relacionadas à própria doença de base. De maneira geral, os estudos são costumeiramente realizados em pacientes já sob tratamento antineoplásico.10,18,19
A mucosite bucal foi raramente verificada neste estudo, havendo, principalmente, a presença de outras manifestações bucais inespecíficas, como petéquias, lábios ressecados, equimose, palidez de mucosa e pericoronarite. A ocorrência de mucosite bucal em pacientes leucémicos tratados exclusivamente por quimioterapia costuma ser mais baixa do que naqueles que também estão recebendo radioterapia e/ou transplante de medula óssea.20 De maneira geral, a mucosite bucal tem sido relatada em 40% ou mais dos pacientes com leucemia.16,20‑22
A presença de petéquias em mucosa bucal foi descrita na literatura por alguns pesquisadores em palato mole e mucosa bucal.16,19,23 Embora Gandhi et al.16 tenham observado essa manifestação bucal em 22,6% (n=14) dos pacientes recebendo quimioterapia para diversas neoplasias, Ponce‑Torres et al.19examinando pacientes em tratamento para leucemia linfoblástica, encontraram frequência maior, 35,7% (n=17) nessa população. A presença de lábios ressecados em pacientes quimioterápicos também é relatada na literatura, como Ponce‑Torres et al.19 que identificaram essa condição em 93,8% (n=46) de sua amostra. O ressecamento labial pode estar correlacionado a outros fatores além da quimioterapia, possivelmente a permanente exposição dos pacientes institucionalizados ao ar condicionado.24
A equimose em mucosa labial de pacientes com leucemia também foi relatada, com frequências variando de 25% (n=8) a 36,73% (n=18).17,21Além disso, outras manifestações foram descritas ao longo do tratamento quimioterápico desses pacientes.
A palidez de mucosa foi encontrada em 43,4% (n=9) e 31,25% (n=10).21,23Além disso, o acometimento por infecções bucais (fúngicas, virais ou bacterianas) em pacientes recebendo quimioterapia é um achado frequente.10,16,25,26No presente trabalho tais manifestações bucais podem representar achados ocasionais.
Em recente publicação de série de casos realizada na mesma Instituição de nossa pesquisa, alterações bucais foram observadas em 3 de 9 pacientes com LL‑B sob tratamento pelo protocolo GBTLI‑LLA 2009, sendo elas eritema, lábios ressecados e episódio de xerostomia.27
Concernente ao local de apresentação dessas manifestações bucais, nossos achados são coerentes com a literatura, que relata áreas de mucosa não‑queratinizada tais como mucosa labial, mucosa bucal, palato mole, superfície ventral e lateral da língua como sítio de predileção dessas lesões.10,28,29
Neste estudo foi escolhida a pré‑fase/indução para avaliação dos pacientes em razão da maior possibilidade de manifestações bucais nessa etapa do tratamento devido a imediata mucotoxicidade das drogas quimioterápicas utilizadas nessa fase. Vários autores também elegeram a primeira fase do tratamento para avaliação bucal.10,17,23,30Além disso, durante esta pesquisa, dois protocolos de tratamento quimioterápico foram adotados. Em setembro/2018 os pacientes eram tratados sob o protocolo GBTLI LLA‑2009, no qual até o D15, são usadas as medicações Prednisona, Metotrexato, Dexametasona, L‑Asparaginase, Vincristina, Daunorrubicina e Ara‑c (Citarabina). Para os grupos de alto e baixo risco de recaída são usadas as mesmas medicações, porém em dosagens e momentos diferentes.7 Em janeiro de 2019 este protocolo foi temporariamente suspenso e até o final desta pesquisa, em agosto/2019, os pacientes passaram a ser tratados pelo protocolo
ALL IC‑BFM 2009, amplamente utilizado em grandes centros de tratamento pelo mundo. De forma semelhante, esse protocolo faz uso da Prednisona, Vincristina, Daunorrubinina, L‑Asparaginase e Metotrexato. A duração da indução nessa terapêutica é de 33 dias.8
Atualmente, na busca de um tratamento mais completo para o paciente, os cuidados bucais ocupam lugar estratégico na terapia de suporte. Com isso, reforça‑se o sentido do especialista em odontopediatria desempenhando função estratégica dentro da equipe multidisciplinar que assiste o paciente com leucemia.9,11,12O HEMOAM possui equipe odontológica atuante para manejo dos pacientes em tratamento quimioterápico.
As limitações encontradas no presente trabalho referem‑se principalmente a baixa casuística, ao tipo de amostra - de conveniência - oriunda de único centro de tratamento e também a provável exclusão de pacientes transferidos para outros hospitais da cidade pela necessidade de unidade para terapia intensiva (UTI), em função de agravamento da doença. Alguns desses casos estão relacionados a pacientes com LL‑T, cuja gravidade costuma ser maior que o de células B, o que limitou nosso acesso a esses pacientes.5 Em virtude das limitações encontradas nesse estudo, essa amostra pode não ser representativa dos pacientes com LL de células B ou T. Dessa maneira, a baixa ocorrência de manifestações bucais pode estar relacionada tanto à quantidade e perfil de pacientes alocados no estudo quanto à provável baixa toxicidade dos protocolos utilizados.
O presente estudo trouxe informações epidemiológicas e de perfil de manifestações bucais encontradas em pacientes infantojuvenis com leucemia linfoblástica em um centro de referência em hematologia do norte do Brasil.
Conclusões
Os achados de mucosite bucal, classicamente verificada na literatura como sequela do tratamento em pacientes com leucemia, foi incipiente nesta pesquisa, estando outras manifestações bucais inespecíficas encontradas em baixa frequência.
Este perfil pode estar relacionado à baixa casuística da pesquisa, bem como à provável baixa toxicidade dos protocolos adotados, ou ainda à atuação da equipe odontológica na Instituição, o que poderia favorecer a prevenção de agravos bucais.