Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Acta Obstétrica e Ginecológica Portuguesa
versión impresa ISSN 1646-5830
Acta Obstet Ginecol Port vol.10 no.2 Coimbra jun. 2016
ARTIGOS ORIGINAIS/ORIGINAL ARTICLES
Transfusão intra-uterina para o tratamento de anemia fetal grave - experiência de 14 anos de um centro de diagnóstico pré-natal em Portugal
Intrauterine blood transfusion for fetal anemia treatment - the experience of 14 years of a prenatal diagnosis center in Portugal
Cláudia Rijo*, Álvaro Cohen**, Ana Teresa Martins**, Jader Cruz*, Alexandra Queirós*, Helena Ramos***, Joaquim Correia****
Maternidade Dr. Alfredo da Costa - CHLC
*Assistente Hospitalar de Ginecologia e Obstetrícia
**Assistente Graduado de Ginecologia e Obstetrícia
***Assistente Hospitalar de Pediatria
****Chefe de serviço de Ginecologia e Obstetrícia
Endereço para correspondência | Dirección para correspondencia | Correspondence
ABSTRACT
Overview and aims: Intrauterine blood transfusion (IBT) is an established technique for the treatment of severe fetal anemia, increasing the survival of these fetuses. We aimed to describe the experience of a single center in pregnancies complicated with severe fetal anemia, that underwent IBT.
Study design, Population, Methods: A retrospective cohort study was conducted from January 1996 to June 2014. Data were collected from 98 IBT performed in 44 pregnancies. Data included: anemia etiology, gestacional age at IBT, hemoglobin and hematocrit levels, presence of hydrops, number of IBTs, gestacional age at birth, sex and weight. Neonatal data included: number of exchange transfusions, respiratory distress syndrome, sepsis and other complications.
Results: The main cause of fetal anemia was anti-D alloimmunization in 79.5% of the cases and the mean gestational age (GA) of the first IBT was 26 weeks. The minimum pre-transfusion hemoglobin was 1.5 g/dL, with an average of 6.4g/dL. The post transfusion hematocrit increased to the desired values in 90% of cases. Nine fetuses (20.5%) had hydrops at diagnosis. We had 4 cases of fetal death, and 40 pregnancies resulted in live births, with mean gestational age of 34.3 weeks, average weight of 2446g and mean hemoglobin of 11g/dL. A cesarean was performed in most cases. The overall survival was 86.4%, since in addition to the four fetal deaths there were two cases of early neonatal death. Fetal hydrops and early GA seemed to be associated with a poorer prognosis.
Conclusions: IBT is a safe and effective procedure for the treatment of severe fetal anemia. Vigilance should be done in hospitals with experience to allow timely and proper treatment of this condition.
Keywords: Intrauterine blood transfusion; Cordocenteses; Anemia.
Introdução
A transfusão intrauterina (TIU) é uma técnica estabelecida na terapêutica da anemia fetal grave aumentando a sobrevida destes fetos.1 A utilização universal da imunoglobulina anti-D reduziu drasticamente a necessidade de TIU, mas esta continua a ser um procedimento fundamental na doença hemolítica grave do feto1.
A técnica foi descrita pela primeira vez por Liley, em 1963, com transfusão de glóbulos vermelhos com controlo fluoroscópico, utilizando técnica intraperitoneal2. A ecografia foi utilizada pela primeira vez em 1977 e a via intravascular foi descrita por Rodeck em 19813. Actualmente o método mais utilizado é a punção da veia umbilical no topo placentário4. Na nossa Unidade esta técnica realiza-se desde 1989.
A técnica é realizada em fetos entre as 18 e as 35 semanas, porque em idades gestacionais mais precoces é tecnicamente difícil e depois das 35 semanas os riscos da técnica excedem os da prematuridade, apesar de alguns centros realizarem esta técnica em gestações mais precoces.
A indicação mais frequente para TIU é anemia fetal associada à aloimunização maioritariamente anti-D, mas são conhecidos mais de 50 anticorpos que podem originar doença hemolítica do feto. Outras causas descritas de anemia fetal são infecção fetal (Parvovírus e Citomegalovírus (CMV) entre outras), hemorragia feto-materna , alterações hereditárias dos glóbulos vermelhos, e algumas complicações relativas a gestações monocoriónicas1,2.
A TIU pode ser realizada por via intravascular ou intraperitoneal, sendo que esta última permite acesso indireto à circulação fetal através da absorção linfática, podendo ser útil em fetos com idades gestacionais mais precoces, mas com utilização limitada em fetos com hidrópsia, pela diminuição da circulação linfática. O acesso intravascular é o mais utilizado, uma vez que permite a correcção da anemia de forma mais rápida, principalmente em casos com hidrópsia, e porque permite o acesso aos valores de hemoglobina fetal podendo calcular exatamente o volume de concentrado eritrocitário a transfundir. O local de acesso é a veia umbilical, preferencialmente no topo placentário mas, uma ansa livre, ou o trajeto intra-hepático da veia umbilical podem ser alternativas em algumas circunstâncias. Uma terceira via de abordagem é o acesso intracardíaco, mas que tem vindo a ser menos utilizado porque está associado a maior mortalidade fetal1,2,5.
A sobrevida global descrita após a TIU é superior a 90%, mas varia com o centro e a experiência do operador, bem como com a presença de hidrópsia fetal1,6. Os fetos com hidrópsia tem uma menor sobrevida, bem como os fetos com idades gestacionais mais precoces2.
As principais complicações descritas, por procedimento, são bradicárdia fetal (5%), necessidade de cesariana de emergência (2%), morte fetal (1,6%), infecção (0,3%) e ruptura pré-termo de membranas (RPPM) (0,1%).
Outros riscos descritos são hematoma do cordão umbilical e laceração no local da punção com hemorragia podendo levar, em casos extremos, à morte fetal12.
Outra preocupação relativa a estas gestações é que possa ocorrer um aumento de alterações do neurodesenvolvimento associadas à anemia fetal e à TIU6,7. O maior estudo realizado em casos de TIU por anemia hemolítica (LOTUS) revela que ocorrem alterações do neurodesenvolvimento (definida como alterações cognitivas, do tónus, postura e marcha) em 1,7% dos casos, paralisia cerebral associada a alterações do neurodesenvolvimento em 1,4%7, surdez bilateral em 1% e paralisia cerebral isolada16 em 0,7%7. Estes valores não são diferentes dos da população em geral, ajustados à idade gestacional do nascimento, excepto em relação à paralisia cerebral em que existe um aumento7. Este estudo revelou que o principal factor que agrava o prognóstico destes crianças é a presença de hidrópsia fetal grave no momento do diagnóstico sendo que é um factor de risco independente. Outro factor que modifica o prognóstico é o valor de hemoglobina pré-transfusional, uma vez que valores de inferiores a 3 g/dl estão muito frequentemente associados à ocorrência de hemorragia intracraniana6,7.
Em relação à surdez, esta parece estar associada ao quadro de hiperbilirubinémia e pode ser diminuída com a utilização de fototerapia e exsanguíneo-transfusões após o parto6,7.
Existem poucos dados sobre o neurodesenvolvimento neonatal quando a etiologia da anemia é infecção fetal, mas parece ser semelhante ao neurodesenvolvimento após TIU por aloimunização18.
Os autores pretendem descrever a experiência do nosso centro nas gestações complicadas com anemia fetal grave que foram submetidos a TIU de glóbulos vermelhos.
Métodos
Análise retrospectiva de 98 TIU realizadas em 44 gestações entre 1996 e Junho 2014 correspondente a 14 anos, uma vez que durante 4 anos o centro não realizou a técnica.
Incluímos na nossa análise todos os casos com diagnóstico de anemia fetal grave confirmado na cordocentese e submetidos a TIU, independentemente da sua etiologia.
Registamos em base de dados os seguintes parâmetros que permitiram a análise dos dados: Idade gestacional na transfusão, indicação da transfusão, hemoglobina pré e pós transfusão, hematócrito pré e pós transfusão, localização da placenta, local da punção, volume transfundido, idade gestacional (IG) do parto, tipo de parto, Índice de Apgar ao 1º e 5º minuto. Incluímos também dados neonatais como número de exsanguíneo-transfusões e complicações neonatais. Consultamos os processos clínicos de Obstetrícia e consulta de Neurodesenvolvimento do Serviço de Pediatria, para avaliação do desenvolvimento pós-natal.
Excluímos desta análise as situações de hidrópsia fetal nas quais não se verificou anemia fetal, após cordocentese. Excluímos também as suspeitas de anemia fetal após as 35 semanas de gestação nos quais se procedeu ao parto e confirmou-se o diagnóstico no período pós-natal.
Perante uma suspeita de anemia fetal foi realizada história clínica detalhada com avaliação de gestações prévias, história de isoimunização, hidrópsia fetal ou morte fetal.
Para o estudo etiológico, realizou-se avaliação laboratorial com hemograma, grupo de sangue e teste de coombs indirecto com pesquisa de anticorpos irregulares. No teste de coombs indirecto, considerou-se 1/16 como nível crítico para iniciar o protocolo de vigilância de anemia fetal.
Para exclusão de etiologia infecciosa (CMV, parvovírus) pediram-se serologias maternas. O diagnóstico de infecção materna foi efectuado quando se documentou seroconversão na gravidez. Em algumas situações foi importante pedir o estudo da avidez das Imunoglobulinas G (para inferir o momento da primoinfecção). Para diagnóstico de infecção fetal realizamos pesquisa de DNA do agente infecioso no liquido amniótico (tendo em atenção o período de latência entre a infecção e a excreção no liquido amniótico). Em algumas situações também foi necessária a colheita de sangue fetal através da cordocentese.
Em casos de história familiar foram também excluídas hemoglobinopatias de transmissão hereditária.
Perante uma suspeita de anemia fetal, realizou-se avaliação ecográfica com estudo Doppler para pesquisa indireta de anemia fetal. Determinamos o pico de velocidade sistólica (PVS) da artéria cerebral média (ACM), avaliamos presença de hidrópsia fetal e o bem estar fetal.
A medição do PVS da ACM foi ajustada para a idade gestacional de acordo com o Normograma de Mari4 e consideramos que valores iguais ou superiores a 1,5 MoM (múltiplos da mediana) correspondem a anemia fetal grave e, portanto, com indicação para realização de cordocentese diagnóstica e eventual terapêutica com transfusão intrauterina.
De referir que no nosso centro, até ao ano 2000, o diagnóstico e vigilância de anemia fetal foi feito através de amniocenteses seriadas para realização de espectrofotometria do líquido amniótico com luz de comprimento de onda de 450ìm (micrómetros).
No nosso centro, a técnica utilizada para cordocentese e TIU foi adaptada a partir da descrição feita por Nicolaides (Quadro I)5.
Todas as gestações foram vigiadas em consulta de risco obstétrico e mantiveram vigilância ecográfica seriada para monitorização do bem estar fetal, para avaliar a necessidade de terapêutica e para detecção de eventuais complicações, nomeadamente de desenvolvimento do sistema nervoso. Nos casos em que o valor de hemoglobina inicial era inferior a 3g/dL realizamos também avaliação do sistema nervoso por ressonância magnética após as 30 semanas.
Todas as TIU foram realizadas por 2 operadores, sendo que desde o ano de 2003 foram todas realizadas por um operador (72 TIU).
Em casos de anemia hemolítica, a programação de nova TIU baseou-se na premissa de que ocorre uma descida de 1% do hematócrito fetal por dia e a decisão de uma nova TIU baseou-se nesta descida esperada de hematócrito e avaliação do PVS-ACM. Quando a etiologia da anemia foi infecciosa não houve necessidade de nova transfusão.
A programação do parto ocorreu entre as 36-38 semanas, dependendo da avaliação fetal e materna. Deve considerar-se a via vaginal para o parto, mas pode ponderar-se cesariana em casos graves .
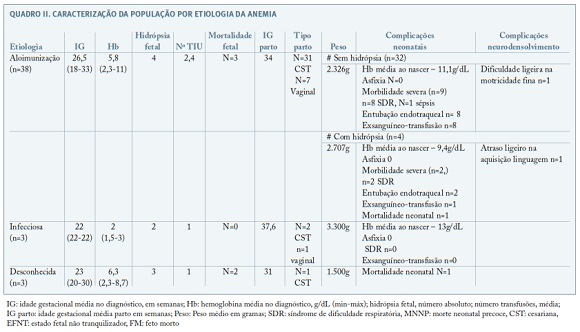
Resultados
A caracterização da população submetida a TIU está descrita no Quadro II. Obtivemos 98 TIU que foram realizadas em 44 gestações. A principal causa de anemia fetal foi aloimunização anti D em 79% (n=35) dos casos, seguida de aloimunização não D em 7% (n=3), infecção fetal em 7% (n=3) e causa desconhecida em 7% (n=3).
A idade gestacional média da primeira TIU foi 26 semanas (mínimo18 semanas e 6 dias, máximo 33 semanas e 2 dias). Na maioria dos fetos foi realizada apenas uma TIU (n=17, 39%), mas em 13 fetos (29%) foram necessárias pelo menos 3 TIU.
A hemoglobina pré-transfusão mínima foi de 1,5g/dL sendo a média de 6,4 g/dL. A quantidade de sangue transfundido variou entre 10 mL e 125 mL. O hematócrito pós transfusão subiu para os valores desejados em 90% dos casos, sendo que o valor médio de hemoglobina pós TIU foi 14g/dL. De referir, que por motivos técnicos, não obtivemos o valor de hemoglobina/hematócrito pós-transfusão em 10 casos. As transfusões foram repetidas até às 34 semanas com um intervalo médio de 2,2 semanas.
Do ponto de vista técnico, a placenta tinha localização posterior em 43% (n=43) das TIU. Realizamos transfusão intravascular na veia umbilical em todos os casos. O local de punção foi maioritariamente a inserção placentar, sendo que em 3 casos a punção foi realizada em ansa livre. Realizamos transfusão combinada (intravascular e intraperitoneal) num caso, no feto que iniciou as transfusões às 18 semanas e 6 dias.
Nove fetos (21%) apresentavam hidrópsia no momento do diagnóstico.
Os valores de hemoglobina pré-transfusional mais baixos verificaram-se no grupo da etiologia infecciosa (Hb média de 2g/dL) onde foi necessária apenas uma TIU por cada feto para reverter o quadro de anemia. Neste grupo não ocorreram casos de mortalidade fetal ou neonatal e todos os partos ocorreram no termo da gravidez sem complicações neonatais.
No grupo com anemia de etiologia desconhecida todas as gestações tiveram desfechos obstétricos graves sendo que se verificaram 2 mortes fetais e uma morte neonatal precoce.
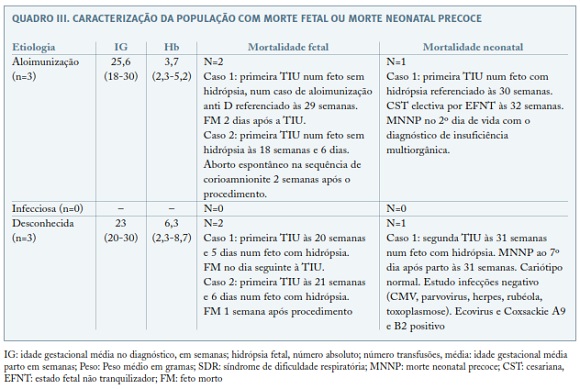
Durante o período avaliado, em 98 TIU ocorreram 3 mortes fetais e um aborto, sendo a sobrevida fetal de 91%. Se associarmos as 2 mortes que ocorrerram no período nenonatal a sobrevida neonatal é de 86% (Quadro III).
Em nenhuma das TIU ocorreu bradicárdia fetal mantida que motivasse a realização de cesariana de emergência.
Ocorreu parto de um nado-vivo em 40 gestações, com idade gestacional média de 34,3 semanas (mínimo 29 semanas e 4 dias, máximo 39 semanas) sendo que a gravidez atingiu as 34 semanas em 68% (n=27) dos casos.
A maioria dos partos ocorreu por cesariana ( N=34, 85%), sendo a principal indicação estado fetal não tranquilizador.
O peso médio dos RN foi de 2446g ( 870-4090). À nascença, a hemoglobina média foi de 11g/dL (7,3-16,2), sendo que foi necessária exsanguíneo-transfusão sanguínea pós-natal imediata em 10 casos (25%).
Não ocorreu nenhum caso de asfixia perinatal e as complicações neonatais foram relacionadas com a prematuridade.
Perdemos o follow-up pós-natal em 5 casos, por o parto ter ocorrido noutra instituição. A avaliação realizada na consulta de desenvolvimento na pediatria, com um follow-up médio de 12 meses revelou um caso de atraso da linguagem e um caso de dificuldade ligeira de motricidade fina, sem outros alterações no neurodesenvolvimento.
Discussão
Na nossa série e, apesar de 43% das placentas terem inserção na parede posterior do útero, factor associado a uma maior dificuldade técnica, em todos os casos foi possível realizar TIU por via intravascular, maioritariamente no topo placentário. Os autores consideram que a rigorosa programação e planeamento da TIU com avaliação ecográfica detalhada é um passo fundamental para o correcto acesso e concretização da TIU. Os autores consideram também, que pode ser útil, em situações em que a punção tenha que ser realizada em ansa livre, se utilize a parede uterina e a ponta da agulha para fixar o cordão umbilical e assim ser mais fácil a estabilização necessária para a TIU. Realizámos apenas uma TIU combinada (intravascular e intraperitoneal) numa situação com idade gestacional precoce (18 semanas e 6 dias), com o objectivo de reduzir a sobrecarga hemodinâmica fetal uma vez que a reabsorção de sangue pela via intraperitoneal ocorre de forma mais lenta permitindo a adaptação hemodinâmica do feto.
Os autores defendem que sempre que possível, a TIU seja realizada via intravascular no topo placentário, pois permite que o procedimento seja mais rápido, com maior estabilidade da agulha, reduzindo os riscos de múltiplas punções, de contaminação bacteriana e trombose/laceração da veia umbilical. Permite também de forma mais precisa calcular o valor a transfundir bem como o valor de hemoglobina e hematócrito finais, permitindo planear de forma mais rigorosa a transfusão seguinte uma vez que a especificidade e sensibilidade do pico sistólico da artéria cerebral média como método de rastreio de anemia fetal grave decaem após a primeira TIU.
A sobrevida fetal foi de 91% e a sobrevida neonatal foi de 86% ( n= 38), uma vez que além das 4 mortes fetais, ocorreram dois casos de morte neonatal precoce, o que está de acordo com o descrito na literatura6,8,9,16.
Na nossa série, nos 9 casos referenciados com hidrópsia fetal a sobrevida neonatal foi de 55%. O mau prognóstico que foi verificado neste grupo parece dever-se à presença de hidrópsia fetal, que é uma factor prognóstico independente para mortalidade fetal, mas os autores pensam que também terá contribuído para o mau prognóstico o facto da anemia fetal ter sido diagnosticada em idades gestacionais muito precoces e consequentemente com pior adaptação hemodinâmica destes fetos à TIU, dados este corroborados pela literatura2,4,16,17. De referir que nos fetos sem hidrópsia a sobrevida global foi de 94%, o que reflete o melhor prognóstico deste grupo.
Na nossa série 7% das anemias são causadas por quadros de infecção fetal. Em todas as situações de infecção fetal, e apesar de no momento do diagnóstico todos os fetos terem hemoglobinas inferiores a 3g/dL, o desfecho destas situações foi excelente, sendo que em todas se realizou apenas 1 TIU que corrigiu a anemia. Todos os partos ocorreram após as 36 semanas e não se verificou qualquer alteração no neurodesenvolvimento destas crianças. Contudo, os autores defendem que a série tem números pequenos em relação a infeção fetal e não se devem retirar conclusões definitivas destes resultados.
De referir, que na nossa série, além dos casos com infecção fetal existiam mais 7 casos de fetos com valores de hemoglobina inferiores a 3 g/dL no momento do diagnóstico. Neste grupo sobreviveram 5 ao período neonatal, sendo que não está descrito nenhuma alteração do neurodesenvolvimento. Estes dados não estão de acordo com a literatura em que a probabilidade de ocorrência de HIV (hemorragia intraventricular) e outras alterações no neurodesenvolvimento é frequente neste grupo de fetos11. Provavelmente o número reduzido de casos presente na nossa série com estas características limita a interpretação dos resultados.
Quanto a outras complicações, não ocorreu na nossa série nenhuma bradicárdia que motivasse cesariana de emergência ou que levasse a morte fetal no momento da TIU. Realçamos o caso de corioamnionite após 3 semanas do procedimento que poderá estar relacionado com o mesmo apesar do período temporal ser grande.
O tratamento da anemia fetal grave não é possível sem o recurso à TIU. Esta é tecnicamente exigente e requer treino para melhorar o prognóstico fetal, uma vez que a mortalidade fetal diminui com a experiência do serviço para efetuar esta terapêutica.
Vários autores demonstraram que a probabilidade de surgirem complicações é maior quando este procedimento é realizado por operadores inexperientes ou de forma irregular. As casuísticas consultadas confirmam uma curva de aprendizagem com um excesso de perdas fetais nos primeiros 100 procedimentos, que pode atingir os 12%8-10. É, por isso, uma técnica que requer bastante treino e que deve ser realizada apenas em locais de referenciação terciária com médicos treinados para este fim, uma vez que tem uma elevada taxa de mortalidade
A TIU é um procedimento seguro e eficaz no tratamento da anemia fetal grave. Os resultados do nosso centro são semelhantes aos descritos por outros centros de medicina fetal, tanto na mortalidade fetal como nos resultados pós-natais, apesar da limitação que o pequeno número de casos coloca.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Rodeck C, Red Cell alloimmunization in Fetal Medicine- In: Basic science and Clinical practice (2nd ed), Rodeck C, Whittle M (eds.),Churchill Livingstone; 2009:
2. Liley A. W., Liley A Intrauterine Transfusion of Foetus in Haemolytic Disease. Br Med J. 1963 Nov 2; 2(5365): 1107-1109. [ Links ]
3. Rodeck CH, Kemp JR, Holman CA, Whitemore DN, Karnicki J, Austin MA, Direct intravascular fetal blood transfusion by fetoscopy in severe Rhesus isoimmunization. Lancet, 1981 Mar 21; 1(8221): 625-627. [ Links ]
4. Mari G, Deter RL, Carpenter RL, Rahman F, Zimmerman R, Moise KJ Jr, et al. Noninvasive diagnosis by Doppler ultrasonography of fetal anemia due to maternal red-cell alloimmunization. Collaborative Group for Doppler assessment of the blood velocity in anemic fetuses.N Engl J Med 2000; 342:9-14. [ Links ]
5. Nicolaides KH, Soothill PW, Rodeck CH, Clewell W. Rh disease: Intravascular fetal blood transfusion by cordocentesis, Fetal Therapy. 1986;1:185-192. [ Links ]
6. Schumacher B, Moise KJ Jr, Fetal transfusion for red cell alloimmunization in pregnancy. Obstet Gynecol 1996;88:137-150. [ Links ]
7. Lindenburg IT, Smits-Wintjens VE, van Klink JM, van Kamp IL, Walther FJ, Schonewille H, et al. Long term neurodevelopmental outcome after intrauterine transfusion for hemolytic disease of the fetus/newborn: the LOTUS study. Am J Obstet Gynecol 2012;206: 141-145. [ Links ]
8. Harman CR, Bowman JM, Manning FA, Menticoglou SM, Intrauterine transfusion- intraperitoneal versus intravascular approach: a case-control comparison. Am J Obstet Gynecol 1990; 162:1053-1059. [ Links ]
9. Sampson AJ, Permezel M, Doyle LW, de Crespigny L, Ngu A, Robinson H. Ultrasound guided fetal intravascular transfusions for severe erythroblastosis 1984-1993. Aust N Z J Obstet Gynaecol 1994;34:125-130. [ Links ]
10. Weiner CP, Wenstrom KD, Sipes SL, Williamson RA. Risk factors for cordocentesis and fetal intravascular transfusion. Am J Obstet Gynecol 1991;165:1020-1025. [ Links ]
11. Linderburg ITM, van Klink JM, Smits-wintjens VE, van Kamp IL, Oepkes D, Lopriore E. Long term neurodevelopmental and cardiovascular outcome after intrauterine transfusions for fetal anemia. Prenat Diagn 2013;33:815-822. [ Links ]
12. Van Kamp IL, Kumper FJ, Oepkes D, Meerman RH, Scerjon SA, Vandenbussche FP, Kanhai HH. Complications of the intrauterina intravascular transfusion for fetal anemia due to maternal red-cell alloimmunization. Am J Obstet Gynecol 2005;192:172. [ Links ]
13. Oepkes D, Adama van Scheltema P. Intrauterine fetal transfusions in the management of fetal anemia and fetal thrombocytopenia. Semin Fetal Neonatal Med 2007; 12: 432-438.
14. Lewis M, Bowman JM, Pollock J, Lowen B, Absorption of red cells from the peritoneal cavity of an hydroptic twin. Transfusion 1973;13:37-40. [ Links ]
15. Westgren M, Selbing A, Stangenberg M, Fetal intracardiac transfusions in patients with severe Rhesus isoimmunization, BR Med J,1988;296:885-886. [ Links ]
16. Surveillance of cerebral palsy in Europe; a collaboration of cerebral palsy surveys and registers. Surveillance of cerebral palsy in Europe (SCPE). Dev Med Child Neurol 2000;42:816-824. [ Links ]
17. Luis Mendes da Graça, Perfil Biofísico do feto in Medicina Materno-fetal (4º Ed.), Luis Mendes da Graça (ed), Lidel, 2010, 269-272.
18. Gebb J, Dar P, Rosner M, Evans MI, Long-term neurologic outcomes after common fetal interventions. Am J Obstet Gynecol 2015;212:527. [ Links ]
Endereço para correspondência | Dirección para correspondencia | Correspondence
Cláudia Rijo
E-mail: claurijo@gmail.com
Recebido em: 29-03-2015
Aceite para publicação: 28-02-2016