Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Acta Obstétrica e Ginecológica Portuguesa
versión impresa ISSN 1646-5830
Acta Obstet Ginecol Port vol.10 no.3 Coimbra set. 2016
RECOMENDAÇÕES DA SOCIEDADE PORTUGUESA DE GINECOLOGIA/RECOMMENDATIONS OF THE PORTUGUESE SOCIETY OF GYNECOLOGY
Endometriose - recomendações de consenso nacionais - tratamento médico
Endometriosis - medical treatment Portuguese consensus recommendation
Grupo de trabalho constituído por Maria João Carvalho1, António Barbosa2, Daniela Couto3, Fernanda Geraldes4, Isabel Vilhena5, José Lourenço Reis6, José Damasceno7, Sofia Figueiredo8, Fernanda Águas9, pela Sociedade Portuguesa de Ginecologia
1. Assistente Hospitalar, Centro Hospitalar e Universitário de Coimbra, Coimbra, Portugal. Assistente Convidada da Faculdade de Medicina da Universidade de Coimbra, Portugal
2. Assistente Hospitalar Graduado, Centro Hospitalar Gaia/Espinho, Portugal
3. Assistente Hospitalar, Centro Hospitalar e Universitário de Coimbra, Coimbra, Portugal
4. Assistente Hospitalar Graduada, Centro Hospitalar e Universitário de Coimbra, Coimbra, Portugal
5. Assistente Hospitalar Graduada do Serviço de Anestesiologia do Centro Hospitalar e Universitário de Coimbra, Coimbra, Portugal
6. Assistente Hospitalar Graduado do Serviço de Ginecologia e Obstetrícia do Hospital Beatriz Ângelo, Loures, Portugal
7. Assistente Hospitalar Graduado, Hospital São Teotónio, Viseu, Portugal
8. Assistente Hospitalar do Serviço de Ginecologia e Obstetrícia da Maternidade Alfredo da Costa, Lisboa, Portugal
9. Assistente Graduada Sénior, Diretora do Serviço de Ginecologia A e B, Centro Hospitalar e Universitário de Coimbra, Coimbra, Portugal
ABSTRACT
Overview and aims: This article summarises the Portuguese endometriosis consensus elaborated in order to adapt to our population the consensus documents published in the literature. Endorsed by the Portuguese Society of Gynaecology, we established recommendations that provide guidance to our medical society to better decision making concerning the assistance of patients with endometriosis, to improve diagnosis and to optimize management. We expose here a short version of the second section of the guidelines, addressing the medical treatment of this disease.
Study design and Methods: The European Society of Human Reproduction and Embryology (ESHRE) guideline for the diagnosis and treatment of endometriosis (2014) was the reference paper for these clinical recommendations in endometriosis. A group of experts in the field performed a thorough systematic search of the publications between January 2012 up to December 2014 and a quality assessment of the included papers. A consensus meeting with all members of the guidelines developing group reached the final version of the recommendations.
Conclusions: The present clinical practice guidelines on endometriosis may improve the medical management in endometriosis-associated pain.
Keywords: endometriosis; evidence based; guidelines
Introdução
Este artigo consiste na revisão e súmula de recomendações elaboradas pelos autores, com o objetivo de adaptar à realidade portuguesa os documentos de consenso publicados na literatura e, produzir e disponibilizar, à nossa sociedade médica, em consonância com a Sociedade Portuguesa de Ginecologia, diretrizes de prática clínica fundamentadas para a tomada das melhores decisões quanto à orientação das doentes com endometriose.
Revemos aqui as orientações relativas ao tratamento médico desta doença.
O tratamento ideal da endometriose não está ainda definido e a investigação existente revela algumas lacunas. Importa referir que os estudos com as terapêuticas clássicas são antigos, com métodos de diagnóstico e imagem mais restritos do que os que atualmente dispomos. Os estudos randomizados com terapêuticas mais recentes são escassos, com amostras reduzidas e com limitações, até porque suscitariam questões éticas desenhar ensaios clínicos com controlo de placebo nesta doença.
A mulher com dor pélvica e suspeita de endometriose pode ser tratada com terapêutica médica empírica mesmo antes que seja estabelecido um diagnóstico definitivo1.
Os implantes endometrióticos comportam-se como o endométrio funcional, daí o recurso a medicamentos que diminuem ou inibem o crescimento do tecido endometrial causando hipomenorreia/amenorreia2. Os medicamentos atualmente utilizados criam um estado de hipoestrogenismo (agonistas da GnRh) ou um clima hiperprogestagénico (estroprogestativos e progestativos).
Todos estes tratamentos são supressivos e não curativos pelo que a recorrência da doença é a regra depois da sua descontinuação2. A terapêutica médica da endometriose deve ser encarada como um tratamento de longa duração tal como qualquer outro utilizado em doenças inflamatórias crónicas. Os analgésicos podem ser utilizados no tratamento da dor, isoladamente ou em associação a um tratamento hormonal3.
Material e métodos
Estas recomendações foram obtidas após uma análise e avaliação rigorosa das evidências científicas disponíveis e, após discussão e uma tomada de consenso dos autores, tendo por base as orientações da European Society of Human Reproduction and Embryology (ESHRE).
Foi usada como alicerce de trabalho o documento guidelines para o diagnóstico e tratamento em endometriose da ESHRE (2014)4, realizada uma pesquisa da literatura de artigos relevantes publicados até Dezembro de 2014 usando os termos: endometriosis, medical treatment, hormonal contraception, progestin, estroprogestin, GnRh agonists, analgesics, systematic review, case controlled study, cohort study.
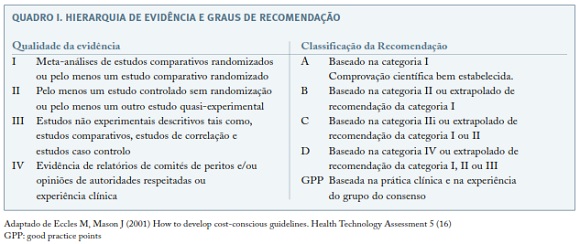
Foram na ausência de revisões sistemáticas ou estudos caso-controlo ou de coorte, valorizadas séries de casos ou casos clínicos relevantes, em função da hierarquia de evidência e graus de robustez da recomendação7 (Quadro I).
Tratamento médico
tratamento hormonal
Estroprogestativos
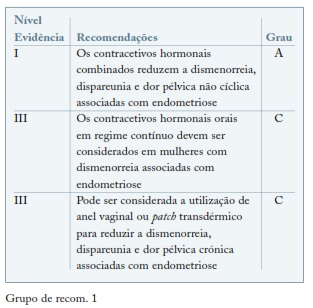
Os estroprogestativos são habitualmente a primeira linha para o tratamento da dor associada com endometriose5,6. Os estroprogestativos, pelo seu efeito anti-gonadotrófico, reduzem a produção de estradiol e aumentam a decidualização condicionando a atrofia dos implantes endometrióticos. A dose de etinilestradiol utilizada nos contracetivos hormonais combinados (CHC) atualmente disponíveis não é suficiente para atingir o limiar de ativação da doença7.
Existem poucos ensaios clínicos randomizados que avaliem a sua eficácia no tratamento da endometriose e que os comparem com outros tratamentos médicos. Não há evidência inequívoca quanto ao regime ideal de administração, cíclico ou contínuo. A COC administrada de forma contínua, sem o período de pausa, foi considerada como mais benéfica para alívio de dor pélvica associada com endometriose. (ver Grupo de recom. 1)
Progestativos
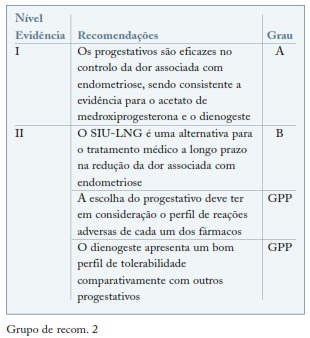
O efeito anti-mitótico dos progestativos induz a decidualização do endométrio eutópico bem como do endométrio em localização ectópica com a consequente atrofia das lesões de endometriose8,9. As indicações terapêuticas dos progestativos englobam o controlo da dor, a redução do tamanho das lesões e a diminuição das recorrências pós-cirúrgicas10. O dienogeste é o progestativo mais estudado no contexto de endometriose. Combina as vantagens dos derivados da nortestosterona com os benefícios dos derivados da progesterona11-14.
Os progestativos orais e as fórmulas depot são equivalentes aos agonistas da GnRH e à CHC no alívio da dor associada a endometriose. O sistema intrauterino com levonorgestrel (SIU-LNG) surge como uma alternativa eficaz no tratamento médico da endometriose. A eficácia do implante contracetivo com etonogestrel no controlo das queixas de endometriose foi comprovada mas o padrão irregular da hemorragia, limita a sua utilização como opção na abordagem farmacológica da endometriose15. (ver Grupo de recom. 2)
Agonistas da GnRH
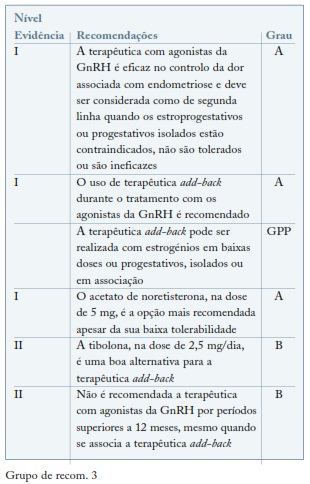
Os agonistas da GnRH são uma das terapêuticas aprovadas para tratamento da endometriose16. O mecanismo de ação destes fármacos exerce-se na ligação contínua e não pulsátil aos recetores da GnRH provocando assim a dessensibilização hipofisária e a interrupção do eixo hipófise/ovário levando a um estado hormonal de hipogonadismo hipogonadotrófico17. O hipoestrogenismo condiciona atrofia endometrial levando a amenorreia secundária e a uma ação direta local nos implantes de endometriose18-20.
As limitações desta terapêutica são por um lado uma taxa de recorrência elevada (50%) após 6 meses de interrupção deste tratamento e os efeitos associados ao hipoestrogenismo simulando uma menopausa tais como a perda de densidade mineral óssea, sintomatologia vasomotora, atrofia urogenital, diminuição da líbido, depressão e alteração do lipidograma21-23.
A terapêutica com agonistas da GnRH é considerada de segunda linha quando os estroprogestativos falham, não são tolerados ou são contraindicados8,9,22.
A terapêutica hormonal add-back tem como objetivo aumentar a adesão ao tratamento e possibilitar o uso mais prolongado dos agonistas da GnRH, nas mulheres com endometriose. A prescrição de tratamento hormonal para normalizar os níveis de estrogénios tem como objetivo reduzir os efeitos adversos - perda de massa óssea e sintomatologia vasomotora - sem interferir na eficácia17,24.
Embora as guidelines recomendem o uso de terapêuticas de add-back, esta prescrição ocorre apenas num terço destas mulheres25. Têm sido utilizados diferentes regimes, hormonais e não hormonais, incluindo o uso de progestativos e estrogénios isolados, estroprogestativos e a tibolona26,27. (ver Grupo de recom. 3)
Inibidores da aromatase
Os inibidores da aromatase constituem um grupo farmacológico que atua por inibição ou inativação da aromatase, enzima que catalisa a conversão de androgénios em estrogénios. Vários estudos sugerem que a aromatase P450 está sobre-expressa tanto no endométrio eutópico como nos implantes endometrióides em mulheres com endometriose28-32.
Na pré́-menopausa, os estudos revelam pouca eficácia dos inibidores da aromatase devido ao aumento da secreção de gonadotrofinas, por feedback negativo do hipoestrogenismo por eles induzido ao nível do hipotálamo e da hipófise, resultando na estimulação ovárica e aumento dos níveis de estradiol de origem ovárica. Consequentemente, o uso de inibidores da aromatase no tratamento da endometriose deverá ocorrer em associação com outros tratamentos com ação antigonadotrófica, como os estroprogestivos, os progestativos e/ou os agonistas da GnRH, para que seja bloqueada a produção ovárica e extra-ovárica de estrogénios5,33-35. (ver Grupo de recom. 4)
Antagonistas da progesterona e Moduladores seletivos dos recetores de progesterona
Os moduladores seletivos dos recetores de progesterona (MSRP) são substâncias sintéticas derivadas dos esteroides, que têm a capacidade de se ligar aos recetores da progesterona, podendo desempenhar atividade agonista, antagonista ou mista consoante o tecido em que atuem36.
Os MSRP inibem a ovulação e muitas mulheres tornam-se amenorreicas, mantendo no entanto níveis fisiológicos de estrogénios circulantes. O racional para uso dos MSRP na endometriose reside na inibição seletiva da proliferação endometrial e na potencial supressão da produção de prostaglandinas pelo tecido endometrial, mantendo os níveis de estrogénios circulantes. A interrupção da ovulação é em parte responsável pela amenorreia, mas há concomitantemente alterações únicas a nível endometrial, designadas como progesterone receptor modulator associated endometrial changes (PAEC).
À data apenas a mifepristona e o acetato de ulipristal estão aprovados para uso clínico para outras indicações, ainda que outros fármacos estejam em fase avançada de investigação. (ver Considerações)
Outras terapêuticas
A terapêutica médica mais usada na endometriose passa presentemente pelos contracetivos hormonais e pelos agonistas GnRH cuja eficácia está estabelecida.
As novas áreas de investigação incidem sobretudo na resposta inflamatória, resposta hormonal, na sobrevivência, proliferação e invasão celulares e na neoangiogénese37. As estatinas, pelo seu papel de inibição da proliferação celular, são vistas com potencial interesse mas ainda estão em fase de estudo de investigação pré-clínica38. Os agentes de desmetilação e os inibidores da desacetilase das histonas (HDACI), podem interferir nos processos de silenciamento genético reativando genes, antes inativados por hipermetilação dos promotores (ex. gene do recetor da progesterona). Os RCT com inibidor da COX-2 versus placebo, revelaram melhor controlo da dor no grupo tratado39. A pentoxifilina utilizada durante 6 meses em pós-operatório quando comparada com placebo revelou melhoria significativa da dor40
A terapêutica com imunomoduladores é uma outra possibilidade ainda em investigação. Num RCT com interferon alfa-2b intra-peritoneal versus solução salina verificou-se menor taxa de recorrência pós-operatória aos 12 meses41. A injeção intra-quística de IL-12 em mulheres com endometriomas tratadas com agonistas da GnRH revelou menor taxa de recorrência42. O infliximab, anti-fator de necrose tumoral (TNF, do inglês tumoral necrosis factor) durante três meses melhorou a dor e o volume dos nódulos endometrióticos e a sensibilidade pélvica comparando com placebo43.
Um fármaco seletivo, com efeito somente no endométrio ectópico, ainda não está disponível. Portanto, de momento, fica-nos a manipulação hormonal como a principal forma de estabilizar o crescimento das lesões e frenar a progressão da doença3.
Situações especiais
Infertilidade
A endometriose está presente em 10 a 22% das mulheres férteis e em 20-25% da população feminina infértil. Por outro lado, 30 a 50% das mulheres com endometriose têm infertilidade4,44.
Será a terapêutica médica hormonal eficaz no tratamento da infertilidade associada à endometriose?
Esta questão foi exaustivamente analisada numa revisão da Cochrane45. A supressão ovárica efetuada com agonistas da GnRH ou com estroprogestativos não é eficaz quando utilizada para tentar melhorar a fertilidade associada a endometriose mínima. Um estudo randomizado controlado em doentes com endometriose moderada/grave, com agonistas da GnRh após tratamento por laparoscopia, não mostrou superioridade em relação à atitude expectante no que diz respeito a taxas de conceção natural, durante um período de follow-up de 5 anos46.
A terapêutica médica tem interesse previamente à inseminação intrauterina nas mulheres com infertilidade associada endometriose?
A terapêutica médica prévia à inseminação intrauterina (IIU), nomeadamente com agonistas da GnRh, não está recomendada, uma vez que não há estudos que demonstrem qualquer benefício47.
Quais são as implicações da endometriose nas taxas de sucesso das TRA?
A única revisão sistemática sobre o tema conclui que as taxas de gravidez no sub-grupo de mulheres com endometriose no estadio I/II não são diferentes das obtidas no grupo de mulheres com fator tubário. Já para o grupo de mulheres com endometriose no estadio III/IV a taxa de gravidez é significativamente inferior48. Não parece haver diferença nas taxas de gravidez obtidas com protocolo com antagonistas da GnRH ou agonistas da GnRH nas mulheres com endometriose mínima/ligeira e endometriomas49.
A estimulação ovárica controlada agrava a endometriose?
A evidência disponível não sugere um agravamento da doença após estimulação ovárica para fertilização in vitro (FIV) / injeção intracitoplasmática (ICSI, do inglês intracytoplasmic sperm injection)50-53.
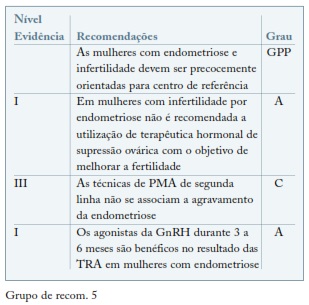
Recomenda-se a realização de procriação medicamente assistida (PMA) nas mulheres com infertilidade e endometriose, sobretudo nas situações associadas a fator masculino, tubário ou no caso de insucesso de outras terapêuticas.
Será a terapêutica adjuvante às TRA útil no tratamento da infertilidade associada à endometriose?
A terapêutica melhor estudada é a utilização de agonistas da GnRH e foi alvo de uma revisão da Cochrane que incluiu 3 artigos47,54,55. A dessensibilização hipofisária com agonistas da GnRH durante 3 a 6 meses em mulheres com endometriose aumenta a probabilidade de gravidez clínica cerca de 4 vezes56. A terapêutica com estroprogestativos tem sido também utilizada, não existindo evidência que suporte esta opção terapêutica. Tem sido proposto que o efeito benéfico dos agonistas da GnRh resulta da melhoria na recetividade endometrial ou da melhoria da qualidade ovocitária/embrionária57. Os efeitos anti-proliferativos e pró-apoptóticos dos agonistas da GnRH podem ter efeito benéfico nas taxas de gravidez após transferência de embriões congelados58-60. (ver Grupo de recom. 5)
Tratamento hormonal da pós-menopausa na mulher com endometriose
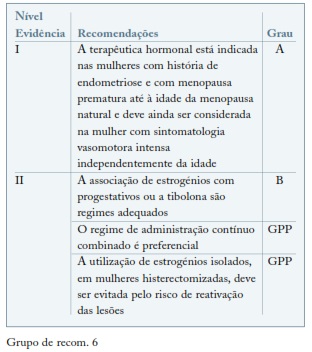
A endometriose é uma doença estrogénio dependente e como tal atinge a mulher jovem em idade reprodutora. Depois da menopausa o crescimento dos implantes endometrióticos é suprimido em resultado da redução da produção de estrogénios pelo ovário e verifica-se uma melhoria dos sintomas. Cerca de 96,9% das mulheres com endometriose deixam de ter dores na menopausa.
A terapêutica hormonal pós-menopausa na mulher com história de endometriose pode reativar a doença e a sintomatologia a ela inerente. Há ainda a considerar o potencial de transformação maligna das lesões de endometriose após a menopausa, espontaneamente ou associado ao uso de terapêutica hormonal61.
Por outro lado a mulher com história de endometriose pode ter um risco aumentado de doenças associadas à privação de estrogénios fruto do uso de algumas terapêuticas médicas como os agonistas da GnRh ou de uma falência ovárica precoce devido a sucessivas cirurgias ou mesmo de uma menopausa cirúrgica precoce, terapêutica que por vezes é adotada quando falham todas as estratégias para controlo da doença.
O uso de estrogénios em baixas doses associados a progestativos ou a tibolona, são as alternativas terapêuticas mais seguras tanto em mulheres histerectomizadas como naquelas que conservam o útero62,63.
Não há estudos que analisem com rigor qual o melhor regime terapêutico mas o conhecimento dos efeitos da associação estrogénio com progestativos em administração contínua combinada deverá fazer com que este seja o regime preferencialmente recomendado4,64.
A tibolona tem sido amplamente utilizada na endometriose como terapêutica de add-back no uso de análogos da GnRh e é considerada uma hipótese eficaz e segura no tratamento hormonal da mulher com história de endometriose4,64. (ver Grupo de recom. 6)
Terapêutica médica nas adolescentes com endometriose
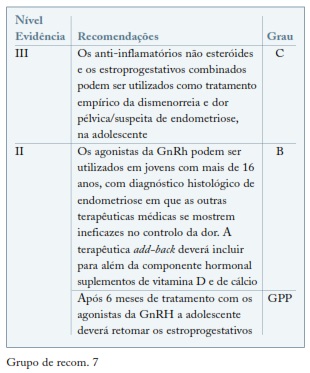
A endometriose é uma hipótese de diagnóstico que deve ser considerada nas adolescentes com dor pélvica crónica e nas das adolescentes com dismenorreia ou dor pélvica resistente à toma de estroprogestativos ou anti-inflamatórios não esteróides65-67. Na adolescência existe uma associação entre endometriose e anomalias congénitas do aparelho genital, 11% das adolescentes com endometriose apresentam anomalias mullerianas e 76% de adolescentes com anomalias obstrutivas têm endometriose68,69. O tratamento empírico com estroprogestativos ou anti-inflamatórios não esteroides (AINE) durante 3 ciclos poderá ser a abordagem inicial. Os agonistas da GnRh podem ser utilizados em jovens com mais de 16 anos resistentes a outras terapêuticas e com o diagnóstico histológico de endometriose obtido após laparoscopia. Não é aceitável que antes dos 18 anos se utilize um tratamento empírico com agonistas da GnRh68-70. Deve ser sempre associada terapêutica de add-back, incluindo cálcio e vitamina D e monitorizada a densidade mineral óssea através de densitometria70. Este regime pode ser utilizado por períodos de 3 a 6 meses seguido de estroprogestativos em administração contínua ou de ciclo longo. O tratamento médico deverá também ser utilizado após a cirurgia até à idade em a maternidade seja desejada71,72. Progestativos orais ou em implantes subcutâneos ou SIU-LNG, podem ser uma alternativa aos estroprogestativos; contudo os seus efeitos ainda não estão bem estudados nas adolescentes69. (ver Grupo de recom. 7)
Tratamento médico pré-cirurgia
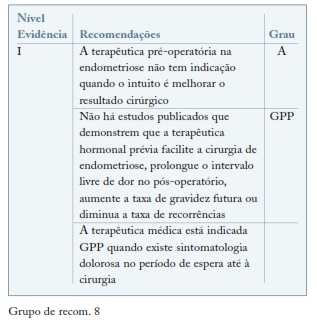
A endometriose é uma patologia crónica, que requer uma abordagem a longo prazo. Neste contexto é relevante a otimização da terapêutica médica, evitando procedimentos cirúrgicos repetidos. É comum, na prática clínica, a prescrição de terapêutica hormonal pré-operatória, nomeadamente agonistas GnRh com o intuito de facilitar o procedimento cirúrgico, assumindo que a terapêutica médica possa diminuir a inflamação, vascularização e aderências das lesões de endometriose. A revisão da Cochrane faz referência a 2 estudos em mulheres em idade reprodutora, que abordam o tema da terapêutica médica pré-cirúrgica, concluiu que não existe evidência de benefício na terapêutica médica pré-operatória73. (ver Grupo de recom. 8)
Tratamento médico pós-cirurgia
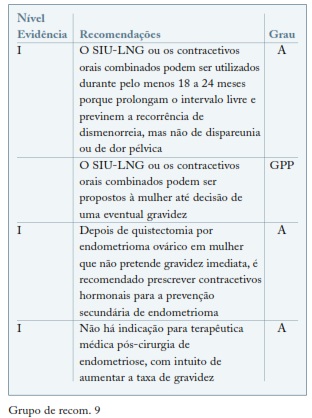
A cirurgia não afeta o mecanismo patogénico da endometriose, pelo que os sintomas e recorrência das lesões são frequentes (40-50% a cinco anos) quando não é instituída terapêutica pós-operatória74 em particular a recorrência dos endometriomas é de 10% ao ano nos primeiros três anos após a cirurgia75. A terapêutica médica hormonal, após cirurgia de endometriose, pode ser considerada para prevenção da recorrência de dor (dismenorreia, dispareunia e dor pélvica não relacionada com a menstruação) e/ou prevenção de recorrência da doença (recorrência de endometriomas e/ou outras lesões de endometriose).
A terapêutica hormonal adjuvante pós-operatória pode ser considerada no regime de curta duração (inferior a 6 meses), em que o objetivo é melhorar o resultado cirúrgico e a longo termo (superior a 6 meses), cujo objetivo é a prevenção secundária das lesões e sintomatologia associada75,76.
No que respeita à influência do tratamento pós-cirurgia na fertilidade, não foi encontrada evidência que suporte o uso de terapêutica médica no pós-operatório com o intuito de aumentar a taxa de gravidez77,78. (ver Grupo de recom. 9)
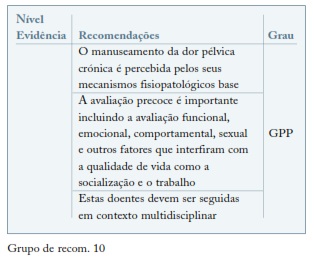
Tratamento da dor crónica
A Sociedade Internacional de Dor Pélvica define-a como dor cíclica ou não cíclica com duração superior a 6 meses, localizada à pélvis, ao abdómen infra umbilical ou região lombar suficientemente grave para causar incapacidade funcional ou psicológica e requerendo intervenção e tratamento. A nível fisiopatológico é uma dor complexa envolvendo os 3 mecanismos da dor: somático, visceral e neuropático79.
Estudos atuais sustentam que a endometriose gera um estado inflamatório com produção de citocinas, fatores de crescimento, recrutamento de macrófagos e outras células inflamatórias com ativação de toda a cascata inflamatória80.
Alguns estudos comprovaram não haver relação entre a extensão da lesão e a doença, mas sim a sua localização e profundidade81.Está também comprovado a existência de maior densidade de nociceptores nos tecidos afetados por endometriose, nomeadamente próximo das glândulas endometriais e vasos sanguíneos80.
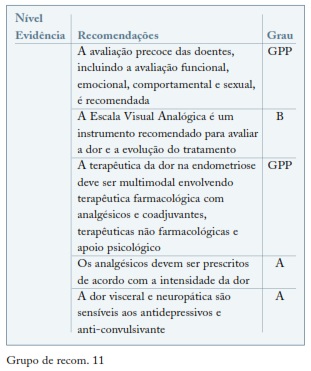
A dor na endometriose é referida mais frequentemente por dismenorreia, dispareunia profunda e dor pélvica crónica não menstrual82. Estudos baseados na avaliação da dor na endometriose recomendam a utilização da Escala Visual Analógica (EVA) para avaliar a intensidade da dor. É também importante o registo diário da dor, distinguindo a dismenorreia da dor pélvica82. A abordagem terapêutica deverá ser multidisciplinar e personalizada, combinando terapêuticas farmacológicas com terapias não farmacológicas e psicoterapia83.
Os fármacos utilizados no tratamento da dor pertencem aos seguintes grupos: analgésicos não opióides (primeira opção terapêutica na dor ligeira, EVA 1-3); analgésicos opióides (dor moderada, EVA 4-6); opióides fortes (dor severa, EVA 7-10), a sua utilização deverá ser reservada a unidades de dor. Podem ser utilizados concomitantemente fármacos com acção co-adjuvante tais como os anti-depressivos e os anti-convulsivantes. (ver Grupo de recom. 10)
Não existem estudos que permitam tirar conclusões relativamente à aplicação dos diferentes fármacos utilizados para a terapêutica da dor na situação específica da dor crónica associada com a endometriose. Os algoritmos propostos são baseados em investigações feitas para a terapêutica da dor em geral e em opiniões de peritos. (ver Grupo de recom. 11)
Conclusões
Este artigo fornece recomendações sobre as diversas terapêuticas médicas na endometriose nomeadamente estroprogestativos, progestativos e agonistas da GnRH. Os estroprogestativo e progestativos devem ser considerados de primeira linha para o controlo da dor associada com a endometriose. Esta revisão enquadra ainda o tratamento médico em situações especiais como infertilidade, endometriose na adolescência, terapêutica hormonal da pós-menopausa e integração pré e pós-operatória. Salienta-se a necessidade de estudos que fortaleçam a evidência na abordagem das diversas terapêuticas e seus contextos clínicos.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Bulletins-Gynecology AC on P. ACOG practice bulletin. Medical management of endometriosis. Number 11, December 1999 (replaces Technical Bulletin Number 184, September 1993). Clinical management guidelines for obstetrician-gynecologists. Int. J. Gynaecol. Obstet. 2000;71:183-196. [ Links ]
2. Bruner-Tran KL, Herington JL, Duleba AJ, Taylor HS, Osteen KG. Medical management of endometriosis: Emerging evidence linking inflammation to disease pathophysiology. Minerva Ginecol. 2013. p. 199-213.
3. Vercellini P, Crosignani P, Somigliana E, Vigan P, Frattaruolo MP, Fedele L. ’Waiting for Godot: A commonsense approach to the medical treatment of endometriosis. Hum. Reprod. 2011;26: 3-13. [ Links ]
4. Dunselman G a J, Vermeulen N, Becker C, Calhaz-Jorge C, D’Hooghe T, De Bie B, et al. ESHRE guideline: management of women with endometriosis. Hum. Reprod. 2014;29:400-412.
5. Streuli I, de Ziegler D, Santulli P, Marcellin L, Borghese B, Batteux F, et al. An update on the pharmacological management of endometriosis. Expert Opin. Pharmacother. 2013;14:291-305.
6. Falcone T, Lebovic DI. Clinical management of endometriosis. Obstet. Gynecol. 2011;118:691-705. [ Links ]
7. Johnson NP, Hummelshoj L. Consensus on current management of endometriosis. Hum. Reprod. 2013;28:1552-1568. [ Links ]
8. Kappou D, Matalliotakis M, Matalliotakis I. Medical treatments for endometriosis. Minerva Ginecol. 2010. p. 415-432.
9. Ruhland B, Agic A, Krampe J, Diedrich K, Hornung D. Innovations in conservative endometriosis treatment: An updated review. Minerva Ginecol. 2011. p. 247-249.
10. Soares SR, Martínez-Varea A, Hidalgo-Mora JJ, Pellicer A. Pharmacologic therapies in endometriosis: a systematic review. Fertil. Steril. 2012;98:529-555. [ Links ]
11. Harada T, Taniguchi F. Dienogest: a new therapeutic agent for the treatment of endometriosis. Womens. Health (Lond. Engl). 2010;6:27-35. [ Links ]
12. Sasagawa S, Shimizu Y, Imada K, Mizuguchi K. Pharmacological and clinical profile of dienogest (DINAGEST Tab. 1 mg). Nippon yakurigaku zasshi. Folia Pharmacol. Jpn. 2009;133:32-40. [ Links ]
13. Foster RH, Wilde MI. Dienogest. Drugs. 1998;56:825-33; discussion 834-835. [ Links ]
14. Sasagawa S, Shimizu Y, Kami H, Takeuchi T, Mita S, Imada K, et al. Dienogest is a selective progesterone receptor agonist in transactivation analysis with potent oral endometrial activity due to its efficient pharmacokinetic profile. Steroids. 2008;73:222-231. [ Links ]
15. Walch K, Unfried G, Huber J, Kurz C, van Trotsenburg M, Pernicka E, et al. Implanon versus medroxyprogesterone acetate: effects on pain scores in patients with symptomatic endometriosis—a pilot study. Contraception. 2009;79:29-34.
16. Brown J, Pan A, Hart RJ. Gonadotrophin-releasing hormone analogues for pain associated with endometriosis. Cochrane Database Syst. Rev. 2010;CD008475.
17. Surrey ES. Gonadotropin-releasing hormone agonist and add-back therapy: what do the data show? Curr. Opin. Obstet. Gynecol. 2010;22:283-288. [ Links ]
18. Practice T, Medicine R. Treatment of pelvic pain associated with endometriosis: A committee opinion. Fertil. Steril. American Society for Reproductive Medicine; 2014;101:927-935.
19. Giudice LC. Clinical practice. Endometriosis. N. Engl. J. Med. 2010;362:2389-2398. [ Links ]
20. Kang AR, Young J. Medical therapy of endometriosis. J. Korean Med. Assoc. 2010;53:424-429. [ Links ]
21. Crosignani PG, Luciano A, Ray A, Bergqvist A. Subcutaneous depot medroxyprogesterone acetate versus leuprolide acetate in the treatment of endometriosis-associated pain. Hum. Reprod. 2006;21:248-256. [ Links ]
22. Vercellini P, Somigliana E, Viganò P, Abbiati A, Barbara G, Crosignani PG. Endometriosis: Current therapies and new pharmacological developments. Drugs. 2009. p. 649-675.
23. Somigliana E, Vigano P, Barbara G, Vercellini P. Treatment of endometriosis-related pain: options and outcomes. Front. Biosci. (Elite Ed). 2009;1:455-465. [ Links ]
24. Wu D, Hu M, Hong L, Hong S, Ding W, Min J, et al. Clinical efficacy of add-back therapy in treatment of endometriosis: a meta-analysis. Arch. Gynecol. Obstet. 2014;290:513-523. [ Links ]
25. Fuldeore MJ, Marx SE, Chwalisz K, Smeeding JE, Brook RA. Add-back therapy use and its impact on LA persistence in patients with endometriosis. Curr. Med. Res. Opin. 2010;26: 729-736. [ Links ]
26. Agorastos T, Vaitsi V, Paschopoulos M, Vakiani A, Zournatzi-Koiou V, Saravelos H, et al. Prolonged use of gonadotropin-releasing hormone agonist and tibolone as add-back therapy for the treatment of endometrial hyperplasia. Maturitas. 2004;48:125-32. [ Links ]
27. Surrey ES. The role of progestins in treating the pain of endometriosis. J. Minim. Invasive Gynecol. 2006. p. 528-534.
28. Rocha ALL, Reis FM, Petraglia F. New trends for the medical treatment of endometriosis. Expert Opin. Investig. Drugs. 2012. p. 905-919.
29. Kitawaki J, Kusuki I, Koshiba H, Tsukamoto K, Fushiki S, Honjo H. Detection of aromatase cytochrome P-450 in endometrial biopsy specimens as a diagnostic test for endometriosis. Fertil. Steril. 1999;72:1100-1106. [ Links ]
30. Wölfler MM, Nagele F, Kolbus A, Seidl S, Schneider B, Huber JC, et al. A predictive model for endometriosis. Hum. Reprod. 2005;20:1702-1708. [ Links ]
31. Velasco I, Rueda J, Acién P. Aromatase expression in endometriotic tissues and cell cultures of patients with endometriosis. Mol. Hum. Reprod. 2006;12:377-381. [ Links ]
32. Ferrero S, Gillott DJ, Venturini PL, Remorgida V. Use of aromatase inhibitors to treat endometriosis-related pain symptoms: a systematic review. Reprod. Biol. Endocrinol. 2011;9:89. [ Links ]
33. Chawla SCS. Treatment of endometriosis and chronic pelvic pain with letrozole and norethindrone acetate. Med. J. Armed Forces India. 2010;66:213-215. [ Links ]
34. Ferrero S, Camerini G, Seracchioli R, Ragni N, Venturini PL, Remorgida V. Letrozole combined with norethisterone acetate compared with norethisterone acetate alone in the treatment of pain symptoms caused by endometriosis. Hum. Reprod. 2009;24:3033-3041. [ Links ]
35. Pavone ME, Bulun SE. Aromatase inhibitors for the treatment of endometriosis. Fertil. Steril. Elsevier Inc.; 2012;98:1370-9.
36. Merviel P, Lourdel E, Sanguin S, Gagneur O, Cabry R, Nasreddine a. Intérêt actuel des selective progesterone receptor modulators (SPRM) dans l’endométriose. Gynécologie Obs. Fertil. 2013;41:524-528. [ Links ]
37. Vercellini P, Viganò P, Somigliana E, Fedele L. Endometriosis: pathogenesis and treatment. Nat. Rev. Endocrinol. Nature Publishing Group; 2014;10:261-275. [ Links ]
38. Piotrowski PC, Kwintkiewicz J, Rzepczynska IJ, Seval Y, Cakmak H, Arici A, et al. Statins inhibit growth of human endometrial stromal cells independently of cholesterol availability. Biol. Reprod. 2006;75:107-111. [ Links ]
39. Cobellis L, Razzi S, De Simone S, Sartini A, Fava A, Danero S, et al. The treatment with a COX-2 specific inhibitor is effective in the management of pain related to endometriosis. Eur. J. Obstet. Gynecol. Reprod. Biol. 2004;116:100-102. [ Links ]
40. Kamencic H, Thiel JA. Pentoxifylline After Conservative Surgery for Endometriosis: A Randomized, Controlled Trial. J. Minim. Invasive Gynecol. 2008;15:62-66. [ Links ]
41. Acién P, Quereda F, Campos A, Gomez-Torres MJ, Velasco I, Gutierrez M. Use of intraperitoneal interferon α-2b therapy after conservative surgery for endometriosis and postoperative medical treatment with depot gonadotropin-releasing hormone analog: A randomized clinical trial. Fertil. Steril. 2002. p. 705-711.
42. Acién P, Quereda FJ, Gómez-Torres MJ, Bermejo R, Gutierrez M. GnRH analogues, transvaginal ultrasound-guided drainage and intracystic injection of recombinant interleukin-2 in the treatment of endometriosis. Gynecol. Obstet. Invest. 2003;55: 96-104. [ Links ]
43. Koninckx PR, Craessaerts M, Timmerman D, Cornillie F, Kennedy S. Anti-TNF-alpha treatment for deep endometriosis-associated pain: a randomized placebo-controlled trial. Hum. Reprod. 2008;23:2017-2023. [ Links ]
44. Allaire C. Endometriosis and infertility: a review. J. Reprod. Med. 2006;51:164-168. [ Links ]
45. Hughes E, Brown J, Collins JJ, Farquhar C, Fedorkow DM, Vandekerckhove P. Ovulation suppression for endometriosis. Cochrane Database Syst. Rev. 2007.
46. Loverro G, Carriero C, Rossi AC, Putignano G, Nicolardi V, Selvaggi L. A randomized study comparing triptorelin or expectant management following conservative laparoscopic surgery for symptomatic stage III-IV endometriosis. Eur. J. Obstet. Gynecol. Reprod. Biol. 2008;136:194-198. [ Links ]
47. Rickes D, Nickel I, Kropf S, Kleinstein J. Increased pregnancy rates after ultralong postoperative therapy with gonadotropin-releasing hormone analogs in patients with endometriosis. Fertil. Steril. 2002. p. 757-762.
48. Barnhart K, Dunsmoor-Su R CC. The effect of endometriosis on in vitro fertilization outcome. Fertil Steril. 2002;77: 1148-1155. [ Links ]
49. Pabuccu R, Onalan G, Kaya C. GnRH agonist and antagonist protocols for stage??I-II endometriosis and endometrioma in in vitro fertilization/intracytoplasmic sperm injection cycles. Fertil. Steril. 2007;88:832-839. [ Links ]
50. Benaglia L, Somigliana E, Santi G, Scarduelli C, Ragni G, Fedele L. IVF and endometriosis-related symptom progression: Insights from a prospective study. Hum. Reprod. 2011;26: 2368-2272. [ Links ]
51. Benaglia L, Somigliana E, Vercellini P, Benedetti F, Iemmello R, Vighi V, et al. The impact of IVF procedures on endometriosis recurrence. Eur. J. Obstet. Gynecol. Reprod. Biol. 2010;148:49-52. [ Links ]
52. Coccia ME, Rizzello F, Gianfranco S. Does controlled ovarian hyperstimulation in women with a history of endometriosis influence recurrence rate? J. Womens. Health (Larchmt). 2010;19:2063-2069.
53. D’Hooghe TM, Denys B, Spiessens C, Meuleman C, Debrock S. Is the endometriosis recurrence rate increased after ovarian hyperstimulation? Fertil. Steril. 2006;86:283-290. [ Links ]
54. Dicker D, Goldman JA, Levy T, Feldberg D, Ashkenazi J. The impact of long-term gonadotropin-releasing hormone analogue treatment on preclinical abortions in patients with severe endometriosis undergoing in vitro fertilization-embryo transfer. Fertil. Steril. 1992.
55. Surrey ES, Silverberg KM, Surrey MW, Schoolcraft WB. Effect of prolonged gonadotropin-releasing hormone agonist therapy on the outcome of in vitro fertilization-embryo transfer in patients with endometriosis. Fertil. Steril. 2002. p. 699-704.
56. Sallam HN, Garcia-Velasco JA, Dias S, Arici A. Long-term pituitary down-regulation before in vitro fertilization (IVF) for women with endometriosis. Cochrane Database Syst. Rev. 2006;CD004635.
57. Van Der Houwen LEE, Mijatovic V, Leemhuis E, Schats R, Heymans MW, Lambalk CB, et al. Efficacy and safety of IVF/ICSI in patients with severe endometriosis after long-term pituitary down-regulation. Reprod. Biomed. Online. 2014;28: 39-46.
58. Morimoto C, Osuga Y, Yano T, Takemura Y, Harada M, Hirata T, et al. GnRH II as a possible cytostatic regulator in the development of endometriosis. Hum. Reprod. 2005;20:3212-3218. [ Links ]
59. Limonta P, Moretti RM, Marelli MM, Motta M. The biology of gonadotropin hormone-releasing hormone: Role in the control of tumor growth and progression in humans. Front. Neuroendocrinol. 2003. p. 279-295.
60. Khan KN, Kitajima M, Hiraki K, Fujishita A, Nakashima M, Ishimaru T, et al. Cell proliferation effect of GnRH agonist on pathological lesions of women with endometriosis, adenomyosis and uterine myoma. Hum. Reprod. 2010;25:2878-2890. [ Links ]
61. Soliman NF, Hillard TC. Hormone replacement therapy in women with past history of endometriosis. Climacteric. 2006;9: 325-335. [ Links ]
62. Rattanachaiyanont M, Angsuwatthana S, Inthawiwat S, Tanmahasamut P, Techatraisak K, Leerasiri P. Hormonal replacement therapy in surgical menopause with underlying endometriosis. J. Med. Assoc. Thail. 2003;86:702-707. [ Links ]
63. Al Kadri H, Hassan S, Al-Fozan HM, Hajeer A. Hormone therapy for endometriosis and surgical menopause. Cochrane Database Syst. Rev. 2009;
64. Moen MH, Rees M, Brincat M, Erel T, Gambacciani M, Lambrinoudaki I, et al. EMAS position statement: Managing the menopause in women with a past history of endometriosis. Maturitas. Elsevier Ireland Ltd; 2010;67:94-97.
65. Laufer MR. Helping “Adult gynecologists” Diagnose and treat adolescent endometriosis: Reflections on my 20 years of personal experience. J. Pediatr. Adolesc. Gynecol. Elsevier; 2011;24:S13-17. [ Links ]
66. Steenberg CK, Tanbo TG, Qvigstad E. Endometriosis in adolescence: Predictive markers and management. Acta Obstet. Gynecol. Scand. 2013;92:491-495. [ Links ]
67. Janssen EB, Rijkers a CM, Hoppenbrouwers K, Meuleman C, D’Hooghe TM. Prevalence of endometriosis diagnosed by laparoscopy in adolescents with dysmenorrhea or chronic pelvic pain: a systematic review. Hum. Reprod. Update. 2013;19:570-582. [ Links ]
68. Propst AM, Laufer MR. Endometriosis in adolescents. Incidence, diagnosis and treatment. J. Reprod. Med. 1999;44: 751-758. [ Links ]
69. ACOG. ACOG Committee Opinion. Number 310, April 2005. Endometriosis in adolescents. Obstet. Gynecol. 2005;105: 921-927.
70. DiVasta AD, Laufer MR. The use of gonadotropin releasing hormone analogues in adolescent and young patients with endometriosis. Curr. Opin. Obstet. Gynecol. 2013;25:287-292. [ Links ]
71. Doyle JO, Missmer SA, Laufer MR. The Effect of Combined Surgical-Medical Intervention on the Progression of Endometriosis in an Adolescent and Young Adult Population. J. Pediatr. Adolesc. Gynecol. 2009;22:257-263. [ Links ]
72. Smorgick N, As-Sanie S, Marsh C a., Smith YR, Quint EH. Advanced Stage Endometriosis in Adolescents and Young Women. J. Pediatr. Adolesc. Gynecol. Elsevier; 2014;27:320-323.
73. Furness S, Yap C, Farquhar C, Cheong Ying C. Pre and post-operative medical therapy for endometriosis surgery. Cochrane Database Syst. Rev. 2004;3-5.
74. Guo SW. Recurrence of endometriosis and its control. Hum. Reprod. Update. 2009;15:441-461. [ Links ]
75. Vercellini P, Somigliana E, Vigan P, De Matteis S, Barbara G, Fedele L. Post-operative endometriosis recurrence: A plea for prevention based on pathogenetic, epidemiological and clinical evidence. Reprod. Biomed. Online. 2010;21:259-265. [ Links ]
76. Seracchioli R, Mabrouk M, Manuzzi L, Vicenzi C, Frasc C, Elmakky a., et al. Post-operative use of oral contraceptive pills for prevention of anatomical relapse or symptom-recurrence after conservative surgery for endometriosis. Hum. Reprod. 2009;24: 2729-2735. [ Links ]
77. Lu D, Song H, Li Y, Clarke J, Shi G. Pentoxifylline for endometriosis. Cochrane Database Syst. Rev. 2012;
78. Brown J, Farquhar C. Endometriosis: an overview of Cochrane Reviews. Cochrane database Syst. Rev. 2014;3:CD009590. [ Links ]
79. Lopes JC. Fisiologia da dor. Portugal P, editor. Portugal; 2003.
80. Morotti M, Vincent K, Brawn J, Zondervan KT, Becker CM. Peripheral changes in endometriosis-associated pain. Hum. Reprod. Update. 2014;20:717-736. [ Links ]
81. The Practice Committee of the American Society for Reproductive Medicine. Treatment of pelvic pain associated with endometriosis: A committee opinion. Fertil. Steril. American Society for Reproductive Medicine; 2014;101:927-935.
82. Bourdel N, Alves J, Pickering G, Ramilo I, Roman H, Canis M. Systematic review of endometriosis pain assessment: how to choose a scale? Hum. Reprod. Update. 2014;21:136-152. [ Links ]
83. Green IC, Cohen SL, Finkenzeller D, Christo PJ. Interventional therapies for controlling pelvic pain: What is the evidence? Curr. Pain Headache Rep. 2010;14:22-32. [ Links ]