Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Acta Obstétrica e Ginecológica Portuguesa
versão impressa ISSN 1646-5830
Acta Obstet Ginecol Port vol.11 no.1 Coimbra mar. 2017
ESTUDO ORIGINAL/ORIGINAL STUDY
Associação entre o rastreio bioquímico de aneuploidias do primeiro trimestre e desfechos obstétricos adversos
Association between biochemical screening for fetal aneuploidy in the first trimester and adverse obstetric outcomes
Alexandra Miranda*, Cátia Azevedo**, Alexandra Cadilhe***, Isabel Reis****
Hospital de Braga
* Interna do Internato de Formação Específica em Ginecologia e Obstetrícica, Hospital de Braga
** Interna do Ano Comum, Hospital de Braga
***Assistente Hospitalar Graduada de Ginecologia e Obstetrícia, Coordenadora da Unidade de Diagnóstico Pré Natal e Medicina Materno-Fetal, Hospital de Braga
****Chefe de Serviço, Diretora do Serviço de Ginecologia e Obstetrícia do Hospital de Braga
As autoras Alexandra Miranda e Cátia Azevedo, contribuiram de igual forma para a elaboração do presente artigo.
Endereço para correspondência | Dirección para correspondencia | Correspondence
ABSTRACT
Overview: The first trimester screening for fetal aneuploidy includes a combined evaluation of maternal age, obstetric history, ultrasound and biochemical markers. Variations in maternal serum levels of biochemical markers (free b-hCG and PAPP-A) have been associated with adverse obstetric outcomes, even in the absence of aneuploidy. This study aimed to evaluate the association of PAPP-A and free b-hCG with the occurrence of adverse obstetric outcomes, in an obstetric population with negative first trimester screening for chromosomal abnormalities.
Study design: Observational, descriptive, analytic and retrospective study that included 1128 pregnancies with a negative first trimester screening, in 2013. Delivery occurred in our Hospital.
Methods: The levels of both biochemical markers (free b-hCG and PAPP-A) were compared between groups with a given adverse obstetric outcome and women without any adverse event. Binary logistic regression and multiple linear regression analysis were performed to determine if free b-hCG and PAPP-A were important predictors for adverse outcomes.
Results: Maternal serum levels of PAPP-A were significantly lower in women who developed pre-eclampsia compared to women without any adverse obstetric outcome (0.98±0.2 vs. 1.18±0.63 MoM; p=0.027). Maternal serum free b-hCG was significantly lower in pregnant women who had birth before 37 weeks of gestation, compared to pregnant women with a term birth (median; interquartile range: 0.78; 0.39 vs.0.94; 0.75 MoM; p=0.037). Linear regression analysis showed that PAPP-A is an independent predictor of fetal birth weight and that free b- hCG is a predictor of fetal gestational age at birth.
Conclusion: Serum PAPP-A and free â-hCG in the first trimester are significantly reduced in pregnancies, with a negative first trimester combined screening for fetal aneuploidy, who developed pre-eclampsia and had a preterm delivery, respectively. In these populations, for a better risk assessment, we suggest to perform pre-eclampsia and preterm labour screening.
Keywords: First trimester screening; Pregnancy-associated placental protein A (PAPP-A); Free b-human chorionic gonadotropin (free b-hCG); Pre-eclampsia; Preterm delivery.
Introdução
O primeiro rastreio pré-natal para a deteção de malformações congénitas foi implementado, há mais de 30 anos, com a pesquisa da alfa-fetoproteína, na perspetiva de selecionar uma população obstétrica com risco aumentado para defeitos abertos do tubo neural (DATN)1. Desde então, múltiplos marcadores, tanto bioquímicos como ecográficos, têm sido implementados na prática clínica1. No que concerne ao rastreio combinado de aneuploidias do primeiro trimestre, encontra-se bem estabelecido que a avaliação combinada da idade materna, antecedentes obstétricos, marcadores ecográficos (translucência da nuca (TN) fetal, presença de ossos próprios do nariz, regurgitação da válvula tricúspide e índice de pulsatilidade do ductus venosus) e marcadores bioquímicos (subunidade beta livre da gonadotrofina coriónica humana (b-hCG livre) e proteína A plasmática associada à gravidez (PAPP-A)) é, atualmente, o método de eleição para despiste das aneuploidias mais frequentes 2-4. Recentemente, o doseamento do fator de crescimento placentar (PlGF) também demonstrou ter impacto na performance global do rastreio combinado de aneuploidias, bem como no rastreio pré-natal de pré-eclâmpsia (PE), embora a disponibilidade para o seu doseamento ainda não seja generalizada 5,6.
A b-hCG livre, produzida pelo sinciciotrofoblasto, é a principal hormona responsável pela manutenção do corpo lúteo até à implantação da placenta7. A PAPP-A, também sintetizada pelo sinciciotrofoblasto, é uma protease da proteína de ligação do Insulin-like growth factor e, por este motivo, tem um papel na regulação do crescimento do trofoblasto, através do controlo do uptake de glucose e aminoácidos8. Sabe-se, no entanto, que o valor obtido destes dois marcadores bioquímicos é influenciado por vários fatores, pelo que os seus níveis séricos são apresentados em múltiplos da mediana (MoM), permitindo o ajuste para as variáveis de confundimento9. Frequentemente, perante uma cromossomopatia, estes marcadores encontram-se alterados, desviando-se de 1 MoM. A título de exemplo, na trissomia 21 o valor de PAPP-A aproxima-se de 0,5 MoM e a b-hCG livre de 2 MoM4. Na trissomia 18 e 13, ambos os marcadores encontram-se, geralmente, diminuídos6,10.
Níveis séricos maternos de b-hCG livre e PAPP-A têm sido associados a desfechos obstétricos adversos, mesmo na ausência de aneuploidias. A probabilidade de ocorrência de um desfecho adverso aumenta à medida que os valores de determinado marcador se tornam mais extremos e o número de marcadores anormais aumenta 1, 11-13. Entre os desfechos adversos já descritos na literatura, destacam-se o parto pré-termo (PPT), a PE e a restrição de crescimento fetal (RCF).
O PPT constitui a principal causa de morbilidade e mortalidade perinatal nos países desenvolvidos1. A estratificação do risco de PPT, com base na história obstétrica e no comprimento do colo uterino, permite identificar apenas um terço dos casos. Têm sido, no entanto, descritos estudos que associam níveis diminuídos de PAPP-A, no primeiro trimestre, a um PPT, particularmente antes das 32 semanas de gestação) 11,14-17. Constituindo a PAPP-A uma proteína de produção placentar, níveis diminuídos deste marcador foram, igualmente, associados a insuficiência placentar e a fetos pequenos para a idade gestacional 2,11.A relação deste desfecho obstétrico adverso com níveis séricos diminuídos de b-hCG livre não está comprovada 18.
Níveis séricos maternos de PAPP-A e de PlGF, em associação com os antecedentes médicos e obstétricos da gestante, o índice de pulsatilidade da artéria uterina e a pressão arterial média estão a ser, atualmente, combinados no primeiro trimestre da gravidez, num algoritmo de cálculo de risco de desenvolvimento de PE, com uma taxa de deteção de 95% 19-24. Se apenas for tida em consideração a história clínica da grávida (por exemplo, nuliparidade e antecedentes de PE), a taxa de deteção é de apenas 30%25.
A associação entre PE e o valor de b-hCG livre é menos consensual. Segundo alguns autores, níveis baixos de b-hCG livre poderão estar relacionados com complicações hipertensivas na gravidez, no entanto, os mesmos achados não foram encontrados noutros trabalhos 1,11,26,27. Paralelamente, níveis de b-hCG livre abaixo do percentil 5 (0,41 MoM), parecem relacionar-se com morte fetal antes das 20 semanas de gestação11. Não obstante, apesar das múltiplas associações com significância estatística entre marcadores séricos maternos de aneuploidias e desfechos obstétricos adversos, a sensibilidade e valor preditivo positivo destes marcadores, isoladamente, permanece insatisfatória para serem utilizados na atividade clínica como testes de rastreio2,11,26. Não existe, atualmente, uma prática uniformemente aceite para o seguimento de grávidas com marcadores séricos maternos anormais, no que concerne à estratificação de risco de desenvolvimento de complicações obstétricas.
O presente estudo pretendeu avaliar a associação dos valores séricos maternos de PAPP-A e b-hCG livre, numa população obstétrica com rastreio pré-natal combinado de cromossomopatias do primeiro trimestre de baixo risco, com a ocorrência de desfechos obstétricos adversos.
Métodos
O presente trabalho de investigação foi submetido e aprovado pelas Comissões de Ética locais, tendo-se procedido a um estudo observacional, transversal, retrospetivo e analítico. A recolha de dados foi realizada mediante a consulta dos processos clínicos das grávidas e respetivos recém-nascidos, nos programas informáticos Astraia Database® e Glintt - Soluções Clínicas®.
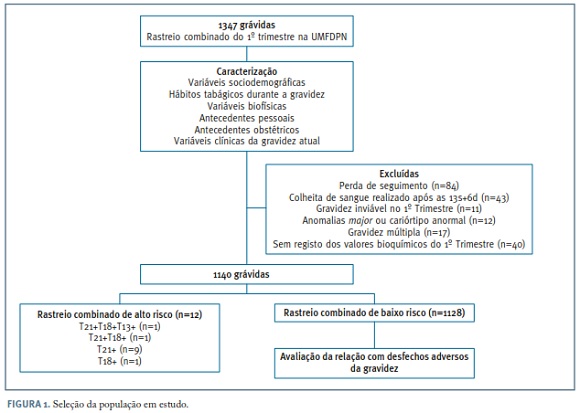
De todas as grávidas submetidas a rastreio combinado do primeiro trimestre na Unidade de Medicina Fetal e Diagnóstico Pré Natal (UMFDPN), no ano de 2013 (n=1347), apenas foram incluídas neste estudo as que tiveram o parto na nossa instituição. Foram excluídas da análise as pacientes perdidas no seguimento (n=84), cuja colheita de sangue para rastreio bioquímico foi realizada após as 13 semanas e 6 dias (n=43), que apresentaram uma gravidez inviável do primeiro trimestre (n=11), cujos fetos apresentaram anomalias major detetadas ecograficamente ou cariótipo anormal (n=12) e mulheres com gravidez múltipla (n=17). Também foram excluídas mulheres que não apresentaram registo dos valores bioquímicos do primeiro trimestre (n=40). Os níveis de PAPP-A e b-hCG livre foram avaliados por um laboratório certificado pela Fetal Medicine Foundation (FMF), sendo que esses níveis fo-ram, posteriormente, ajustados para a idade gestacional, peso materno, paridade, etnia, tabagismo, presença de diabetes mellitus (DM) prévia à gravidez e método de conceção. O risco para anomalias cromossómicas, obtido através do rastreio combinado de primeiro trimestre, foi calculado, por operadores certificados pela FMF, de acordo com as recomendações da mesma fundação e da UK National Screening Program, tendo sido considerado um limiar de 1:100 para a definição de rastreio combinado de alto risco para trissomia 21 e 1:50 para as trissomias 18 e 1328. As grávidas que apresentaram um rastreio combinado do primeiro trimestre de alto risco (n=12), mesmo na ausência de alterações cromossómicas, foram excluídas da análise, restando 1128 gestações com rastreio combinado de aneuploidias do primeiro trimestre de baixo risco (Figura 1).
Todos os dados foram colhidos e armazenados de forma anónima, tendo-se atribuído a cada processo clínico analisado, no momento da inclusão no estudo, um código único.
Para avaliar a distribuição normal das variáveis quantitativas, obteve-se o valor absoluto da assimetria e curtose29. A normalidade não foi assumida para b-hCG livre (MoM) em 2 grupos de desfechos obstétricos adversos, sendo que, nesses casos, os resultados foram apresentados em mediana e intervalo interquartil (IIQ) e a comparação dessa variável, nesses grupos, realizada através do teste Mann-Whitney U. As restantes variáveis quantitativas foram comparadas com recurso ao teste t-student. Para quantificar a importância das diferenças verificadas, calculou-se o d de Cohen (teste t-student) e o r de Cohen (teste Mann-Whitney U) para as variáveis quantitativas e o phi para variáveis qualitativas como uma medida de dimensão do efeito30.
Para determinar se os valores bioquímicos do primeiro trimestre são preditores importantes de desfechos obstétricos adversos foi realizada uma regressão logística binária 31. Quando a variável dependente era quantitativa realizou-se a análise através de uma regressão linear múltipla.
A análise estatística foi realizada com recurso ao programa Statistical Package for the Social Science (SPSS®), versão 22, e foi estabelecido um nível de significância estatística para valor p <0,05.
Resultados
Caracterização da amostra
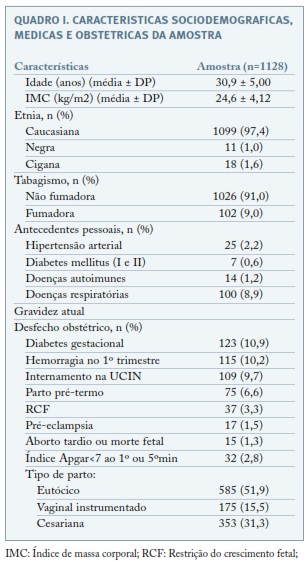
A amostra final compreendeu 1128 grávidas com rastreio combinado de aneuploidias do primeiro trimestre de baixo risco. As características sociodemográficas, médicas e obstétricas da amostra em estudo estão apresentadas no Quadro I.
A média das idades maternas foi de 30,9±5,0 anos, com idades compreendidas entre os 14 e 46 anos. Relativamente aos desfechos obstétricos adversos na gravidez atual, a diabetes gestacional (DG) foi a patologia mais prevalente (10,9%), seguida da hemorragia do primeiro trimestre (10,2%), RCF (3,3%) e PE (1,5%). Quanto ao desfecho da gravidez, 6,6% apresentaram um PPT (51 dos quais iatrogénicos e 24 PPT espontâneos), 1,3% das grávidas teve um aborto tardio ou morte fetal e 9,7% dos recém-nascidos necessitaram de ser internados na unidade de cuidados intensivos neonatais (UCIN), 10,9% apresentavam um peso ao nascimento inferior ao percentil 10 e 2,8% um índice de Apgar inferior a 7, ao primeiro ou quinto minutos de vida. Nenhum dos recém-nascidos incluídos na análises apresentou malformações major à nascença ou reuniu critérios para determinação do cariótipo no período pós-natal precoce.
Marcadores bioquímicos e desfechos obstétricos adversos
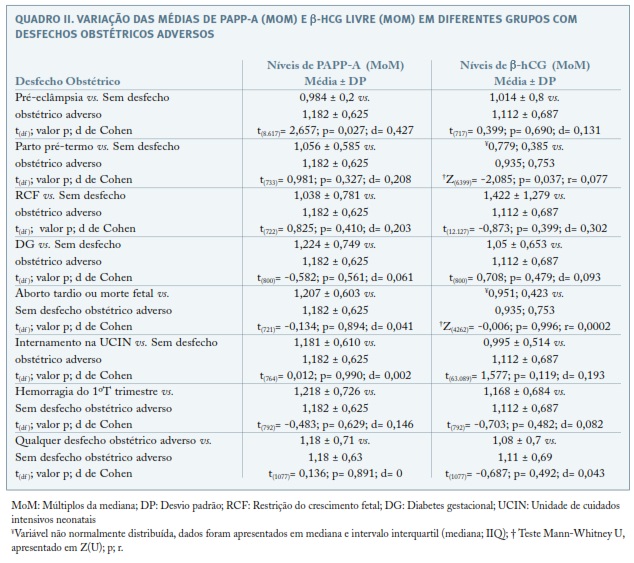
Os valores dos marcadores bioquímicos foram comparados entre os grupos com um desfecho obstétrico adverso específico e o grupo que não apresentou qualquer desfecho adverso durante a gravidez, como apresentado no Quadro II. O grupo de participantes que desenvolveu PE apresentou valores médios de PAPP-A de 0,984±0,2 MoM, que foi estatisticamente diferente e inferior à apresentada pelo grupo de grávidas que teve uma gravidez sem quaisquer desfechos obstétricos adversos; t(8.617)=2,657; p=0,027; d=0,427. Não foram observadas diferenças significativas entre os valores de b-hCG livre, no mesmo grupo de desfecho adverso. Também se verificou uma diferença estatisticamente significativa entre as medianas e IIQ dos valores de b-hCG livre no grupo que teve um PPT espontâneo (U=6399; z=-2,085; p=0,037; r=0,077), sendo que a mediana do marcador das grávidas que desenvolveram o desfecho adverso é mais baixa. Essa diferença não se verificou para os níveis de PAPP-A. No que diz respeito aos restantes desfechos adversos, não se observaram diferenças estatisticamente significativas nas médias dos marcadores bioquímicos entre os grupos em análise.
(clique para ampliar ! click to enlarge)
Preditores de desfechos obstétricos adversos
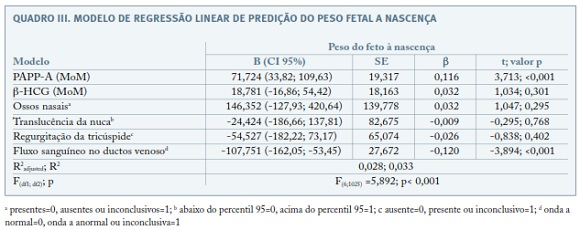
Foram testados modelos de regressão linear múltipla, ajustados para os fatores de confundimento major, com os marcadores bioquímicos do primeiro trimestre como variáveis independentes para predizer desfechos obstétricos, variável dependente. O Quadro III representa o resultado do modelo de regressão linear múltipla para predição do peso fetal à nascença. Os valores bioquímicos do primeiro trimestre, PAPP-A e b-hCG livre, ossos nasais, TN, ductus venosus e regurgitação da válvula tricúspide foram usados como variáveis independentes, resultando num modelo preditivo significativo para o peso do feto à nascença (valor p<0,001). O valor em MoM da PAPP-A (p<0,001) e o fluxo sanguíneo no ductus venosus (valor p<0,001) foram preditores significativos. No entanto, apenas 2,8% (R2adjusted=0,028) da variabilidade encontrada para o peso do feto à nascença é explicada por estes fatores.
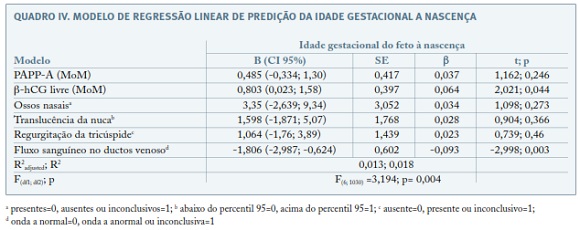
As mesmas variáveis independentes foram utilizadas para a criação do modelo de regressão linear múltipla para predizer a idade gestacional à nascença (Quadro IV), que se mostrou igualmente estatisticamente significativo (valor p=0,004) mas explica apenas 1,3% (R2adjusted=0,013) da variância da idade gestacional do feto à nascença. A b-hCG livre e o fluxo sanguíneo no ductus venosus foram preditores significativos (valor p=0,044 e valor p=0,003, respetivamente).
Para avaliar se os marcadores bioquímicos do primeiro trimestre também eram preditivos de outros desfechos obstétricos adversos (hemorragia no 1º trimestre, DG, peso fetal à nascença inferior ao percentil 10, internamento na UCIN), foram realizadas regressões logísticas binárias, controladas para os mesmos fatores de confundimento supracitados. No entanto, nenhum modelo foi preditivo para os desfechos obstétricos avaliados.
Discussão
Num novo paradigma do Diagnóstico Pré-Natal, o valor potencial de uma abordagem integrada às 11-13 semanas de gestação, que englobe as características e antecedentes maternos e o resultado de uma série de marcadores bioquímicos e ecográficos, tem sido extensivamente documentado, podendo estes algoritmos atribuir um risco específico às grávidas para um largo espectro de complicações obstétricas 32. No entanto, de acordo com algumas recomendações, gravidezes com níveis baixos isolados de PAPP-A (<0,3 MoMs) devem ser vigiadas atentamente devido ao risco de ocorrência RCF, PPT ou morte fetal. Especificamente, a FMF recomenda, na presença de níveis baixos de PAPP-A, uma avaliação seletiva do crescimento entre as 28 e 32 semanas, adicionalmente à vigilância pré-natal de rotina33.
No presente estudo, na avaliação da associação dos valores séricos maternos de PAPP-A e b-hCG livre com a ocorrência desfechos obstétricos adversos, foi observada uma diferença significativa no valor das MoM’s da b-hCG livre no grupo de grávidas que teve um PPT espontâneo, sendo os níveis de b-hCG livre mais baixos neste grupo, comparativamente ao grupo de grávidas cujo parto ocorreu após as 37 semanas de gestação (mediana; intervalo interquartil: 0,78; 0,39 vs. 0,94; 0,75 MoM; p=0,037). Esta relação é corroborada pelo modelo de regressão linear, no qual a b-hCG livre mostrou ser um fator preditivo da idade gestacional ao nascimento. Este achado não foi, até à data, relatado na literatura, tendo sido encontrada, apenas, a descrição da ausência de relação entre a b-hCG livre e a ocorrência de PPT 11,34,35. Relativamente ao PPT, existem ainda relatos da sua associação com baixos níveis de PAPP-A, achado não encontrado na nossa análise14,35.
Concomitantemente, o presente estudo confirma alguns resultados de trabalhos prévios que descrevem a associação entre baixos níveis de PAPP-A, no primeiro trimestre, e o aumento do risco para o desenvolvimento de PE2,12,14,36. Adicionalmente, à semelhança de estudos anteriores, este desfecho obstétrico não foi associado a baixos níveis de b-hCG livre 14,26,37.
Existem, igualmente, referências na literatura à relação entre níveis de PAPP-A diminuídos e peso à nascença inferior ao percentil 10 para a idade gestacional14,26,34,38. Neste estudo, verificou-se que níveis baixos de PAPP-A se relacionam com menor peso fetal à nascença, apesar do primeiro não parecer ser um preditor direto para RCF, possivelmente pela limitação do número amostral.
À semelhança de achados previamente relatados, não se observaram variações significativas dos níveis séricos dos marcadores bioquímicos em gravidezes que desenvolveram DG 34,39.
A PE afeta cerca de 2% das gravidezes e representa uma causa major de morbi-mortalidade materna e perinatal. Um algoritmo de rastreio de PE que inclui a avaliação fluxométrica por doppler pulsado da artéria uterina, a medição da pressão arterial média materna e os valores de PAPP-A e PlGF, determinados entre as 11 semanas e 13 semanas e 6 dias, em combinação com as características maternas, permite uma taxa de deteção de cerca de 95% para PE precoce (requerendo parto antes das 34 semanas), com uma taxa de falsos positivos de 10,9% 40-43.Se tivermos em consideração exclusivamente os níveis séricos maternos de PAPP-A, a taxa de deteção de PE será de apenas 57%, com uma taxa de falsos positivos estimada em 11,3%44. Atualmente, na nossa UMFDPN, não dispomos do doseamento dos níveis séricos maternos de PlGF e, por falta de recursos humanos, não é exequível realizar a medição do índice de pulsatilidade da artéria uterina a todas as grávidas. Assim, sugerimos, de acordo com os resultados encontrados neste estudo, disponibilizar, pelo menos às grávidas com desvio isolado de PAPP-A, a avaliação da fluxometria da artéria uterina no primeiro trimestre que, juntamente com os antecedentes maternos, os níveis de PAPP-A e a medição da pressão arterial média materna permitem uma taxa de detecção de PE precoce de aproximadamente 93,9%44. A importância da avaliação do risco de PE de início precoce relaciona-se com o facto da incidência desta condição poder ser potencialmente reduzida com a administração profilática de aspirina em baixa dose, se iniciada antes das 16 semanas de gestação45,46.
O risco de restrição de crescimento fetal, que afeta 5% das gestações, tem sido estimado com uma taxa de deteção de cerca de 55%, recorrendo a um modelo que combina a história materna, índice de pulsatilidade da artéria uterina, tensão arterial média e o valor de PAPP-A no primeiro trimestre44. No entanto, à semelhança do rastreio de PE, também por escassez de recursos humanos, o rastreio de RCF ainda não é disponibilizado, sistematicamente, à população obstétrica da nossa UMFDPN. Considerando a relação encontrada, neste estudo, entre níveis de PAPP-A e o peso fetal à nascença sugerimos, nas grávidas com desvios dos níveis de PAPP-A no primeiro trimestre, a realização do rastreio de RCF de modo a aumentar a taxa de detecção desta complicação obstétrica. Nas grávidas com alto risco de RCF, a avaliação seletiva do crescimento fetal pelas 28 semanas, permite detetar mais precocemente e orientar em consonância, eventuais RCF.
O presente estudo foi o primeiro a fazer uma avaliação da predição dos marcadores bioquímicos do rastreio de aneuploidias do primeiro trimestre para desfechos obstétricos adversos numa população de grávidas portuguesas. Não obstante, e apesar de uma amostra de dimensão notável para a população da área de abrangência da nossa instituição, a principal limitação apontada relaciona-se com a baixa prevalência dos diversos desfechos adversos, que se traduziu num número amostral reduzido para cada desfecho isoladamente, não se tendo conseguido, destarte, identificar um algoritmo que inclua as características bioquímicas e ecográficas do primeiro trimestre, com sensibilidade e especificidade clinicamente úteis. Ainda assim, a maioria dos resultados é corroborada por estudos com poder estatístico elevado, o que reforça os nossos achados. É desejável, no entanto, replicar esta análise em amostras de maiores dimensões, de forma a termos dados mais robustos e reprodutíveis para a nossa população. Uma outra limitação que pode ser apontada, relaciona-se com o facto de se tratar de um estudo retrospetivo e, por este motivo, apesar de existirem normas de orientação para o diagnóstico dos diferentes desfechos obstétricos adversos, nomeadamente PE e RCF, existe alguma variabilidade clínica no seu diagnóstico, que seria minimizada num estudo prospetivo com homogeneização dos critérios de inclusão.
Conclusão
No presente estudo, observámos que os marcadores bioquímicos do primeiro trimestre podem estar alterados em gravidezes que desenvolvem PE ou que resultam em RCF ou PPT. Contudo, estes produtos feto-placentares não se mostraram úteis para serem utilizados, individualmente, como ferramenta de rastreio de complicações obstétricas. Porém, valores bioquímicos anormais isolados, em mulheres com rastreio combinado do primeiro trimestre de baixo risco, podem motivar a realização de rastreios obstétricos complementares, nomeadamente de PE, PPT e RCF, atualmente não disponíveis, por rotina, à nossa população obstétrica geral.
Futuramente, devem ser determinados pontos de corte preditores de maus desfechos, para cada marcador bioquímico, e realizados ensaios sobre a eficácia de estratégias preventivas em mulheres com alterações nesses mesmos marcadores.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Krantz D, Hallahan T, Janik D et al. Maternal Serum Screening Markers and Adverse Outcome: A New Perspective. J Clin Med. 2014;3(3):693-712. [ Links ]
2. D’Antonio F, Rijo C, Thilaganathan B et al. Association between first-trimester maternal serum pregnancy-associated plasma protein-a and obstetric complications. Prenat Diagn. 2013;33(9): 839-847. [ Links ]
3. Walsh J. Fetal Aneuploidy Detection by Maternal Plasma DNA Sequencing: a technology assessment. Prenat Diagn. 2013; 33, 514-520. [ Links ]
4. Nicolaides KH. Screening for fetal aneuploidies at 11 to 13 weeks. Prenat Diagn. 2011;31:7-15. [ Links ]
5. Pandya P, Wright D, Syngelaki A et al., Maternal serum placental growth factor in prospective screening for aneuploidies at 8-13 weeks’ gestation. Fetal Diagn Ther. 2012;31:87-93. [ Links ]
6. Wright D, Syngelaki A, Bradbury I et al., First-trimester screening for trisomies 21, 18 and 13 by ultrasound and biochemical testing. Fetal Diagn Ther. 2014;35(2):118-126. [ Links ]
7. Yaron Y, Ochshorn Y, Heifetz S et al. First trimester maternal serum free human chorionic gonadotropin as a predictor of adverse pregnancy outcome. Fetal Diagn Ther. 2002;17:352-356. [ Links ]
8. Lawrence JB, Oxvig C, Overgraard MT et al. The insulin-like growth factor (IGF)-dependent IGF binding protein-4 protease secreted by human fibroblasts is pregnancy-associated plasma protein-A. Proc Natl Acad Sci. 1999;96:3149-3153. [ Links ]
9. Kagan K, Wright D, Baker A et al. Screening for trisomy 21 by maternal age, fetal nuchal translucency thickness, free beta-human chorionic gonadotropin and pregnancy associated plasma protein- A. Ultrasound Obs Gynecol. 2008;31:618-624. [ Links ]
10. Shiefa S, Amargandhi M, Bhupendra J et al. First Trimester Maternal Serum Screening Using Biochemical Markers PAPP-A and Free b-hCG for Down Syndrome, Patau Syndrome and Edward Syndrome. Indian J Clin Biochem. 2013;28(1):3-12. [ Links ]
11. Dugoff L. First- and Second-Trimester Maternal Serum Markers for Aneuploidy and Adverse Obstetric Outcomes. Soc Matern Med. 2010;1052-1061. [ Links ]
12. Audibert F, Boucoiran I, An N, et al. Screening for pre-eclampsia using first-trimester serum markers and uterine artery Doppler in nulliparous women. Am J Obstet Gynecol. Elsevier Inc.; 2010; 203(4):383.e1-383.e8. [ Links ]
13. Poon LCY, Syngelaki A, Akolekar R et al. Combined screening for preeclampsia and small for gestational age at 11-13 weeks. Fetal Diagn Ther. 2013;33(1):16-27. [ Links ]
14. Dugoff L, Hobbins JC, Malone FD et al. First-trimester maternal serum PAPP-A and free-beta subunit human chorionic gonadotropin concentrations and nuchal translucency are associated with obstetric complications: a population-based screening study (The FASTER Trial). Am J Obstet Gynecol. 2004;1991: 1446-1451. [ Links ]
15. Spencer K, Cowans NJ, Kagan K et al. First-trimester ultrasound and biochemical markers of aneuploidy and the prediction of preterm or early preterm delivery. Ultrasound Obs Gynecol. 2008;31:147-152. [ Links ]
16. Stout MJ, Goetzinger KR, Tuuli MG. First trimester serum analytes, maternal characteristics and ultrasound markers to predict pregnancies at risk for preterm birth. Placenta. 2013;34:14-19. [ Links ]
17. Goetzinger KR, Cahill AG, Kemna J. First-trimester prediction of preterm birth using ADAM12, PAPP-A, uterine artery Doppler, and maternal characteristics. Prenat Diagn. 2012; 32:1002-1007. [ Links ]
18. Smith GC, Stenhouse EJ, Crossley JA et al. Early pregnancy levels of pregnancy-associated plasma protein a and the risk of intrauterine growth restriction, premature birth, preeclampsia, and stillbirth. J Clin Endocrinol Metab. 2002;87:1762-1766. [ Links ]
19. Poon L, Maiz N, Valencia C. First-trimester maternal serum pregnancy-associated plasma protein-A and pre-eclampsia. Ultrasound Obs Gynecol. 2009;33:23-33. [ Links ]
20. Pilalis A, Souka A, Antsaklis P et al. Screening for pre-eclampsia and fetal growth restriction by uterine artery Doppler and PAPP-A at 11-14 weeks’ gestation. Ultrasound Obs Gynecol. 2007;29:135-140. [ Links ]
21. Poon LC, Kametas NA, Maiz N et al. First-trimester prediction of hypertensive disorders in pregnancy. Hypertension. 2009;53:812-818. [ Links ]
22. Wright D, Akolekar R, Syngelaki A. A competing risks model in early screening for preeclampsia. Fetal Diagn Ther. 2012;32(171):178. [ Links ]
23. Akolekar R, Syngelaki A, Poon L. Competing risks model in early screening for preeclampsia by biophysical and biochemical markers. Fetal Diagn Ther. 2013;33:8-15. [ Links ]
24. Poon LC, Nicolaides KH. First-trimester maternal factors and biomarker screening for preeclampsia. Prenat Diagn. 2014;34: 618-627. [ Links ]
25. Yu CK, Smith GC, Papageorghiou A et al. An integrated model for the prediction of pre-eclampsia using maternal factors and uterine artery Doppler velocimetry in unselected low-risk women. J Obs Gynecol. 2006;195:300. [ Links ]
26. Canini S, Prefumo F, Pastorino D et al. Association between birth weight and first-trimester free beta-human chorionic gonadotropin and pregnancy-associated plasma protein A. Fertil Steril. 2008;89(1):174-178. [ Links ]
27. Lai J, Pinas A. Maternal Serum Placental Growth Factor, Pregnancy-Associated Plasma Protein-A and Free -Human Chorionic Gonadotrophin at 30-33 Weeks in the Prediction of Pre-Eclampsia. Fetal Diagn Ther. 2013;33:164-172. [ Links ]
28. The First Trimester Screening module 2012 algorithm (Internet). The Fetal Medicine Foundation. Obtido de: http://documents.mx/documents/03-guide-for-the-first-trimester-screening-module.html
29. Kleine RB. Principles and practice of structural equation modeling. Guilford press. 2011. [ Links ]
30. Kotrlik JWKJW, Williams HAWHA. The Incorporation of Effect Size in Information Technology, Learning, Information Technology, Learning, and Performance Research and Performance Research. Inf Technol Learn Perform J. 2003;21(1):1. [ Links ]
31. Peduzzi P, Concato J, Kemper E et al. A simulation study of the number of events per variable in logistic regression analysis. JClinEpidemiol. 1996;49(0895-4356 (Print)):1373-1379.
32. Nicolaides K. Turning the Pyramid of Prenatal Care. Fetal Diagn Ther. 2011;29:183-196. [ Links ]
33. Gagnon A, Wilson R, Audibert F, Allen V, Blight C, Brock J. Obstetrical complications associated with abnormal maternal serum markers analytes. J Obs Gynecol. 2008;30:918-932. [ Links ]
34. Tul N, Pusenjak S, Osredkar J et al. Predicting complications of pregnancy with first-trimester maternal serum free-betahCG, PAPP-A and inhibin-A. Prenat Diagn. 2003;23(12):990-996 [ Links ]
35. Beta A, Akolekar R, Ventura W et al. Prediction of spontaneous preterm delivery from maternal factors, obstetric history and placental perfusion and function at 11-13 weeks. Prenat Diagn. 2011;31:75-83. [ Links ]
36. Myatt L, Clifton RG, Roberts JM et al. First-Trimester Prediction of Preeclampsia in Nulliparous Women at Low Risk. Obstet Gynecol. 2012;119(6):1234-1242. [ Links ]
37. Krantz DA, Goetzl L, Simpson JL et al. Association of extreme first-trimester free human chorionic gonadotropin-beta, pregnancy-associated plasma protein A, and nuchal translucency with intrauterine growth restriction and other adverse pregnancy outcomes. Am J Obstet Gynecol. 2004;191:1452-1458. [ Links ]
38. Carbone JF, Tuuli MG, Bradshaw R et al. Efficiency of first-trimester growth restriction and low pregnancy-associated plasma protein-A in predicting small for gestational age at delivery. Prenat Diagn. 2012;32(8):724-729. [ Links ]
39. Savvidou MD, Syngelaki A, Muhaisen M et al. First trimester maternal serum free b-human chorionic gonadotropin and pregnancy-associated plasma protein A in pregnancies complicated by diabetes mellitus. BJOG. 2012;119(4):410-416. [ Links ]
40. Martin A, Bindra R, Curcio P et al. Screening for pre-eclampsia and fetal growth restriction by uterin artery Doppler at 11-14 weeks of gestation. Ultrasound Obs Gynecol. 2001;18: 583-586. [ Links ]
41. Aquilina J, Thompson O, Thilaganathan B et al. Improved early prediction of pre-eclampsia by combining second-trimester maternal serum inhibin-A and uterine artery Doppler. Ultrasound Obs Gynecol. 2001;17:477-484. [ Links ]
42. Meads CA, Cnossen JS, Meher S et al. Methods of prediction and prevention of pre-eclampsia: systematic reviews of accuracy and effectiveness literature with economic modelling. Health Technol Assess. 2008;12(6):iii - iv, 1-270.
43. Cuckle HS. Screening for pre-eclampsia-lessons from aneuploidy screening. Placenta. 2011;32 Suppl:S42-48. [ Links ]
44. Fetal Medicine Foundation. The first trimester screening module 2012 algorithm. [ Links ]
45. Roberge S, Giguère Y, Villa P et al. Early administration of low-dose aspirin for the prevention of severe and mild preeclampsia: a systematic review and meta-analysis. Am J Perinatol. Thieme Medical Publishers; 2012;29(7):551-556. [ Links ]
46. Bujold E, Roberge S, Lacasse Y et al. Prevention of preeclampsia and intrauterine growth restriction with aspirin started in early pregnancy: a meta-analysis. Obstet Gynecol. 2010;116(2 Pt 1): 402-414. [ Links ]
Endereço para correspondência | Dirección para correspondencia | Correspondence
Alexandra Miranda
E-mail: alexandramir@gmail.com
Recebido em: 22/02/2016
Aceite para publicação: 30/05/2016