Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Acta Obstétrica e Ginecológica Portuguesa
versão impressa ISSN 1646-5830
Acta Obstet Ginecol Port vol.11 no.4 Coimbra out. 2017
ARTIGO DE REVISÃO/REVIEW ARTICLE
Síndrome de transfusão feto-fetal
Twin-Twin transfusion syndrome
Catarina Maia*, João Silva**, Mariana Novais Veiga**, Manuela Pinho***, Francisco Valente****
Serviço de Ginecologia e Obstetrícia, Centro Hospitalar Vila Nova de Gaia/Espinho
*Interna de Formação Específica de Ginecologia e Obstetrícia, Serviço de Ginecologia e Obstetrícia, Centro Hospitalar Vila Nova de Gaia/Espinho
**Assistente Hospitalar de Ginecologia e Obstetrícia, Serviço de Ginecologia e Obstetrícia, Centro Hospitalar Vila Nova de Gaia/Espinho
***Assistente Hospitalar Graduada de Ginecologia e Obstetrícia, Serviço de Ginecologia e Obstetrícia, Centro Hospitalar Vila Nova de Gaia/Espinho
****Chefe de Serviço de Ginecologia e Obstetrícia, Serviço de Ginecologia e Obstetrícia, Centro Hospitalar Vila Nova de Gaia/Espinho
Endereço para correspondência | Dirección para correspondencia | Correspondence
ABSTRACT
Twin-Twin Transfusion Syndrome affects 10-15% of monochorionic twin gestations. When left untreated, the perinatal mortality rates are above 90%. The surveillance of these pregnancies allows early detection of this syndrome to improve long-term outcomes. There are several forms of treatment but laser ablation is the first-line treatment in severe cases occurring before 26 weeks. In stage I the best management is not defined. The preterm birth influences negatively perinatal morbidity and mortality.
Keywords: Monochorionic pregnancy; Twin-Twin transfusion syndrome; Perinatal morbility; Perinatal mortality.
Introdução
A Síndrome de Transfusão Feto-fetal (STFF) afeta cerca de 10 a 15% das gestações gemelares monocoriónicas (MC), sendo responsável não só por um risco elevado de mortalidade fetal e neonatal, mas também morbilidade cardíaca e neurológica com afetação do desenvolvimento nos fetos sobreviventes. Esta caracteriza-se classicamente por uma discrepância no volume de líquido amniótico (VLA), com oligoâmnios no feto dador e hidrâmnios no feto receptor, secundários a hipo e hipervolémia, respectivamente, com origem em anastomoses vasculares placentárias não equilibradas1,2.
A apresentação da STFF é muito variável, mas ocorre na maioria das situações no segundo trimestre, entre as 15 e 26 semanas de gravidez1. A classificação de Quintero mantém-se como método preferencial de classificação da sua evolução apesar das limitações e críticas apontadas, nomeadamente a falta de correlação direta com a mortalidade perinatal3.
Na ausência de tratamento a mortalidade para ambos os fetos pode chegar aos 90%, pelo que foram desenvolvidos vários tratamentos ao longo dos anos sendo atualmente a coagulação endoscópica por laser das anastomoses o tratamento de escolha4,5.
Fisiopatologia
A fisiopatologia subjacente à STFF constitui um processo complexo e não totalmente conhecido. Todas as placentas das gestações MC apresentam anastomoses vasculares entre a circulação dos dois fetos. Em 95% destas gestações são encontradas anastomoses arteriovenosas (AAV) com fluxo unidirecional. As anastomoses arterioarteriais (AAA) e venovenosas (AVV) ocorrem em 80% e 20% das gestações MC, respetivamente, e apresentam fluxo bidirecional dependente da pressão hidrostática de ambos os fetos. Durante o desenvolvimento e crescimento da placenta ocorrem fenómenos de rotura aleatória das anastomoses. O balanço hemodinâmico dos fetos é alcançado quando existe um equilíbrio entre as AAV; ocorrendo um excesso de AAV numa direção este é compensado pelas AAA. A desproporção entre as AAV e AAA constitui um fenómeno importante para o desequilíbrio hemodinâmico, do qual resultará o desenvolvimento da STFF6,7.
Estudos que avaliaram a perfusão placentária demonstraram que as AAA são menos frequentes na STFF do que nas gestações MC não complicadas, atribuindo-lhe um papel protetor em relação a esta complicação. Apesar das AAV serem mais frequentes nas placentas de gestações afetadas por STFF, o seu papel no desenvolvimento desta patologia não está totalmente definido8,9. As AVV estão associadas a um aumento do risco de STFF e mortalidade perinatal, mas não constituem um fator de risco independente para mortalidade perinatal nas gestações gemelares MC10.
O desequilíbrio do fluxo sanguíneo entre o feto dador e o feto receptor desencadeia o processo inicial da STFF, mas não constitui um papel fundamental para o desenvolvimento da patologia subsequente. Na tentativa de equilibrar o volume intravascular em redução no feto dador, verifica-se aumento dos níveis de vasopressina e ativação do sistema renina-angiotensina com consequente hipertensão, diminuição da perfusão renal e oligúria, restrição de crescimento e lesão de órgão alvo (cérebro e rim)11. O processo de vasoconstrição é detetado ecograficamente através da ausência ou inversão do fluxo diastólico da artéria umbilical6,8. No caso do feto receptor, o aumento do volume intravascular resulta na dilatação auricular e libertação de mediadores vasoactivos (péptido natriurético auricular e cerebral) com consequente aumento da perfusão renal, poliúria e hidrâmnios6,12. Através das AAV existe uma ativação paradoxal do sistema renina-angiotensina no feto receptor13.
Diagnóstico
O diagnóstico da STFF assenta no achado ecográfico de uma discrepância de VLA entre os dois sacos amnióticos numa gravidez MC, constituindo este o sinal cardinal desta patologia1. O saco gestacional do feto dador apresenta oligoâmnios e o do receptor hidrâmnios, definidos como a presença de um maior lago vertical inferior a 2 centímetros (cm) e superior a 8cm, respectivamente14.
Embora a STFF possa ocorrer em qualquer idade gestacional, a maioria dos casos ocorre no segundo trimestre de gravidez, entre as 15 e as 26 semanas de gravidez1. A apresentação clínica e progressão desta entidade é extremamente variável e heterogénea15.
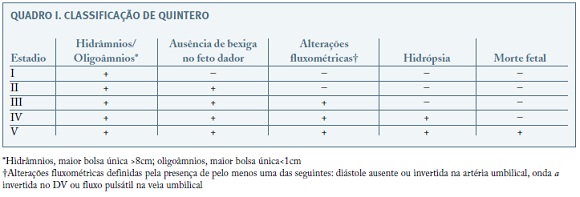
A classificação de Quintero (Quadro I), que surgiu em 1999, baseia-se nos achados ecográficos desta patologia e inclui 5 estadios com gravidade crescente. Deste modo, proporciona não só algum significado prognóstico, mas sobretudo permite maior acuidade na comparação da eficácia e desfechos de diferentes modalidades terapêuticas16. Apesar de não existir uma correlação direta com a mortalidade perinatal, esta classificação permite uma melhoria na comunicação entre as grávidas e profissionais de saúde, bem como a identificação dos casos que beneficiarão de medidas terapêuticas3,17,18.
Em 2007, um grupo de investigadores criou um novo sistema de classificação da STFF englobando as alterações ecocardiográficas do feto receptor e achados na fluxometria Doppler do dador (Children's Hospital of Philadelphia (CHOP) score), tendo verificado que existiam diferenças significativas quando se comparavam os dois sistemas de classificação19. Posteriormente, esta classificação não mostrou apresentar valor prognóstico adicional em termos de sobrevivência perinatal20.
A classificação de Cincinnati adiciona uma subdivisão ao estadio III de Quintero se existirem sinais ecográficos de cardiomiopatia no feto receptor, subclassificando em IIIa, IIIb ou IIIc de acordo com o facto de esta ser leve, moderada ou grave, respectivamente21.
Em 2008, Shah et al propõem uma outra classificação da STFF, o fetal cardiovascular profile score (CVPS), baseada em 5 parâmetros, com atribuição de 1 ou 2 pontos por cada segundo a gravidade para um máximo de 10, e nos quais também se incluem achados ecocardiográficos do feto receptor (presença ou ausência de hidrópsia, alterações arteriais e venosas da fluxometria Doppler, cardiomegalia, regurgitação nas válvulas auriculoventriculares e insuficiência cardíaca). O estudo desenvolvido por estes autores mostrou existir relação entre as anomalias cardíacas e os resultados perinatais do feto receptor22.
Em 2010 Stirnemann et al demonstraram que as alterações ecocardiográficas permitem uma avaliação quantitativa da progressão da STFF e podem ser utilizadas como marcadores precoces no diagnóstico desta patologia23.
Marcadores precoces
Apesar do diagnóstico da STFF só poder ser estabelecido quando existe uma discrepância de VLA com alterações da fluxometria Doppler na artéria umbilical, vários marcadores têm sido propostos para a detecção precoce e rastreio desta patologia, na tentativa de melhorar a vigilância destas gestações de alto risco24.
A constatação ecográfica de discordância da translucência da nuca (TN) fetal, entre as 11 e as 13 semanas e 6 dias, está relacionada com um risco quatro vezes superior de desenvolver STFF25. No estudo desenvolvido por Kagan et al cerca de 12% das gestações MC desenvolveram STFF, mas este risco aumentou para 30% naquelas que apresentavam uma discordância de TN igual ou superior a 20% (30% vs 10%)26. A discrepância de comprimento crânio-caudal (CCC), proposto como marcador do primeiro trimestre por Lewi et al, não mostrou associação com o desenvolvimento de STFF, com uma baixa sensibilidade de 8,3%. Estes dois marcadores apresentam altas taxas de falsos positivos24,26,27.
Nas gestações gemelares a presença de onda a invertida no ductus venoso (DV) está associada a um aumento do risco de aneuploidias, abortamento e desenvolvimento de STFF. O risco de STFF é de 30% se esta alteração se verificar em pelo menos um dos fetos, comparativamente com um risco de 10% se ambos os fetos não apresentarem alterações fluxométricas no DV28. O risco relativo de desenvolver STFF perante a associação de onda a invertida no DV e discrepância de TN igual ou superior a 0,6 milímetros (mm) é 21 vezes superior, comparando com um risco relativo de 10 vezes se ausência de discrepância de TN24.
Numa revisão sistemática publicada em 2016, verificou-se que a discrepância da TN, TN superior ao percentil 95, discrepância de CCC e onda a invertida no DV estão relacionadas com um risco superior de desenvolvimento da STFF. No entanto, o valor preditivo destes marcadores não permite definir uma alteração da conduta de vigilância destas gestações MC29.
Vigilância no período pré-natal
A identificação da corionicidade nas gestações gemelares deve ser realizado o mais precocemente possível, de forma a estabelecer a vigilância pré-natal adequada. No entanto, não existem estudos randomizados que avaliem o início e periodicidade ideais da vigilância ecográfica das gestações gemelares MC no sentido de detetar precocemente as suas complicações, nomeadamente a STFF. A maioria dos centros de diagnóstico pré-natal inicia esta vigilância às 16 semanas com periodicidade de 2 em 2 semanas e preconiza a avaliação da maior bolsa de líquido amniótico em cada saco e visualização da bexiga fetal15,30. Nas situações de discordância de crescimento e/ou líquido amniótico, a vigilância deverá ser semanal31.
Apesar da probabilidade de desenvolvimento da STFF ser menor após as 28-30 semanas, a vigilância não deve ser interrompida pela necessidade de detecção de outras anomalias, nomeadamente restrição de crescimento fetal que é mais frequente nas gestações gemelares31.
Não existe evidência de que a adição de outros parâmetros a esta vigilância melhore os desfechos perinatais15.
Tratamento
Historicamente existem diversas formas de abordagem perante o diagnóstico de STFF: atitude expectante, amniorredução, septostomia, coagulação endoscópica por laser das anastomoses e feticídio seletivo.
Não existem estudos que comparem a atitude expectante com outras intervenções na STFF grave, mas a história natural desta patologia indica que as taxas de mortalidade perinatal são superiores a 90% na ausência de tratamento5.
A amniorredução consiste na drenagem de líquido amniótico do saco do feto recetor e pode ser realizado após as 14 semanas. Esta intervenção permite a redução da pressão intramniótica e nos vasos placentários, melhorando a perfusão sobretudo do feto dador15. Por outro lado, a diminuição da distensão uterina poderá reduzir o risco de rotura prematura de membranas pré-termo (RPM-PT) e parto pré-termo (PPT), bem como melhorar a sintomatologia materna associada ao hidrâmnios. No entanto, este procedimento não interrompe o processo patogénico subjacente à STFF1. Estudos observacionais mostram que as taxas de sobrevivência após amniorredução seriada, se situam entre os 37 e os 60% com risco de atingimento neurológico de 17 a 33%32. Mari et al. demonstrou que a taxa de sobrevivência após protocolo de amniorredução antes das 28 semanas era de 78%, mas 4 semanas após o parto apenas 60% dos recém-nascidos estavam vivos. Em um terço das gestações apenas um dos fetos nasceu vivo e em 14% ocorreu a morte intra-uterina dos dois fetos. Nas gestações complicadas pela morte fetal de apenas um dos fetos, 67% dos receptores e 75% dos dadores sobreviventes não apresentavam alterações neurológicas às 4 semanas de vida33. Aos 24 meses, 7,1% da população estudada apresentava o diagnóstico de paralisia cerebral34. As principais complicações da amniorredução são RPM-PT, PPT, descolamento placentar, infeção e morte fetal. A taxa destas complicações nas primeiras 48 horas após o procedimento situa-se nos 15%15,33.
A septostomia consiste na punção intencional da membrana amniótica que separa as duas cavidades amnióticas de forma a igualar o volume de líquido amniótico entre elas. Apesar de constituir uma das formas de abordagem da STFF na qual apenas requer um procedimento isolado, na maioria das situações, tem sido abandonada pelo risco de rotura da membrana amniótica na totalidade e transformação em gestação monoamniótica15. Um estudo randomizado não encontrou vantagem na septostomia em relação à amniorredução e em cerca de 40% das situações foram necessários procedimentos adicionais35.
O feticídio seletivo resulta da interrupção do fluxo sanguíneo no cordão umbilical de um dos fetos de forma a melhorar a possibilidade de sobrevivência do outro gémeo, devendo ser considerado apenas nas situações de STFF grave (estadio III/IV de Quintero)15. Numa revisão da literatura, a taxa de sobrevivência do outro gémeo foi de 79%, com um risco de morte 6,5 vezes superior nas primeiras duas semanas após o procedimento, e 7% dos sobreviventes apresentava morbilidade neonatal, nomeadamente neurológica. As principais complicações consistem na RPM-PT e PPT, e são responsáveis por 75% das mortes neonatais36.
A coagulação endoscópica por laser consiste na ablação dos vasos anastomóticos, com a consequente interrupção da via patogénica desta síndrome, criando a “dicorionização” da massa placentar única. Desde a publicação do estudo Eurofetus em 2004 que esta modalidade terapêutica se tornou o tratamento de primeira linha na STFF grave antes das 26 semanas de gestação2,15. Este estudo multicêntrico randomizado publicado em 2004 demonstrou que o grupo submetido a terapia laser apresentava maior idade gestacional na altura do parto (33 vs 29 semanas) e taxa de sobrevivência de pelo menos um dos fetos aos 28 dias de vida (76% vs 56%), quando comparados com o grupo submetido a amniorredução. A taxa de mortalidade fetal na semana seguinte ao procedimento foi superior no grupo do laser mas ocorreram mais mortes neonatais no grupo submetido a amniorredução, provavelmente relacionado com uma idade gestacional inferior no parto. Aos 6 meses de vida o desfecho neurológico era superior no grupo do laser com um risco inferior de leucomalácia periventricular (6% vs 14%)5. Estes benefícios não foram demonstrados num outro estudo americano, provavelmente pelas diferenças nos critérios de inclusão, nomeadamente idade gestacional e protocolo de amniorredução37.
A coagulação endoscópica por laser das anastomoses apresenta complicações maternas e fetais.
As complicações maternas incluem dor provocada pela acumulação de líquido amniótico na cavidade peritoneal, hemorragia, corioamnionite e descolamento placentar e ocorrem em 5,4% dos procedimentos realizados, sendo que em 1% dos procedimentos são consideradas complicações graves1,44.
As principais complicações fetais são RPM-PT, descolamento amniocorial, PPT, STFF recorrente, pseudobanda amniótica, gestação monoamniótica iatrogénica, sequência anemia-policitemia e morte de um ou ambos os fetos. A maioria das complicações precoces consiste na RPM-PT seguida pelo descolamento amniocorial e morte fetal. No caso das complicações tardias, a RPM-PT é também a mais frequente seguida da STFF recorrente, sequência anemia-policitemia, pseudobanda amniótica e descolamento placentar2. A RPM-PT está reportada em cerca de 12 a 28% dos casos e a ocorrência de PPT antes das 32 semanas em 30,5% das situações38-41. A realização de septostomia iatrogénica acidental durante o procedimento laser constitui uma complicação importante pois relaciona-se com a transformação em gestação monoamniótica e pseudobanda amniótica2. Num estudo prospectivo, Cruz-Martinez et al verificaram que 7,2% dos procedimentos laser se complicaram com septostomia, apresentando estes casos um maior risco de PPT antes das 32 semanas (76,7% vs 30,2%), RPM-PT antes das 32 semanas (46,7% vs 19%), morte fetal (43,3% vs 25,8%) e pseudobanda amniótica (13,3% vs 1%). A septostomia ocorreu principalmente nas situações em que se procedeu à coagulação de vasos próximo da membrana interamniótica42. Skupski et al. procuraram estabelecer os fatores preditivos de morte fetal após este tratamento. As conclusões deste estudo mostram que no caso do feto dador, o baixo peso estimado e a diástole invertida na artéria umbilical se associam a maior probabilidade de morte deste feto. No caso do receptor, os fatores associados a maior risco de morte fetal são o baixo peso estimado, onda a invertida no DV e hidrópsia43.
A primeira técnica descrita para este procedimento consistia na ablação de todos os vasos que cruzam a membrana interamniótica. Como consequência verificava-se igualmente ablação de vasos que não conectavam os dois sistemas circulatórios, com consequente redução do território vascular, o que aumentava a probabilidade de morte do feto dador1. Posteriormente, foi desenvolvida uma técnica seletiva que necessita da identificação precisa das anastomoses e que apresenta uma maior taxa de sucesso (83,1% vs 61,1%) diminuindo, simultaneamente, o risco de morte fetal dos dois gémeos e aumentando a taxa de sobrevivência de um deles50. Uma terceira técnica foi desenvolvida e consiste na ablação sequencial das anastomoses pela seguinte ordem: AAV do dador para o receptor, AAV do receptor para o dador, AAA superficiais e AVV superficiais. Com esta última técnica verificou-se um aumento da sobrevivência dos dois fetos (75% vs 60%) e diminuição do risco de morte do dador, comparativamente à técnica não sequencial (7,3% vs 21,4%), por diminuição da hipotensão do mesmo51. Aos 28 dias de vida, os fetos submetidos à técnica sequencial apresentavam maior taxa de sobrevivência (83% vs 63%)52. No entanto, esta técnica aumenta o tempo operatório e pode colocar dificuldades nas situações de placentas anteriores1.
Apesar da terapia laser constituir o tratamento de escolha nas situações de STFF, a presença de anastomoses residuais (AR) constitui um problema que pode ser detetado em mais de um terço dos casos53,54. A maioria das AR situam-se nas margens da placenta e são de diâmetro reduzido (inferior a 1mm)55. No entanto, as AR podem associar-se à recorrência do STFF em 14% dos casos e a sequência anemia-policitemia41.
Embora possa surgir espontaneamente (1-5% das gestações monocoriónicas), a sequência anemia-policitemia é mais frequentemente uma complicação da coagulação laser das anastomoses, ocorrendo em 1 a 16% dos casos. O diagnóstico consiste na constatação de uma discrepância significativa de hemoglobina entre os fetos (após o nascimento superior a 8g/dL, com um ratio de reticulócitos superior a 1,7 ou evidência de anastomoses <1mm), sem a existência de discordância nos volumes de líquido amniótico56,57. À semelhança do descrito para o rastreio de anemia em situações de isoimunização na gravidez, durante a gestação o diagnóstico baseia-se na medição seriada da velocidade de pico sistólico da artéria cerebral média. Recentemente, Slaghekke et al. demonstraram que o diagnóstico pré-natal de anemia poderá ser feito com valores iguais ou superiores a 1,5 múltiplos da mediana (MoM) no feto dador, e de policitemia para valores iguais ou inferiores a 1,0 MoM no caso do feto receptor. Outros autores sugeriram o diagnóstico de policitemia para valores inferiores a 0,8 MoM; no entanto, diversos casos de policitemia severa foram diagnosticados com valores entre 0,8 e 1,0 MoM58. O tratamento pode consistir na atitude expectante, transfusão intrauterina do feto dador (podendo ser associada a exsanguinotransfusão do feto receptor), feticídio selectivo ou terapia laser. Este último é o único tratamento capaz de alterar o mecanismo fisiopatológico, uma vez que estudos placentários demonstraram a presença de raras AAV de pequenas dimensões (<1mm), na ausência de AAA compensatórias57,59. Recentemente, foram publicados estudos que avaliam o desfecho neurológico dos fetos afetados pela sequência de anemia-policitemia após tratamento laser por TTTS tendo-se verificado lesão neurológica em 9% dos recém-nascidos com uma incidência de 17% de atraso cognitivo leve a moderado, sem diferenças entre os fetos. Deste modo, a vigilância ecográfica com fluxometria da artéria cerebral média assume especial importância para a detecção precoce desta complicação após terapia laser56.
As consequências neurológicas dos fetos sobreviventes, após a realização de terapia laser, constituem um importante ponto na avaliação deste procedimento. A incidência de anomalias a nível neurológico situa-se entre os 6 e os 25%2. Numa série de 167 casos de STFF, submetidos a tratamento laser, verificou-se que 86,8% das crianças não apresentavam qualquer atingimento neurológico, 7,2% apresentavam alterações minor e 6% tinham alterações neurológicas major. No entanto, estes resultados devem ser interpretados considerando um risco de 3 a 7 vezes superior de morbilidade e mortalidade associado a gestações monocoriónicas, quando comparadas com gestações únicas45. Num estudo desenvolvido por Lenclen et al. verificou-se que 88,6% dos fetos submetidos a terapia laser se encontravam sem atingimento neurológico aos 2 anos, o que é comparável aos fetos nascidos de gestações dicoriónicas46. Salomon et al. avaliaram o desenvolvimento neurológico aos 6 anos das crianças que participaram no estudo Eurofetus e verificaram que em 12% das crianças existiam afeções neurológicas major. Além disso, concluíram que a terapia laser se associa a uma redução em 40% do risco de morte fetal e danos neurológicos a longo prazo, quando comparada com a amnioredução47. Diversos estudos foram realizados no sentido de avaliar os fatores de risco para lesão neurológica tendo-se concluído que a idade gestacional avançada no momento da terapia laser, baixa idade gestacional ao nascimento, baixo peso e estadio de Quintero avançado predispõem ao seu desenvolvimento48,49.
Os estudos desenvolvidos por Slaghekke et al. vieram demonstrar que a utilização da técnica de Solomon, que consiste na coagulação dos vasos placentários a nível da membrana interamniótica, permite a redução da incidência da sequência anemia-policitemia e STFF recorrente, sem aumento das complicações ou maus desfechos perinatais. Hoje considera-se que esta técnica poderá constituir o procedimento de eleição para o tratamento da STFF60-62.
Numa revisão sistemática publicada em 2015, que avaliou a utilização da técnica laser desde a sua introdução há cerca de 25 anos, verificou-se uma melhoria significativa da taxa de sobrevivência de um ou dos dois fetos. Esta melhoria parece estar relacionada com um conjunto de fatores: adaptações na técnica laser, efeito da curva de aprendizagem e rapidez na referenciação para os centros especializados63.
Estadio I de Quintero
A conduta e tratamento dos casos de STFF que se classificam no estadio I de Quintero permanece controverso, não existindo estudos randomizados15. Um estudo retrospetivo mostrou que 41% dos casos de STFF no estadio I e II resolveram após amniodrenagem e que em 35% das situações foi necessário apenas um procedimento, considerando os autores que a amniodrenagem constitui uma opção terapêutica nestas situações64. Outro estudo retrospectivo que comparou a coagulação endoscópica por laser das anastomoses com a atitude expectante, demonstrou que as taxas de mortalidade de um ou de ambos os fetos eram semelhantes, mas que no grupo da atitude expectante se verificou maior taxa de morbilidade neonatal grave e piores desfechos neurológicos a longo prazo65.
Recentemente, uma revisão sistemática da literatura evidenciou que a amniodrenagem apresenta uma taxa de sobrevivência inferior (77%) quando comparada com a atitude expectante (86%) e coagulação endoscópica por laser das anastomoses (85%). A taxa de progressão é superior no grupo da amniodrenagem (30%), comparativamente com a atitude expectante (15%) e coagulação endoscópica por laser das anastomoses (0%). Os autores consideram que a amniodrenagem não deve constituir uma opção para o tratamento para da STFF no estadio I66.
Deste modo, o tratamento ideal para este estadio da STFF não é conclusivo, pelo que serão necessários mais estudos para a sua definição1,67.
Seguimento e momento do parto
Não existem estudos randomizados que avaliem a eficácia da monitorização pré-natal nas situações de STFF. No entanto, parece ser razoável a realização de avaliação ecográfica semanal, especialmente nas primeiras 6 semanas após tratamento laser. Apesar de não estar provada a sua eficácia, a realização de cardiotocografia e perfil biofísico deve ser considerada15.
Devido ao risco elevado de PPT está indicada a administração de um ciclo de corticoterapia entre as 24 e as 34 semanas e 6 dias, especialmente se o estadio for igual ou superior ao III. A evidência disponível mostra que o parto ocorre em idades gestacionais muito variáveis de acordo com diversos fatores nomeadamente estadio e progressão da doença, resposta ao tratamento, crescimento fetal e resultados dos estudos de diagnóstico pré-natal. Os casos tratados com laser têm habitualmente doença mais grave e apresentam maior risco de PPT pela própria doença e complicações do procedimento. Deste modo, tem sido defendido que de acordo com a história clínica e expectativas médicas e parentais se possa optar por uma das seguintes opções: PPT eletivo às 32-34 semanas ou atitude expectante até às 35-36 semanas1,15,68.
Prevenção do parto pré-termo
O PPT continua a constituir um desafio na abordagem dos casos de STFF, com impacto a nível da morbi-mortalidade perinatal, custos para os sistemas de saúde e repercussões a longo prazo, nomeadamente a nível neurológico. Deste modo, têm sido várias as tentativas de identificar os mecanismos envolvidos, bem como estabelecer estratégias que permitam diminuir a sua ocorrência. A utilização de progesterona nas gestações gemelares não está associada a uma melhoria dos desfechos perinatais em amostra não selecionada69. Contudo, em meta-análises recentemente publicadas, o uso de progesterona vaginal em gestações gemelares com comprimento do colo inferior a 25mm associou-se a uma redução do parto pré-termo e morbi-mortalidade neonatal70. Num estudo retrospetivo desenvolvido por Papanna et al. verificou-se que a ciclorrafia não apresentava benefícios nos casos de colo curto (≤25mm) submetidos a coagulação endoscópica por laser das anastomoses, tanto a nível de prolongamento da gravidez como na melhoria da sobrevida neonatal71. Num estudo publicado em 2014 verificou-se que os seguintes fatores se associavam à ocorrência de PPT: mulher jovem, história de PPT anterior, estadio II de Quintero, colo curto, uso de trocarte de 12F, amnioinfusão e não utilização de tamponamento com colagénio72. Mais recentemente, Papanna et al. verificaram que o comprimento do colo (CC) nos casos de STFF apresentava uma distribuição normal, e que a idade materna e paridade se associam positivamente ao CC e idade gestacional na altura do procedimento e placenta anterior estão associados de forma negativa. Por outro lado, se CC <28mm, o risco de PPT antes das 34 semanas é superior bem como o período de latência entre o procedimento laser e o parto se reduz para cerca de 3 semanas. Finalmente, o risco de PPT antes das 24 semanas é muito elevado se CC <15mm73.
Num estudo de Finneran et al. verificou-se que, apesar do hidrâmnios e consequente aumento da pressão intrauterina constituir um fator para o aumento do risco de PPT, o CC não está relacionado com a gravidade do hidrâmnios. As alterações do CC verificadas no período após a terapia laser não constituem um fator de prognóstico para o tempo de latência até ao parto ou a idade gestacional em que o parto ocorre. A RPM-PT iatrogénica e um número elevado de anastomoses submetidas a oclusão são fatores independentes para o ocorrência de PPT espontâneo ou induzido74.
Conclusão
A STFF é uma complicação das gestações gemelares MC com importante impacto a nível da morbilidade e mortalidade perinatal. A fisiopatologia subjacente a este síndrome é complexa e consiste num processo não totalmente esclarecido mas que se sabe envolver o desequilíbrio de anastomoses placentárias entre a circulação de ambos os fetos. O diagnóstico assenta na discrepância de VLA entre as duas bolsas amnióticas e deverá ser rapidamente reconhecido. A introdução da terapia com laser para ablação das anastomoses há cerca de 25 anos constituiu um fator decisivo na melhoria dos resultados alcançados a nível pré e pós-natal. No entanto, a ocorrência da síndrome mantém-se associada a um elevado risco de morbi-mortalidade neonatal, a exigir uma vigilância pré-natal adequada para rastreio de complicações como a sequência de anemia-policitemia.
Apesar das melhorias a nível do diagnóstico e tratamento da STFF, ainda existem diversos desafios na sua abordagem, nomeadamente o estabelecimento de um modelo de predição do risco, a conduta no estadio I de Quintero e o eventual benefício na utilização da terapia laser para além das 26 semanas de gravidez. Persistem igualmente limitações na avaliação dos desfechos a longo prazo, nomeadamente morbilidade neurológica, assim como estratégias que permitam a redução da ocorrência de PPT e morbilidade e mortalidade perinatal associadas. O uso de progesterona vaginal poderá ser promissor, mas carece ainda de validação neste grupo de grávidas.
A dificuldade na definição da melhor estratégia de seguimento destas gestações leva a discrepâncias no seu reconhecimento e atraso na referenciação para centros especializados, essencial para uma optimização dos desfechos perinatais.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Mosquera C, Miller RS, Simpson LL. Twin-twin transfusion syndrome. Semin Perinatol 2012;36(3):182-189. [ Links ]
2. Khalek N, Johnson MP, Bebbington MW. Fetoscopic laser therapy for twin-to-twin transfusion syndrome. Semin Pediatr Surg 2013;22(1):18-23. [ Links ]
3. Stamilio DM, Fraser WD, Moore TR. Twin-twin transfusion syndrome: an ethics-based and evidence-based argument for clinical research. Am J Obstet Gynecol 2010;203(1):3-16. [ Links ]
4. Sauders NJ, Snijders RJ, Nicolaides KH. Therapeutic amniocentesis in twin-twin transfusion syndrome appearing in the second trimester of pregnancy. Am J Obstet Gynecol 1992;166(3): 820-824. [ Links ]
5. Senat MV, Deprest J, Boulvain M, Paupe A, Winer N, Ville Y. Endoscopic laser surgery vs serial amnioreduction for severe twin-to-twin transfusion syndrome. N Engl J Med 2004;351(2):136-144. [ Links ]
6. Johnson A. Diagnosis and management of twin-twin transfusion syndrome. Clin Obstet Gynecol 2015;58(3):611-631. [ Links ]
7. van den Wijngaand JP, Umur A, Ross MG, van Gemert MJ. Twin-twin transfusion syndrome: mathematical modelling. Prenat Diag 2008;28(4):280-291. [ Links ]
8. de Villiers SF, Slaghekke F, Midderldorp JM, Walther FJ, Oepkes D, Lopriore E. Arterio-arterial vascular anastomoses in monochorionic placentas with and without twin-twin transfusion syndrome. Placenta 2012;33(8):652-654. [ Links ]
9. Zhao DP, Cohen D, Midderldorp JM, Klumper FJ, Haak MC, Oepkes D, Lopriore E. The role of veno-venous anastomoses in twin-twin transfusion syndrome. Placenta 2014;35(5):334-336. [ Links ]
10. de Villiers SF, Zhao DP, Cohen D, van Zwet EW, Duan T, Oepkes D, Lopriore E. Correlation between veno-venous anastomoses, TTTS and perinatal mortality in monochorionic twin pregnancies. Placenta 2015; 36(5):603-606. [ Links ]
11. Galea P, Barigye O, Wee L, Jain V, Sullivan M, Fisk NM. The placenta contributes to activation of the renin angiotensin system in twin-twin transfusion syndrome. Placenta 2008;29(8):734-742. [ Links ]
12. Bajoria R, Ward S, Chatterjee R. Natriuretic peptides in the pathogenesis of cardiac dysfunction in the recipiente fetos of twin-twin transfusion syndrome. Am J Obstet Gynecol 2002;186(1): 121-127 [ Links ]
13. Mahieu-Caputo D, Meulemans A, Martinovic J, Gubler MC, Delezoide AL, Muller F, Madelenat P, Fisk NM, Dommergues M. Paradoxic activation of the renin-angiotensin system in twin-twin transfusion syndrome: an explanation for cardiovascular disturances in the recipiente. Pediatr Res 2005;58(4):685-688. [ Links ]
14. Marin L, Lim K. Ultrasound in twin pregnancies. J Obstet Gynaecol Can 2011;33(6):643-656. [ Links ]
15. Simpson LL. Twin-twin transfusion syndrome. Am J Obstet Gynecol 2013; 208(1):3-18. [ Links ]
16. Quintero RA, Morales WJ, Allen MH, Bornick PW, Johnson PK, Kruger M. Staging of twin-twin transfusion syndrome. J Perinatol 1999;19(8Pt1):550-555. [ Links ]
17. Taylor MJ, Govender L, Jolly M, Wee L, Fisk NM. Validation of the Quintero staging system for twin-twin transfusion syndrome. Obstet Gynecol 2002;100(6):1257-1265 [ Links ]
18. Rossi AC, D'Addario V. The efficacy of Quintero staging system to assess severity of twin-twin transfusion syndrome treated with laser therapy: a systematic review with meta-analysis. Am J Perinatol 2009;26(7):537-544. [ Links ]
19. Rychik J, Tian Z, Bebbington M, Xu F, McCann M, Mann S, Wilson RD, Johnson MP. The twin-twin transfusion syndrome: spectrum of cardiovascular abnormality and development of a cardiovascular score to assess severity of disease. Am J Obstet Gynecol 2007;197(4):392.e1-8. [ Links ]
20. Stirnemann JJ, Nasr B, Proulx F, Essaoui M, Ville Y. Evolution of the CHOP cardiovascular score as a prognostic predictor of outcome in twin-twin transfusion syndrome after laser coagulation of placental vessels in a prospective cohort. Ultrasound Obstet Gynecol 2010;36(1):52-57. [ Links ]
21. Crombleholme TM, Lim FY, Habli M, Polzin W, Jaekle R, Michelfelder E, Cnota J, Liu C, Kim MO. Improved recipiente survival with maternal nifedipine in twin-twin transfusion syndrome complicated by TTTS cardiomyopathy undergoing selective fetoscopic laser photocoagulation. Am J Obstet Gynecol 2010;203(4):397.e1-9. [ Links ]
22. Shah AD, Border WL, Crombleholme TM, Michelfelder EC. Initial fetal cardiovascular profile score predicts recipiente twin outcome in twin-twin transfusion syndrome. J Am Soc Echocardiogr 2008;21(10):1105-1108. [ Links ]
23. Stirnemann JJ, Mougeot M, Nasr B, Essaoui M, Fouron JC, Ville Y. Profiling fetal cardiac function in twin-twin transfusion syndrome. Ultrasound Obstet Gynecol 2010;35(1):19-27. [ Links ]
24. Matias A, Montenegro N, Loureiro T, Cunha M, Duarte S, Freitas D, Severo M. Screening for twin-twin transfusion syndrome at 11 - 14 weeks of pregnancy: the key role of ductus venosus blood flow assessment. Ultrasound Obstet Gynecol 2010;35(2): 142-148. [ Links ]
25. Sebire NJ, D'Ercole C, Hughes K, Carvalho M, Nicolaides H. Increased nuchal translucency thickness at 10 - 14 weeks of gestation as a predictor of severe twin-to-twin transfusion syndrome. Ultrasound Obstet Gynecol 1997;10(2):86-89. [ Links ]
26. Kagan KO, Gazzoni A, Sepulveda-Gonzalez G, Sotiriadis A, Nicolaides KH. Discordance in nuchal translucency thickness in the prediction of severe twin-to-twin transfusion syndrome. Ultrasound Obstet Gynecol 2007; 29(5):527-532. [ Links ]
27. Lewi L, Lewi P, Diemert A, Jani J, Gucciando L, Van Mieghem T, Doné E, Gratacós E, Huber A, Hecher K, Deprest J. The role of ultrasound examination in the first trimester and at 16 weeks' gestation to predict fetal complications in monochorionic diamniotic twin pregnancies. Am J Obstet Gynecol 2008;493.e:1-7.
28. Maiz N, Staboulidou I, Leal AM, Minekawa R, Nicolaides KH. Ductus venosus Doppler at 11 to 13 weeks of gestation in the prediction of outcome in twin pregnancies. Obstet Gynecol 2009;113(4):860-865. [ Links ]
29. Stagnati V, Zanardini C, Fichera A, Pagani G, Quintero RA, Belloco R, Prefumo F. Early prediction of twin-to-twin transfusion syndrome: systematic review and meta-analysis. Ultrasound Obstet Gynecol 2016. [ Links ]
30. McDonald R, Hodges R, Knight M, Teoh M, Edwards A, Nei P, Wallace EM, DeKonick P. Optimal interval between ultrasound scans for the detection of complications in monochorionic twins. Fetal Diagn Ther 2016. [ Links ]
31. Carver A, Haeri S, Moldenhauer J, Wolfe HM, Goodnight W. Monochorionic diamniotic twin pregnancy: timing and duration of sonographic surveillance for detection of twin-twin transfusion syndrome. J Ultrasound Med 2011; 30(3):297-301. [ Links ]
32. Roberts D, Gates S, Kilby M, Neilson JP. Interventions for twin-twin transfusion syndrome: a Cochrane review. Ultrasound Obstet Gynecol 2008; 31(6): 701-711. [ Links ]
33. Mari G, Roberts A, Detti L, Kovanci E, Stefos T, Bahado-Singh RO, Deter RL, Fisk NM. Perinatal morbidity and mortality rates in severe twin-twin transfusion syndrome: results of the international amnioreduction registry. Am J Obstet Gynecol 2001; 185(3): 708-715. [ Links ]
34. Mari G, Detti L, Oz U, Abuhamad AZ. Long-term outcome in twin-twin transfusion syndrome treated with serial aggressive amnioreduction. Am J Obstet Gynecol 2000; 183(1): 211-217. [ Links ]
35. Moise KJ, Dorman K, Lamvu G, Saade GR, Fisk NM, Dickinson JE, Wilson RD, Gagnon A, Belfort MA, O'Shaughnessy RO, Chitkara U, Hassan SS, Johnson A, Sciscione A, Skupski D. A randomized trial of amnioreduction vs septostomy in the treatment of twin-twin transfusion syndrome. Am J Obstet Gynecol 2005; 193(3 Pt 1): 701-707. [ Links ]
36. Rossi AC, D'Addario V. Umbilical cord occlusion for selective feticide in complicated monochorionic twins: a systematic review of literature. Am J Obstet Gynecol 2009; 200(2): 123-129. [ Links ]
37. Crombleholme TM, Shera D, Lee H, Johnson M, D'Alton M, Porter F, Chyu J, Silver R, Abuhamad A, Saade G, Shields L, Kauffman D, Stone J, Albanese CT, Bahado-Singh, Ball RH, Bilaniuk L, Coleman B, Farmer D, Feldstein V, Harrison MR, Hedrick H, Livingston J, Lorenz RP, Miller DA, Norton ME, Polzin WJ, Robinson JN, Rychik J, Sandberg PL, Seri I, Simon E, Simpson LL, Yedigarova L, Wilson RD, Young B. A prospective randomized multicentre trial of amnioreduction vs selective fetoscopic laser photocoagulation for the treatment of severe twin-twin transfusion syndrome. Am J Obstet Gynecol 2007; 197(4): 396.e1-9. [ Links ]
38. Rustico MA, Lanna MM, Faiola S, Schena V, Dell'Avanzo M, Mantegazza V, Parazzini C, Lista G, Scelsa B, Consonni D, Ferrazzi E. Fetal and maternal complications after selective fetoscopic laser surgery for twin-to-twin transfusion syndrome: a single-center experience. Fetal Diagn Ther 2012; 31(3): 170-178. [ Links ]
39. Habli M, Bombrys A, Lewis D, Lim FY, Polzin W, Maxwell R, Crombleholme T. Incidence of complications in twin-twins transfusion syndrome after selective fetoscopic laser photocoagulation: a single-center experience. Am J Obstet Gynecol 2009; 20(4): 417.e1-7. [ Links ]
40. Yamamoto M, El Murr L, Robyr R, Leleu F, Takahashi Y, Ville Y. Incidence and impact of perioperative complications in 175 fetoscopy-guided laser coagulations of chorionic plate anastomoses in fetofetal transfusion syndrome before 26 weeks of gestation. Am J Obstet Gynecol 2005; 193(3 Pt 2): 1110-1116. [ Links ]
41. Robyr R, Lewi L, Salomon LJ, Yamamoto M, Bernard JP, Deprest J, Ville Y. Prevalence and management of late fetal complications following successful selective laser coagulation of chorionic plate anastomoses in twin-to-twin transfusion syndrome. Am J Obstet Gynecol 2006; 194(3): 796-803. [ Links ]
42. Cruz-Martinez R, Van Mieghem T, Lewi L, Eixarch E, Cobo T, Martinez JM, Deprest J, Gratacos E. Incidence and clinical implications of early inadvertent septostomy after laser therapy for twin-twin transfusion syndrome. Ultrasound Obstet Gynecol 2011; 37(4): 458-462. [ Links ]
43. Skupski D, Luks FI, Walker M, Papanna R, Bebbington M, Ryan G, O'Shaughnessy R, Moldenhauer J, Bahtiyar O. Preoperative predictors of death in twin-to-twin transfusion syndrome treated with laser ablation of placental anastomoses. Am J Obstet Gynecol 2010; 203(4):388.e1-388.e11. [ Links ]
44. Merz W, Tchatcheva K, Gembruch U, Kohl T. Maternal complications of fetoscopic laser photocoagulation (FLP) for treatment of twin-twin transfusion syndrome (TTTS). J Perinat Med 2010; 38(4): 439-443. [ Links ]
45. Graef C, Ellenrieder B, Hecher K, Hackeloer BJ, Huber A, Bartmann P. Long-term neurodevelopmental outcome of 167 children after intrauterine laser treatment for severe twin-twin transfusion syndrome. Am J Obstet Gynecol 2006; 194(2): 303-308. [ Links ]
46. Lenclen R, Ciarlo G, Paupe A, Bussieres L, Ville Y. Neurodevelopmental outcome at 2 years in children born preterm treated by amnioreduction or fetoscopic laser surgery for twin-to-twin transfusion syndrome: comparison with dichorionic twins. Am J Obstet Gynecol 2009; 20(3): 291.e1-5. [ Links ]
47. Salomon LJ, Ortqvist L, Aegerter P, Bussieres L, Staracci S, Stirnemann JJ, Essaoui M, Bernard JP, Ville Y. Long-term developmental follow-up of infants who participated in a randomized clinical trial of amniocentesis vs laser photocoagulation for the treatment of twin-to-twin transfusion syndrome. Am J Obstet Gynecol 2010; 203(5): 444.e1-7. [ Links ]
48. Lopriore E, Ortibus E, Acosta-Rojas R, Le Cessie S, Middeldorp Jm, Oepkes D, Gratacos E, Vandenbussche FPHA, Deprest J, Walther FJ, Lewi L. Risk factors for neurodevelopment impairment in twin-twin transfusion syndrome treated with fetoscopic laser surgery. Obstet Gynecol 2009; 113 (2 Pt 1): 361-366. [ Links ]
49. Gray PH, Poulsen L, Gilshenan K, Soong B, Cincotta RB, Gardener G. Neurodevelopmental outcome and risk factors for disability for twin-twin transfusion syndrome treated with laser surgery. Am J Obstet Gynecol 2011; 204(2): 159.e1-6. [ Links ]
50. Quintero RA, Comas C, Bornick PW, Allen MH, Kruger M. Selective vs non-selective laser photocoagulation of placental vessels in twin-to-twin transfusion syndrome. Ultrasound Obstet Gynecol 2000; 16(3): 230-236. [ Links ]
51. Quintero RA, Ishii K, Chmait RH, Bornick PW, Allen MH, Kontopoulos EV. Sequential selective laser photocoagulation of communicating vessels in twin-twin transfusion syndrome. J Matern Fetal Neonatal Med 2007; 20(10):763-768. [ Links ]
52. Chmait RH, Khan A, Benirschke K, Miller D, Korst LM, Goodwin TM. Perinatal survival following preferential sequential selective laser surgery for twin-twin transfusion syndrome. J Matern Fetal Neonatal Med 2010; 23(10):10-16. [ Links ]
53. Lewi L, Jani J, Cannie M, Robyr R, Ville Y, Hecher K, Gratacos E, Vandecruys H, Vandecaveye V, Dymarkowski S, Deprest J. Intertwin anastomoses in monochorionic placentas after fetoscopic laser coagulation for twin-to-twin transfusion syndrome: Is there more than meets the eye?. Am J Obstet Gynecol 2006; 194(3):790-795. [ Links ]
54. Lopriore E, Middeldorp JM, Oepkes D, Klumper FJ, Walther FJ, Vandenbussche FPHA. Residual anastomoses after fetoscopic laser surgery in twin-to-twin transfusion syndrome: frequency, associated risks and outcome. Placenta 2007; 28(2-3):204-208. [ Links ]
55. Lopriore E, Slaghekke F, Middeldorp JM, Klumper FJ, Oepkes D, Vandenbussche FP. Residual anastomoses in twin-to-twin transfusion syndrome treated with selective fetoscopic laser surgery: localization, size, and consequences. Am J Obstet Gynecol 2009; 201(1):66.e1-4. [ Links ]
56. Slaghekke F, van Klink JM, Koopman HM, Middeldorp JM, Oepkes D, Lopriore E. Neurodevelopmental outcome in twin anemia-polycythemia sequence after laser surgery for twin-twin transfusion syndrome. Ultrasound Obstet Gynecol 2014; 44(3): 316-21. [ Links ]
57. Moaddab A, Nassr AA, Espinoza J, Ruano R, Bateni ZH, Shamshirsaz AA, Mandy GT, Welty SE, Erfani H, Popek EJ, Belfort MA, Shamshirsaz. Twin anemia polycythemia sequence: a single center experience and literature review. Eur J Obstet Gynecol Reprod Biol 2016; 205:158-164. [ Links ]
58. Slaghekke F, Pasman S, Veujoz M, Middeldorp JM, Lewi L, Revlieger R, Favre R, Lopriore E, Oepkes D. Middle cerebral artery peak systolic velocity to predict fetal haemoglobin levels in twin anemia-polycythemia sequence. Ultrasound Obstet Gynecol 2015; 46(4):432-436. [ Links ]
59. Baschat AA, Oepkes D. Twin anemia-polycythemia sequence in monochorionic twins: implication for diagnosis and treatment. Am J Perinatol 2014; Suppl 1:S25-30. [ Links ]
60. Slaghekke F, Lewi L, Middeldorp JM, Weingertner AS, Klumper FJ, Dekoninck P, Devlieger R, Lanna MM, Deprest J, Favre R, Oepkes D, Lopriore E. Residual anastomoses in twin-twin transfusion syndrome after laser: the Salomon randomized trial. Am J Obstet Gynecol 2014; 211(3):285.e1-7. [ Links ]
61. Slaghekke F, Oepkes D. Solomon technique vs selective coagulation for twin-twin transfusion syndrome. Twin Res Hum Genet 2016;19(3):217-221. [ Links ]
62. Dhillan RK, Hillmon SC, Pounds R, Morris RK, Kilby MD. Comparison of Solomon technique with selective laser ablation for twin-twin transfusion syndrome: a systematic review. Ultrasound Obstet Gynecol 2015;46(5):526-533. [ Links ]
63. Akkermans J, Peeters SH, Klumper FJ, Lopriore E, Middeldorp JM, Oepkes D. Twenty-five years of fetoscopic laser coagulation in twin-twin transfusion syndrome: a systematic review. Fetal Diagn Ther 2015;38(4):241-253. [ Links ]
64. Fichera A, Lanna M, Fratelli N, Rustico M, Frusca T. Twin-to-twin transfusion syndrome presenting at early stages: is there still a possible role for amnioreduction?. Prenat Diagn 2010;30(2): 144-148. [ Links ]
65. Wagner MM, Lopriore E, Klumper FJ, Oepkes D, Vandenbussche FP, Middeldorp JM. Short and long-term outcome in stage 1 twin-to-twin transfusion syndrome treated with laser surgery compared with conservative management. Am J Obstet Gynecol 2009;201(3):286.e:1-6. [ Links ]
66. Rossi AC, D'Addario V. Survival outcomes of twin-twin transfusion syndrome stage I: a systematic review of literature. Am J Perinatol 2013;30(1):5-10. [ Links ]
67. Khalil A, Cooper E, Townsend R, Thilaganathan B. Evolution of stage 1 twin-to-twin transfusion syndrome (TTTS): systematic review and meta-analysis. Twin Res Hum Genet 2016;19 (3):207-216. [ Links ]
68. Stirnemann JJ, Quibel T, Essaoui M, Salomon LJ, Bussieres L, Ville Y. Timing of delivery following selective laser photocoagulation for twin-to-twin transfusion syndrome. Am J Obstet Gynecol 2012; 207(2):127.e1-6. [ Links ]
69. Schuit E1, Stock S, Rode L, Rouse DJ, Lim AC, Norman JE, Nassar AH, Serra V, Combs CA, Vayssiere C, Aboulghar MM, Wood S, Çetingöz E, Briery CM, Fonseca EB, Worda K, Tabor A, Thom EA, Caritis SN, Awwad J, Usta IM, Perales A, Meseguer J, Maurel K, Garite T, Aboulghar MA, Amin YM, Ross S, Cam C, Karateke A, Morrison JC, Magann EF, Nicolaides KH, Zuithoff NP, Groenwold RH, Moons KG, Kwee A, Mol BW; Global Obstetrics Network (GONet) collaboration. Effectiveness of progestogens to improve perinatal outcome in twin pregnancies: an individual participant data meta-analysis. BJOG 2015;122(1):27-37.
70. Romero R, Conde-Agudelo A, El-Refair W, Rode L, Brizot ML, Centigoz E, Serra V, Da Fonseca E, Abdelhafez MS, Tabor A, Perales A, Hassan SS, Nicolaides KH. Vaginal progesterone decreases preterm birth and neonatal morbidity and mortality in women with a twin gestation and a short cervix: an updated meta-analysis of individual patient data. Ultrasound Obstet Gynecol 2017; [ Links ] doi:10.1002/uog.17397.
71. Papanna R, Habli M, Baschat AA, Bebbington M, Mann LK, Johnson A, Ryan G, Walker M, Lewis D, Harman C, Crombleholme T, Moise KJ Jr. Cerclage for cervical shortening at fetoscopic laser photocoagulation in twin-twin transfusion syndrome. Am J Obstet Gynecol 2012; 206(5):425.e1-7. [ Links ]
72. Papanna R, Block-Abraham D, Mann LK, Buhimschi IA, Bebbington M, Garcia E, Kahlek N, Harman C, Johnson A, Baschat A, Moise KJ Jr. Risk factors associated with preterm delivery after fetoscopic laser ablation for twin-twin transfusion syndrome. Ultrasound Obstet Gynecol 2014; 43(1):48-53. [ Links ]
73. Papanna R, Mann LK, Baschat AA, Bebbington MW, Kahlek N, Johnson A, Snowise S, Moise KJ Jr. Cervical length in prediction of preterm birth after laser surgery for twin-twin transfusion syndrome. Ultrasound Obstet Gynecol 2015; 45(2):175-182. [ Links ]
74. Finneran M, Temming L, Templin M, Stephenson C. Effect of cervical length recovery after laser surgery for twin-twin transfusion syndrome. AJP Rep 2016;6(1):e137-141. [ Links ]
Endereço para correspondência | Dirección para correspondencia | Correspondence
Catarina Maia
E-mail: catarina_maia16@hotmail.com
Recebido em: 13/06/2016
Aceite para publicação: 18/02/2017