Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Acta Obstétrica e Ginecológica Portuguesa
Print version ISSN 1646-5830
Acta Obstet Ginecol Port vol.11 no.4 Coimbra Oct. 2017
ARTIGO DE REVISÃO/REVIEW ARTICLE
Sistema intrauterino de libertação de levonorgestrel e cancro da mama
Levonorgestrel-releasing intrauterine system and breast cancer
Joana Cruz*, Ana Rosa Costa**
Serviço de Ginecologia e Obstetrícia, Centro Hospitalar de São João E.P.E.
*Interna de Formação Específica de Ginecologia e Obstetrícia, Centro Hospitalar de São João E.P.E.
**Assistente Hospitalar Graduada, Serviço de Ginecologia e Obstetrícia, Centro Hospitalar de São João E.P.E.
Endereço para correspondência | Dirección para correspondencia | Correspondence
ABSTRACT
Levonorgestrel intrauterine system (LNG-IUS) is a highly effective long-term contraception that causes endometrial suppression with considerably lower systemic exposure than oral progesterone. It is currently approved for the treatment of abnormal uterine bleeding, dysmenorrhea, for endometrial protection during estrogen therapy and its use in patients with breast cancer taking tamoxifen (TMX) is being debated. The aim of this systematic review was to describe the risk of breast cancer in LNG-IUS users and to define it safety in women taking adjuvant TMX following breast cancer, for the outcomes of endometrial and uterine pathology and secondary breast cancer events.
Keywords: Intrauterine device; Medicated intrauterine device; levonorgestrel-releasing intrauterine system; Breast neoplasm; Breast cancer.
Introdução
O sistema intrauterino de libertação de levonorgestrel (SIU-LNG) é um dispositivo intrauterino (DIU) em forma de «T» com um reservatório de 52mg de levonorgestrel (LNG), um progestagénio de segunda geração derivado da nortestosterona, libertado a uma taxa diária de 11-20µg ao longo de cinco anos, mas com eficácia aprovada até sete anos1. A libertação intracavitária de LNG permite uma potenciação do efeito progestativo local (supressão da proliferação endometrial, decidualização e atrofia glandular), garantindo níveis hormonais sistémicos baixos (0,1-0,4 ng/mL) e significativamente inferiores à dos progestativos orais ou subdérmicos (1,7-15,2 ng/mL)2.
Comercializado na Europa desde 1990 com um fim contracetivo, o SIU-LNG está atualmente aprovado no tratamento de um conjunto de outras situações ginecológicas, nomeadamente no tratamento de hemorragias uterinas anómalas (HUA), dismenorreia e proteção endometrial durante a terapêutica estrogénica.
A crescente popularidade do SIU-LNG foi acompanhada por um aumento do número absoluto de relatos de cancro da mama em utilizadoras destes dispositivos. Apesar de um eventual viés de utilização, relacionado com uma prescrição preferencial de SIU-LNG em mulheres com fatores de risco para cancro da mama, o potencial oncogénico tumoral destes dispositivos não pode ser excluído3.
O cancro da mama é o tumor maligno mais frequente na mulher em todo o mundo e a segunda principal causa de morte por cancro na mulher4. Em Portugal, são diagnosticados cerca de 6.000 novos casos de cancro da mama e 1.500 mulheres morrem com esta doença todos os anos5.
O cancro da mama tem uma dependência hormonal conhecida. Aproximadamente 75% dos tumores expressam recetores de estrogénio (RE) ou de progesterona (RP) e têm uma elevada taxa de resposta ao tratamento com agentes que bloqueiam a sinalização hormonal6.
O tamoxifeno (TMX) é um modulador seletivo dos RE que inibe competitivamente a ligação do estrogénio aos recetores, atuando como antagonista dos RE na mama e como agonista no endométrio6. Apesar dos reconhecidos benefícios do TMX na resposta terapêutica e sobrevida das doentes com cancro da mama, este foi associado a um aumento do risco de pólipos (5-35%), hiperplasia (4,7-16%) e cancro do endométrio (0,5-5%), levando alguns autores a sugerir o recurso à terapia progestativa oral (noretisterona, megestrol e acetato de medroxiprogesterona) ou local (SIU-LNG), no sentido de minimizar o impacto do TMX ao nível endometrial7.
Este trabalho tem como objetivo rever a literatura existente e avaliar: 1) o risco de cancro da mama associado à utilização de SIU-LNG; 2) a proteção endometrial conferida pelo SIU-LNG nas mulheres com cancro da mama a fazer hormonoterapia com TMX e 3) o risco de recidiva tumoral nas mulheres com cancro nas mulheres a fazer hormonoterapia com TMX, com SIU-LNG.
Métodos
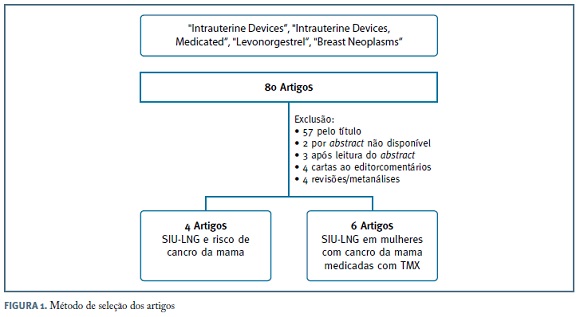
Foi efetuada revisão sistemática da literatura utilizando os termos «Intrauterine Devices», «Medicated Intrauterine Devices», «Levonorgestrel» e «Breast Neoplasms», limitada aos artigos publicados em língua inglesa, francesa e portuguesa até junho de 2016.
Desta pesquisa resultaram 80 artigos, 60 dos quais foram eliminados após leitura do título e do resumo. Foram excluídas as cartas ao editor e comentários, bem como artigos de revisão e metanálises. Foram selecionados 10 artigos, todos eles disponíveis na íntegra, incluíndo estudos observacionais e ensaios clínicos, avaliando o risco de cancro da mama nas utilizadoras de SIU-LNG (4 estudos) e os riscos e benefícios da utilização destes dispoditivos nas doentes com cancro da mama sob tratamento hormonal com TMX (6 estudos). A metodologia e os principais resultados dos estudos incluídos encontram-se resumidos nos Quadro I e II.
SIU-LNG e risco de cancro da mama
O impacto da contraceção hormonal no aparecimento do cancro da mama é controverso e a maioria dos estudos tem-se focado essencialmente na contraceção hormonal combinada8, sendo escassa a literatura sobre a contraceção progestativa em geral e sobre o SIU-LNG em particular.
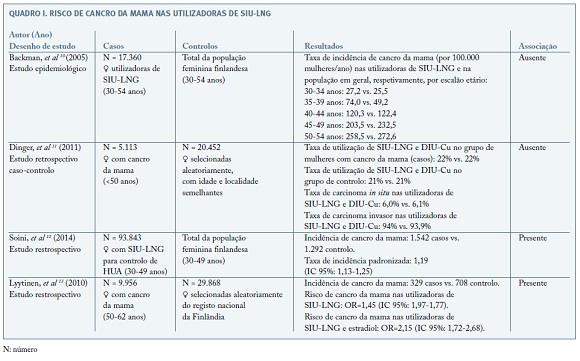
Um dos primeiros trabalhos a analisar a relação entre cancro da mama e a utilização de SIU-LNG foi publicado por Backman et al 9 em 2005. Este estudo epidemiológico baseou-se nos dados de um estudo de grandes dimensões realizado na Finlândia após a comercialização do SIU-LNG, envolvendo 17.360 mulheres entre os 30-54 anos10. Os autores compararam a incidência de cancro da mama nesta coorte de mulheres utilizadoras de SIU-LNG, com a incidência na totalidade da população feminina finlandesa, com base no registo oncológico nacional. A incidência de cancro da mama foi inferior nas utilizadoras de SIU-LNG com idades entre os 40-54 anos, mas superior no grupo de mulheres com 30-39 anos, quando comparado com a população em geral. Estas diferenças não foram, no entanto, significativas para nenhum dos intervalos etários e os autores concluíram não existir uma relação causal entre o uso de SIU-LNG e a ocorrência de cancro da mama.
Um estudo retrospetivo de caso-controlo publicado por Dinger et al11, comparou a incidência de cancro da mama em mulheres com menos de 50 anos utilizadoras de SIU-LNG e de dispositivo intrauterino de cobre (DIU-Cu). No total, 5.113 casos de cancro da mama foram identificados dos registos oncológicos nacionais da Finlândia e Alemanha entre 2000-2007 e comparados com 20.452 controlos, ajustados por ano de nascimento e área de residência. A taxa de utilização de SIU-LNG e de DIU-Cu foi semelhante nos grupos de caso (22%) e de controlo (21%), não tendo sido encontrado acréscimo do risco de cancro da mama associado a uma utilização prévia (Odds ratio [OR]: 0,99; intervalo de confiança 95% [IC95%]: 0,88-1,12) ou atual de SIU-LNG (OR: 0,85; IC95%: 0,52-1,39).
Estes dados foram contrariados por um estudo retrospetivo de grandes dimensões publicado em 2015 por Soini et al 12. Estes autores compararam a incidência de cancro da mama numa coorte de 93.843 mulheres pré-menopausa (30-49 anos) medicadas com SIU-LNG para controlo de HUA, com a população em geral. Neste estudo, a utilização de SIU-LNG para o tratamento de HUA durante a idade reprodutiva foi associada a uma diminuição do risco de cancro do endométrio, do ovário, do pâncreas e do pulmão, mas a uma maior incidência de cancro da mama, comparativamente com a população em geral (taxa de incidência padronizada: 1,19; IC 95%: 1,13-1,25). A interpretação destes resultados deverá, no entanto, ter em consideração o viés não desprezível na seleção da amostra, ao comparar um grupo selecionado de mulheres (mulheres com HUA), com características específicas e provavelmente com algum grau de hiperestrogenismo, com a população em geral.
A mesma crítica poderá ser apontada ao estudo de Lyytinen et al 13, ao avaliar a relação entre a terapêutica hormonal da menopausa e o cancro da mama, numa coorte de 9.956 mulheres na pós-menopausa. Neste trabalho, os autores não encontraram associação entre o uso de terapia oral com progestativos e cancro da mama (OR: 0,97). No entanto, descrevem um aumento do risco de cancro da mama associado a uma exposição progestagénica sistémica significativamente inferior, quer nas utilizadoras de SIU-LNG (OR: 1,45; IC 95%: 1,97-1,77), como naquelas com associação SIU-LNG e estradiol (OR: 2,15; IC 95%: 1,72-2,68). De facto, para além do tamanho reduzido da amostra analisada (291 utilizadoras de SIU-LNG, 137 com associação de estradiol), não é referido na metodologia do estudo qual o resultado da avaliação endometrial prévia à colocação do SIU-LNG, nem quais os motivos que levaram à opção pela terapêutica intra-uterina.
SIU-LNG em mulheres com cancro da mama
O TMX é atualmente o principal tratamento adjuvante em mulheres pré e pós-menopausa com cancro da mama com RE positivos. A maioria das pacientes (95%) tolera bem a terapia com TMX, sendo o principal efeito indesejado associada à sua utilização, a ação promotora nos RE ao nível do endométrio, que se traduz clinicamente no risco de aparecimento de hiperplasia endometrial, pólipos endometriais e miomas submucosos. No entanto, apesar do potencial risco pré-neoplásico e neoplásico endometrial (0,5-5%) associados à terapêutica com TMX, nomeadamente na mulher pós-menopausa, este não se sobrepõe aos seus benefícios no tratamento adjuvante do cancro da mama14.
Conhecidos os efeitos anti-proliferativos diretos e anti-estrogénicos indiretos da progesterona ao nível do endométrio, tem sido proposta a sua utilização quer por via oral (acetato de noretisterona, acetato de megestrol e acetato de medroxiprogesterona) quer local (SIU-LNG), na proteção endometrial das mulheres medicadas com TMX7.
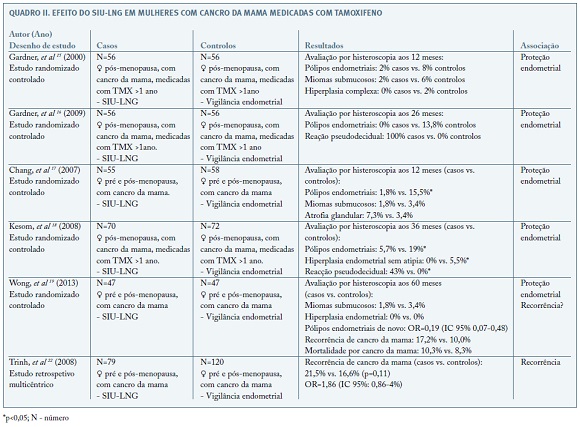
Até à data, foram publicados cinco estudos randomizados controlados15-19 avaliando a eficácia do SIU-LNG na prevenção das alterações endometriais induzidas pelo TMX em doentes com cancro da mama (Quadro II).
Gardner et al 15 relatou uma menor incidência de pólipos endometriais (2% vs. 8%), miomas submucosos (2% vs. 6%) e hiperplasia complexa (0% vs. 2%) nos primeiros 12 meses após a colocação de SIU-LNG, num estudo envolvendo 113 mulheres na pós-menopausa medicadas com TMX há pelo menos 1 ano. A avaliação a longo prazo (25 meses) destas doentes confirmou as alterações benignas induzidas pelo SIU-LNG ao nível do endométrio nas mulheres em tratamento com TMX, nomeadamente na prevenção de pólipos endometriais (0% vs. 13,8%)16.
Num estudo randomizado controlado publicado por Chan et al 17, a inserção profilática de SIU-LNG prévia ao início da hormonoterapia em 113 mulheres com cancro da mama na pré e pós-menopausa, também se traduziu numa redução da incidência de pólipos endometriais aos 12 meses (1,8% vs. 15,5%; risco relativo: 0,12; IC 95%: 0,02-0,91).
Kesim et al 18 avaliou os efeitos do SIU-LNG ao fim de 36 meses, em doentes com cancro da mama a fazer tratamento com TMX. Os autores constataram uma menor incidência de pólipos endometriais (5,7% vs. 19%), de miomas submucoso (2% vs. 6%) e de hiperplasia endometrial sem atipia (0% vs. 5,5%) no grupo de tratamento com SIU-LNG, comparativamente com o grupo de controlo.
Wong et al 19 seguiram 94 mulheres durante 5 anos. Os autores não objetivaram diferenças significativas na ocorrência de miomas submucosos (1,8% vs. 3,4%) ou de hiperplasia endometrial (0% vs. 0%) entre os grupos, mas descrevem uma redução significativa no que diz respeito ao aparecimento de pólipos endometrais no grupo de tratamento com SIU-LNG comparativamente com o grupo de controlo (OR: 0,19; IC 95%: 0,07-0,48). Durante os 5 anos de seguimento, não houve um aumento estatisticamente significativo na taxa de recorrência de cancro da mama (17,2% vs. 10,0%) ou de mortes relacionadas com cancro (10,3% vs. 8,3%) no grupo de tratamento com SIU-LNG comparativamente com o grupo de vigilância. No entanto, o tamanho da amostra neste estudo não foi suficiente para avaliar com rigor este risco.
Uma meta-análise20 incluindo três destes estudos (Gardner et al 15, Kesim et al 18 e Wong et al 19) e envolvendo 359 pacientes, demonstrou que a utilização de SIU-LNG em doentes com cancro da mama medicadas com TMX está associada a uma redução no aparecimento de pólipos de novo (OR: 0,18; IC 95%: 0,08-0,42; p<0,0001), não descrevendo, no entanto, diferenças estatisticamente significativas no que diz respeito ao risco de hiperplasia endometrial (OR: 0,20; IC 95%: 0,04-1,18; p=0,08), de recorrência de cancro da mama (OR: 1,75; IC 95%: 0,64-4,80; p=0,28) ou de morte por cancro (OR: 1,22; IC 95%: 0,42-3,52; p=0,71).
De facto, uma das principais preocupações e limitações associadas à utilização de progestativos nas mulheres medicadas com TMX, prende-se com o receio de uma eventual interferência na eficácia da hormonoterapia na prevenção da recorrência de cancro da mama. A hipótese de uma estimulação das células malignas pelo SIU-LNG está relacionada com o doseamento hormonal sistémico. Apesar de a concentração progestativa sistémica do SIU-LNG ser significativamente inferior à dos progestativos orais, sabe-se que quer a libertação como a absorção sistémica de levonorgestrel não é constante entre as utilizadoras e é influenciada pelo meio envolvente21.
A segurança do SIU-LNG relativamente ao risco de recorrência de cancro da mama foi avaliado por Trinh et al 22 num estudo retrospetivo multicentrico. Os autores compararam uma coorte de 79 mulheres com cancro da mama com SIU-LNG (subgrupo A: 38 pacientes portadoras de SIU-LNG no momento do diagnóstico; subgrupo B: 41 pacientes com inserção do dispositivo posteriormente ao diagnóstico de cancro) com 120 mulheres sem história de uso de SIU-LNG. Ao fim de 3 anos de acompanhamento não foram encontradas diferenças estatisticamente significativas no que diz respeito à recorrência de cancro entre as utilizadoras e as não utilizadoras de SIU-LNG (21,5% vs. 16,6%). No entanto, quando analisados os subgrupos, os autores constataram que as utilizadoras de SIU-LNG cujo diagnóstico foi feito durante o seu uso (subgrupo A), apresentavam pior prognóstico, nomeadamente maior envolvimento ganglionar (47,4% vs. 29,3%), comparativamente com as doentes do subgrupo B. Os autores justificam estes resultados com a hipótese de o SIU-LNG poder estar associado ao desenvolvimento de tumores mais agressivos, no entanto, considerando o baixo poder amostral do estudo, este fato deve ser analisado com precaução.
Algumas sociedades internacionais, nomeadamente a Society of Family Planing e a Cancer and contraception e Canadian Society of Contraception, aceitam atualmente a colocação de SIU-LNG em mulheres medicadas com TMX, depois de considerados e ponderados de forma multidisciplinar com o oncologista assistente, os riscos e benefícios, a nível do endométrio e da mama (nível de evidência I-II)23,24.
Conclusão
O SIU-LNG é um método contracetivo de longa duração altamente eficaz (Índice de Pearl de 0,2)25 e com um conjunto de benefícios não contracetivos reconhecidos, estando atualmente aprovado no tratamento de HUA, dismenorreia e proteção endometrial durante a terapia estrogénica.
As principais vantagens do SIU-LNG estão diretamente relacionadas com oa potenciação do seu efeito progestativo local, juntamente com exposições sistémicas baixas (0,1-0,4 ng/mL).
Na revisão realizada não há evidência de que a utilização de SIU-LNG esteja associada a um aumento do risco de cancro da mama na população geral9,11, onde se sobrepõe claramente os benefícios contracetivos e médicos.
De facto, o principal tema de debate foca-se atualmente nos eventuais benefícios e riscos associados à utilização do SIU-LNG em mulheres com antecedentes de cancro da mama e nas medicadas com TMX. Nos estudos incluídos neste revisão, a utilização de SIU-LNG foi associada a uma redução significativa do aparecimento de pólipos endometriais de novo, permitindo uma redução na frequência da vigilância endometrial e uma melhor adesão terapêutica, não havendo dados consistentes no que diz respeito à redução do risco de cancro do endométrio, nem estudos prospetivos suficientemente longos para avaliar a taxa de recorrência e mortalidade por cancro.
O SIU-LNG poderá ter especial utililidade nas mulheres com risco acrescido para patologia endometrial ou naquelas com diagnóstico de patologia endometrial à data do início do tratamento com TMX.
Para o futuro, perspetivam-se novos ensaios clínicos que avaliem a farmacocinética e farmacodimâmica do progestagénio plasmático deste dispositivo (ou do seu sucessor com 13,5mg de levonorgestrel), bem como estudos randomizados de longo prazo de maiores dimensões.
REFERÊNCIAS BIBLIOGRÁFICAS
1. McNicholas C, Maddipati R, Zhao Q, Swor E, Peipert JF. Use of the Etonogestrel Implant and Levonorgestrel Intrauterine Device Beyond the U.S. Food and Drug Administration- Approved Duration. Obstet Gynecol. 2015; 125(3): 599-604. [ Links ]
2. Contraceção, Joaquim Neves. Lisboa, Lidel. 2013. 252-267. [ Links ]
3. Dinger J, Bardenheuer K, Minh TD. Levonorgestrel-releasing and copper intrauterina devices and the risk of breast cancer. Contraception. 2010;83:211-217. [ Links ]
4. Ferlay J, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer. 2015;136(5):359-386. [ Links ]
5. Programa Nacional das doenças oncológicas 2014, Direcção-Geral da Saúde.
6. Livro de Ginecologia.
7. Chin J, Konje JC, Hickey M. Levonorgestrel intrauterine system for endometrial protection in women with breast cancer on adjuvant tamoxifen. Cochrane Database Syst Rev. 2009.
8. Burkman R, Schlesselman JJ, Zieman M. Safety concerns and health benefits associated with oral contraception. AmJObstet Gynecol 2004;190:S5-22. [ Links ]
9. Backman T, et al. Use of the levonorgestrel-releasing intrauterine system and breast cancer. Obstet Gynecol. 2005;106(4):813-817. [ Links ]
10. Backman T, et al. Length of use and symptoms associated with premature removal of the levonorgestrel intrauterine system: a nation-wide study of 17,360 users. BJOG. 2000;107:335-339. [ Links ]
11. Dinger J, Bardenheuer K, Minh TD. Levonorgestrel-releasing and copper intrauterine devices and the risk of breast cancer. Contraception. 2011;83(3):211-217. [ Links ]
12. Soini et al. Cancer risk in women using the levonorgestrel-releasing intrauterine system in Finland. Obstet Gynecol. 2014;124:292-299.
13. Lyytinen HK, Dyba T, Ylikorkala O, Pukkala EI. A case-control study on hormone therapy as a risk factor for breast cancer in Finland: Intrauterine system carries a risk as well. Int J Cancer. 2010;126(2):483-489. [ Links ]
14. Gizzo A, et al; Levonorgestrel Intrauterine System in adjuvant tamoxifen treatment: balance of breast risks and endometrial benefits - systematic review of the literature. Reprod Sci. 2014; 21(4):423-431. [ Links ]
15. Gardner FJ, et al. Endometrial protection from tamoxifen-stimulated changes by a levonorgestrel-releasing intrauterine system: a randomised controlled trial. Lancet. 2000;356(9243):1711-1717. [ Links ]
16. Gardner FJ, et al. Prevention of tamoxifen induced endometrial polyps using a levonorgestrel releasing intrauterine system long-term follow-up of a randomised control trial. Gynecol Oncol. 2009;114(3):452-456. [ Links ]
17. Chan SS, et al. A randomised controlled trial of prophylactic levonorgestrel intrauterine system in tamoxifen-treated women. BJOG. 2007;114(12):1510-1515. [ Links ]
18. Kesim MD, Aydin Y, Atis A, Mandiraci G. Long-term effects of the levonorgestrel-releasing intrauterine system on serum lipids and the endometrium in breast cancer patients taking tamoxifen. Climacteric. 2008;11(3):252-257. [ Links ]
19. Wong AW, Chan SS, Yeo W, Yu MY, Tam WH. Prophylactic use of levonorgestrel-releasing intrauterine system in women with breast cancer treated with tamoxifen: a randomized controlled trial. Obstet Gynecol. 2013;121(5):943-950. [ Links ]
20. Trinh XB, van Dam PA, Tjalma WA. Plasma concentrations of levonorgestrel in patients with an intrauterine progestogen delivery system: do they have any significance? Maturitas. 2006; 55(1):94-95. [ Links ]
21. Fu Y, Zhuang Z. Long-term effects of levonorgestrel-releasing intrauterine system on tamoxifen-treated breast cancer patients: a meta-analysis. Int J Clin Exp Pathol. 2014;7:6419-6429. [ Links ]
22. Trinh XB, Tjalma WA, Makar AP, Buytaert G, Weyler J, van Dam PA. Use of the levonorgestrel-releasing intrauterine system in breast cancer patients. Fertil Steril. 2008;90(1):17-22 [ Links ]
23. Patel A, Schwarz EB; Society of Family Planning. Cancer and contraception. SFP Guideline #20121. Contraception. 2012; 86(3):191-198. [ Links ]
24. Black A, et al. Canadian Contraception Consensus. J Obstet Gynaecol Can. 2016; 38(2):182-222. [ Links ]
25. Trussell J. Contraceptive efficacy. In: Hatcher RA, Trussell J, Nelson AL, Cates W, Kowal D, Policar M, editors. Contraceptive technology: twentieth revised edition. New York (NY): Ardent Media; 2011. [ Links ]
Endereço para correspondência | Dirección para correspondencia | Correspondence
Joana Cruz
E-mail: joanadacruz@hotmail.com
Recebido em: 17/08/2016
Aceite para publicação: 17/11/2016