Introdução
O estado ganglionar axilar é um fator determinante no tratamento de doentes com cancro da mama e constitui um dos mais importantes fatores de prognóstico1,2.
Nos últimos 25 anos, o estudo da axila em doentes com cancro da mama evoluiu significativamente3,4. Durante décadas, a linfadenectomia axilar sistemática constituiu o único procedimento utilizado para estadiamento ganglionar axilar.
A primeira revolução na cirurgia axilar do cancro da mama aconteceu na década de 90 ao se demonstrar que o estado do gânglio sentinela (GS) refletia o estado ganglionar de toda a axila por constituir o primeiro local de drenagem do tumor primário da mama3,4. Além do advento do GS, outros fatores contribuíram para esta mudança de paradigma. A implementação de programas de rastreio aumentou a taxa de deteção de cancro da mama em estádios mais precoces com consequente redução de cerca de 15 a 20% do envolvimento clínico ganglionar3. Por outro lado, os avanços nas terapêuticas adjuvantes, com melhor controlo local e sistémico da doença, o downstaging da doença com terapêuticas neoadjuvantes e o aparecimento de biomarcadores moleculares com valor prognóstico e preditivo da terapêutica sistémica adjuvante constituíram eventos importantes4, reservando-se, atualmente, a linfadenectomia axilar a um grupo limitado de doentes.
Este artigo pretende ser uma revisão narrativa da evidência científica sobre a abordagem clínica atual da cirurgia axilar no contexto do Cancro da Mama invasivo inicial.
Biópsia do gânglio sentinela no cancro da mama inicial
Atualmente, a biópsia do gânglio sentinela (BGS) constitui a abordagem de primeira linha no estadiamento axilar no cancro da mama inicial com axila clinicamente negativa ou imagiologicamente suspeita sem confirmação patológica2,5. O maior estudo randomizado (NSABP B32 trial) que envolveu 5611 doentes com cancro da mama e axila clinicamente negativa demonstrou que a BGS apresentou uma sobrevida global, sobrevida livre de doença e taxa de recorrência locorregional estatisticamente equivalente à linfadenectomia axilar sistemática para um tempo médio de follow-up de 96 meses6. Tratando-se de um procedimento menos invasivo, os estudos randomizados IEO 0185/000 trial7, RACS SNAC trial8 e ALMANAC trial9 demonstraram que a BGS esteve também associada a melhor qualidade de vida das doentes e a uma redução estatisticamente significativa da morbilidade cirúrgica do membro superior7,8,9. Particularmente, mostraram uma melhoria das taxas de dor, linfedema (5% vs 13% aos 12 meses, p<0.019), movimento do membro superior, perda sensitiva (11% vs 31% aos 12 meses, p<0.019) e parestesia no grupo submetido a BGS em relação ao esvaziamento axilar, respetivamente.
Abordagem axilar em doentes com BGS negativo
A principal preocupação face a um resultado histológico do GS negativo é a taxa de falsos negativos (FN). Apesar da variabilidade na técnica de pesquisa e estudo histológico do GS, os principais estudos randomizados sobre a eficácia e segurança da BGS em doentes com cancro da mama com axila clinicamente negativa revelaram uma taxa de deteção do mesmo de aproximadamente 96%6-10. A taxa de FN variou em média entre 5% e 10%, com valor preditivo negativo (VPN) entre 92,3% e 98%6-11. Vários fatores mostraram ter impacto neste resultado, nomeadamente a experiência do cirurgião9 e a técnica de deteção do gânglio13, com a técnica dupla a revelar maior eficácia de deteção12,13.
Os dados obtidos relativamente à taxa de FN, ao elevado VPN, à sobrevida global e livre de doença e à menor morbilidade, reduziram em cerca de 45% o número de esvaziamentos em doentes sem metastização ganglionar conhecida pré-operatoriamente6-13. Por isso, o esvaziamento axilar após diagnóstico de gânglio sentinela sem doença metastática não está recomendado2,5,14.
Abordagem axilar em doentes com BGS positivo
Na primeira década desde a introdução da BGS, perante qualquer resultado positivo para doença metastática o tratamento standard era completar o esvaziamento axilar15. Contudo, a melhoria dos métodos de imagem, o desenvolvimento de tratamentos adjuvantes mais efetivos, o aperfeiçoamento do planeamento cirúrgico e o resultado de estudos retrospetivos foram ao longo do tempo interrogando quanto à necessidade da realização sistemática do esvaziamento axilar em todas as doentes com BGS positiva para doença metastática ganglionar16-18. Estes estudos demonstraram que nestas doentes, uma fração significativa (entre 20 a 50% se GS macrometastático) não apresentava envolvimento ganglionar axilar adicional, e, portanto, eram sujeitas a esvaziamento axilar desnecessário16-19.
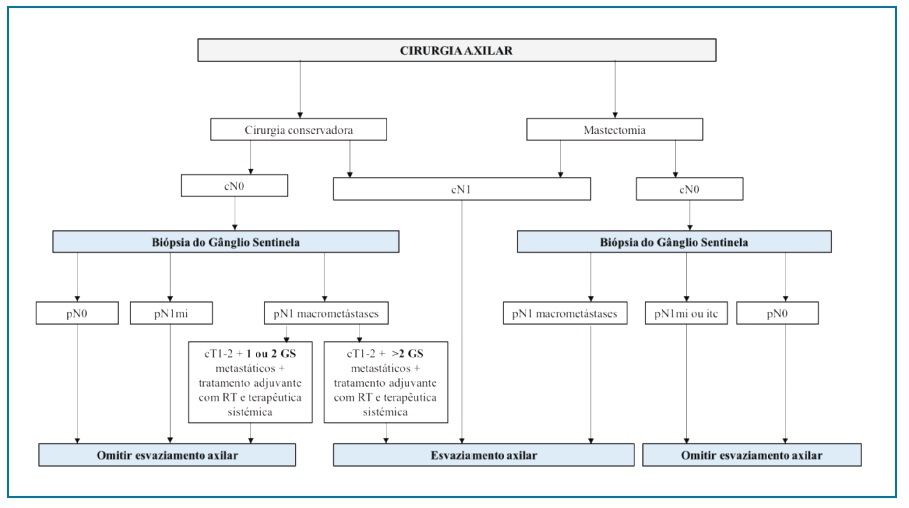
O principal e primeiro estudo prospetivo randomizado multicêntrico Z0011 do American College of Surgeons Oncology Group (ACOSOG)20 identificou as doentes com BGS positivo e com possibilidade de omissão da realização da linfadenectomia axilar adicional sem prejuízo da taxa de sobrevida global e recorrência da doença. Foram incluídas doentes com cancro da mama invasivo clinicamente T1-2 (< 5cm), N0, M0, propostas para cirurgia conservadora da mama. Foram envolvidas 856 doentes com 1 a 2 GS positivos que foram randomizadas em 2 grupos, BGS isolada (446 doentes) vs BGS complementada pelo esvaziamento axilar nível I e II (445 doentes). Como terapêutica adjuvante, todas as doentes foram submetidas a radioterapia adjuvante com irradiação da glândula mamária com uma dose de 45-50Gy (frações de 1,8 a 2 Gy por dia) e terapêutica sistémica adjuvante que incluiu hormonoterapia ou quimioterapia adjuvante, conforme definido por oncologista.
Com tempo mediano de follow-up de 6,3 anos, os principais resultados do estudo20 revelaram que as mulheres com cancro da mama invasivo clinicamente T1-T2 com 1 a 2 gânglios sentinela positivos submetidos a cirurgia conservadora e radioterapia seguida de terapêutica sistémica não beneficiaram de lindafenectomia axilar adicional para controlo loco-regional da doença e melhoria da sobrevida global e sobrevida livre de doença. Pelo risco da metastização locorregional tardia constituir uma preocupação, o estudo Z011 teve um prolongamento do tempo mediano de follow-up para aproximadamente 10 anos, continuando a não se verificar diferenças na sobrevida global e livre de doença e recorrência locorregional21.
A falha na estratificação das doentes baseada no tamanho das metástases do GS foi uma limitação apontada ao Z01122. Os estudos randomizados multicêntricos IBGSG trial 23-0122, AATRM 048/13/2000 trial23 e NSABP B32 trial6 revelaram que em doentes com GS micrometastático, a linfadenectomia seletiva do GS foi suficiente para controlo da doença locorregional e à distância, sem efeitos significativos na sobrevida global e livre de doença, em comparação com o esvaziamento axilar6,22,23.
O estudo Z011 englobou um número reduzido de mulheres com idade inferior a 50 anos e tumores triplo negativos e não apresenta informação relativa ao status HER2, o que gera controvérsia quanto à possibilidade de os resultados poderem ser aplicados a estes subgrupos de mulheres24. Um estudo prospetivo25 incluiu 701 mulheres que cumprem os critérios de elegibilidade do estudo Z011, das quais 35% apresentavam tumores triplo negativos ou HER2 positivo ou idade inferior a 50 anos. Para este subgrupo de doentes, a taxa de esvaziamento axilar (14%vs15%) e as suas indicações foram equivalentes ao grupo controlo, com número adicional de gânglios positivos para doença metastática similar entre os grupos. Num follow-up mediano de 31 meses, não se verificou nenhum caso de recidiva axilar em ambos os grupos. Por isso, este estudo suporta a aplicabilidade dos resultados do ACOSOG Z011 a doentes que cumpram os seus critérios de elegibilidade clínica, independentemente do status hormonal do tumor, do HER2 e da idade da doente. Sustentando estes resultados, Alice Chung et al26 e Yi et al27 também demonstraram que estes fatores não constituem fatores preditores significativos para o esvaziamento axilar, demonstrando taxas de sobrevivência semelhantes e ausência de recorrência regional entre as doentes submetidas à BGS isolada ou complementada com o esvaziamento axilar.
Outra controvérsia apontada ao estudo Z011 foram as variações encontradas no protocolo de radioterapia adjuvante, com doentes inclusivamente a realizar concomitantemente radioterapia axilar.
Apesar da violação do protocolo ter ocorrido em frequência comparável em ambos os grupos, esta não teve impacto na sobrevida global e taxas de recorrência20. Os estudos randomizados multicêntricos NCIC MA. 20 trial28 e EORTC 22922/10925 trial29 que englobaram 1832 e 4004 doentes com cancro da mama elegíveis para o Z011, respetivamente, demonstraram que a adição de irradiação ganglionar regional à irradiação total da glândula mamária não melhorou a sobrevida global, mas reduziu a taxa de recorrência locorregional. Consequentemente, verificou-se também um aumento significativo dos efeitos adversos, nomeadamente patologia cardíaca, pneumonites agudas, linfedema, fibrose subcutânea, entre outros28,29. Conclui-se assim, que às doentes que cumprem os critérios de eligibilidade Z011, não deve ser realizada por rotina RT ganglionar regional, mas esta pode ser benéfica em algumas doentes com base no seu perfil de risco de recorrência global, pelo que a decisão deve ser individualizada e após discussão multidisciplinar.
Por sua vez, o estudo randomizado multicêntrico AMAROS30 demonstrou que em detrimento do esvaziamento axilar, a RT axilar pode constituir uma opção válida em doentes que não cumprem totalmente os critérios Z011 e com BGS positiva, sem compromisso da sobrevida e controlo locorregional da doença e com menor morbilidade28.
Desde a publicação dos resultados do estudo Z011, os mesmos têm sido aplicados na maioria das instituições e guidelines2,5,14. O algoritmo representado na Figura 1 representa esquematicamente as recomendações das principais sociedades internacionais2,5,14.
A técnica OSNA no cancro da mama inicial
Numa era em que a BGS assume um papel fundamental na predição do status ganglionar axilar, tornou-se fundamental otimizar o timing e as técnicas de estudo do GS.
O estudo intra-operatório (IO) do GS tem a principal vantagem de permitir a realização do EA quando indicado no mesmo tempo cirúrgico19,31, otimizando recursos e custos e minimizando a morbilidade associada à necessidade de dois procedimentos cirúrgicos. Contudo, como principal limitação considera-se a baixa sensibilidade diagnóstica dos principais métodos convencionais de estudo IO do GS, essencialmente as técnicas citológicas e análise por cortes de congelação, com uma sensibilidade global de 63% e 73%, respetivamente19,31-33. A baixa sensibilidade destas técnicas traduz-se numa taxa de FN que pode atingir os 25%, podendo ser superior na presença de micrometástases e carcinomas lobulares primários, pelo padrão de crescimento infiltrativo com células pouco coesas31.
One Step Nucleic Acid Amplification (OSNA) é uma técnica de biologia molecular automatizada para avaliação da presença de doença metastática no GS. É uma variante da técnica de PCR que utiliza a tecnologia rapid nucleic acid amplification technology (RT-LAMP) como método de amplificação de ácidos nucleicos para deteção e quantificação do nível de mRNA do gene que codifica a CK1934, um marcador celular epitelial ductal expresso em pelo menos 95% dos cancros da mama31,34. O protocolo para a utilização do OSNA foi desenvolvido por Tsujimoto et al34 em 2007, reportando uma taxa de concordância de 98.3% entre o número de cópias de mRNA CK19/uL e o tamanho do foco metastático do GS, permitindo distinguir micrometástases de macrometástases, com importantes implicações terapêuticas. A presença de pelo menos 5000 cópias/uL corresponde a foco macrometastático (>2mm) e entre 250 e 4999 cópias/uL a foco micrometastático (0.2-2mm). Número de cópias inferior a 250/uL equivale a foco não metastático ou com células tumorais isoladas34. Um estudo de revisão englobando 17 estudos mostrou que o OSNA apresenta uma elevada especificidade, alta taxa de concordância e elevado VPN, verificando-se na análise agrupada 94,8%, 93,8% e 97,6%, respetivamente35. Numa meta-análise mais recente que englobou 19 estudos (6657 GS)36, a sensibilidade e especificidade da técnica para a deteção da totalidade das metástases ganglionares foram 90% e 96%, respetivamente. Para a deteção de macrometástases, a sensibilidade e especificidade foram 85% e 98%, respetivamente. Estes resultados revelam que este método tem uma eficácia diagnóstica comparável ao método histopatológico convencional no estudo do GS, incluindo na deteção de macrometástases, constituindo assim um método alternativo a este. O elevado VPN evidencia que o EA pode ser seguramente omitido em doentes com GS negativo para doença metastática pelo método OSNA34-36. Sendo o OSNA uma técnica automatizada e independente do patologista, tem claras vantagens na standardização, reprodutibilidade, objetividade e evita erros subjetivos dependentes de operador37. Outra vantagem é o tempo médio de obtenção de resultados descrito entre 30 a 40 minutos, considerado aceitável para o estudo IO do GS35. Em comparação aos métodos convencionais de estudo IO do GS, o OSNA tem uma sensibilidade diagnóstica superior à análise por cortes de congelação e às técnicas citológicas38. Na identificação de GS com micrometástases, a eficácia diagnóstica do OSNA foi também superior38.
Assim, nesta era pós-Z011, o OSNA revelou-se uma técnica de interesse no estudo IO e em diferido do GS, pelas vantagens já apontadas mas, sobretudo, pela sua capacidade diagnóstica semelhante ao estudo histológico convencional e melhor que as técnicas IO convencionais34-38.
Em 2013, foi introduzido o conceito de carga tumoral total (Total Tumour Load- TTL), que traduz a quantidade total de cópias mRNA CK19 em todos os GS positivos39. Desde então, vários autores demonstraram que a carga tumoral total pode ser usada como fator preditor independente do envolvimento ganglionar axilar extra-GS, tornando o método OSNA uma ferramenta eficaz na tomada de decisões intra-operatórias em doentes com BGS positiva37,39-43,44. Contudo, o cut-off da carga tumoral total que determina a realização do EA não é ainda consensual. C. Nabais et al37 definiu o cut-off de 19 000 cópias/uL, com uma sensibilidade de 73,3%, especificidade 74,4% e VPN 88,9%. Peg V et al39 reportou resultados semelhantes para um cut-off de 15.000 cópias/uL. Recentemente, o estudo português Porttle43, multicêntrico e retrospetivo, demonstrou que o cut-off de 30 000 cópias/uL constitui um fator preditor independente de doença ganglionar metastática extra-GS (OR 2,84, p<0,001). Comparando com outros cut-offs e outros modelos preditores, o cut-off 30 000 cópias/uL foi identificado como aquele que maximiza a sensibilidade e especificidade diagnóstica e, por isso, foi considerado um cut-off seguro e equilibrado para decidir completar o EA43.
O OSNA apresenta algumas limitações, nomeadamente a incapacidade de armazenamento de material ganglionar para estudo histológico posterior, impossibilitando a informação relativa à à extensão extra-capsular da metástase ganglionar e à coexistência de outras lesões que podem originar resultados falso positivos44,45. Por outro lado, o OSNA não é aplicável a tumores sem expressão de CK19, o que ocorre numa incidência inferior a 5%44,45. Além disso, 30% dos cancros da mama triplos-negativos não expressam CK1944. Por isso, torna-se essencial a pesquisa por imuno-histoquímica da expressão de CK19 no tumor primário previamente à BGS para determinar a possibilidade de utilização desta técnica molecular44.
Cirurgia axilar após quimioterapia neo-adjuvante (QTNA)
Um downstaging do envolvimento metastático ganglionar verifica-se em 30 a 40% dos doentes tratados com QTNA19. Com este conhecimento, torna-se possível uma diminuição da extensão da cirurgia axilar com possibilidade de BGS em doentes com doença ganglionar axilar residual após QTNA19,46. Várias meta-análises demonstraram que a BGS após QTNA revelou uma taxa de deteção do GS em média superior a 90% e taxa de FN de cerca de 10%47,48,49.
Doentes cN0 pré-QTNA
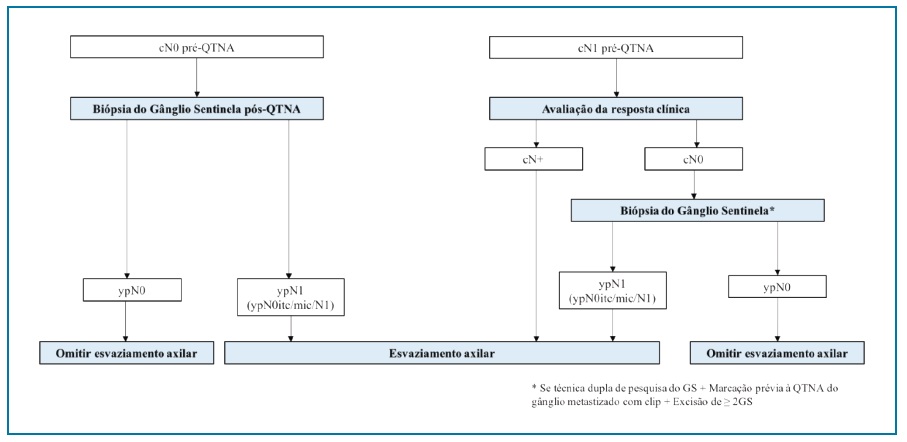
Estudos que avaliaram a eficácia diagnóstica da BGS pós-QTNA, especificamente neste subgrupo de doentes, revelaram taxas de deteção do GS e de FN similares às encontradas em doentes submetidos à BGS no contexto de cirurgia primária do cancro da mama, independentemente das técnicas de pesquisa e estudo histológico do GS46,50. Portanto, conclui-se que a BGS pode ser realizada com segurança após QTNA em doentes cN0 e em doentes com BGS negativa pode-se omitir a cirurgia axilar adicional 5,31,46,50 (Figura 2).
Doentes cN+ pré-QTNA
Um foco importante de investigação tem sido o papel da BGS após QTNA em doentes que apresentam metástases ganglionares axilares na apresentação inicial. A taxa predefinida ótima de identificação do GS e de FN é de 90% e inferior a 10%, respetivamente46. Os estudos randomizados SENTINA, ACOSOG Z1071e SN FNAC revelaram taxas de FN entre 13 e 14% e taxas de deteção do GS entre 80,1% e 92,9%51-53. Quando pelos menos três GS foram identificados, a taxa de FN foi inferior a 10% (FN 7-9% ≥3 GS, 19-21% 2GS)51,52. Por outro lado, a utilização de técnica dupla no mapeamento do GS demonstrou também reduzir significativamente a taxa de FN no estudo ACOSOG Z107152. Quando se combinou a realização de ecografia à BGS após QTNA, verificou-se que na combinação das duas técnicas a taxa de FN foi de 9,8%52.
Desta forma, a BGS demonstrou ser vantajosa, nomeadamente quando se utiliza a técnica dupla de pesquisa do GS, quando são examinados três GS e quando a ecografia pós-QTNA não mostra gânglios axilares suspeitos, resultando numa taxa de FN clinicamente aceitável31,46. A necessidade de identificação de pelo menos 3 GS para um estadiamento axilar pós-QTNA eficaz potencialmente limita a utilização da BGS, uma vez que em mais de dois terços dos casos são identificados menos que 3 GS54. Nos estudos ACOSOG Z1071 e SENTINA só em 56% e 34% dos doentes foram removidos pelos menos 3 GS51,52. Como alternativa, foram desenvolvidos métodos que incluem a marcação por clip ou tatuagem de gânglios axilares anormais no momento da biópsia prévia à QTNA, para permitir a localização e a excisão do gânglio metastático conhecido após a QTNA31,46. Esta estratégia em combinação com a BGS permite uma taxa de FN inferior a 5%31,46.
Para doentes cN+ pré-QTNA que permanecem com axila clinicamente positiva após QTNA (cN+), o esvaziamento axilar é considerado a abordagem terapêutica standard, incluindo aqueles com micrometástases5,31,46. No entanto, está a ser estudada a hipótese de a RT axilar poder fornecer controlo regional da doença comparável ao EA em doentes com doença residual axilar no GS31,46. O estudo randomizado controlado Alliance A011202 que se encontra em curso irá comparar a recorrência locorregional, sobrevida global e desenvolvimento de linfedema do braço nos doentes submetidos a EA vs RT axilar após BGS positivo para doença residual55.
Para doentes que convertem de cN+ em cN0 após QTNA, é controversa a omissão do esvaziamento axilar, sobretudo pela falta de estudos prospetivos que avaliem a taxa de recorrência ganglionar31,46,51-53. Galimbert et al, num estudo retrospetivo englobou 396 doentes cT1-4, cN0/1/2 que se tornaram ou mantiveram-se cN0 após QTNA e realizaram BGS sem realização de EA posterior se BGS negativa. Após um follow-up mediano de 61 meses, a sobrevida global aos 5 anos foi de 93,3% naqueles cN0 inicialmente e 86,3% naqueles inicialmente cN1-2. Recorrência axilar ocorreu em apenas 1 doente (0,7%) inicialmente cN1-256. Estes resultados sugerem que a BGS é aceitável em doentes cN1-2 que se tornaram cN0 após QTNA após combinação de várias técnicas que minimizem a taxa de FN, nomeadamente mapeamento duplo, identificação de pelo menos 2 GS, marcação ganglionar previamente à QTNA e realização de ecografia axilar pós QTNA31,46,56. As recomendações atuais consideram também a omissão do esvaziamento axilar nestes casos desde que garantidas medidas que minimizem a taxa de FN5. Se não for possível garantir estas estratégias e nos casos em que existe doença metastática no GS, incluindo ITC e micrometástases, está indicado completar o EA5,31,46 (Figura 2).
A técnica OSNA após quimioterapia neoadjuvante
A eficácia diagnóstica do estudo IO convencional do GS pós-QTNA parece ser comparável aos casos de estudo IO do BGS na cirurgia primária46. Contudo, a eficácia diagnóstica da técnica OSNA nestas doentes tem sido demonstrada ser menor no estudo IO do GS57. Takamoto K et al. descreve uma sensibilidade de cerca de 75% com especificidade de 91,2%57. As principais razões apontadas para a baixa sensibilidade da técnica OSNA no estudo do GS após QTNA são as mudanças histopatológicas severas provocadas pela QTNA, incluindo fibrose estromal e elastose, e a redução da expressão de CK19 induzida pela QTNA, que sugerem que a maioria das micrometástases dos GS podem não ser detetadas pelo método OSNA57. Por estes achados e a necessidade de mais estudos incluindo este grupo de doentes, atualmente não está recomendada a sua utilização neste contexto. Achados morfológicos mínimos ou incertos mais frequentes após QTNA são melhor avaliados com o método histopatológico convencional com recurso a imuno-histoquímica19,46.
Conclusão
Em resumo, nas últimas décadas assistimos a um avanço significativo na abordagem da axila no cancro da mama, resultando em menos esvaziamentos axilares em grupos específicos de doentes. Também nas técnicas de estudo do GS, o método OSNA demonstrou ser uma técnica eficaz com papel prognóstico importante. Contudo, ainda se aguardam resultados para refinar a abordagem da axila de doentes com BGS positiva que não foram incluídos, sub-representados ou não especificados nos ensaios clínicos mencionados.
Por último, a utilização da BGS em doentes com cancro da mama submetidos a QTNA está a evoluir. A BGS parece ser um método adequado de estadiamento axilar para pacientes que são cN0 pré-QTNA e estudos mostram que pode ser adequado para pacientes selecionados cN+ pré-QTNA que se convertem em cN0 após o tratamento.