Introdução
As malformações do sistema urinário são as anomalias mais frequentemente diagnosticadas no período pré-natal (20-30%)1,2,3. O seu espetro é amplo, desde malformações assintomáticas até situações graves, incompatíveis com a vida4. O diagnóstico pré-natal é essencial para o tratamento precoce e prevenção da deterioração da função renal.
O presente artigo tem como objetivo rever as malformações mais frequentes do sistema urinário, com ênfase sobre os achados ecográficos e diagnóstico diferencial, e propor um protocolo de atuação clínica.
Para efeitos desta revisão, as anomalias serão classificadas em: anomalias de número, anomalias de posição/fusão, anomalias do parênquima renal e dilatações do sistema coletor.
Avaliação ecográfica do sistema urinário fetal
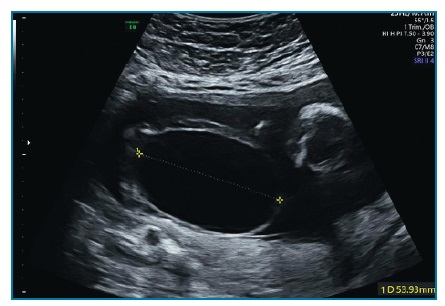
Em Portugal, é realizada por rotina uma ecografia no 1º trimestre (11-13+6 semanas). Nesta fase, a bexiga apresenta estrutura anecóica com paredes hiperecogénicas, circundada pelas artérias umbilicais, que podem ser visualizadas com color Doppler (figura 1-A)5. Os rins poderão eventualmente já ser visíveis5.
Esta avaliação inicial é posteriormente com-plementada com a ecografia morfológica (20-22 semanas). Na avaliação dos rins, podemos ver uma zona externa e hiperecogénica, o córtex, e uma zona interna e hipoecogénica, a medula. No plano axial, os rins apresentam-se como estruturas arredondadas na região paravertebral, sendo este o plano da medição da largura e espessura dos rins (figura 1-B). A medição do comprimento renal é realizada no plano coronal, no qual os rins apresentam forma elíptica (figura 1-C), com as glândulas suprarrenais visíveis cranialmente5.
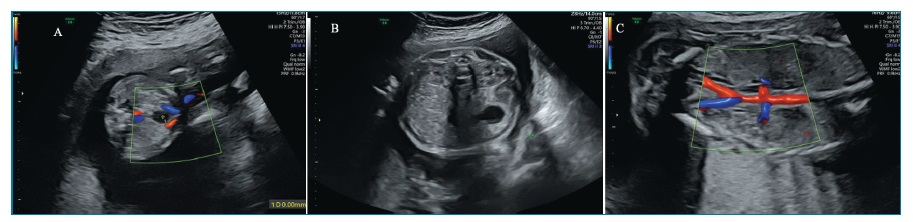
Figura 1 Aparência ecográfica normal dos rins, artérias renais e bexiga. A- Artérias umbilicais a circundar a bexiga (cursor) com Doppler a cores; B - Visualização dos rins na região paravertebral - Plano Axial; C - Visualização dos rins e artérias renais com Doppler a cores - Plano Coronal
Os ureteres e a uretra habitualmente não são visíveis na ecografia, exceto quando dilatados5.
A partir das 16-17 semanas, o líquido amniótico é produzido quase exclusivamente através da urina fetal, pelo que a presença de oligoâmnios/anidrâmnios a partir desta idade gestacional requer sempre investigação5,6.
Anomalias de número
Agenesia renal
Corresponde à ausência congénita de um ou ambos os rins1.
A sua prevalência é de 1:2000 (unilateral) e de 1:5000 nascimentos (bilateral). É mais frequente no sexo masculino e à esquerda7,8.
Ecograficamente, na AR unilateral não se visualiza um dos rins (figura 2-A), sendo a bexiga e o volume de líquido amniótico (VLA) normais. O rim único pode encontrar-se aumentado de tamanho em 90% dos fetos9,10. Uma razão entre os diâmetros anteroposterior e transverso do rim superior a 0,9 sugere hipertrofia renal compensatória9. O Doppler a cores demonstra uma única artéria renal (figura 2-B). A bilateral caracteriza-se por ausência de visualização de rins, bexiga e das artérias renais e anidrâmnios (a partir das 17 semanas). As glândulas suprarrenais assumem uma forma discoide e movem-se lateral e inferiormente11,12. Como exame complementar para despiste de outras malformações com oligo/anidrâmnios, poderá realizar-se ressonância magnética (RM) fetal13.
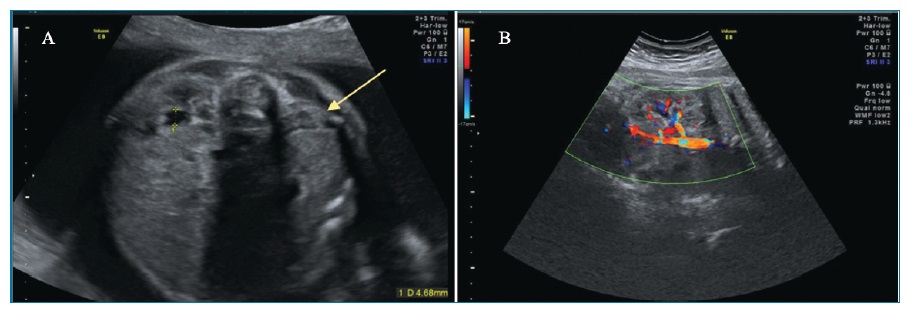
Figura 2 A- Agenesia renal esquerda com glândula suprarrenal a preencher a fossa renal (seta). B- Artéria renal esquerda visível e ausência de visualização da artéria renal direita no Doppler a cores
Na maioria dos casos, é uma anomalia isolada esporádica, estando em 20-30% dos casos associada a Síndrome de Fraser, associação VACTERL, associação MURCS, síndrome de regressão caudal, síndrome de Rokitansky-Kuster-Hauser, entre outros5.
Perante uma AR, é importante pesquisar malformações adicionais do rim contralateral, genitourinárias, musculoesqueléticas (40%) ou cardiovasculares (15%). Se presentes, poderá ser realizado cariótipo/array-CGH. Nos fetos do sexo feminino, deverá ser pesquisada a presença de malformações Müllerianas 5,14. Em 1-2% dos casos associa-se a alterações cromossómicas, sendo a mais frequente a trissomia 18.
A AR bilateral pode cursar com morte fetal in utero em até 33% dos casos15. Como resultado do oligoâmnios precoce grave, surgem eventos disruptivos designados de sequência de Potter (hipoplasia pulmonar, alterações na face e pele e deformações dos membros), sendo lícito o casal ponderar interrupção médica da gravidez (IMG)5. Não há evidência científica robusta que apoie a realização de amnioinfusões seriadas, implementadas apenas em contexto investigacional4,16.
No caso da AR unilateral isolada, não há indicação para ecografias seriadas, dependendo apenas de critérios obstétricos. O prognóstico é bom, quando o rim contralateral não se encontra afetado. Em cerca de 20% dos casos, poderá ocorrer refluxo vesicoureteral (RVU) neste rim único8. A longo prazo, poderão apresentar hipertensão (16%), microalbuminúria (21%) e insuficiência renal (10%)8.
O risco de recorrência varia entre 3-6%, podendo atingir os 8% quando associada a múltiplas anomalias congénitas17,18. Os progenitores deverão realizar também avaliação ecográfica. Se algum for afetado, o risco de recorrência sobe para 15-20%5.
Rim duplex
Caracteriza-se por um rim com dois sistemas pielocaliciais e artérias renais e duplicação parcial ou completa dos ureteres. Na duplicação parcial, mais comum, existe um único ureter ou dois ureteres que se unem proximalmente à inserção na bexiga. Na completa, existem 2 ureteres distintos. O ureter do polo superior insere-se habitualmente inferomedialmente à sua normal inserção, podendo também terminar na vagina ou uretra. O ureter do polo inferior drena lateralmente no trígono vesical. Esta inserção ectópica predispõe a obstrução ou a RVU19.
A prevalência descrita varia entre 1:70-1:50019. É mais frequente à esquerda e unilateral em 83-90% dos casos20,21,22,23,24.
Existem achados ecográficos característicos, mas não patognomónicos: presença de hidronefrose, mais comummente do polo superior do rim; ureterocelo (dilatação quística da porção intravesical do ureter causada pelo estreitamento do orifício ureteral) e megaureter, devido a refluxo ou obstrução da junção vesicoureteral25.
A incidência de aneuplodias cromossómicas não se encontra aumentada25.
A vigilância destas grávidas deve incluir ecografias mensais para avaliação do grau de dilatação e VLA26.
O prognóstico é favorável, com a maioria sem compromisso da função renal. Contudo, apresentam RVU em 70% dos casos e risco aumentado de infeção (20 vezes)25,27.
Anomalias de posição/fusão
Durante a embriogénese, os rins migram da sua posição inicial na pelve para a fossa renal e rodam de uma posição horizontal para vertical28. Qualquer disrupção na migração embriológica normal pode resultar numa anomalia da posição/fusão do rim, das quais se destacam o rim pélvico e o rim em ferradura.
Rim pélvico
A sua prevalência varia entre 1:700-1:1000 nascimentos5. Predomina no lado esquerdo e sexo masculino. É bilateral em 12% dos casos.
Ecograficamente, visualiza-se o rim na pelve acima da bexiga, encontrando-se a glândula suprarrenal a preencher a fossa renal vazia, com bexiga e VLA normais. O Doppler a cores é útil para localizar o hilo do rim ectópico5. Deverá ser realizado diagnóstico diferencial com AR ou ectopia renal cruzada (rins presentes, mas fundidos de um dos lados)5.
Pode associar-se a malformações esqueléticas, cardíacas ou genitourinárias28-30, sendo apenas nestes casos com incidência aumentada de alterações cromossómicas ou genéticas, justificado o cariótipo/array com hibridação genómica comparativa (array-CGH)5,30.
A vigilância destas situações inclui ecografias mensais para diagnóstico de hidronefrose de aparecimento tardio. Adicionalmente, deverá ser proposta ecografia aos progenitores5.
O rim ectópico poderá apresentar diminuição da sua função e associar-se a RVU em 5-30% dos casos e obstrução da junção pieloureteral (OJPU)5,30. O prognóstico é mesmo assim favorável, desde que o rim contralateral desenvolva hipertrofia compensatória30.
Nos casos isolados, não apresenta risco de recorrência30.
Rim em ferradura
A sua prevalência é de 1:400 nascimentos, predominando no sexo masculino5.
Ecograficamente, observa-se fusão dos polos inferiores dos rins, anteriormente aos grandes vasos. Nos planos coronal ou axial, visualiza-se uma ponte de tecido a conectar os rins anteriormente. A bexiga e VLA são normais.
Pode associar-se a aneuploidias cromossómicas (Síndrome de Turner em 30% dos casos ou Trissomia 18 em 20%); a síndromes congénitos (15% dos casos, mais frequente o síndrome de regressão caudal) e ainda, em 1/3 dos casos, a malformações genitais, cardíacas, esqueléticas e do sistema nervoso central (SNC)5. Se isolado ou parte do síndrome de Turner, sem risco de recorrência. No caso da trissomia 18 livre, o risco de recorrência é baixo (1%).
Deverá ser pedido cariótipo/array-CGH fetal e a vigilância incluir ecografias seriadas mensais para pesquisa de hidronefrose de aparecimento tardio.
A maioria dos pacientes é assintomática, embora o risco de infeções, nefrolitíase (70%), hidronefrose (80%) e tumores renais esteja aumentado2.
Anomalias do parênquima renal
Doença Quística Renal (DQR)
A DQR manifesta-se ecograficamente por aumento da ecogenicidade renal. Os rins são considerados hiperecogénicos quando, a partir das 15-17 semanas, apresentam maior ecogenicidade do que o fígado ou o baço (figura 3)5,31.
A avaliação ecográfica de fetos com rins hiperecogénicos deverá incluir: avaliação do VLA, tamanho/volume do rim, diferenciação corticomedular e localização/tamanho dos quistos renais. Adicionalmente, deverá ser questionada história familiar de DQR. A RM poderá ser útil para caracterização de malformações adicionais, sobretudo na presença de oligo/anidrâmnios32.
Na DRQ bilateral, oferecer sempre estudo genético, independentemente da presença de oligoâmnios ou malformações extrarrenais. Na unilateral apenas na presença de malformações extrarrenais32. O estudo genético poderá incluir análise molecular (PKD1,PKD2, PKHD1), array-CGH ou painéis de sequenciação de nova geração33.
O parto deverá ocorrer sempre em unidade com cuidados perinatais diferenciados32.
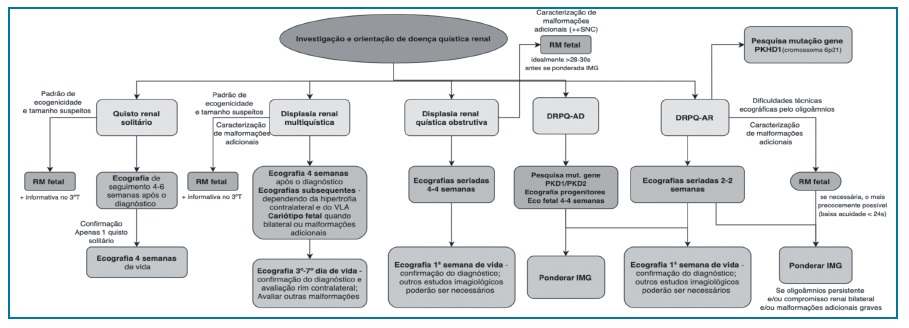
O diagnóstico diferencial de rins hiperecogénicos é realizado de acordo com o fluxograma 1.
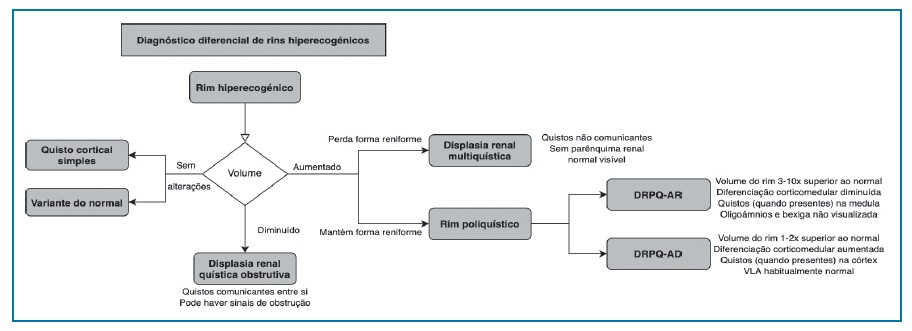
Fluxograma 1 Diagnóstico diferencial de rins hiperecogénicos. Fluxograma adaptado de Paladini (2014). Legenda: DRPQ-AR - doença renal poliquística autossómica recessiva; DRPQ - doença renal poliquística autossómica dominante; VLA - volume de líquido amniótico
A investigação e orientação da DQR encontra-se descrita no fluxograma 2.
Displasia Renal Multiquística (DRMQ)
A sua prevalência é de 1:1000-5000 nascimentos5,14. Em 75-80% dos casos é unilateral e mais frequente no sexo masculino34,35.
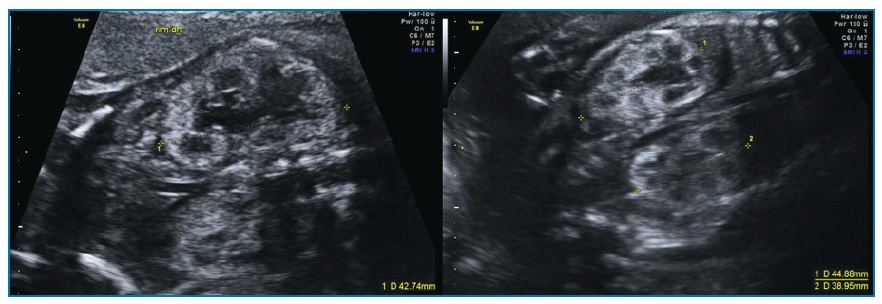
O parênquima renal é substituído por múltiplos quistos irregulares de tamanho variável não comunicantes entre si (figura 4). Não se visualiza tecido nem pelve renal normais. O ureter e a artéria renal ipsilateral podem estar ausentes. Quando bilateral, associa-se a anidrâmnios e ausência de bexiga.
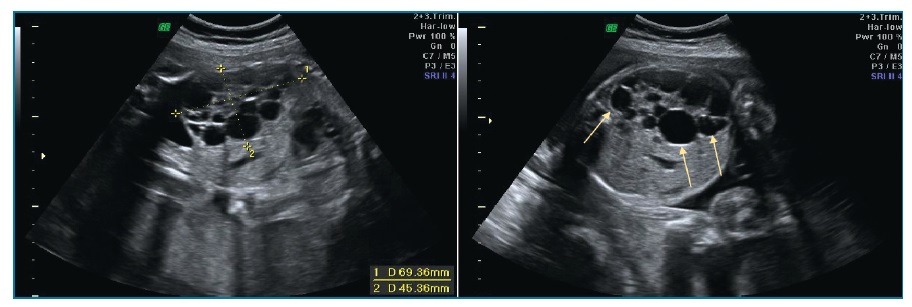
Figura 4 Displasia renal multiquística. Múltiplos quistos de tamanhos variáveis não comunicantes entre si (seta)
Em 25-40% dos casos, pode associar-se a anomalias do rim contralateral ou a RVU, AR e OJPU34,36. Estão também descritas malformações cardíacas, SNC, gastrointestinais ou dos membros. O risco de cromossomopatias é baixo, quando isolada (2-4%), podendo atingir os 15-18% se bilateral ou 25-28% quando associado a outras anomalias 5. Em cerca de 10% dos casos, existe um síndrome associado, sendo os mais frequentes os síndromes branquio-oto-renal, polidactilia-costela curta, Meckel-Gruber e associação VACTERL5. Na forma isolada, o risco de recorrência é de cerca de 3%. Quando associado a síndromes, o risco depende do síndrome em questão5.
As grávidas com DRMQ deverão realizar ecografias mensais para detetar hidronefrose de início tardio. Quando unilateral e em formas isoladas, o prognóstico é bom, sendo o maior fator prognóstico o tamanho do rim contralateral e a presença/ausência de malformações adicionais37. Nas bilaterais, há risco de hipoplasia pulmonar. No período pós-natal, o rim pode sofrer involução progressiva, podendo mesmo desaparecer em aproximadamente 40% dos casos38,39.
Doença Renal Poliquística Autossómica Recessiva (DRPQ-AR)
A DRPQ-AR representa uma forma grave de DQR que envolve o rim e o trato biliar1. É subdividida nos tipos perinatal (40% dos casos), neonatal, infantil e juvenil, de acordo com a idade de aparecimento. A sua prevalência é de 1:20.000 nascimentos. Resulta de uma mutação no gene PKHD11.
Ecograficamente, caracteriza-se por rins aumentados de volume bilateralmente (3-10 vezes o normal) e hiperecogénicos, com fraca diferenciação corticomedular e aparecimento gradual de oligoâmnios a partir do 2º trimestre1. A bexiga habitualmente não é visualizada.
O prognóstico é muito reservado quando a manifestação é perinatal (40-50% morrem no período neonatal precoce por hipoplasia pulmonar). A maioria dos sobreviventes desenvolve hipertensão e ocorre progressão para doença renal crónica com necessidade de transplante renal em 50% dos casos5. Os tipos infantil e juvenil resultam em falência renal crónica, fibrose hepática e hipertensão portal.
Nos casos em que se prossiga com a gravidez, a vigilância ecográfica deverá ser realizada a cada 2-4 semanas com avaliação do tamanho renal, crescimento fetal e VLA1.
O risco de recorrência é de 25%1. Dado o seu padrão AR é fundamental uma consulta de genética para programação de gravidez futura.
Doença Renal Poliquística Autossómica Dominante (DRPQ-AD)
A DRPQ-AD é mais prevalente (1:1000). Raramente diagnosticada no período pré-natal (2-5%), a clínica surge tipicamente entre a 3ª-5ª décadas de vida5. Resulta de uma mutação nos genes PKD1 (85%) ou PKD2 (10-12%)1,5.
Quando a manifestação é pré-natal, os rins encontram-se aumentados de tamanho bilateralmente (1-2 vezes o normal) e hiperecogénicos. A presença de quistos é variável e só raramente cursa com oligo/anidrâmnios1.
A manifestação da doença no período pré-natal é um sinal de mau prognóstico, podendo associar-se a hipertensão durante o primeiro ano de vida. Se oligoâmnios ou hipoplasia pulmonar, a mortalidade a 1 ano poderá atingir os 40% e os 80%, respetivamente1. O risco de recorrência é de 50%, exceto se mutação de novo.
O diagnóstico diferencial entre DRPQ-AD e DRPQ-AR é realizado através de diagnóstico molecular ou história familiar, dada a variabilidade do fenótipo e da altura de apresentação. É importante ter ainda em consideração que rins hiperecogénicos podem ser uma variante do normal, especialmente quando isolados e com VLA normal. Adicionalmente, também poderão surgir associados a outras malformações nos síndromes de Meckel-Gruber, Beckwith-Wiedemann, Bardet-Biedl, trissomia 13 e nefronoftise1.
Dilatações Do Sistema Coletor (DSC)
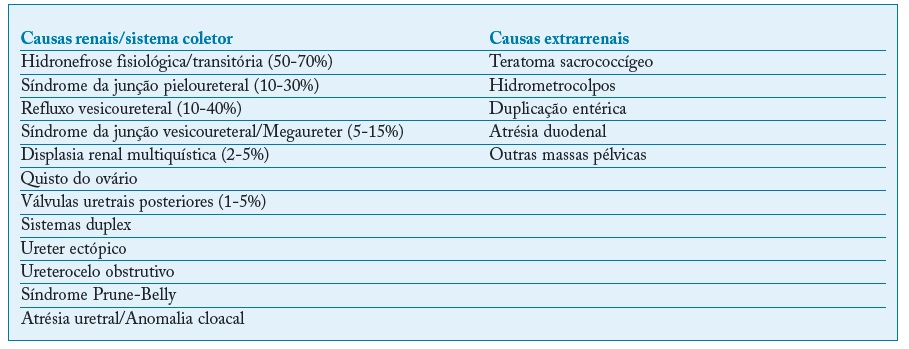
Um dos achados mais frequentes de diagnóstico pré-natal (1-3% das gravidezes)40. Apresenta um elevado espetro de manifestações, desde dilatações fisiológicas transitórias até uropatias com evolução para doença renal significativa41 (Tabela I).
Tabela I Etiologia renal e extrarrenal das dilatações do sistema coletor renal. Adaptada de Woodward (2002) e Nguyen (2010)42,44
Na avaliação ecográfica, é fundamental avaliar: localização dos rins; quantificação e caracterização da dilatação piélica e/ou calicial; definição da ecogenicidade renal e diferenciação corticomedular; verificação da existência de megaureter; verificação da existência e tipo de quistos; quantificação do VLA; visualização da bexiga (parede, forma, esvaziamento vesical); pesquisa de malformações extrarrenais e sexo fetal.
Para efeitos deste protocolo, as DSC serão apresentadas de acordo com o achado ecográfico (hidronefrose, megaureter e megabexiga).
Hidronefrose
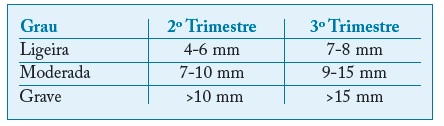
Considera-se hidronefrose a dilatação da pelve renal, com ou sem dilatação dos cálices. Existem vários critérios para o seu diagnóstico, nomeadamente o diâmetro anteroposterior da pelve renal (DPR)42, o sistema de estadiamento da Sociedade de Urologia Fetal43 e o sistema multidisciplinar de classificação da dilatação do trato urinário44,45. O sistema habitualmente preferido pelos obstetras é o do DPR46. Apesar de não haver consenso nos valores que definem uma dilatação clinicamente significativa, classicamente considera-se um DPR superior a 4 mm no 2º trimestre e a 7 mm no 3º trimestre45.
A sua prevalência varia entre 0,6-5,4%, dependendo do critério de diagnóstico utilizado47. É mais frequente no sexo masculino48 e na maioria dos casos, unilateral49.
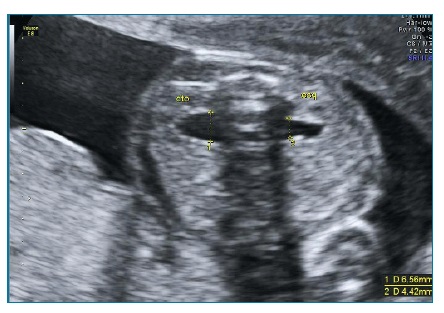
Ecograficamente, deverá proceder-se à medição do maior DPR obtido em corte transversal do abdómen, com a bexiga fetal vazia (figuras 5 e 6). De acordo com a medição obtida em cada trimestre é determinado o grau de dilatação piélica (Tabela II).
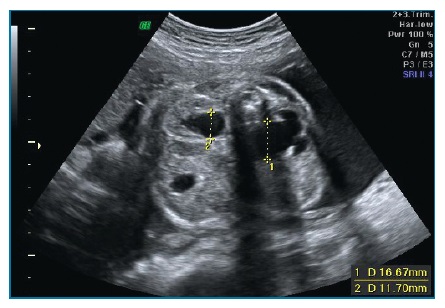
Figura 6 Hidronefrose grave à esquerda (DPR 16,67 mm) e moderada à direita (DPR 11,7 mm) em ecografia do 3º trimestre da gravidez
Tabela II Classificação da gravidade da hidronefrose de acordo com o trimestre de gravidez. Adaptado de Nguyen (2010)44
A etiologia mais frequente é a hidronefrose fisiológica/transitória, que habitualmente resolve durante o terceiro trimestre ou após o parto, não representando doença significativa50,51. A presença de dilatação pielocalicial sem dilatação do ureter e da bexiga, mais comummente unilateral, é altamente sugestiva de OJPU36,44. Já se a causa for o RVU, será visível dilatação intermitente da pelve renal, de grau variável, que aumenta após a micção36.
Nas formas isoladas, existe baixa associação a alterações cromossómicas. Pode-se associar a malformações no rim contralateral, como DRMQ, ectopia ou AR. No contexto sindrómico, associa-se a malformações cardíacas, displasias esqueléticas e anomalias da coluna vertebral, justificando nestes casos cariótipo fetal e/ou array-CGH.
O seguimento ecográfico é dependente da idade gestacional ao diagnóstico, da gravidade da dilatação, se é bilateral ou se há suspeita de obstrução do trato urinário inferior45. A orientação específica encontra-se descrita no fluxograma 3. Não existe evidência para antecipação do parto.
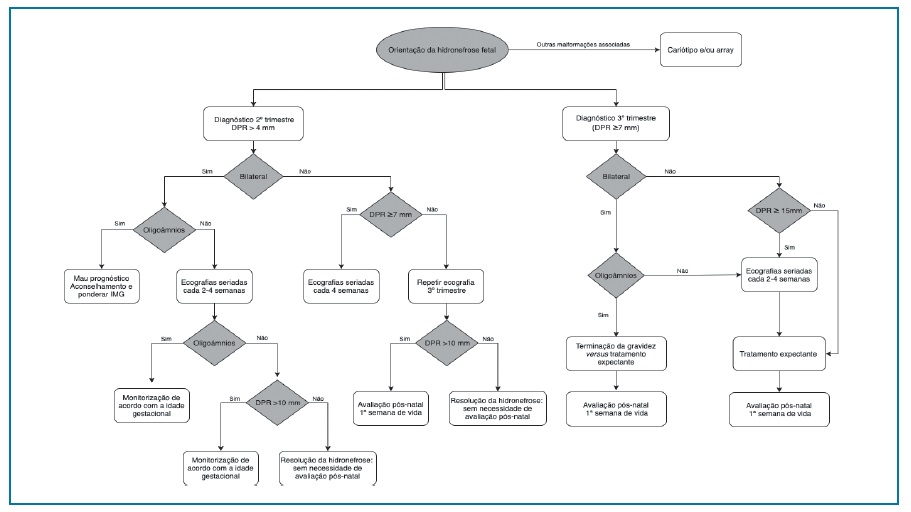
Fluxograma 3 Orientação da hidronefrose fetal. Legenda: DPR - diâmetro da pelve renal. IMG - interrupção médica da gravidez. Fluxograma adaptado de Liu41 (2014).
Até 88% das DSC resolvem no período pré-natal ou neonatal precoce52. Em cerca de 20% dos casos, poderá requerer seguimento pós-natal e eventualmente cirurgia42. A hidronefrose moderada é geralmente progressiva e em mais de 50% dos casos a cirurgia é necessária nos primeiros 2 anos de vida.
Megaureter
Hidronefrose associada a dilatação do ureter, sem dilatação da bexiga (figura 7)44. Quando unilateral, bexiga e VLA são normais. A sua prevalência é de 1:6500 nascimentos.
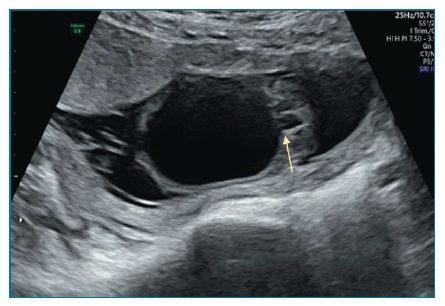
Figura 9 Dilatação da bexiga por válvulas uretrais posteriores (sinal em buraco de fechadura - seta)
Pode ser primário, quando resulta de uma anomalia funcional ou estrutural da JVU, ou secundário a uma anomalia da bexiga ou uretra2. As causas mais frequentes são a obstrução da junção vesicoureteral (OJVU), o RVU, ureterocelo e ureter ectópico5. Pode associar-se a rim duplex, RVU e anomalias genitais, sobretudo em fetos do sexo feminino.
A vigilância deverá incluir ecografias mensais.
Megabexiga
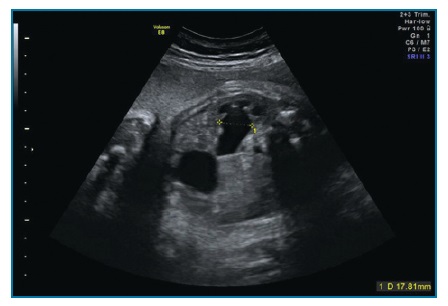
No 1º trimestre define-se como diâmetro longitudinal da bexiga superior ou igual a 7 mm (figura 8)1. A partir do 2º trimestre, as definições não são tão claras: diâmetro longitudinal da bexiga > (idade gestacional em semanas + 2 mm); espessura da parede da bexiga >3 mm ou bexiga aumentada de tamanho (2º ou 3º trimestre) sem se visualizar esvaziamento ao fim de 45 minutos1,53.
A sua prevalência ronda 1:3000 nascimentos. As causas podem ser obstrutivas (válvulas uretrais posteriores (VUR), atrésia uretral ou disgenesia cloacal) ou não obstrutivas (doenças neurológicas, cromossómicas ou genéticas, das quais se destaca o síndrome de megabexiga-microcolón-hipoperistaltismo intestinal (MMHI))1,5.
Ecograficamente, nas VUR (25% dos casos, apenas no sexo masculino) verifica-se dilatação da uretra proximal decorrente da obstrução incompleta ou intermitente da uretra (sinal do ‘buraco de fechadura’ - figura 9), dilatação e hipertrofia da bexiga (espessura da parede > 3mm) e graus variáveis de hidroureteres, hidronefrose, displasia renal cística, oligoâmnios (>17 semanas) e hipoplasia pulmonar36.
No caso de atrésia uretral (condição mais grave) não há excreção de urina, visualizando-se a bexiga muito aumentada precocemente (12 semanas). A partir das 16/17 semanas associa-se a anidrâmnios. É uma condição letal5.
O síndrome MMHI, mais frequente no sexo feminino, cursa com hidronefrose, megabexiga, hidrâmnios e dilatação do estômago1, sendo o estudo genético útil para diagnóstico.
Em aproximadamente 8-20% dos casos encontram-se alterações cromossómicas (trissomia 13, 18 ou 21) e em 40% dos casos malformações cardíacas ou gastrointestinais, sendo imperativa uma ecografia detalhada e cariótipo/array-CGH.
Dependendo da gravidade e da idade gestacional, pode ser formulada IMG, transferência para centro diferenciado para derivação vesical, terminação da gravidez ou atitude expectante com cirurgia pós-parto.
A intervenção fetal (shunts vesicoamnióticos e cistoscopia fetal) para causas obstrutivas permanece controversa, uma vez que se associa a elevadas taxas de complicações, sem evidência de melhoria da sobrevida ou da função renal a longo prazo45. Testes de avaliação da função renal, como a concentração de b2-microglobulina ou cistatina-C (marcadores da função glomerular) na urina fetal ou dos eletrólitos e osmolalidade urinária (marcadores da função tubular fetal), obtidos por vesicocentese36,41, parecem não ser suficientemente fidedignos para predizer a função renal pós-natal54.
Se for decidido prosseguir com a gravidez realizar ecografias mensais para avaliar a sua evolução e o VLA.
Em alguns casos, sobretudo para dilatações entre 8-12 mm, há resolução espontânea. Diâmetros superiores a 17 mm são mais frequentemente de causa obstrutiva, com progressão para uropatia grave, verificando-se elevada mortalidade perinatal nos casos mais graves12. Nos que sobrevivem, cerca de 30% necessitam de diálise e/ou transplante renal antes dos 5 anos de idade.
Contribuição individual de cada autor
Mariana Dória - Pesquisa bibliográfica, processamento da recolha de dados, revisão científica sobre o tema, escrita do manuscrito e revisão final do trabalho
Ana Mesquita Varejão - Apoio na pesquisa bibliográfica e processamento da recolha de dados e revisão final do trabalho
Inês Sarmento Gonçalves - Revisão final do trabalho
Fátima Soares - Revisão final do trabalho