Introdução
A infertilidade é reconhecida pela Organização Mundial de Saúde (OMS) como uma doença do sistema reprodutivo, definida pela incapacidade de atingir uma gravidez clínica após 12 meses de relações sexuais regulares e desprotegidas1. Contudo, esta definição aplica-se a mulheres com idade inferior a 35 anos. Em idades iguais ou superiores, a infertilidade refere-se à incapacidade de conceber após seis meses de relações sexuais desprotegidas2. A sua prevalência tem vindo a aumentar nas últimas décadas. Estima-se que afete entre 8 a 12% dos casais em idade reprodutiva a nível mundial3. Em algumas regiões do mundo, incluindo a região do sul Asiático, Ásia Central, Médio Oriente e Norte de África, Europa Central e Oriental, podem atingir os 30%4. Com o objetivo de reverter esta situação, muitos casais recorrem a tratamentos de Procriação Medicamente Assistida (PMA). Em 2016, cerca de 3% do total de crianças nascidas em Portugal foram com recurso a PMA5.
A produção excessiva de espécies reativas de oxigénio (ERO) tem um impacto significativo no sucesso das técnicas de PMA6. Um desequilíbrio nas concentrações de oxidantes e antioxidantes designa-se por stress oxidativo (SO). Nesta revisão abordamos as principais fontes de SO no microambiente ovárico, assim como revemos o seu impacto ao nível da idade, obesidade e outras patologias associadas à infertilidade feminina. Por fim, resumimos os principais estudos que recorrem a suplementos alimentares para reverter ou atenuar os danos induzidos pelo SO.
A infertilidade feminina
Estima-se que a infertilidade afete 10% das mulheres em todo o mundo7. Contudo, devido à aplicação de diferentes metodologias e definições de infertilidade, assim como à dificuldade de compilação de todos os dados existentes, este valor pode encontrar-se subestimado7. As principais causas da infertilidade feminina compreendem alterações ovulatórias, obstrução ou lesão das trompas de Falópio, anomalias uterinas e cervicais ou endometriose8. O fator idiopático é também frequente9.
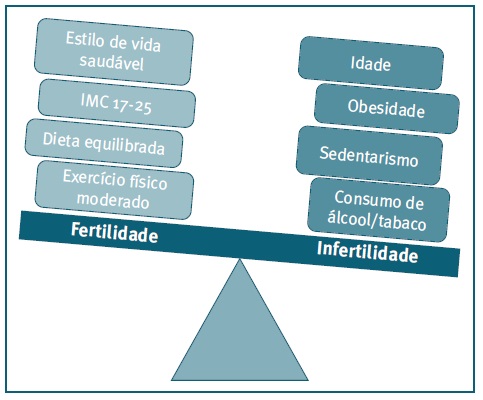
A qualidade dos gâmetas (ovócito e espermatozoide) é determinante para alcançar uma gravidez sendo influenciada pelo estilo de vida (i.e., hábitos tabágicos, consumo de álcool, prática de exercício físico) assim como pela exposição ambiental (i.e., raios UV, poluição, químicos) (8), (10. No caso da mulher, a idade reprodutiva avançada e o excesso de peso contribuem para o agravamento desta condição (Figura 1) (11), (12. A prática de atividade física sugere uma redução da produção de mediadores oxidativos e um aumento na eficiência mitocondrial o que, associado, resulta na diminuição da produção de ERO, no aumento na produção de ATP e da capacidade antioxidante. (13
Stress oxidativo vs reprodução
As células possuem mecanismos de defesa contra as ERO, existindo um equilíbrio entre oxidantes e antioxidantes. As ERO, são caracterizadas pela carência de eletrões de valência (i.e., anião radical superóxido (O2 -) ou pela sua poderosa capacidade oxidativa (i.e., peróxido de hidrogénio (H2O2), peroxinitrito (ONOO-))14. Estas obtêm estabilidade ao adquirir eletrões provenientes de lípidos, ácidos nucleicos, proteínas ou de moléculas vizinhas15. Contudo, tal ação desencadeia uma cascata de reações que acaba por resultar em danos significativos nas estruturas celulares e respetiva função. Por outro lado, existem os antioxidantes enzimáticos e não enzimáticos, ambos essenciais para manter níveis adequados de ERO. Os Antioxidantes enzimáticos incluem a catalase (CAT), superóxido dismutase (SOD), glutationa redutase (GSR) e glutationa peroxidase (GPx) (16. Em alternativa, os antioxidantes não enzimáticos incluem as vitaminas C e E, o β-caroteno, o zinco, entre outros17.
No ovário, existem várias fontes potenciais de ERO, nomeadamente os macrófagos e os neutrófilos residentes18. No entanto, as ERO nem sempre estão associadas a efeitos negativos. Sabe-se que estas desempenham um papel de relevo na regulação da angiogénese durante o processo de maturação folicular. Grandes quantidades de ERO são produzidas durante o transporte de eletrões, indicando que as células da granulosa são capazes de potenciar o estado pró-oxidante folicular. A meiose I é induzida por um aumento de ERO e inibida por agentes antioxidantes, reforçando o seu papel na ovulação19. Por outro lado, estas afetam negativamente a progressão da metáfase II, pois estão associadas a danos no DNA e à inibição na produção de ATP20. Além do mais, estudos sugerem que as ERO estão envolvidas na perda da função esteroidogénica das células da granulosa, característica de atresia folicular. A formação de ERO pela NADPH oxidase está descrita como essencial para a angiogénese que acompanha estes processos21.
Por outro lado, à exceção do folículo maduro, os folículos iniciam o processo de apoptose promovido pelas ERO22. Concomitantemente, a síntese de estrogénio induzida pela FSH e a sobrexpressão da catalase nos folículos em crescimento, equilibram o processo de apoptose, mantendo o normal funcionamento da função ovárica19. Durante a fase lútea, são necessárias grandes quantidades de progesterona. As ERO produzidas no corpo lúteo, estão envolvidas na degradação estrutural e funcional do mesmo19. Deste modo, as ERO e os antioxidantes afetam a síntese de progesterona na fase lútea. No segundo trimestre da gravidez, a ocorrência de SO é considerada natural, sendo suportada pelo aumento da produção de peróxidos lipídicos, radicais livres e vitamina E pela placenta ao longo da gestação23.
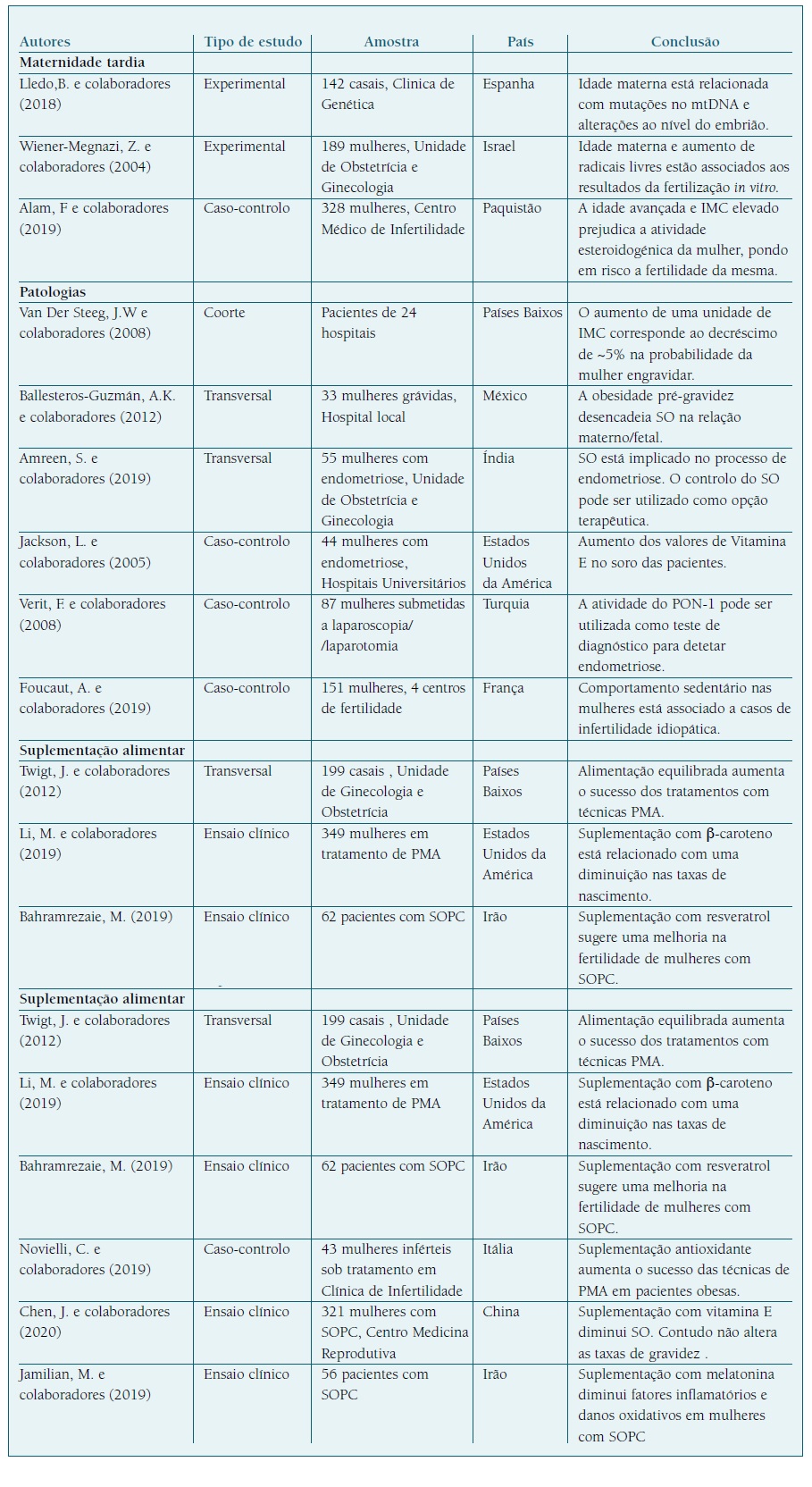
Por último, é unânime que deve existir um balanço adequado entre as quantidades de ERO e antioxidantes que permita o desenvolvimento funcional dos sistemas biológicos. Deste modo, o SO ocorre quando se verifica uma produção excessiva de ERO ou quando os mecanismos de defesa antioxidante se encontram debilitados, desencadeando danos ao nível do DNA, aumento da peroxidação lipídica e alterações na estrutura e função das proteínas24. O balanço inadequado pode influenciar negativamente a foliculogénese, a oogénese e o estabelecimento de uma gravidez viável. O SO desempenha um papel de relevância tanto em casos de infertilidade com patologia associada, como em casos de infertilidade idiopática25. Na verdade, apesar de serem moléculas-chave em processos fisiológicos, quando em excesso, as ERO podem mediar processos patológicos que envolvem o trato reprodutivo25), (26. Além da obesidade, o SO está também associado a outras patologias como a endometriose e a Síndrome do Ovário Policístico (SOP) (27; contudo, em alguns casos, a infertilidade manifesta-se sem explicação aparente. Estas patologias influenciam negativamente as taxas de gravidez assim como os resultados da fertilização in vitro (Quadro I). Após o estabelecimento de uma gravidez, o SO pode ainda afetar a funcionalidade da placenta e, por fim, a saúde e bem-estar fetal28.
Maternidade tardia
A medicina da reprodução enfrenta sérios desafios no que diz respeito à diminuição da qualidade ovocitária, como consequência da maternidade tardia. Com o avançar da idade, são observadas alterações morfológicas e estruturais dos ovócitos, incluindo um aumento do número e disfunção mitocondrial29. Esta disfunção está correlacionada com o envelhecimento das células somáticas, devido ao acúmulo de deleções/mutações do DNA mitocondrial (mtDNA) e à redução da função da cadeia respiratória. O mtDNA é vulnerável e facilmente mutável, devido à sua proximidade com a cadeia respiratória que produz ERO, assim como devido à falta de histonas e ausência de mecanismos de reparação eficientes30. Igualmente nos ovócitos, os danos celulares acompanham o avançar da idade da mulher. Deste modo, o SO interfere com vários componentes celulares que resultam na deterioração da qualidade do ovócito31.
Desde os anos 60 que a maternidade passou a ser cada vez mais uma questão de preferência pessoal da mulher ao invés de uma imposição cultural ou social32. Para a maioria das mulheres nos países desenvolvidos, o alcançar dos objetivos académicos e a realização profissional passaram a estabelecer-se como prioridades prévias à maternidade9), (33. Em vários países da Europa, incluindo Portugal, a média de idade para a primeira gravidez ronda atualmente os 30 anos (Figura 2) (3.
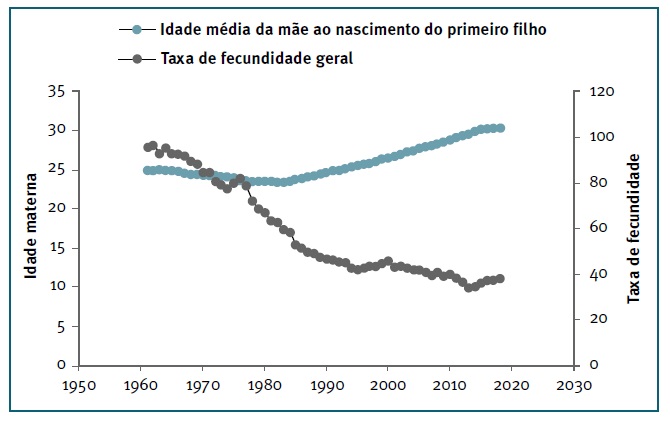
FIGURA 2 Evolução da fertilidade feminina em Portugal. Comparação entre a idade média da mãe ao nascimento do primeiro filho e o número de filhos por cada 1000 mulheres em idade fértil (taxa de fecundidade geral), ao longo das décadas. Fontes/Entidades: Instituto Nacional de Estatística (INE), PORDATA.
Contudo, uma gravidez tardia está associada a um decréscimo no potencial reprodutivo da mulher de cerca de 5% a partir dos 25 anos de idade, atingindo os 7% aos 303. A fertilidade feminina é condicionada pela qualidade dos ovócitos que deteriora com o avançar da idade34. Esta hipótese baseia-se na premissa de que os ovócitos acumulam, entre outros fatores, danos oxidativos, anomalias cromossómicas, alterações da zona pelúcida, assim como se verifica uma diminuição na capacidade de reparação de DNA, durante o tempo em que se encontram em metáfase II (ovócito maduro) (30), (35.
Tem sido atribuído um papel-chave à mitocôndria no que diz respeito ao seu envolvimento na função reprodutora feminina e masculina36), (37. Os mecanismos através dos quais as mitocôndrias intervêm no envelhecimento celular têm sido investigados e caracterizados38. Sob condições fisiológicas normais, as mitocôndrias produzem pequenas quantidades de ERO39. No entanto, em concentrações elevadas, as ERO danificam o mtDNA e as proteínas, conduzindo a um estado de auto-oxidação24. Deste modo, os danos provocados podem levar a um aumento no número de cópias de mtDNA, tal como nos mostra um estudo realizado em Espanha, que analisou o mtDNA de 159 blastocistos provenientes de 142 casais. Os resultados demonstram que mulheres com mais de 40 anos de idade possuem níveis mais elevados de mtDNA em comparação com mulheres mais jovens, resultando em embriões com anomalias genéticas (42.96% vs 17.65%, p < 0.05). Os investigadores admitem que o aumento no número de cópias de mtDNA pode estar relacionado com a acumulação de mutações38.
O fenómeno do envelhecimento é ainda apoiado por um aumento das ERO detetado no líquido folicular de mulheres em idade reprodutiva avançada40. O peróxido de hidrogénio (H2O2) tem sido implicado como um marcador de envelhecimento do ovário, assim como, um aumento da atividade de radicais livres correlacionado com uma diminuição nas taxas de sucesso da fertilização in vitro40), (41.
Um outro estudo, realizado por Alam e colaboradores, procedeu à comparação entre marcadores de stress e quantificação hormonal de 328 pacientes (50% férteis e 50% inférteis) com a idade, Índice de Massa Corporal (IMC), duração e causa da infertilidade. Através de ensaios enzimáticos (ELISA), os autores procederam à quantificação da hormona folículo-estimulante (FSH), LH, estradiol, cortisol e glutationa redutase presentes no soro das pacientes. Os resultados obtidos permitiram concluir que o aumento da idade das mulheres, assim como um IMC elevado, resultam numa diminuição da atividade antioxidante, prejudicando a atividade esteroidogénica e aumentando o risco de infertilidade (OR:2, IC = 95%)8.
Todavia, e apesar de toda a investigação desenvolvida nesta área de estudo, a relação entre o SO, a idade e a infertilidade feminina, continua a gerar controvérsia entre a comunidade científica, sendo que o mecanismo de ação do SO e a relação com o declínio da qualidade oocitária continua por esclarecer/identificar.
Obesidade
A obesidade está associada a um aumento dos fatores inflamatórios e de SO23. O excesso de peso leva a efeitos adversos na mitocôndria do ovócito, assim como a alterações no líquido folicular, perturbando o microambiente ovárico e afetando negativamente o metabolismo do embrião.
No contexto de obesidade, os triglicerídeos em circulação são armazenados nos adipócitos, resultando em hipertrofia adipocitária e necrose por hipoxia acompanhado de infiltração de macrófagos e células T auxiliares42. Os macrófagos libertam citoquinas pró-inflamatórias que ativam a via de sinalização NF-kB que, por sua vez, irá produzir mais citoquinas pró-inflamatórias42. No ovário, o NFkB-p65 promove a expressão de NADPH oxidase produzindo O-. Este radical é posteriormente convertido em H2O2 pela SOD, o que irá aumentar a produção de citoquinas pró-inflamatórias, incluindo TNF-alfa e IL-642. Verifica-se assim uma interdependência entre a obesidade, inflamação e SO.
Estas alterações afetam negativamente o potencial reprodutivo da mulher, nomeadamente com dificuldade de conceção (tanto espontânea, como com recurso a tratamentos de reprodução assistida), hiperandrogenismo, diabetes gestacional, pré-eclâmpsia e aborto espontâneo43. Um estudo de Van der Steeg conclui que por cada aumento de uma unidade de IMC (acima de 29 kg/m2), ocorre um decréscimo de aproximadamente 4% na probabilidade da mulher engravidar [HR:0.96 (95% IC 0.91-0.99)] (44. Deste modo, a perda de peso pode refletir-se num aumento significativo nas probabilidades de engravidar. Este pressuposto foi mais tarde confirmado um estudo do Centro Médico da Universidade de Stanford, que estabeleceu como objetivo para pacientes obesas, a perda de 10% do seu peso, verificando um aumento significativo na taxa de gravidez (88% vs 54%, p = 0.049) e na taxa de nados-vivos (71% vs 37%, p = 0.024) em comparação com as que não perderam peso45.
Em pacientes obesas foi verificado um aumento de ácidos gordos livres, peroxidação lipídica e alteração do perfil das adipocitocinas46. De facto, o efeito combinado de SO e níveis lipídicos aumentados, estimula a oxidação lipídica com consequente acumulação intracelular destes produtos, o que pode influenciar negativamente a função mitocondrial. Como organelos produtores de energia para as células, as mitocôndrias sintetizam ATP via fosforilação oxidativa. Deste modo, um IMC elevado associado a SO e aumento de oxidação lipídica pode igualmente influenciar a função das mitocôndrias das células ováricas e assim afetar a ovulação. Está documentado que o SO afeta o corpo lúteo e a sua capacidade esteroidogénica em ensaios in vitro e in vivo47.
Contudo, o SO não afeta exclusivamente a capacidade de a mulher atingir uma gravidez bem-sucedida. Num estudo recente, Ballesteros-Guzmán e colaboradores evidenciaram a relação entre obesidade pré-gestacional, marcadores de SO e capacidade antioxidante ao longo da relação materno-fetal48. Os autores procederam à avaliação de 33 grávidas acompanhadas numa unidade de obstetrícia local. As pacientes foram divididas em dois grupos de acordo com o seu IMC antes de engravidarem (peso normal e obesas). Após análise das amostras de sangue da mãe, do cordão umbilical e da placenta, os autores concluíram que um estado de obesidade antes da gravidez está associado a uma diminuição da expressão de glutationa peroxidase 4 (GPx4) na placenta (p < 0.05), que por sua vez, se relaciona com a existência de um estado de SO aumentado no recém-nascido48. A família da GPx está presente em diferentes tecidos, incluindo na placenta, conferindo uma proteção antioxidante, sendo que a isoforma GPx4 desempenha um papel fundamental na proteção das membranas contra o SO49.
Existem alguns estudos que abordam os mecanismos pela qual a obesidade pode conduzir à infertilidade; contudo, o mecanismo exato não está totalmente esclarecido. No entanto, as pacientes com IMC elevado, devem ser acompanhadas e informadas sobre a importância da redução de peso, especialmente antes de dar início aos tratamentos de infertilidade, de modo a garantir a obtenção de melhores resultados.
Endometriose
A endometriose é uma das patologias mais comuns em ginecologia, afetando cerca de 10 a 15% das mulheres em idade reprodutiva50. Os indícios mais comuns são a dor pélvica e a infertilidade51. Apesar de muita investigação sobre o diagnóstico e evolução da doença, a compreensão dos mecanismos da endometriose continua a ser controversa. Pacientes com endometriose apresentam uma taxa de gravidez inferior52. O aumento das ERO pode estar relacionado com a redução da qualidade ovocitária.
Evidências recentes apontam para uma relação entre o metabolismo do ferro e o desenvolvimento da endometriose53. O metabolismo e os níveis de ferro aparentam estar aumentados na endometriose54. O ferro pode atuar como catalisador e potenciar a toxicidade do oxigénio e do nitrogénio, através da produção de uma ampla gama de ERO, induzindo lesão oxidativa nas células55. Deste modo, o SO gerado é responsável pela destruição local do mesotélio peritoneal, contribuindo para a adesão células endometriais em localização ectópica55. A atividade da SOD, importante para a regulação e equilíbrio oxidativo, encontra-se diminuída no plasma de mulheres com endometriose, indicando uma diminuição na capacidade antioxidante56. Assim, mulheres com endometriose apresentam ainda níveis mais elevados de marcadores de SO57.
Por outro lado, alterações a nível molecular, tais como a instabilidade genética e viabilidade celular são temas de debate na patogénese da endometriose. Estudos recentes identificam o fator nuclear hepatocitário (HNF) e microARNs58 como estando relacionados com o SO. Os microARNs responsáveis por direcionar as moléculas inflamatórias, encontram-se diminuídos nas mulheres com endometriose58. Por outro lado, sabe-se que o ião superóxido desempenha um papel importante no processo epigenético, tais como a metilação de DNA e a acetilação de histonas59. Além disso, em pacientes com endometriose foram observadas alterações em vários genes envolvidos no metabolismo oxidativo dos estrogénios, tais como o CYP1A1 e CYP3A7 e uma diminuição da expressão de enzimas fundamentais para a homeostasia do estrogénio, tais como SULT1E1, SULT12B1 e UGT2B760. Estas evidências sugerem que um desequilíbrio na expressão enzimática desencadeia alterações na formação de ERO, na estimulação da proliferação e formação de um endométrio ectópico.
Amreen e colaboradores estudaram 55 mulheres diagnosticadas com endometriose, sendo que mais de 80% apresentava infertilidade61. As amostras de sangue e de líquido peritoneal das pacientes foram analisadas para biomarcadores de SO tais como: GPx, SOD e peroxidação lipídica. Os resultados demonstram níveis reduzidos de antioxidantes GPx e SOD perante casos de endometriose severa (p < 0.05). Em concordância, a peroxidação lipídica aumentou em paralelo com a severidade da doença tanto em amostras de sangue como de líquido peritoneal. Este estudo permitiu concluir que existe um aumento de SO diretamente relacionado com a severidade da doença61. Contudo, a relação entre a capacidade antioxidante e a endometriose não aparenta ser tão linear, como demonstram Jackson e colaboradores. Os autores identificam um aumento significativo de vitamina E no soro de 44 pacientes com endometriose, quando comparado com as mulheres do grupo de controlo (12.2 vs 10.1 mg/ml; p = 0.04). No entanto, o aumento podia resultar da dieta ou do consumo de suplementos por parte das mulheres com esta patologia62. Do mesmo modo, um outro estudo observou níveis de pro-oxidantes mais elevados no soro das mulheres com endometriose em comparação com as pacientes controlo (saudáveis) (p < 0.0001) (63), (64.
Embora os níveis de ERO sejam considerados relevantes na relação entre endometriose e infertilidade, os mecanismos responsáveis pelo aumento do SO permanecem por esclarecer. Por outro lado, é difícil isolar a causalidade, isto é, não está claramente estabelecido se o SO é responsável pelo estabelecimento da endometriose e uma diminuição da fertilidade ou, ao invés é uma consequência dos processos inflamatórios inerentes à própria endometriose27.
Síndrome do ovário policístico (SOP)
A SOP é atualmente um dos distúrbios hormonais mais comuns, ocorrendo em 5 a 10 % das mulheres em idade reprodutiva65. Além de características de hiperandroginismo, está também associada a oligo- ou amenorreia e anovulação66. Evidências demonstram que 50% de pacientes com SOP são obesas, apresentando na sua maioria excesso de gordura visceral. As mulheres padecem igualmente de hirsutismo, acne e alopecia androgénica, o que impacta negativamente a sua qualidade de vida65. Esta síndrome metabólica conduz a manifestações clínicas observadas em várias doenças crónicas, nomeadamente diabetes e doenças cardiovasculares65.
A SOP está de igual modo associada à diminuição das concentrações de antioxidantes, e por consequência, a um estado oxidativo. A diminuição do consumo de oxigénio pelas mitocôndrias, juntamente com o aumento da produção de ERO, explica a disfunção mitocondrial em pacientes com SOP. Por outro lado, o número de células mononucleares do sangue de pacientes com SOP está aumentado23. No caso da hiperglicemia, esta gera níveis elevados de ERO nas células mononucleares que, por sua vez, ativam a libertação de fator de necrose tumoral alfa (TNF-α) e aumentam a expressão do fator de transcrição inflamatório NF-kappa B, desencadeando concentrações ainda mais elevadas de TNF-α, mediador de resistência da insulina. Deste modo, o SO resultante contribui para um ambiente inflamatório favorável ao aumento da resistência à insulina23.
Poucos estudos se debruçaram sobre o envolvimento do SO na fisiopatologia da SOP pelo que as evidências são bastante limitadas. Um ensaio clínico com 56 pacientes com SOP e com idades compreendidas entre os 18 e 40 anos estudou o efeito de suplementos de 5 mg de melatonina (poderoso antioxidante) duas vezes ao dia ao longo de 12 semanas67. A melatonina está presente no LF e a sua avaliação tem-se revelado uma ferramenta importante na gestão da fertilidade humana68. A administração de melatonina reduziu significativamente o hirsutismo (IC = 95%, -0.86, -0.09; p = 0.01), o nível de testosterona (IC = 95%, -0.21, -0.02; p = 0.01) e a concentração de MDA (IC = 95%, -0.38, -0.11; p = 0.001). Por outro lado, levou ao aumento da capacidade antioxidante total (IC = 95%, 62.97, 149.28; p < 0.001) e dos níveis de glutationa (IC = 95%, 36.08, 126.03; p = 0.001). Além disso, a melatonina reduziu a expressão génica de fatores inflamatórios tais como interleucina-1 (IL-1) e TNF-α (p = 0.01) (67.
Um outro estudo, realizado no Centro de Medicina Reprodutiva em Nanjing, teve como objetivo avaliar o efeito da suplementação com vitamina E, durante um curto período, na indução da ovulação em pacientes com SOP e explorar a sua associação com as taxas de gravidez69. Para tal, foram incluídas 321 pacientes, das quais 211 experienciaram estimulação ovárica após suplementação com vitamina E. Após quantificação hormonal e análise de marcadores de SO presentes no soro das pacientes, os resultados refletem uma diminuição dos níveis séricos de MDA e de albumina modificada por isquemia (IMA), assim como um aumento na capacidade antioxidante total e nos níveis de estradiol (p < 0.05). Contudo, os autores não encontraram diferenças significativas na taxa de gravidez após a indução da ovulação entre as mulheres com SOP suplementadas com a vitamina E69.
Apesar da necessidade de esclarecimento dos mecanismos subjacentes, torna-se evidente que o SO está envolvido no desenvolvimento da SOP. Por outro lado, existe ainda muita controvérsia sobre os suplementos antioxidantes a utilizar, não apenas relativamente à sua dosagem e duração da toma, mas também relativamente aos seus benefícios em pacientes com SOP.
Infertilidade idiopática
Por definição, a infertilidade idiopática é considerada um “diagnóstico de exclusão”, quando se desconhecem os fatores que contribuem para a infertilidade do casal68. Apesar de não se conhecer a origem da infertilidade idiopática, evidências demonstram que fatores que interferem no equilíbrio oxidativo possam estar envolvidos. Um aumento na produção de ERO é sugestivo de uma redução das defesas antioxidantes, incluindo GSH e vitamina E. Está descrito que baixas concentrações de antioxidantes no líquido peritoneal podem ser determinantes na infertilidade idiopática23.
Além dos efeitos observados, em estudos que recorrem à toma de suplementos antioxidantes, fatores como uma alimentação equilibrada, a prática de exercício físico, hábitos tabágicos, consumo de álcool, entre outros, têm sido igualmente analisados70), (71. A atividade física leva a um aumento nos níveis de ERO desencadeando um igual incremento na resposta antioxidante. Em certas doenças a produção excessiva de ERO, após a prática de exercício físico intenso, pode potenciar o aumento das defesas antioxidantes em comparação com os indivíduos saudáveis23.
Por outro lado, o consumo de tabaco, álcool e drogas está relacionado com alterações nos mecanismos de reprodução feminina. O fumo do tabaco induz a produção de ERO, sendo que os fumadores passivos estão igualmente expostos a partículas nocivas que têm sido relacionadas com menores taxas de fertilidade72. Por sua vez, o consumo regular de álcool promove a sobreprodução de ERO, desencadeando peroxidação lipídica, diminuição da atividade antioxidante da SOD e redução dos níveis de GSH. Após a desidrogenação, os metabolitos do álcool são responsáveis pela geração de ERO73.
Neste âmbito, uma investigação desenvolvida em França, teve como objetivo compreender a relação entre o comportamento sedentário e composição corporal com a fertilidade idiopática tanto em homens como em mulheres. Os resultados sugeriram que o comportamento sedentário e a falta de exercício físico, representam dois fatores independentemente associados com a infertilidade74.
O SO desempenha também um papel de relevo nas infeções e doenças autoimunes. No processo de infeção ocorre a geração de ERO pela NAPDH oxidase, pela mieloperoxidase e pela sintase do óxido nítrico. Os radicais livres, ao protegerem contra os microrganismos invasores, podem causar danos nos tecidos75. Além das infeções, também as radiações ultravioleta (UV) e o stress emocional têm sido estudados como fatores exacerbantes de doenças autoimunes75. Por último, os poluentes ambientais (incluindo os pesticidas) têm sido igualmente implicados em distúrbios reprodutivos. Todos estes fatores têm o potencial de induzir SO. Estados de infeção e inflamação ativam os monócitos e neutrófilos, os quais produzem grandes quantidades de ERO, resultando na quebra da homeostasia do sistema imune76.
Suplementos alimentares
No momento da conceção, o SO pode desencadear oxidação das proteínas celulares e danos no DNA. Deste modo, é expectável que os antioxidantes neutralizem os radicais livres. O efeito do consumo de suplementos alimentares contendo antioxidantes ou uma dieta mais rica nestes compostos permanece um tema de debate na área da fertilidade77), (78), (79)- (80. A literatura científica neste tópico é bastante limitada; no entanto, alguns estudos sugerem que a alimentação influencia a fertilidade feminina. Por exemplo, a vitamina D em níveis elevados, está associada a uma maior probabilidade de gravidez bem-sucedida, sendo particularmente benéfica para pacientes com SOP na redução do hiperandroginismo81. De igual modo, o mio-inositol ajuda na redução do excesso de androgénio e na resistência à insulina82. A L-arginina melhora o fluxo sanguíneo e os ácidos gordos polinsaturados influenciam a síntese de prostaglandinas e a esteroidogénese83), (84.
Uma investigação realizada nos Países Baixos com 199 casais em tratamento de fertilização in vitro/ICSI, identificou uma associação entre a adesão a recomendações alimentares e a ocorrência de gravidez (OR:1.65, IC = 95%)85.
Além de uma alimentação equilibrada, o consumo dos micronutrientes com capacidade antioxidante é cada vez mais explorado e incluído na dieta de mulheres sujeitas aos tratamentos de PMA. Através da aplicação de questionários a 349 pacientes do Hospital Geral de Massachussets, foi investigada a associação ente vitamina A, C e E, retinol e carotenoides e suplementos alimentares, e o sucesso dos tratamentos de fertilidade. Surpreendentemente, o estudo refere uma associação inversamente proporcional entre o consumo de β-caroteno obtido através da alimentação com a taxa de nascimento (50 vs 22%; p = 0.03). Contrariamente, o consumo de vitamina A, C e E, não influencia o sucesso das técnicas aplicadas86.
Recentemente, um ensaio clínico envolvendo 62 pacientes com SOP, entre os 18 e os 40 anos de idade, as mulheres sujeitas a uma suplementação diária com 800mg de resveratrol obtiveram uma maior taxa de gravidez. O resveratrol influencia o processo angiogénico. Tal observação deve-se ao facto de ocorrer uma diminuição na expressão dos genes VEGF e HIF1 nas células da granulosa (p = 0.0001) (87. Contudo, estudos in vitro recentes sugerem que a decidualização é inibida com este antioxidante associado a alterações epigenéticas, incluindo acetilação de regiões promotoras dos marcadores de decidualização (PRL e IGFBP1). A suplementação de resveratrol pode inibir a senescência decidual e diminuir a recetividade endometrial em contexto clínico88.
Um outro estudo, em Itália, analisou o líquido folicular em conjunto com as células da granulosa de 19 mulheres com IMC inferior a 25 e de 24 mulheres obesas (IMC > 30). As pacientes em estudo para realização de tratamentos de infertilidade, foram previamente suplementadas com Ácido alfa-Lipóico (ALA, antioxidante natural essencial no metabolismo aeróbico) e Mio-inositol (substância natural relacionada com vitaminas do complexo B) (89), (90. Após dois meses de suplementação, a capacidade antioxidante total foi avaliada no líquido folicular, assim como os níveis de mtDNA nas células da granulosa. Os resultados dos ensaios enzimáticos sugerem um aumento nas defesas antioxidantes e uma diminuição no SO no microambiente ovárico das pacientes obesas, restaurando deste modo os níveis fisiológicos e aumentando o sucesso das técnicas utilizadas91.
Recentemente, uma meta-análise sobre o impacto dos antioxidantes na infertilidade feminina, abrangendo um total de 7760 mulheres92 visou determinar a importância dos suplementos antioxidantes no sucesso reprodutivo. A meta-análise não foi clara sobre a relação entre os antioxidantes e a taxa de nados-vivos em comparação com placebo (OR: 1.81, IC = 95%), assim como entre os antioxidantes e a taxa de gravidez clínica (OR: 1.65, IC = 95%). Embora a heterogeneidade dos estudos seja alta e as evidências de qualidade fraca, a meta-análise sugere que entre as mulheres inférteis com uma taxa esperada de nados-vivos e de gravidez clínica de 19 %, o uso de antioxidantes aumentaria a taxa para entre 24% e 36%. Por último, não foi observado um risco aumentado de aborto, problemas gastrointestinais ou ocorrência de gravidez ectópica. Contudo, não existem evidências claras para apontar o consumo de suplementos antioxidantes como benéfico para casos de infertilidade feminina92.
Conclusão
O SO resulta de produção excessiva de ERO relativamente aos níveis de defesa antioxidantes o que pode influenciar negativamente a fertilidade feminina. Embora os mecanismos subjacentes a estes efeitos não sejam claros, parecem resultar de interferências na foliculogénese, oogénese e no estabelecimento de uma gravidez saudável.
Ao nível celular, uma das possíveis estratégias a ser utilizadas para um maior controlo do SO passa pela modulação da mitocôndria para benefício terapêutico, enriquecendo diferentes compartimentos mitocondriais tanto com antioxidantes como com pró-oxidantes. Esta área tem sido intensamente estudada nos últimos anos, sendo que dados pré-clínicos e clínicos reconhecem um potencial terapêutico para várias patologias93. Contudo, a relação entre modificações mitocondriais e a própria disfunção mitocondrial, assim como a resistência à insulina, continua controversa. Deste modo, são necessários mais estudos que se debrucem sobre a melhor abordagem terapêutica a nível da mitocôndria que permitam modular e equilibrar o mecanismo oxidativo das células-alvo.
Além das alterações do estilo de vida, que devem ser privilegiadas em qualquer tratamento de fertilidade, o consumo de antioxidantes e outros suplementos alimentares pode conferir benefícios adicionais no controlo dos níveis adequados de ERO. Contudo, a necessidade de uma suplementação ou uma alimentação mais rica em antioxidantes, continua bastante controversa. No entanto, a maior parte das evidências que suporta os benefícios dos antioxidantes foi observada em estudos experimentais com animais ou através de estudos in vitro. É por isso crucial que se realizem mais ensaios clínicos que permitam esclarecer a utilidade dos antioxidantes como coadjuvantes dos tratamentos de infertilidade.