Introdução
Em novembro de 2020, a Organização Mundial de Saúde divulgou a estratégia global para a eliminação do cancro do colo do útero (CCU), assente em três pilares: vacinação, rastreio e tratamento adequado das lesões pré-malignas1.
A colposcopia possui um papel-charneira entre o rastreio e o tratamento, reconhecido pelo contributo da prevenção secundária para a redução das taxas de incidência e mortalidade do CCU ao longo das últimas décadas.
A inspecção do colo sob iluminação e magnificação tem por objectivo a identificação ou exclusão de lesões pré-malignas e, por conseguinte, permite a programação do tratamento ou vigilância, diminuindo o número de procedimentos desnecessários. Tendo por base um risco a priori, o colposcopista tem a possibilidade de adaptar a conduta de acordo com o risco-benefício individual, estimado em tempo real, em função dos achados colposcópicos e do contexto clínico.
A vacinação contra o papilomavírus humano (HPV) e a implementação do teste de HPV no rastreio organizado têm consequências sobre a prática colposcópica, e a optimização do seu desempenho deve articular-se com as estratégias de estratificação baseada no risco e na genotipagem.
O objectivo desta revisão foi a sistematização do conhecimento sobre a acuidade diagnóstica da colposcopia e as suas condicionantes, bem como a divulgação de recomendações acerca da terminologia, da técnica e dos indicadores de qualidade.
Métodos
No dia 15 de outubro de 2021, foi realizada uma pesquisa bibliográfica na base de dados Pubmed, utilizando as palavras-chave “colposcopy”, “accuracy” e “quality”, restrita a publicações nos últimos 20 anos. Os artigos científicos foram avaliados através dos seus resumos e os considerados de interesse foram incluídos. Consultou-se também bibliografia de relevo referenciada nos artigos seleccionados.
Resultados e discussão
1. Acuidade diagnóstica da colposcopia
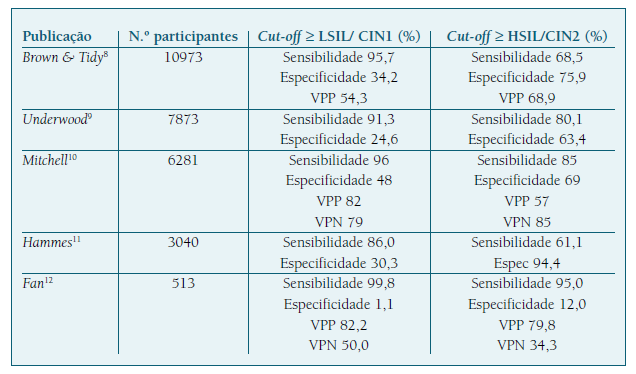
A acuidade diagnóstica corresponde ao grau de concordância entre a impressão colposcópica e os achados histológicos2. De notar que a selecção da área em que a biópsia é realizada depende da impressão colposcópica, pelo que os resultados da biópsia são influenciados pela subjectividade do colposcopista. Como tal, a acuidade da colposcopia com biópsia tem sido melhor avaliada por comparação com os achados da peça excisada ou da peça operatória, com a concordância a variar entre 45,0 e 89,6%3,4,5. Um estudo retrospectivo envolvendo 1901 mulheres calculou uma concordância de 80,6%, com taxas de subdiagnóstico de 5,8% e de sobrediagnóstico de 13,6%6. Numa série restringida a mulheres com citologia HSIL, a biópsia dirigida por colposcopia teve sensibilidade de 87,8%; especificidade de 59,3%; valor preditivo positivo (VPP) de 95,6% e valor preditivo negativo (VPN) de 32,7%7.
Os resultados reportados na literatura devem ser analisados de acordo com a metodologia utilizada, designadamente o limiar para realização de biópsias. Quando o limiar para biópsia é estabelecido num cut-off ≥ lesão intraepitelial escamosa de alto grau (HSIL)/neoplasia intraepitelial cervical (CIN) 2, a acuidade da colposcopia-biópsia reflecte a opinião diagnóstica do colposcopista e representa uma medida da sua performance na identificação de ≥ HSIL/CIN2. Um cut-off ≥ lesão intraepitelial escamosa de baixo grau (LSIL)/CIN1 corresponde à decisão de biópsia na presença de epitélio anormal, traduzindo a atitude do colposcopista no processo de decisão clínica. Apresentam-se as publicações que avaliaram a acuidade da colposcopia de acordo com ambas as metodologias (Quadro I). Verifica-se que um cut-off ≥ LSIL/CIN1 foi associado a maior sensibilidade e menores especificidade e VPP.
A interpretação do desempenho diagnóstico da colposcopia deve também considerar um viés de selecção, pela sobre-representação de casos “positivos”. A não realização de uma biópsia perante uma colposcopia normal ou a abstenção de um procedimento excisional em caso de biópsias “negativas” resultam num aumento da sensibilidade e numa redução da especificidade.
Sublinha-se ainda que o gold standard do diagnóstico, o exame histopatológico da peça excisional, não é inteiramente reprodutível. As discrepâncias interobservador ocorrem sobretudo na distinção CIN1 versus CIN2/3 e vários biomarcadores têm sido testados para as ultrapassar13,14,15,16,17.
Finalmente, a revisão dos diversos artigos científicos encontra uma limitação relacionada com as diferenças na nomenclatura histológica (Sistema de classificação de Bethesda versus Lower Anogenital Squamous Terminology). Os grupos CIN2/3 e HSIL não são inteiramente sobreponíveis e, por conseguinte, os resultados não podem ser directamente comparáveis.
Factores condicionantes
Têm sido apontados vários factores passíveis de influenciar a acuidade da colposcopia, cuja análise é necessária para evitar o subdiagnóstico e, por outro lado, o excesso de biópsias18.
A qualidade e a reprodutibilidade da técnica são condicionadas pela capacidade de resolução da tecnologia utilizada e pela aptidão do colposcopista, sendo que médicos menos experientes tendem a sobre-interpretar as imagens colposcópicas19,20,21,22.
Relativamente ao impacto do número de biópsias efectuadas, a taxa de falsos negativos de uma biópsia única, para o diagnóstico de CIN3/adenocarcinoma in situ (AIS), atingiu 42%23. O aumento no número de biópsias representou um incremento na sensibilidade da detecção de lesão HSIL de 60,6% para 85,6%, com duas biópsias, e 95,6% com três biópsias24. Todavia, a regressão de CIN2/3 após biópsia cifrou-se em 20% e o número crescente de biópsias foi um factor de sobre-estimativa de gravidade em 33,6% dos casos25. Quando comparadas com biópsias realizadas 6 meses antes, as biópsias contemporâneas da excisão mostraram uma concordância mais elevada com o resultado definitivo (56 versus 42%) e uma taxa de infra-diagnóstico de CIN2-3/AIS superior (57 versus 26%). O processo de regressão espontânea e a possibilidade de a biópsia estimular uma resposta imunitária podem justificar os achados. A realização de biópsias aleatórias da zona de transformação, em quadrantes sem lesão colposcópica, aumentou a capacidade de detecção de ≥ HSIL/CIN2, particularmente entre mulheres com citologia de alto grau26. O incremento de 57,1 para 94,5% tem justificado a recomendação neste subgrupo, excepto se estiver uma excisão programada27.
Entre as condicionantes clínicas, algumas são intrínsecas à doente (idade, paridade, estado de menopausa), à zona de transformação (ZT) (visibilidade da junção escamo-colunar) ou à lesão (grau, dimensão, componente endocervical) (12,25.
O risco de discordância da biópsia em relação ao diagnóstico definitivo foi significativamente maior perante idades ≥ 50 anos, nuliparidade, menopausa e ZT tipo 35.
Vários estudos indicam que a acuidade diagnóstica é superior nos casos de maior gravidade. A concordância com o diagnóstico definitivo variou entre 78,5% para lesões de alto grau e 33,3% para lesões de baixo grau28.
Tem sido estudada a influência do genótipo viral sobre a imagem colposcópica e a correlação colpo-histológica. O estado de positividade para HPV-16, tal como a presença de infecção por múltiplos HPV, não influenciou a detecção de CIN3+. A impressão colposcópica das lesões CIN2+ relacionadas com HPV-16 versus HPV não-16 mostrou características semelhantes29. Apesar da sensibilidade comparável, o VPP de qualquer anomalia identificada foi superior no grupo HPV-1630. Também foi demonstrada diferença significativa na especificidade e VPN da detecção colposcópica de CIN2+ entre os grupos31. Numa publicação mais recente, verificou-se que a presença de achados grau 2 foi significativamente mais frequente no contexto de infecção por HPV-16 versus HPV não-16 (10,9 versus 6,9%). O VPP da impressão colposcópica para ≥ HSIL/CIN2 foi de 57,3 versus 32,1%32. Permaneceu por esclarecer se a maior exuberância colposcópica seria atribuível ao genótipo ou à maior prevalência das lesões associadas. Efectivamente, o VPP da colposcopia para lesões de alto grau relacionou-se directamente com a prevalência33.
Foi sugerido que o impacto do genótipo viral possa variar com a idade34. As lesões por HPV-16 foram associadas a maior dimensão, maior persistência e detecção em idades mais jovens29,35. Pelo contrário, as lesões por HPV não-16 foram consideradas de aparecimento mais tardio, e globalmente mais difíceis de identificar36.
A infecção por vários tipos de HPV foi relacionada com lesões colposcópicas mais extensas, também válido nos subgrupos HPV-16 positivos e de lesões CIN3+37.
Actualmente, o estado vacinal não afecta a conduta dos casos referenciados do rastreio. No entanto, prevê-se um aumento da proporção de lesões de baixo grau e de achados colposcópicos ≤ grau 1, com uma redução no número de intervenções diagnósticas e terapêuticas. O aumento das taxas de vacinação HPV acompanha-se de uma redução no VPP da colposcopia para a detecção de ≥ HSIL/CIN2 e justifica a necessidade de maior conhecimento e aptidão para manter o desempenho diagnóstico38.
A composição do microbiota vaginal representa outro factor passível de influenciar a decisão clínica, e tem sido avaliado o seu impacto na história natural da infecção HPV. Foi sugerida uma relação causal entre a disbiose vaginal e a infecção persistente por HPV39. O predomínio de espécies não-Lactobacillus ou Lactobacillus iners determinou um risco três a cinco vezes superior de persistência de HPV, e uma probabilidade duas a três vezes maior de lesão displásica ou invasiva, quando comparado com a preponderância de Lactobacillus crispatus40. Apesar da implicação de subtipos específicos da comunidade vaginal na carcinogénese do colo representar uma perspectiva promissora, foram apontadas limitações metodológicas nos estudos que a estabeleceram.
2. Terminologia
A descrição e documentação dos achados colposcópicos deve procurar ser concisa e reprodutível, porquanto se repercute sobre a conduta e quaisquer iniciativas futuras de investigação clínica ou controlo de qualidade41.
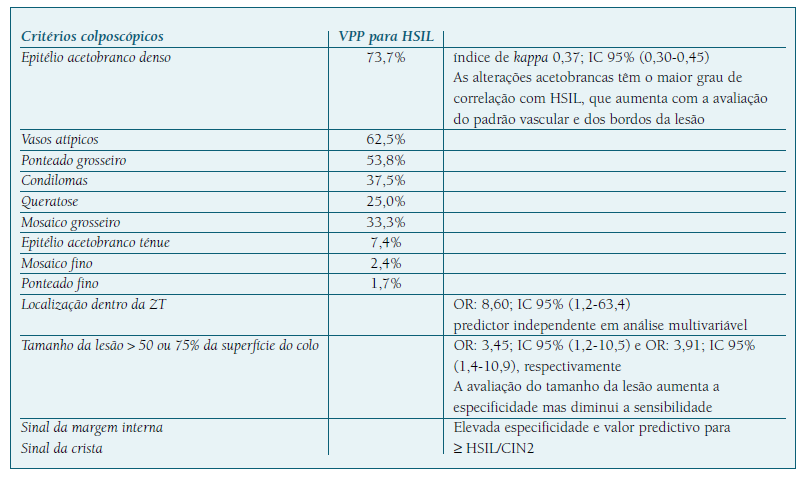
As alterações colposcópicas são valorizadas de acordo com critérios bem estabelecidos, cuja validação assentou na capacidade preditiva das imagens colposcópicas em relação ao diagnóstico histológico (Quadro II) (42,43,44,45,46.
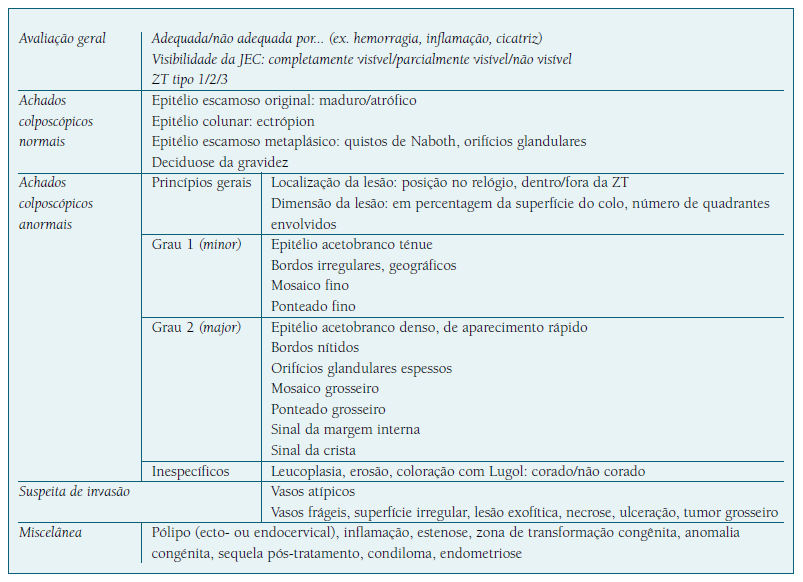
A terminologia colposcópica recomendada é a classificação da International Federation of Cervical Pathology and Colposcopy (IFCPC) de 2011 e inclui os achados grau 1, grau 2 e suspeitos de invasão, além de aspectos relativos à dimensão e à localização das lesões (Quadro III). Foi associada a elevada concordância inter-observador (kappa = 0,843), tendo sido considerada altamente reprodutível11. Uma revisão de 525 colposcopias mostrou uma correlação entre os critérios da classificação da IFCPC e as lesões histológicas de alto grau, com sensibilidade de 63,6% e especificidade de 96,0%47.
Em 2017, a American Society for Colposcopy and Cervical Pathology (ASCCP) adoptou a dicotomia “completamente visível” ou “não completamente visível” para a avaliação do colo e da junção escamo-colunar. Pelo seu valor predictivo elevado e consistente, a presença de epitélio acetobranco mereceu uma categoria adicional. As recomendações emitidas perante um resultado de rastreio de alto risco (ASC-H, HSIL, HPV-16/18) incluíram a biópsia de qualquer área acetobranca, mesmo que interpretada como metaplasia ou alterações colposcópicas de baixo grau48.
A comparação entre a terminologia da IFCPC e o Índice de Reid ou o Score de Swede não mostrou evidência de que estes sistemas formais se associem a maior capacidade predictiva de lesão de alto grau45,49.
3. Técnica
O exame colposcópico deve decorrer de forma sistematizada, incluindo a avaliação do colo sem preparação, com filtro verde, após aplicação de ácido acético e de solução de lugol. O sistema deve permitir a aquisição e armazenamento das imagens e a emissão automática de relatórios ilustrados.
Biópsias
A decisão de realizar biópsias e a escolha do tipo e número de biópsias dependem do risco de lesão ≥ HSIL/CIN 2 e de factores individuais (idade, gravidez, tipo de ZT). As biópsias devem ser sempre realizadas sob colposcopia e dirigir-se às áreas de maior gravidade colposcópica, com representação do epitélio e do estroma. Geralmente são usadas pinças de Tischler Kevorkian e aborda-se primeiro o lábio posterior, para evitar o prejuízo da hemorragia sobre a visualização.
Assim, de acordo com o nível de risco a priori e os achados colposcópicos, recomenda-se, na mulher não grávida com 25 ou mais anos: (48,50,51,52,53,54
• alterações citológicas minor, infecção por HPV não 16/18 e colposcopia sem zonas aceto-brancas: não realizar biópsias aleatórias.
• zonas aceto-brancas sugestivas de metaplasia ou grau 1: realizar biópsia(s) dirigidas(s).
• dois ou três dos seguintes critérios: ASC-H/HSIL/AGC, HPV 16/18, achados grau 2: realizar entre 2 e 4 biópsias dirigidas, segundo a complexidade e a dimensão das alterações identificadas.
• considerar biópsias aleatórias se ASC-H/HSIL/AGC/HPV 16/18 e colposcopia normal ou com achados ≤ grau 1.
Deve ser registada a localização e os achados colposcópicos correspondentes à biópsia. Diferentes biópsias devem ser identificadas e enviadas em separado, fixadas em formol.
Excisão imediata
A estratégia “ver e tratar” (excisão imediata, sob controlo colposcópico, sem biópsia confirmatória) reduz os custos associados e a ansiedade das doentes, mas comporta o risco de sobretratamento. Numa revisão sistemática publicada pela ASCCP, as taxas de detecção de lesões ≥ HSIL/CIN2 foram calculadas em 73% na presença de citologia HSIL e HPV 16/18; em 86% para a coexistência de citologia e colposcopia de alto grau; em 76% perante HPV16/18 e colposcopia de alto grau e em 85% nos casos de HSIL, HPV16/18 e colposcopia de alto grau. (55 Uma análise de treze estudos, com um total de 4611 participantes, determinou uma taxa de sobretratamento de 11,6% nos casos de citologia HSIL e achados grau 2, que aumentou para 29,3% entre as mulheres com citologia HSIL e achados grau 1. Os falsos positivos na presença de citologia LSIL e achados grau 2 foram calculados em 46,4% e atingiram 72,9% perante citologia LSIL e achados grau 1. Os autores validaram a opção de ver e tratar no subgrupo de mulheres com citologia e colposcopia de alto grau, enquanto recomendaram a realização de biópsia prévia nos casos de discordância cito-colposcópica em mulheres jovens56.
Assim, na presença de dois ou três dos seguintes critérios: ASC-H/HSIL/AGC, HPV 16/18, achados grau 2, pode considerar-se um tratamento excisional imediato, preferencialmente se ZT tipo 3, baixa adesão à vigilância e ausência de desejo reprodutivo. De acordo com as orientações da European Federation for Colposcopy (EFC) / European Society of Gynaecological Oncology (ESGO), a excisão está recomendada perante suspeita colposcópica de invasão ou nos casos de ZT tipo 3 em que o estudo histológico é considerado necessário54.
Estudo endocervical
O estudo histológico do endocolo deve ser o último procedimento da colposcopia. A curetagem consiste na introdução de uma cureta endocervical ou cureta fenestrada de Kevorkian, numa extensão de cerca de 2 cm dentro do canal endocervical; a amostra deve ser obtida dos quatro quadrantes, em movimentos de dentro para fora, e colocada em frasco individual com formol. É relatada como inadequada em até 20% dos casos. Está contra-indicada durante a gravidez.
A sensibilidade do escovado comparou-se favoravelmente com a da curetagem (77-93% versus 36-64%) e a percentagem de amostras inadequadas foi cerca de 10 vezes inferior. Associou-se a melhor tolerância da doente e menores custos, justificando-se a sua prática para o estudo endocervical. Todavia, deve ter-se em conta que a taxa de falsos positivos variou entre 28 e 75%57,58.
O estudo endocervical está indicado (1) nos casos de ZT tipo 3, quando não se visualizam anomalias no exocolo ou a lesão possui um componente endocervical, possibilitando o diagnóstico de 5-15% das lesões ≥ HSIL/CIN 2; (2) perante um resultado citológico de AGC, permitindo a colheita de amostras de áreas não contíguas e (3) imediatamente após um tratamento excisional, tendo sido apontada como melhor predictor de doença residual do que o estado das margens de ressecção54,59.
4. Indicadores de qualidade
Cada Unidade de Colposcopia deve promover a realização regular de auditorias da qualidade da sua actividade. O recurso a indicadores de qualidade tem sido sublinhado como requisito do processo de formação e ferramenta de auto-avaliação.
A definição desses indicadores tem procurado corresponder às exigências da prática colposcópica, mantendo-se actualizável de acordo com opiniões de consenso e evidências científicas. Por exemplo, foi reconhecido que a valorização do estado das margens cirúrgicas pode levar à excisão de peças desnecessariamente maiores, com efeitos sobre o prognóstico obstétrico. Paralelamente, a EFC promoveu uma revisão sistemática que mostrou maior sensibilidade do teste de HPV-AR na predicção de cura, em detrimento do envolvimento das margens. Como tal, admite-se que a “taxa de testes HPV aos 6 meses após tratamento > 80%” venha a representar um critério de qualidade numa próxima publicação de consenso.
Os indicadores expressos em percentagem têm sido criticados pela falta de exequibilidade, e foram propostas metas menos ambiciosas: documentação do tipo de ZT > 95%; percentagem de casos com exame colposcópico > 95%; biópsias em ZT’s 1 ou 2 > 90%; CIN2+ em peças de excisão > 80% (excluindo ZT tipo 3 /idade superior a 40 anos). No entanto, aceitou-se a difusão universal de indicadores de qualidade sob o pressuposto de que devem ser interpretados como padrões ideais. As sociedades de colposcopia podem modificar os objectivos para adequá-los à realidade nacional e aos processos de certificação.
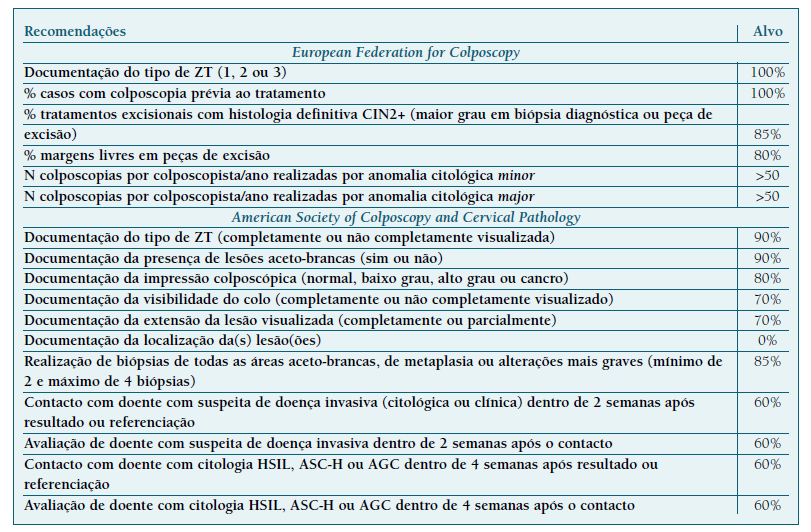
Também em 2017, a ASCCP publicou onze recomendações de qualidade em colposcopia. O primeiro indicador é comum ao consenso da EFC e são incluídos quatro indicadores relacionados com o tempo máximo para informar as mulheres portadoras de lesões de alto grau e seis reguladores da descrição dos achados colposcópicos (Quadro IV) (60.
Conclusão
A determinação da acuidade diagnóstica da colposcopia encontra, na literatura, um amplo espectro de resultados, que variam de acordo com os métodos aplicados. A sua interpretação deve considerar o limiar para realização de biópsias, o número de biópsias efectuadas e o estudo histológico da peça de excisão.
À medida que se verifica uma maior capacidade de individualização do risco, apoiada em marcadores menos operador-dependentes, o colposcopista permanece no centro do processo de decisão clínica. A sua aptidão é desafiada na era vacinal, impondo-se uma adaptação da prática às condicionantes da colposcopia, por forma a continuar a garantir a sua qualidade.
Reconhece-se a importância de estabelecer consensos sobre a terminologia e a técnica colposcópica, e a necessidade de implementar avaliações regulares, baseadas em indicadores auditáveis e validados internacionalmente.